Analizar la experiencia publicada sobre el uso de adalimumab en el tratamiento de enfermedades autoinmunes en adultos.
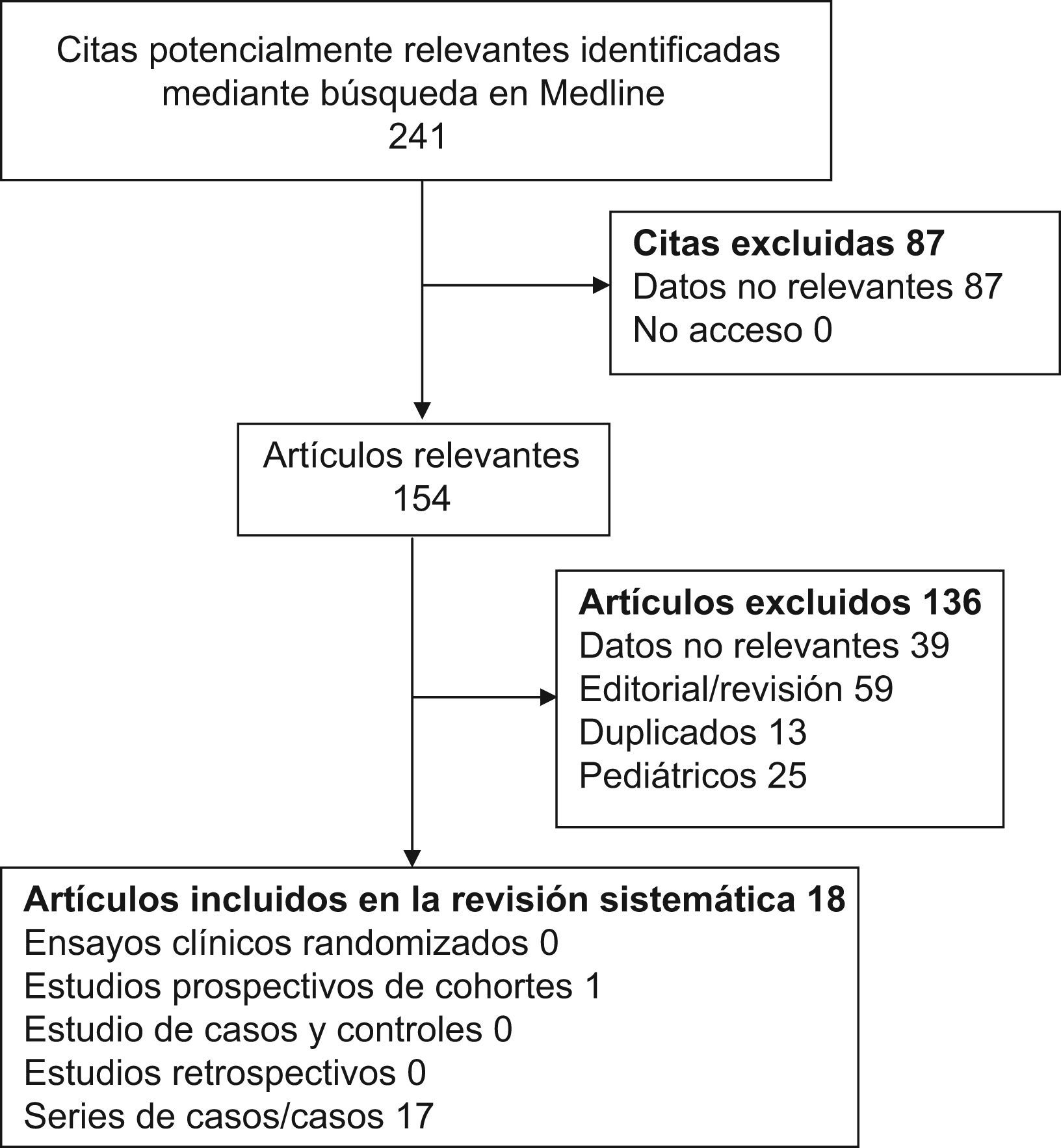
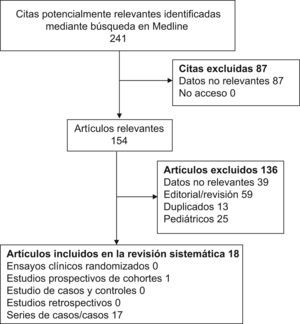
MétodosSe realizó una revisión sistemática de los artículos incluidos en la base de datos Medline desde el 1 de enero de 1990 al 31 de diciembre de 2008, combinando el término «adalimumab» con las diferentes enfermedades autoinmunes sistémicas. Se identificaron un total de 241 artículos, de los que 154 se revisaron a texto completo y 18 fueron finalmente seleccionados como relevantes.
ResultadosEn los 18 artículos seleccionados se incluían 54 pacientes adultos con enfermedades autoinmunes tratados con adalimumab: 16 pacientes con enfermedad de Behçet; 13 con uveítis idiopática; 5 con sarcoidosis; 5 con uveítis asociadas a otras enfermedades (psoriasis en 2, espondilitis anquilosante en 1, artritis idiopática juvenil en 1, enfermedad de Crohn en 1); 4 con enfermedad de Vogt-Koyanagi-Harada; 4 con uveítis de Birdshot; 3 con vasculitis (arteritis de la temporal, enfermedad de Takayasu y una vasculitis cutánea asociada a artritis reumatoide), 2 con enfermedad de Still del adulto; uno con policondritis recidivante y un paciente con esclerosis sistémica. Las manifestaciones clínicas que motivaron la indicación fueron la uveítis (39 casos), afectación mucocutánea (9), vasculitis (3), artritis (6) y afectación pulmonar (3). En todos los casos se trataban de enfermedades refractarias a tratamiento con glucocorticoides (42 casos, 78%), inmunosupresores (42, 78%) y otros biológicos (29, 54%). Cincuenta (93%) pacientes respondieron a adalimumab. La respuesta fue similar tanto en aquellos que habían recibido otro biológico como en los que adalimumab era el primer biológico administrado. En 5 (9%) pacientes se describieron efectos adversos (3 reacciones cutáneas locales, un paciente con angioedema y una exacerbación de una fibrosis pulmonar). Tras un tiempo medio de seguimiento de 11,9 meses, 12 (22%) pacientes presentaron recidiva y uno (2%) falleció por exacerbación de su enfermedad de base.
ConclusionesLa evidencia del uso de adalimumab en enfermedades autoinmunes proviene de casos aislados y ensayos no controlados, que incluyen en todos los casos a pacientes graves y refractarios a tratamiento convencional. En este contexto clínico, el uso de adalimumab aparece como una opción eficaz y segura, especialmente en pacientes con uveítis y enfermedad de Behçet.
To analyze published evidence about adalimumab use in autoimmune diseases.
MethodsSystematic review of MEDLINE database of citations included from January 1990 to December 2008 employing the terms “adalimumab” and the different systemic autoimmune diseases.
ResultsOur search identified 241 potentially relevant citations. 154 were retrieved for detailed evaluation. Finally, 18 were selected as relevant, including 54 patients. The reported diseases were as follow: Behçet disease in 16 patients, idiopathic uveitis in 13, sarcoidosis in 5, uveitis associated with rheumatologic diseases in 5 (psoriasis in 2, ankylosing spondylitis in 1, juvenile idiopathic arthritis in 1, Crohn disease in 1), Vogt-Koyanagi-Harada disease in 4, Birdshot uveitis in 4, vasculitis in 3 (1 temporal arteritis, 1 Takayasu′s disease, 1 skin vasculitis associated with rheumatoid arthritis), adult onset Still disease in 2, relapsing polychondritis in 1 and systemic sclerosis in 1. The clinical spectrum included uveitis (39 cases), skin and/or mucosae (9), vasculitis (3), arthritis (6), lung (3). These patients were refractory to standard therapy, including corticosteroids (42 cases, 78%), immunosuppressants (42, 78%) and biologics (29, 54%). Fifty (93%) patients responded to adalimumab. The clinical response was similar in those patients who had been treated with other biologic and in those who had not received biologic therapy before adalimumab. The patients were followed for 11.9 months. Twelve (22%) patients relapsed. Five (9%) patients suffer some side effect (3 local skin reaction, 1 angioedema, 1 lung fibrosis). One patient (2%) died due to progression of her disease.
ConclusionsAvailable data about the use of adalimumab in autoinmune diseases come from case reports and uncontrolled studies, that include patients with severe disease and refractory to standard therapy. In this setting, it seems to be an effective and safe treatment option, especially in patients with uveitis and Behçet's disease. This initial data must be confirmed by controlled assays before extending adalimumab use.
Las citocinas son moléculas mediadoras esenciales para el funcionamiento normal del sistema inmunológico. El desequilibrio en su producción, causado por la exposición a determinados factores ambientales en un huésped genéticamente predispuesto, se ha relacionado con la etiopatogenia de las enfermedades autoinmunes1,2. El factor de necrosis tumoral (TNF) es una citocina producida principalmente por monocitos, macrófagos y linfocitos T, que ejerce su acción mediante la unión a 2 receptores (p55 y p75) presentes en la membrana de neutrófilos, células endoteliales y fibroblastos. Esta unión promueve la liberación de otros mediadores por parte de las células diana, amplificándose la señal y contribuyendo a producir fenómenos inflamatorios y daño tisular3. El conocimiento de la función del TNF ha sido la base para el diseño y uso de fármacos anti-TNF en patologías de naturaleza autoinmune.
Los fármacos anti-TNF actualmente aprobados por las agencias internacionales reguladoras del medicamento son el infliximab (anticuerpo monoclonal IgG1 quimérico murino y humano), etanercept (proteína de fusión recombinante, que combina dos receptores p75 TNF Sjögren's syndrome, y el dominio Fc de la IgG1 humana) y adalimumab (anticuerpo monoclonal IgG1 completamente humanizado). El adalimumab y el infliximab poseen un mecanismo de acción similar y se unen de manera eficaz tanto a la forma soluble como a la forma transmembrana del TNF, mientras que el etanercept se une únicamente a la forma soluble del TNF. El adalimumab y el etanercept se administran por vía subcutánea, lo que permite su administración domiciliaria y proporciona unos niveles plasmáticos más continuos, mientras que el infliximab precisa la administración intravenosa en medio hospitalario4.
Las indicaciones aprobadas por los organismos internacionales para el uso de los anti-TNF son la artritis reumatoide, espondilitis anquilosante, artritis psoriásica, artritis crónica juvenil, enfermedad inflamatoria intestinal y psoriasis5,6. En la práctica clínica habitual, el uso de estas terapias se ha extendido recientemente a las enfermedades autoinmunes sistémicas en pacientes refractarios a tratamiento convencional y a contexto administrativo de uso fuera de indicación (uso compasivo hospitalario, con aprobación por el Ministerio de Sanidad).
El adalimumab es el primer anticuerpo monoclonal anti-TNF completamente humano, con una estructura y función indistinguibles de la IgG1 humana y una vida media también similar (aproximadamente 2 semanas)7. La FDA y la EMEA avalan el empleo de adalimumab en artritis reumatoide, artritis psoriásica, espondilitis anquilosante, psoriasis, artritis crónica juvenil y enfermedad inflamatoria intestinal6. Sin embargo, no se conoce la evidencia científica existente sobre el uso de adalimumab en enfermedades autoinmunes.
El objetivo de este trabajo consiste en recopilar información acerca de la eficacia y seguridad de adalimumab en enfermedades autoinmunes sistémicas mediante una revisión sistemática de la literatura.
Material y métodosSe realizó una revisión sistemática de la base de datos Medline a través de la página web Pubmed (http://www.ncbi.nlm.nih.gov) de los artículos incluidos desde el 1 de enero de 1990 y al 31 de diciembre de 2008 combinando los siguientes términos: «adalimumab», «antiphospholipid syndrome», «Behçet disease», «Churg Strauss vasculitis», «myositis», «polymyositis», «dermatomyositis», «giant cell arteritis», «Horton arteritis», «systemic lupus erythematosus», «rheumatic polymyalgia», «relapsing polychondritis», «sarcoidosis», «Sjögren's syndrome», «Still's disease», «adult-onset Still's disease», «systemic sclerosis», «Wegener granulomatosis”, «uveitis», «vasculitis», «progressive glomerulonephritis», «polyarteritis nodosa», «microscopic polyangeiitis», «cryoglobulinemia» y «antisynthetase syndrome».
No se estableció ningún filtro respecto al idioma de publicación o al tipo de estudio. En una primera etapa se analizó el contenido de los resúmenes de los artículos identificados. A continuación, fueron seleccionados para revisión a texto completo todos aquellos artículos que hicieran referencia a pacientes con enfermedades autoinmunes. No se evaluó información proveniente de resúmenes ni de resultados no publicados (in press, comunicación personal). Tras la revisión de los artículos a texto completo, su inclusión como relevante para el estudio se basó en las siguientes premisas:
- •
El artículo debía hacer referencia a pacientes adultos (edad >18 años) con enfermedades autoinmunes tratados con adalimumab.
- •
La información contenida en el artículo debía permitir valorar la respuesta al tratamiento y los eventos adversos.
- •
En el caso de revisiones, no se consideraron como relevantes aquellas que no incluyeran casos originales no publicados.
- •
En caso de artículos duplicados, se seleccionó el más reciente.
Definimos como respuesta favorable la mejoría o estabilización de las manifestaciones clínicas que motivaron la indicación de adalimumab. La resolución completa de todas las manifestaciones se consideró respuesta completa y, en el resto de los casos, respuesta parcial. Se definió como respuesta no favorable la progresión clínica a pesar del tratamiento.
ResultadosFueron identificados un total de 241 artículos mediante la combinación de los términos de búsqueda previamente descritos, de los cuales 154 (63,9%) se revisaron a texto completo. Tras esta revisión, se consideraron relevantes para el estudio 18 artículos en los que se comunicaban un total de 54 pacientes adultos con enfermedades autoinmunes tratados con adalimumab8–25. (fig. 1).
- a)
Características generales
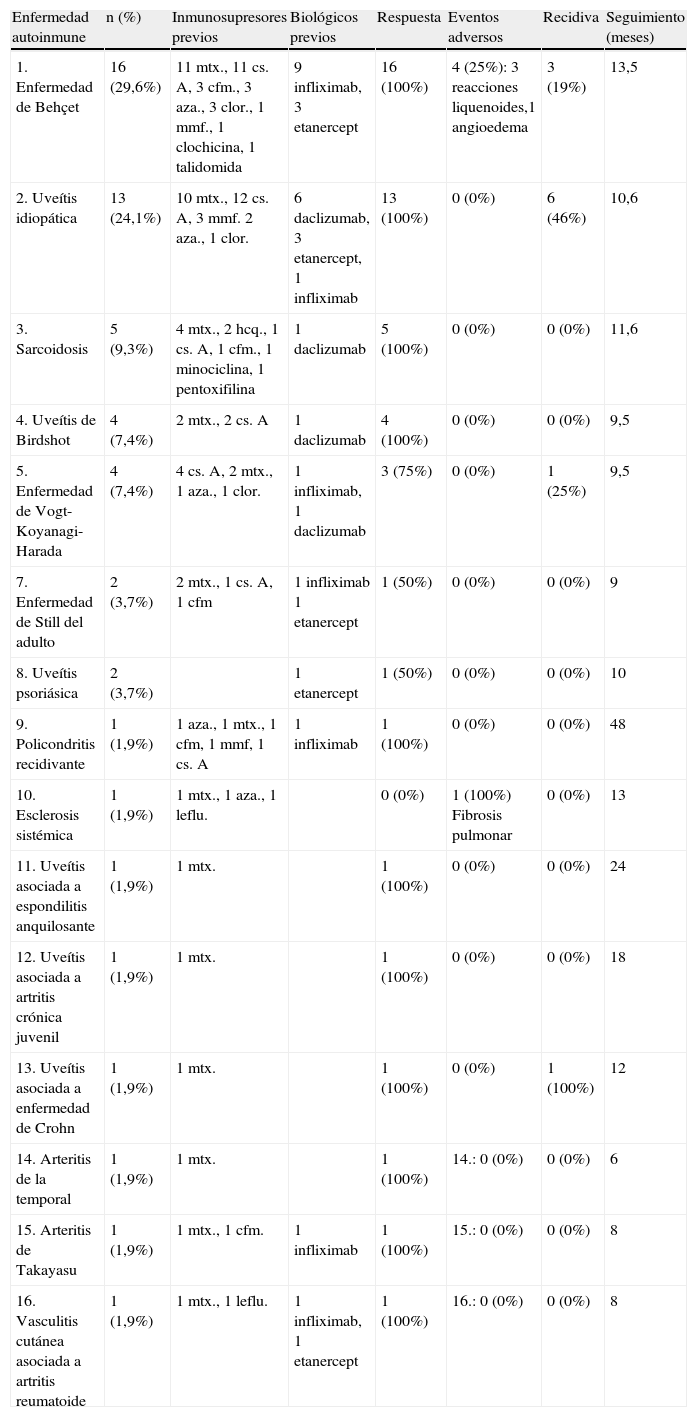
De los 54 pacientes, 34 eran mujeres y 20 hombres, con una edad media de 39,72 años en el momento del inicio del tratamiento con adalimumab (21–74). Las enfermedades autoinmunes y las características generales por enfermedad se detallan en la tabla 1.
Tabla 1.Enfermedades autoinmunes en las que se ha reportado el uso de adalimumab
Enfermedad autoinmune n (%) Inmunosupresores previos Biológicos previos Respuesta Eventos adversos Recidiva Seguimiento (meses) 1. Enfermedad de Behçet 16 (29,6%) 11 mtx., 11 cs. A, 3 cfm., 3 aza., 3 clor., 1 mmf., 1 clochicina, 1 talidomida 9 infliximab, 3 etanercept 16 (100%) 4 (25%): 3 reacciones liquenoides,1 angioedema 3 (19%) 13,5 2. Uveítis idiopática 13 (24,1%) 10 mtx., 12 cs. A, 3 mmf. 2 aza., 1 clor. 6 daclizumab, 3 etanercept, 1 infliximab 13 (100%) 0 (0%) 6 (46%) 10,6 3. Sarcoidosis 5 (9,3%) 4 mtx., 2 hcq., 1 cs. A, 1 cfm., 1 minociclina, 1 pentoxifilina 1 daclizumab 5 (100%) 0 (0%) 0 (0%) 11,6 4. Uveítis de Birdshot 4 (7,4%) 2 mtx., 2 cs. A 1 daclizumab 4 (100%) 0 (0%) 0 (0%) 9,5 5. Enfermedad de Vogt-Koyanagi-Harada 4 (7,4%) 4 cs. A, 2 mtx., 1 aza., 1 clor. 1 infliximab, 1 daclizumab 3 (75%) 0 (0%) 1 (25%) 9,5 7. Enfermedad de Still del adulto 2 (3,7%) 2 mtx., 1 cs. A, 1 cfm 1 infliximab 1 etanercept 1 (50%) 0 (0%) 0 (0%) 9 8. Uveítis psoriásica 2 (3,7%) 1 etanercept 1 (50%) 0 (0%) 0 (0%) 10 9. Policondritis recidivante 1 (1,9%) 1 aza., 1 mtx., 1 cfm, 1 mmf, 1 cs. A 1 infliximab 1 (100%) 0 (0%) 0 (0%) 48 10. Esclerosis sistémica 1 (1,9%) 1 mtx., 1 aza., 1 leflu. 0 (0%) 1 (100%) Fibrosis pulmonar 0 (0%) 13 11. Uveítis asociada a espondilitis anquilosante 1 (1,9%) 1 mtx. 1 (100%) 0 (0%) 0 (0%) 24 12. Uveítis asociada a artritis crónica juvenil 1 (1,9%) 1 mtx. 1 (100%) 0 (0%) 0 (0%) 18 13. Uveítis asociada a enfermedad de Crohn 1 (1,9%) 1 mtx. 1 (100%) 0 (0%) 1 (100%) 12 14. Arteritis de la temporal 1 (1,9%) 1 mtx. 1 (100%) 14.: 0 (0%) 0 (0%) 6 15. Arteritis de Takayasu 1 (1,9%) 1 mtx., 1 cfm. 1 infliximab 1 (100%) 15.: 0 (0%) 0 (0%) 8 16. Vasculitis cutánea asociada a artritis reumatoide 1 (1,9%) 1 mtx., 1 leflu. 1 infliximab, 1 etanercept 1 (100%) 16.: 0 (0%) 0 (0%) 8 aza.: azatioprina; cfm.: ciclofosfamida; clor.: clorambucil; cs. A: ciclosporina A; hcq.: hidroxicloroquina; leflu.: leflunomida; mmf.: micofenolato mofetil; mtx.: metotrexate.
Las manifestaciones clínicas que motivaron la indicación terapéutica incluyeron la uveítis en 39 casos (72%), afectación mucocutánea en 9 (17%), vasculitis en 4 (7%), artritis en 4 (7%), afectación pulmonar en 3 (5%), alteraciones del tubo digestivo en 2 (4%) y afectación del sistema nervioso central en 2 casos (4%). Se trataba en todos los casos de pacientes en los que había fracasado el tratamiento convencional con glucocorticoides, inmunosupresores y/o otros tratamientos biológicos. Cuarenta y dos (78%) pacientes habían sido tratados con glucocorticoides, 42 (78%) con inmunosupresores (31 habían recibido metotrexate, 25 ciclosporina A, 6 azatioprina, 7 metotrexato, 4 micofenolato mofetil, 4 clorambucil, 2 hidroxicloroquina, 2 leflunomida, 2 pentoxifilina, 1 colchicina, 1 minociclina) y 29 (54%) habían recibido otros tratamientos biológicos (15 habían recibido infliximab, 8 etanercept y 7 daclizumab). La dosis de adalimumab empleada fue de 40mg s.c. (quincenal en 46 pacientes y semanal en 4). En 4 casos no se especificó la dosis.
La respuesta clínica al tratamiento con adalimumab fue favorable en 50 (93%) de los pacientes. Solo 4 pacientes no respondieron al tratamiento: un paciente con enfermedad de Vogt-Koyanagi-Harada, el paciente con uveítis psoriásica, un paciente con enfermedad de Still del adulto y el paciente con esclerodermia. El porcentaje de respuesta fue similar en los pacientes que habían sido tratados con otros biológicos respecto a los que no (93% vs. 92%, p=0,843). Se pudo reducir la dosis de glucocorticoides y/o inmunosupresores en 43 (80%) de los 48 pacientes en los que se especificó dicha información.
El tiempo medio de seguimiento de los pacientes fue de 11,9 meses con un rango entre 2 y 48 meses. Durante este periodo de tiempo se observó recidiva en 12 (22%) pacientes (9 casos de uveítis posterior, uno de uveítis anterior idiopática, un caso de enfermedad de Behçet con manifestaciones sistémicas sin afectación ocular y un caso de vasculitis cutánea asociada a artritis reumatoide). En 5 (9%) pacientes se describen eventos adversos (3 reacciones cutáneas liquenoides, una reacción cutánea con angioedema asociado y un paciente en el que se observó exacerbación de una fibrosis pulmonar subyacente). Este mismo paciente (2%) falleció por exacerbación de su enfermedad pulmonar de base.
- b)
Uveítis
Identificamos 39 pacientes con uveítis tratados con adalimumab, de los cuales 19 están incluidos en un ensayo no controlado no randomizado8, perteneciendo los restantes a 6 series de casos9–12,24,25. La etiología de las uveítis fue la siguiente: 18 uveítis asociadas a otras enfermedades (enfermedad de Behçet en 11 pacientes, sarcoidosis en 2, psoriasis en 2 y enfermedad de Crohn, espondilitis anquilosante y artritis idiopática juvenil en un paciente, respectivamente), 13 uveítis idiopáticas, 8 uveítis primarias (enfermedad de Vogt- Koyanagi-Harada en 4 pacientes y uveítis de Birdshot en otros 4 pacientes). De los 39 pacientes, 21 eran varones y 18 mujeres, con una edad media de 38,6 años (21–74). La localización de la uveítis se especificó en 37 casos: 24 casos (61%) padecían una panuveítis, 7 (18%) una uveítis posterior, 3 pacientes (8%) una uveítis intermedia y 3 pacientes (8%) una uveítis anterior. De los 27 pacientes en los que se especificaba si la afección era unilateral o bilateral, 26 (96%) presentaban una uveítis bilateral.
En 37 pacientes se especificaron las características del tratamiento previo recibido. Todos menos 4 habían sido tratados con glucocorticoides y una media de 1,74 inmunodepresores (23 pacientes habían recibido ciclosporina A, 20 metotrexato, 5 azatioprina, 4 clorambucil, 3 ciclofosfamida y 3 micofenolato). Veinte (51%) de los pacientes habían recibido tratamiento con otros fármacos biológicos (infliximab en 7 casos, daclizumab en 7 y etanercept en 6). El tratamiento asociado se especificó en 19 casos. En todos menos uno se emplearon glucocorticoides, que en 15 casos se asociaron a otro inmunosupresor (metotrexato on 12, azatioprina en 1, micenolato mofetil en 1 y ciclosporina en 1).
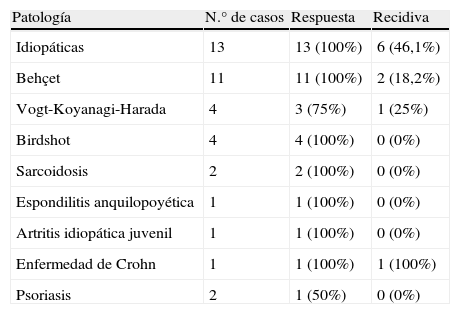
Treinta y siete (95%) pacientes presentaron una respuesta clínica favorable: 27 (69%) experimentaron mejoría clínica y en 10 (26%) se estabilizó el cuadro clínico. Los 2 (5%) pacientes restantes presentaron empeoramiento clínico en uno de los dos ojos afectados pese al tratamiento. En la tabla 2 se resume el porcentaje de respuesta según la etiología de la uveítis. En la tabla 3 se resumen las diferentes definiciones de respuesta en los distintos trabajos.
Tabla 2.Respuesta a adalimumab de los pacientes con uveítis según etiología
Patología N.° de casos Respuesta Recidiva Idiopáticas 13 13 (100%) 6 (46,1%) Behçet 11 11 (100%) 2 (18,2%) Vogt-Koyanagi-Harada 4 3 (75%) 1 (25%) Birdshot 4 4 (100%) 0 (0%) Sarcoidosis 2 2 (100%) 0 (0%) Espondilitis anquilopoyética 1 1 (100%) 0 (0%) Artritis idiopática juvenil 1 1 (100%) 0 (0%) Enfermedad de Crohn 1 1 (100%) 1 (100%) Psoriasis 2 1 (50%) 0 (0%) Tabla 3.Definición de respuesta en aquellos trabajos que incluyeron pacientes con uveítis
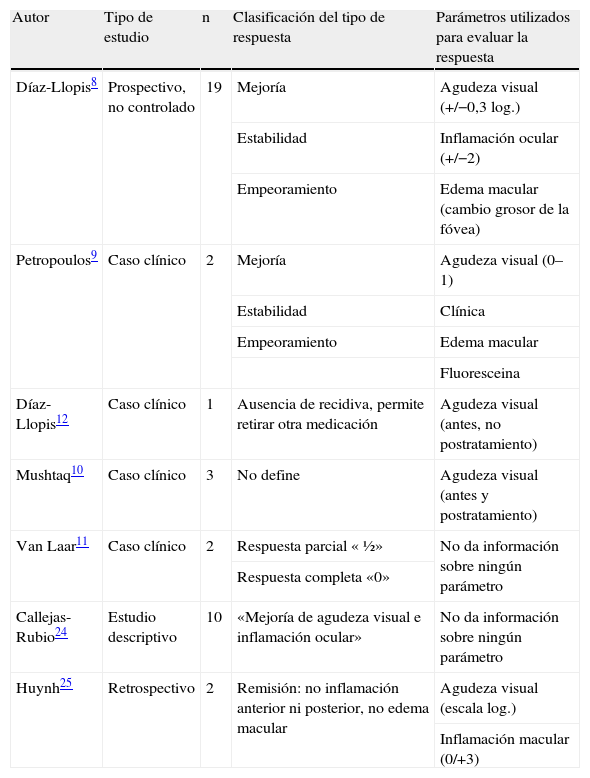
Autor Tipo de estudio n Clasificación del tipo de respuesta Parámetros utilizados para evaluar la respuesta Díaz-Llopis8 Prospectivo, no controlado 19 Mejoría Agudeza visual (+/−0,3 log.) Estabilidad Inflamación ocular (+/−2) Empeoramiento Edema macular (cambio grosor de la fóvea) Petropoulos9 Caso clínico 2 Mejoría Agudeza visual (0–1) Estabilidad Clínica Empeoramiento Edema macular Fluoresceina Díaz-Llopis12 Caso clínico 1 Ausencia de recidiva, permite retirar otra medicación Agudeza visual (antes, no postratamiento) Mushtaq10 Caso clínico 3 No define Agudeza visual (antes y postratamiento) Van Laar11 Caso clínico 2 Respuesta parcial « ½» No da información sobre ningún parámetro Respuesta completa «0» Callejas-Rubio24 Estudio descriptivo 10 «Mejoría de agudeza visual e inflamación ocular» No da información sobre ningún parámetro Huynh25 Retrospectivo 2 Remisión: no inflamación anterior ni posterior, no edema macular Agudeza visual (escala log.) Inflamación macular (0/+3) En cuanto a la tasa de respuesta global, no se observaron diferencias significativas entre los pacientes que habían sido tratados previamente con un biológico (95%) y los que no (94,7%). En cambio, los pacientes no tratados previamente con biológicos tuvieron una mayor tasa de mejoría de la clínica visual (89,5% vs. 50%; p=0,007) que los que habían recibido biológicos.
El tiempo medio de seguimiento de los pacientes fue de 12,6 meses (4–30). Durante este tiempo, 10 (27%) pacientes sufrieron al menos una recidiva, que respondió a la inyección periocular de glucocorticoides en los 8 casos en los que se especificó el manejo de la recidiva. No se reportaron efectos adversos salvo reacciones locales leves en el punto de inyección8.
El trabajo de Díaz-Llopis et al8 es el mejor diseñado y el de mayor tamaño hasta el momento. Se trata de un estudio prospectivo no controlado y no randomizado que incluye a 19 pacientes con uveítis crónica bilateral de diferentes etiologías refractaria a tratamiento con glucocorticoides, inmunosupresores y biológicos. Los resultados en 38 ojos afectados mostraron mejoría de la agudeza visual en 12 (31%), estabilización en 25 (66%) y empeoramiento en uno (3%). El edema macular cistoide crónico se resolvió en el 54% de los ojos afectados. Además, todos los pacientes pudieron disminuir al menos en un 50% la dosis de inmunosupresor. Durante los 12 meses de seguimiento de este estudio, 8 pacientes (42%) sufrieron recidiva, que se controló mediante la inyección de glucocorticoides perioculares en todos los casos. No se objetivaron eventos adversos, salvo reacciones locales leves en el punto de inyección.
Un estudio con resultados similares, aunque retrospectivo, es el de Callejas-Rubio et al24; una serie de 10 pacientes con uveítis refractarias de diferentes etiologías. En esta serie, todos los pacientes son tratados con metotrexato concomitante, excepto 2 que reciben pulsos de glucocorticoides. Todos los pacientes (100%) presentan mejoría de la inflamación ocular y agudeza visual. Únicamente 2 pacientes (20%) recidivaron, y no se describieron eventos adversos.
- c)
Enfermedad de Behçet
Dieciséis pacientes con enfermedad de Behçet fueron tratados con adalimumab8,10,11,20,24 (10 hombres y 6 mujeres, con una edad media de 38,18 años). En cuanto a las manifestaciones clínicas, 11 pacientes presentaban uveítis (9 como única manifestación), 6 úlceras orales y/o genitales, 2 artritis, 2 afectaciones del SNC, 2 afectaciones digestivas en forma de esofagitis o colitis y una vasculitis. Los 9 pacientes tratados exclusivamente por afectación ocular han sido analizados en un apartado anterior. De los 7 pacientes tratados con adalimumab por manifestaciones extraoculares, todos habían sido tratados con glucocorticoides y 5 con inmunosupresores (3 habían recibido metotrexato, 2 ciclosporina A, uno colchicina, uno talidomida y uno azatioprina). Todos los pacientes, excepto uno, habían recibido previamente tratamiento con infliximab.
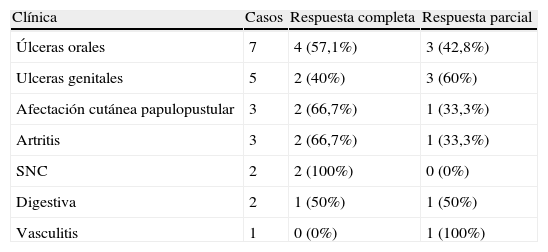
La respuesta clínica fue favorable en todos los pacientes (el 56% fue clasificado como completo y el 44% como parcial). La respuesta según la manifestación clínica se detalla en la tabla 4. En 5 de los 6 pacientes se consiguió reducir la dosis de inmunosupresor. El tiempo de seguimiento fue de 13,2 meses (rango 3–26 meses), durante el cual uno de los pacientes presentó recidiva (14%). Cuatro (57%) pacientes presentaron efectos adversos, que en 3 pacientes consistieron en lesiones cutáneas de tipo liquenoide que se controlaron con esteroides locales, y en un paciente con un cuadro de urticaria con angioedema que precisó la administración de esteroides y antihistamínicos intravenosos, provocando la suspensión del tratamiento.
Tabla 4.Respuesta de los pacientes con enfermedad de Behçet de acuerdo con las manifestaciones clínicas
Clínica Casos Respuesta completa Respuesta parcial Úlceras orales 7 4 (57,1%) 3 (42,8%) Ulceras genitales 5 2 (40%) 3 (60%) Afectación cutánea papulopustular 3 2 (66,7%) 1 (33,3%) Artritis 3 2 (66,7%) 1 (33,3%) SNC 2 2 (100%) 0 (0%) Digestiva 2 1 (50%) 1 (50%) Vasculitis 1 0 (0%) 1 (100%) - d)
Sarcoidosis
Cinco pacientes con sarcoidosis recibieron tratamiento con adalimumab8,9,17–19 (3 mujeres y 2 hombres, con una edad media de 43,2 años). En cuanto a las manifestaciones clínicas, 2 presentaban una afectación cutánea grave, con nódulos y úlceras faciales y en miembros inferiores, en un caso, y úlceras en miembros inferiores, en el otro; otros 2 una uveítis bilateral con importante compromiso visual, y un paciente presentaba enfermedad pulmonar intersticial. Todos habían recibido previamente glucocorticoides e inmunosupresores (4 metotrexato, uno ciclofosfamida, uno ciclosporina). Uno de los pacientes con afectación ocular había sido tratado también con daclizumab. La administración de adalimumab fue semanal en los 2 pacientes con afectación cutánea y la estándar en los otros 3 pacientes (40mg s.c. cada 2 semanas). En cuanto al tratamiento asociado, en 2 pacientes consisitió en glucocorticoides, en uno glucocorticoides y metotrexato y en otro pentoxifilina e hidroxicloroquina. No disponemos de información en uno de los pacientes.
Todos los pacientes respondieron de forma favorable en un plazo de entre 2 semanas y 2 meses. No se evidenciaron recidivas ni eventos adversos durante el tiempo de seguimiento, que fue de 11,6 meses. En la tabla 5 se resume la respuesta de estos pacientes
- e)
Vasculitis
Tres pacientes con vasculitis han sido tratados con adalimumab (una arteritis de la temporal13, una arteritis de Takayasu14 y una vasculitis cutánea asociada a artritis reumatoide15). En todos los casos se trataba de mujeres, con una edad media de 55 años (35–70). Los territorios afectados fueron los troncos supraaórticos, la aorta y la piel. Se trataba en los 3 casos de pacientes que habían presentado fracaso terapeútico a tratamiento convencional. Los paciente con arteritis de la temporal y arteritis de Takayasu recibieron previamente glucocorticoides e inmunosupresores, y en el caso de esta última, además, había sido tratada con infliximab. La paciente con vasculitis asociada a artritis reumatoide fue tratada con metotrexato, infliximab y etanercept, previamente. Se consiguió una remisión completa de la sintomatología en los 3 pacientes. En la paciente con vasculitis de gran vaso se pudo reducir el tratamiento inmunosupresor. El tiempo de seguimiento fue de 10 meses (6–16), durante los cuales no se objetivaron recidivas ni eventos adversos.
- f)
Otras enfermedades autoinmunes
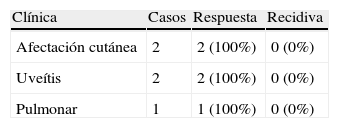
Se ha publicado el uso de adalimumab en 2 pacientes con enfermedad de Still del adulto (un paciente con respuesta clínica favorable23 y otro sin respuesta22); en uno con policondritis recidivante (buena respuesta)16, y en un paciente con esclerosis sistémica (leve mejoría de sus síntomas articulares, pero fallecimiento por progresión de su afección pulmonar de base)21.
Desde la introducción del adalimumab y hasta diciembre de 2008, se han publicado un total de 54 pacientes con enfermedades autoinmunes tratados off-label con adalimumab. Los datos provienen de la comunicación de casos aislados, series de casos y un estudio prospectivo no controlado, que incluyeron a pacientes con fracaso en tratamiento convencional con glucocorticoides e inmunosupresores e incluso a otros tratamientos biológicos. Las 2 entidades con un mayor número de casos comunicados son la uveítis y la enfermedad de Behçet, seguidas por la sarcoidosis y las vasculitis, y casos aislados en otras enfermedades, como la enfermedad de Still del adulto, la policondritis recidivante y la esclerodermia.
Los datos de nuestra revisión muestran una respuesta superior al 90% en los pacientes tratados con adalimumab, con una baja incidencia de eventos adversos, que en la mayoría de los pacientes corresponden a reacciones cutáneas locales en el punto de inyección. Son resultados superponibles a los obtenidos con infliximab en las diferentes patologías analizadas26,27, pero superiores a los observados con etanercept en el tratamiento de la uveítis28–32 (eficacia entre el 78–100% para infliximab vs. entre el 33–65% para etanercept en el tratamiento de la uveítis) y la sarcoidosis26 (eficacia del 97% para infliximab y del 29% para etanercept). Este hecho podría ser debido al diferente mecanismo de acción de etanercept, el cual bloquea únicamente la fracción soluble del TNF.
La uveítis es la entidad clínica con mayor número de casos comunicados en Medline tratados con adalimumab, con un total de 39. Los primeros casos comunicados de uveítis tratadas con adalimumab corresponden al ámbito pediátrico33,34, 2 trabajos que incluyeron 32 niños con uveítis con una eficacia superior al 80%.
En cuanto a la experiencia en adultos, los trabajos publicados hasta el momento muestran datos similares o incluso superiores a la experiencia previa en niños, con un alto porcentaje de respuesta y un bajo índice de efectos adversos.
El trabajo de Díaz-Llopis et al8 es el mejor diseñado y el de mayor tamaño. En este trabajo, el edema macular cistoide crónico, una de las lesiones relacionadas con la inflamación ocular más resistentes al tratamiento, se resolvió en el 54% de los ojos afectados, lo que es superponible a datos previos con infliximab35.
Una limitación importante a la hora de extraer conclusiones de los diferentes trabajos radica en la heterogeneidad de los pacientes y en las diferentes escalas de medida aplicadas a la hora de medir la respuesta de la uveítis al tratamiento.
La siguiente enfermedad, en cuanto a la experiencia reportada sobre adalimumab, es la enfermedad de Behçet, con un total de 16 casos publicados8,10,11,20,24, de los que 11 corresponden a uveítis (9 como única manifestación y 2 acompañadas de afectación sistémica). La respuesta fue favorable en todos los pacientes y para todas las manifestaciones. Los efectos adversos se limitaron a reacciones cutáneas leves en el punto de inyección, salvo un paciente que presentó una reacción grave en forma de urticaria y angioedema que obligó a la suspensión del tratamiento.
Una de las ventajas del adalimumab consiste en la posibilidad de administración subcutánea. Esta ventaja se aborda en los trabajos de Van Laar et al11 y Mustaq et al10. En ellos, un total de 9 pacientes con enfermedad de Behçet refractaria con presencia de uveítis y/u otras manifestaciones sistémicas son tratados inicialmente con infliximab con buena respuesta. En la serie de Van Laar, tras una nueva recidiva, se plantea la sustitución de inflixmab por adalimumab, dada su mayor comodidad de administración, consiguiéndose resultados similares a los previamente obtenidos con infliximab. En el trabajo de Mustaq et al, debido a las dificultades de los pacientes para acudir al hospital, el infliximab fue sustituido por adalimumab tras un periodo de estabilidad clínica, manteniéndose la respuesta en todos los casos.
Otras patologías en las que encontramos un menor número de casos publicados son la sarcoidosis8,9,17–19, vasculitis13–15, enfermedad de Still del adulto22,23, esclerosis sistémica21 y policondritis recidivante16, mostrándose eficaz en todas ellas, excepto en la esclerosis sistémica. En el caso de la sarcoidosis, los casos analizados muestran una respuesta favorable en las diferentes manifestaciones clínicas. Estudios iniciales con infliximab también obtuvieron resultados similares, que un ensayo clínico posterior no confirmó26. De la experiencia con etanercept, tanto en ensayos no controlados como controlados, se desprende una escasa eficacia en el tratamiento de la sarcoidosis26.
Respecto a las vasculitis, infliximab y etanercept, al igual que adalimumab, se han mostrado eficaces en el tratamiento de la arteritis de la temporal36–39 y de la enfermedad de Takayasu40–44 en series de casos previos y ensayos no controlados. Sin embargo, 2 ensayos clínicos randomizados controlados no mostraron diferencias con el placebo45,46.
La eficacia del adalimumab en las diferentes patologías analizadas es especialmente importante, ya que consigue respuestas en pacientes con fracaso en múltiples tratamientos, en los cuales se agotan las opciones terapéuticas. Un caso especialmente ilustrativo en este sentido es el paciente con una aortitis secundaria a policondritis recidivante16, refractaria a glucocorticoides, a 5 inmunosupresores (azatioprina, metotrexato, ciclofosfamida, ciclosporina y micofenolato) y a infliximab, y que presentó una remisión completa tras iniciar adalimumab.
Otro aspecto a tener en cuenta es que la falta de respuesta a un anti-TNF, bien sea por fallo primario, pérdida de eficacia o desarrollo de eventos adversos, no parece condicionar una ausencia de respuesta a otro anti-TNF, como se ha demostrado en estudios previos47,48. Los resultados de nuestra revisión apuntan en la misma dirección. De los 29 pacientes en los que había fracasado previamente otro fármaco biológico, todos, excepto 2, respondieron de manera favorable a adalimumab. Si bien en los pacientes con uveítis y enfermedad de Behçet, en los que se proporcionan datos que permiten estratificar la respuesta en parcial y completa, se observa una mayor proporción de respuestas parciales y menor de completas en aquellos que ya habían fracasado en otro biológico.
Los eventos adversos comunicados, escasos en frecuencia y en gravedad, concuerdan con los descritos en la literatura, consistiendo fundamentalmente en reacciones cutáneas leves en el punto de inyección. La naturaleza 100% humana del adalimumab le confiere un menor riesgo de desarrollar reacciones alérgicas que el infliximab. Sin embargo, aunque menor, el riesgo existe y, en uno de los casos comunicados, un paciente presentó un angioedema en relación con la administración del fármaco, que obligó a la administración de intravenosos y a la suspensión del tratamiento. El adalimumab, al igual que el resto de anti-TNF, aumenta el riesgo de sufrir una infección, especialmente por Mycobacterium tuberculosis. Este riesgo puede reducirse sustancialmente con un cribaje de tuberculosis latente y una profilaxis adecuados49. En la serie de Díaz-Llopis8, 3 pacientes presentaban tuberculosis latente tras el screening inicial. Antes de iniciar el tratamiento con adalimumab recibieron profilaxis con isoniazida y ninguno desarrolló la infección. Un evento adverso en el que no queda clara la participación del adalimumab es el de la paciente con esclerodermia que desarrolla fibrosis pulmonar, ya que los autores no pudieron excluir un proceso infeccioso o progresión de la enfermedad de base. Se han descrito 24 casos de desarrollo y/o progresión de enfermedad pulmonar intersticial en pacientes con enfermedades reumatológicas y/o digestivas tratados con anti-TNF50.
En resumen, la información actual del uso de adalimumab en enfermedades autoinmunes incluye 54 casos publicados principalmente como casos aislados, alguna serie de casos y un ensayo no controlado de pacientes refractarios a tratamiento convencional. En este contexto, se ha mostrado como un fármaco eficaz y seguro, con una mayor experiencia acumulada en pacientes con uveítis y enfermedad de Behçet. El adalimumab parece tener un perfil de eficacia similar al infliximab en las patologías en las que se ha empleado hasta el momento. En cambio, etanercept parece tener una menor eficacia en el tratamiento de las uveítis y la sarcoidosis. En este momento, y a la espera de ensayos clínicos que confirmen los resultados previos, la evidencia científica actual no permite recomendar el empleo de adalimumab como primera opción en el tratamiento de las enfermedades autoinmunes sistémicas. El escenario clínico para el empleo del adalimumab queda restringido a aquellos casos refractarios al tratamiento convencional con glucocorticoides e inmunosupresores, y en aquellos pacientes en los que han fracasado otros anti-TNF, bien por ineficacia o bien por desarrollo de eventos adversos.
Conflicto de interesesCDL y MRC forman parte del proyecto BIOGEAS, que ha recibido financiación de los laboratorios ROCHE y ABBOTT.