El dolor es una experiencia subjetiva difícilmente evaluable de forma objetiva por su variada expresión. Se define como una compleja experiencia sensorio-emocional, modulada por factores cognitivos, y que involucra un amplio sistema neural. La neuroimagen funcional ha contribuido a definir este circuito neural en controles sanos y en pacientes con un síndrome de dolor agudo o crónico implicado en la modulación, la percepción y la respuesta de una experiencia dolorosa. Sin embargo, la activación funcional de la matriz neural del dolor puede modularse, bien por un componente sensorial bien por un componente emocional. Este último podría mediatizar la intensidad a partir de la que un estímulo se percibe como doloroso. Este umbral parece ser menor en pacientes con diagnóstico clínico de fibromialgia (FM), pacientes que generan una anormal activación funcional del circuito neural del dolor, evaluada mediante resonancia magnética funcional (RMf), lo que se considera un síndrome de susceptibilidad central. En apoyo a esta explicación etiológica, los estudios de RMf constatan que una proporción significativa de pacientes con FM presenta una consistente y anormal activación de la matriz neural del dolor a estímulos de baja intensidad. Adicionalmente, se constata una importante y una significativa activación funcional con una duración temporal de activación cerebral superior a la del estímulo nociceptivo aplicado y, específicamente, en las áreas neuroanatómicas implicadas en la dimensión emocional del dolor. En consecuencia, la RMf permite observar, de manera incruenta, la anormal respuesta funcional cerebral a un estímulo nociceptivo en pacientes con diagnóstico clínico de FM.
Pain is a highly subjective experience that is difficult to measure objectively due to its varied expression. It is defined as a complex sensory-emotional experience, it is modulated by cognitive factors and involves a broad neural system. Functional neuroimaging has helped to define that neural circuit involved in the perception, modulation and response to painful experience, both in healthy controls and in patients with acute and chronic pain disorders. However, functional activation of the so-called pain matrix may also be differentially modulated by sensory and emotional processing components. The latter, for example, can influence the intensity to which a stimulus is perceived as painful. Such a threshold seems to be lower in patients with clinical diagnosis of fibromyalgia (FM) and has been linked to an abnormal pattern of activation of the pain matrix when assessed with functional magnetic resonance imaging (fMRI), considering a syndrome of central susceptibility. Supporting an aetiological explanation for FM, studies have noted that a significant proportion of patients with FM demonstrate this abnormal pattern of activation to stimuli of low intensity. Additionally, there is an important and significant temporal dimension to this activation pattern observed in FM patients, where areas commonly associated with the emotional experience of pain show a prolonged response to painful stimuli compared to healthy subjects. Accordingly, fMRI may assist in objectifying the experience of pain in patients with FM in response to nociceptive stimulation.
Actualmente, el dolor se define como una compleja experiencia sensitivo-emocional, modulada por factores cognitivos, que involucra un amplio sistema neural nociceptivo y antinociceptivo1,2. Los estudios de neuroimagen funcional, bien mediante tomografía por emisión de positrones (TEP) bien mediante resonancia magnética funcional (RMf), han contribuido a revelar y a definir, con estudios experimentales y clínicos del dolor, el circuito neuronal implicado en la modulación, la percepción y la respuesta de una experiencia dolorosa3,4. Además, las técnicas de neuroimagen funcional están ayudando a desvelar los secretos neurobiológicos de los componentes sensoriales, emocionales y cognitivos del dolor5.
La resonancia magnética funcionalUna de las aportaciones, y quizá una de las más relevantes, de la resonancia magnética (RM) a las neurociencias, y por extensión al ámbito clínico, ha sido la RMf6. Esta técnica detecta y localiza de manera incruenta la activación cerebral focal acontecida y el circuito neuronal implicado al realizar una tarea cognitiva, emocional o sensitivo-motora7.
Generalmente, los estudios de RMf se basan en la adquisición de las imágenes, durante una misma secuencia, mientras el paciente está en reposo y mientras realiza una determinada tarea. La posterior comparación estadística entre ambas fases (reposo y activación) representa, en un caso ideal, los cambios metabólicos y vasculares focales en la corteza cerebral que entran en funcionamiento durante la ejecución de la tarea en curso6 estudiadas, bien mediante un paradigma de diseño en bloques bien relacionado con el episodio (event-related)7. No obstante, actualmente la RMf permite y cobra interés, en determinados estudios clínicos, la posibilidad de evaluar el estado metabólico y vascular que acontece en situación de reposo (resting-state) y la duración temporal real del patrón de activación funcional cerebral al realizar una determinada tarea en estudio.
Se han propuesto diferentes métodos para poder determinar la actividad cerebral con imágenes de RMf. Sin embargo, el procedimiento más sensible y con el que se ha acumulado una mayor experiencia6,7 es el método BOLD (blood oxygen level dependent [dependiente del nivel de oxígeno en sangre]). En este procedimiento los cambios de la señal de resonancia dependen de las concentraciones de oxígeno en sangre, especialmente de la cantidad de oxígeno ligado a la hemoglobina (oxihemoglobina) en sangre en fase venosa8. Además, con este método no se precisa la inyección de un bolo de contraste para el estudio de la actividad cerebral.
Se sabe que cuando un sujeto realiza una tarea cognitiva, emocional o sensitivo-motora específica se produce un incremento del flujo sanguíneo cerebral regional (FSCR) implicado en la tarea por realizar y, en consecuencia, un incremento de la aportación de oxígeno9. Al parecer, el incremento del FSCR puede llegar a ser de hasta un 50% como respuesta al incremento de la actividad neuronal7. Sin embargo, el incremento del consumo de oxígeno es mucho menor que el aumento del aporte por vía arterial9. Esto conlleva un contenido superior al normal de oxihemoglobina en fase venosa (capilares venosos, vénulas y venas) y respecto a la desoxihemoglobina, lo que produce el efecto de arterialización de la sangre venosa6,8. Esta variación en la relación entre las concentraciones de oxihemoglobina (componente diamagnético) y de desoxihemoglobina (componente paramagnético) en fase venosa cuando el tejido neuronal está en reposo y cuando está activado define el contraste BOLD7.
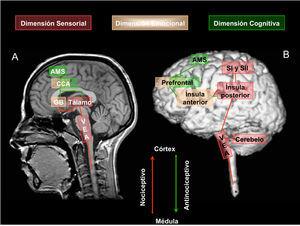
Circuito neural del dolorDiversos estudios clínicos con neuroimagen funcional, bien mediante TEP, bien mediante RMf, han evaluado los cambios funcionales acontecidos en el sistema nervioso central ante una experiencia dolorosa en voluntarios sanos2,4 y en pacientes con dolor neuropático3 con dolor del miembro fantasma10, con neuralgia postherpética11, con dolor de espalda crónico12, con cefalagias1, con fibromialgia (FM)13,14,15,16, con síndrome de colon irritable17 y con síndrome de dolor regional complejo18. Los resultados obtenidos han revolucionado la comprensión de la respuesta fisiológica al dolor y abren nuevas perspectivas para una mejor comprensión de la patofisiología de los denominados síndromes de dolor crónico1,2. Así, los datos actuales de neuroimagen funcional muestran que el dolor no es un trastorno estático con una patofisiología únicamente localizada en el sistema periférico de músculos o tendones, sino que es un cuadro clínico altamente plástico que afecta a múltiples sistemas neurales centrales1 y que define la denominada «matriz neural» del dolor o la red de áreas córtico-subcorticales implicadas en el procesamiento del dolor (figura 1).
Figura 1. Representación de la “matriz neural” del dolor y de las dimensiones clásicas del procesamiento del dolor en relación con las áreas neuroanatómicas implicadas, en corte sagital medial (A) y en corte sagital lateral (B). Representación del sistema neural nociceptivo (flecha en color rojo) y del sistema neural antinociceptivo (flecha en color verde). AMS: área motora suplementaria. CCA: corteza cingulada anterior. GB: ganglios basales. SI: corteza somatosensorial primaria. SII: corteza somatosensorial secundaria. VEA: vía espinal ascendente.
La “matriz neuronal” que modula la percepción y la respuesta al dolor parece involucrar principalmente, tanto en voluntarios sanos como en pacientes con dolor agudo o crónico en respuesta a estímulos dolorosos generados interna o externamente, la corteza somatosensorial secundaria (SII) de forma bilateral, la corteza insular (CI) y la corteza cingulada anterior (CCA)2,19,20. Adicionalmente, otros estudios refieren la activación funcional de la corteza somatosensorial primaria (SI) contralateralmente al hemicuerpo estimulado, el cerebelo, el tálamo, el opérculo, la corteza prefrontal (CPF), el área motora suplementaria (AMS), los ganglios basales y la corteza parietal posterior1,21.
Los recientes estudios de neuroimagen funcional han permitido la diferenciación neuroanatómica de las clásicas dimensiones del procesamiento del dolor. Las dimensiones sensorial y cognitiva se han ubicado en la porción encefálica superior y dorsal (SI contralateral, SII bilateral, CI en su porción posterior, zona opercular, tálamo, AMS y neocorteza frontoparietal)19,20. La dimensión emocional involucra a la CI en su porción ventral y anterior, a la CCA, a los ganglios basales y a la CPF13,15. En consecuencia, la activación funcional del circuito neural del dolor puede estar modulada, bien por un componente sensorial, bien por un componente emocional21, sin olvidar la implicación del componente cognitivo. El componente emocional puede mediatizar el umbral de intensidad en el que un estímulo se percibe como doloroso14,15,21. De hecho, este umbral parece ser mucho menor en pacientes diagnosticados de dolor funcional crónico (como la FM)13 respecto a controles sanos y generan una anormal activación del circuito neuronal del dolor22,23,24. Esto ha motivado a que estos síndromes se denominen, colectivamente, síndromes de susceptibilidad central22.
Resonancia magnética funcional y fibromialgiaLa FM es una de las enfermedades reumatológicas más prevalentes23 y representativas del dolor funcional crónico24 si bien es una de las que presentan mayor controversia diagnóstica25. Se define como un síndrome clínico caracterizado por un estado doloroso generalizado no articular de al menos 3 meses de duración (que afecta predominantemente a las zonas musculares y al raquis) y una hiperalgesia a la palpación digital con 4kg/cm2 de peso, como mínimo en 11 de los 18 pares de puntos sensibles predefinidos. Adicional y típicamente suele acompañarse de otros síntomas clínicos, que no son necesarios para su diagnóstico, como un importante estrés emocional, astenia, un pronunciado y persistente cansancio, un sueño no reparador y una rigidez generalizada26.
La etiología de la FM todavía permanece elusiva y se considera multifactorial e idiopática, lo que postula 2 posibles modelos explicativos sobre su patogénesis25,27. El primer modelo etiológico defiende un mecanismo fisiológico periférico primario que puede deberse bien a factores endógenos, bien a factores exógenos; las alteraciones psicopatológicas se consideran entre éstos últimos28. El segundo modelo etiológico propone una alteración del sistema nervioso central para el procesamiento de las señales del dolor15,22 y se basa en la existencia de una excesiva respuesta, bien a estímulos dolorosos y con una reducción del umbral del dolor (hiperalgesia), bien a estímulos no dolorosos (alodinia)13. Finalmente, algunos estudios han propuesto un modelo etiológico mixto. Éstos demuestran que la combinación de los mecanismos de sensibilización periféricos y la alteración de los mecanismos centrales para el procesamiento del dolor pueden explicar la etiología crónica de la FM al establecerse entre ambos un circuito de retroalimentación positivo que contribuye a perpetuar este síndrome clínico27.
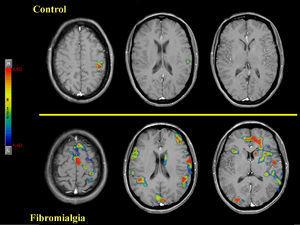
Recientemente, en apoyo al modelo etiológico de una alteración del sistema nervioso central se ha observado en estos pacientes un patrón anormal de la activación funcional cerebral (estudiada mediante RMf)13,14,15,16 como respuesta cerebral a varias intensidades de estímulos mecánicos o térmicos dolorosos y no dolorosos13,14,15. Los estudios de RMf caracterizan a este patrón de respuesta cerebral por un incremento de la sensibilidad y un aumento de la respuesta cerebral al dolor a estímulos nociceptivos de baja intensidad pero subjetivamente percibidos como moderadamente dolorosos por el paciente con FM en términos de extensión y de magnitud de la activación y en las regiones cerebrales que configuran la “matriz neural” del dolor13. Deus et al (2006) plantearon un estudio de RMf en pacientes con diagnóstico clínico de FM con un enfoque eminentemente clínico. En éste, se administró a los pacientes una presión mecánica de 4kg/cm2 durante la adquisición de la RMf, de forma similar a la intensidad recomendada para ejercer la palpación digital sobre los puntos sensibles durante la exploración de los pacientes con FM. Los resultados permitieron constatar que una proporción significativa de pacientes diagnosticados de FM, con un bajo umbral doloroso, presentaban una consistente activación de la “matriz neural” del dolor a estímulos mecánicos de baja intensidad16 (figura 2). Estos resultados muestran una susceptibilidad central para la respuesta al dolor22 y la posibilidad de utilizar la RMf como método diagnóstico complementario al método convencional16.
Figura 2. Cortes axiales de resonancia magnética funcional. En la porción superior de la figura se muestran los resultados de la activación funcional cerebral de un voluntario sano en respuesta a 4kg de peso. Se pueden observar cambios significativos únicamente en el área sensitivo-motora contralateral al dedo pulgar estimulado. En la porción inferior de la figura se muestran los resultados de la activación funcional cerebral de un paciente con diagnóstico clínico de fibromialgia. Se observa un patrón de activación de las regiones cerebrales involucradas, normalmente, en la respuesta al dolor. Los cambios fueron significativos en distintas áreas del lóbulo parietal (corteza somatosensorial primaria y corteza somatosensorial secundaria) y del lóbulo frontal, en la ínsula, en los opérculos y en la región de la corteza cingulada anterior. La letra t expresa el test de la t de Student.
Otros autores postulan que la dimensión emocional-afeciva del procesamiento del dolor puede modular o explicar la anormal activación funcional de la “matriz neural” del dolor en los pacientes con FM. De hecho, la cronicidad de la FM parece estar favorecida por la alta prevalencia de trastornos emocionales que podría modificar la experiencia del dolor28. En esta línea, Gracely et al (2004) han valorado cómo el grado de percepción catastrófica puede afectar la respuesta funcional cerebral al dolor en pacientes con diagnóstico de FM14. Otros estudios psicológicos muestran que los pacientes con diagnóstico de FM precisan un mayor tiempo para recuperarse de una sensación dolorosa aversiva después de que hayan recibido una estimulación nociceptiva27. Esto puede demostrar una distorsión de la percepción temporal, en los pacientes con FM respecto a los sujetos sanos, entre la aplicación de un estímulo doloroso y la correspondiente respuesta funcional cerebral de la «matriz neural» del dolor y, en especial, en aquellas regiones cerebrales que procesan los componentes afectivo-emocionales de la respuesta emitida ante un estímulo doloroso exógeno o endógeno. En consecuencia, puede esperarse que no siempre haya una perfecta coincidencia entre la duración de un estímulo doloroso aplicado y la duración de la experiencia subjetiva del dolor en los pacientes con FM.
De acuerdo con este último supuesto teórico descrito, en un reciente estudio pendiente de publicación y que presentó en comunicación oral el grupo de investigación al que pertenece el autor de este artículo, se ha delimitado la “matriz neural” implicada en la respuesta a un estímulo mecánico equivalente a 4kg/cm2 de peso, que no causa dolor relevante en un grupo control de voluntarios sanos, y de acuerdo con el curso temporal real de la respuesta cerebral y no al curso temporal que define la aplicación de un estímulo nociceptivo. En primer lugar, esta matriz implica una mayor perfusión sanguínea cerebral de la SI contralateral a la extremidad estimulada y de la SII. Esta región se activa tanto en los pacientes con FM como en los pacientes del grupo control de voluntarios sanos con una duración equivalente, en ambos grupos, a la duración del estímulo nociceptivo aplicado. Ambas regiones corticales se consideran como áreas cerebrales involucradas en la dimensión sensorial del procesamiento del dolor1,29. En segundo lugar, se constata una importante y significativa activación funcional, con una duración temporal de activación superior a la del estímulo nociceptivo aplicado, de la porción anterior de la ínsula únicamente en el grupo de pacientes con FM. Además, se constata que la activación de esta región, como consecuencia de la aplicación del estímulo doloroso, se encuentra específica y positivamente relacionada con el dolor que experimentan los pacientes con FM (figura 2). Estos resultados están en concordancia con estudios previos que demuestran un importante papel de la región opérculo-insular en el componente afectivo-motivacional de la experiencia dolorosa, al relacionarse con la dimensión emocional del dolor13,14,15,29 y con el grado de angustia que muestra el paciente ante un estímulo doloroso29.
Direcciones futuras de la resonancia magnética en la fibromialgiaEl estudio de la neurobiología funcional y anatómica de la FM, mediante los diferentes procedimientos de estudio que actualmente aporta la RM, puede ampliarse. Desde el punto de vista funcional se pueden especificar 3 directrices. En primer lugar, bien mediante la RMf, bien mediante la RM de perfusión, se puede evaluar el estado metabólico y vascular que acontece en situación de reposo (resting-state), de forma similar a los estudios con TEP. En segundo lugar, el análisis de la activación funcional con RMf se puede ampliar con procedimientos de análisis dirigidos (data-driven). Éstos complementarían los datos obtenidos con los análisis convencionales de RMf para caracterizar la respuesta cerebral al dolor de acuerdo con la duración temporal real de la activación funcional de la “matriz neural” del dolor. En tercer lugar, la RM espectroscópica posibilita el estudio del metabolismo cerebral in vivo y, por tanto, puede proporcionar información bioquímica no invasiva de regiones anatómicas de la «matriz neural» del dolor.
Desde el punto de vista neuroanatómico, se pueden especificar 2 futuras líneas de trabajo. En primer lugar, los estudios de tractografía con RM (imágenes con tensor de difusión) posibilitan evaluar de forma no invasiva la difusión molecular del agua que refleja la configuración del tejido microscópico de la sustancia blanca. Esto permitiría el estudio de los fascículos o de los tractos implicados en el procesamiento del dolor. En segundo lugar, el estudio de la morfología cerebral de ciertas áreas anatómicas de interés e implicadas en las dimensiones del procesamiento del dolor mediante técnicas de análisis de la RM volumétrica o 3D.
Agradecimientos
El Plan Nacional de I + D + I (Beca SAF2007-62376) del Ministerio de Educación y Ciencia de España ha apoyado en parte la elaboración del presente manuscrito. El autor agradece la colaboración para la elaboración del presente manuscrito a los Dres. Jesús Pujol y Marina López-Sola de la Unidad de Investigación en RM de CRC-Hospital del Mar del Parque de Investigación Biomédica de Barcelona (PRBB).