Evaluar la translocación nuclear del factor NF-κB en las glándulas salivales menores de pacientes con síndrome de Sjögren primario (SSp).
MétodosSe realizaron biopsias de glándulas salivares menores en 24 pacientes mujeres con diagnóstico de SSp del Servicio de Reumatología del Hospital Rivadavia. Las glándulas fueron teñidas con H&E y la inmunohistoquímica para NF-κB, fueron clasificados de acuerdo con la puntuación de Chisholm y Masson.
ResultadosLas biopsias de pacientes con SSp (H&E) mostraron infiltrados linfoplasmocitarios, formando focos periacinares y periductales cuyo número depende del estadio de la enfermedad. En las fases III y IV se observa la destrucción de los acinos y, en algunos casos, fibrosis. En las biopsias con diagnóstico de sialoadenitis observamos elementos linfoplasmocitarios intersticiales dispersos y también neutrófilos polimorfonucleares. Las biopsias de labio de pacientes con diagnóstico clínico serológico de SSp mostraron la translocación nuclear de NF-κB en los linfocitos de infiltración focal y en el epitelio de los acinos adyacentes a los infiltrados. En acinos y en las estructuras ductales alejadas de los infiltrados, no observamos translocación nuclear. Sin embargo, en pacientes con sialoadenitis se observaron linfocitos intersticiales con translocación nuclear pero no en acinos y ductos. Los pacientes con SSp con glándula normal no mostraron translocación nuclear del factor NF-κB, ni en acinos ni en el conducto.
ConclusionesEstos resultados nos permiten inferir la importancia de la interacción linfocitosepitelio y, la activación del factor NF-κB en pacientes con diagnóstico de SSp.
To evaluate nuclear NF-κB translocation in minor salivary glands (mSG) of human primary Sjögren Syndrome (pSS).
MethodsLip biopsies’ mSG were done in 24 female patients with pSS from the Rheumatology Service of Rivadavia Hospital. Glands were stained with H&E and immunostained for NF-kB. Specimens were classified according to the Chisholm and Masson score.
ResultsThe biopsies (H&E staining) showed lymphoplasmocitic infiltrates, forming periacini and periductal focuses which number depending on the stage of the disease. In stages III and IV there was acini destruction and, in some cases, fibrosis. In the biopsies with a diagnosis of sialadenitis we observed interstitially-dispersed lymphoplasmocitic elements and also polimorphonuclear neutrophils. The lip biopsies’ mSG of patients with clinical-serological diagnosis of pSS showed nuclear translocation of NF-κB in lymphocytes of focal infiltrates and in the acini epithelium adjacent to the infiltrates. In distal acini and ductal structures from the infitrates we did not observe nuclear translocation. However, in SSp patients with sialadenitis interstitial lymphocytes with nuclear translocation were observed but neither in the acini or the ducts. SSp patients with normal glands did not show nuclear translocation of NF-κB factor either in the acini or in the ducts.
ConclusionsThese results allow us to infer the importance of lymphocyte-epithelium interaction on the activation of NF-κB in human pSS.
El síndrome de Sjögren (SS) es una enfermedad crónica sistémica autoinmune caracterizada por queratoconjuntivitis seca, xerostomía y manifestaciones extraglandulares (artritis, síndrome de Raynaud, vasculitis, etc.)1,2. El síndrome de Sjögren primario (SSp) debe distinguirse del síndrome de Sjögren secundario (SSs), asociado a otras enfermedades autoinmunes como lupus eritematoso sistémico, artritis reumatoide y esclerosis sistémica, así como también de otras causas asociadas a «síndrome sicca», tales como medicamentos o infecciones3,4. Más frecuente en mujeres (10/1) entre 45–62 años5.
Histológicamente se caracteriza por hiperplasia linfoide con presencia de células plasmáticas e histiocitos en glándulas salivales y lagrimales con pérdida progresiva de las estructuras acinares y fibrosis en estadíos tardíos, conduciendo estas alteraciones a los trastornos funcionales glandulares6. Los infiltrados linfoides están constituidos predominantemente por linfocitos T CD4 y en menor número linfocitos B7. Los pacientes con SSp y SSs presentan a nivel sérico autoanticuerpos (anti SS-A/Ro y anti SS-B/La), así como también en linfocitos T CD4, la expresión de varios marcadores de activación (complejo de histocompatibilidad [MHC] HLA-DR, moléculas de adhesión, IL-2 e IFN-γ)8. Otros autoanticuerpos como los antirreceptores muscarínicos9 y anti alfa fodrina10, han sido descritos.
El factor nuclear κB (NF-κB) es un factor de transcripción que forma parte de una familia de factores de transcripción inducibles que participan en la respuesta inmune y en la inflamación11.
El NF-κB normalmente se encuentra en el citoplasma de las células del sistema inmune o en otros tipos celulares como algunas células epiteliales en forma inactiva formando un complejo con una proteína llamada inhibidor del NF-κB (I-κB), lo cual produce un impedimento estérico que frena la translocación del NF-κB al núcleo y de este modo impide la estimulación de la transcripción de diversos genes.
Distintos estímulos, como las infecciones, lipopolisacaridos, radiación UV o las citoquinas IL-1 y TNF-α, activan una serie de enzimas que en último término producen la activación y liberación del NF-κB que puede ser translocado al núcleo y comenzar la transcripción de una amplia gama de genes que poseen elementos respondedores a NF-κB, entre ellos, genes productores de citoquinas proinflamatorias (TNF-α, IL-6, IL-8), moléculas de adhesión, receptores de citoquinas y moléculas de histocompatibilidad11.
Nuestra hipótesis de trabajo sobre la etiopatogenia en las glándulas salivares accesorias de pacientes con SSp es que los linfocitos que infiltran a la glándula secretan citoquinas proinflamatorias, entre ellas al TNF-α, IL-1 e IL-6, que activarían a receptores específicos para estas citoquinas en las células epiteliales de los acinos y ductos. La activación de estos receptores desencadenaría la activación de la vía de señalización del NF-κB. Este factor de transcripción translocaría al núcleo activando genes proinflamatorios que producirían la secreción citoquinas proinflamatorias al intersticio que autoperpetuaría la respuesta inflamatoria.
Esta hipótesis se basa en que ha sido descrita la participación del NF-κB en el desarrollo de otras enfermedades autoinmunes como la diabetes tipo 1, el lupus eritematoso sistémico y la artritis reumatoidea12.
Además, las células del epitelio glandular tendrían un rol activo en la inducción y perpetuación del proceso inflamatorio8 a través de la expresión de citoquinas proinflamatorias, IL-1 e IL-6, TNF-α, MHC clase II HLA-DR, el protooncogen c-myc y autoantígenos13.
El objetivo de este trabajo fue evaluar en las glándulas salivares menores de pacientes con SSp la translocación nuclear del factor NF–κB en el epitelio acinar y ductal y en los focos inflamatorios de estas glándulas.
Pacientes, materiales y métodosPacientesFueron estudiados 24 pacientes de sexo femenino, entre 39–58 años, provenientes del Servicio de Reumatología del Hospital Bernardino Rivadavia con diagnóstico de SSp según el criterio americano europeo para diagnóstico de SSp14.
Los pacientes fueron diagnosticados como SSp porque presentaban síntomas y signos de ojo seco, síntomas de boca seca y, serología positiva para anticuerpos anti-Ro (SS-A) y/o anti-La (SS-B) sin otra enfermedad asociada14.
En estos pacientes se realizaron biopsias de glándulas salivales menores a través de una incisión horizontal en la mucosa vestibular del labio inferior. Se disecaron 1–2 glándulas salivares menores. Todas las biopsias se fijaron en formol buffer al 10%.
De acuerdo a los hallazgos histopatológicos los pacientes se agruparon en 3 grupos: grupo A: glándula salival con infiltrado linfoplasmocitario focal periacinar y periductal; grupo B: presencia de leucocitos mononucleares y polinucleares neutróficos dispersos en intersticio (sialoadenitis inespecífica), y grupo C: glándula salivar sin alteraciones morfológicas.
El estudio fue aprobado por el comité de ética de la facultad de medicina de la Universidad de Buenos Aires.
Coloración de hematoxilina-eosina (H & E)Todas las glándulas salivales menores humanas fijadas en formol buffer al 10% se incluyeron en parafina, efectuándose cortes de 5μ en micrótomo de deslizamiento Jung (Alemania) y se colorearon con hematoxilina de Harris y eosina acuosa (Biopure, Argentina) según se describió anteriormente15.
Las glándulas salivales menores fueron clasificadas según escore de Chisholm et al que los agrupa en 4 estadíos de acuerdo al número de focos (0=glándula normal, I=sialoadenitis inespecífica, II=presencia de un foco, III=presencia de 2 o más focos y IV=estadío III, más presencia de fibrosis y amplios sectores de destrucción acinar); cada foco debe estar constituido por 50 o más células por 4mm215.
InmunohistoquímicaLa técnica de inmunohistoquímica (IHQ) se realizó en cortes de parafina. Se deparafinizaron e hidrataron los cortes con posterior lavado en buffer fosfato. Se realizó recuperación antigénica en microondas en buffer citrato. Se inhibió la peroxidasa endógena en H2O2 30%. Se incubó con anticuerpo primario NF-κB (cell signalling) a 37°C en cámara húmeda toda la noche. Se lavó en buffer fosfato y se pasó al sistema de detección utilizando el anticuerpo secundario biotinilado (Vectastain Universal ABC kit PK-G200, Lab. Vector) 20′. Se lavó en buffer fosfato y se pasó al sistema de revelado con DAB (Peroxidase Substrate kit SK 4100, Lab. Vector) controlando al microscopio. Se realizó contraste nuclear con hematoxilina, se deshidrató, se aclaró y se montaron los preparados en portaobjetos xilanizados con carga positiva.
Todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en el mismo.
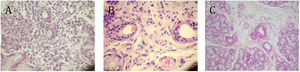
ResultadosEn este estudio nosotros evaluamos biopsias de glándulas salivales menores de 24 pacientes con diagnóstico de SSp. En 12/24 glándulas salivales mostraron infiltrado linfoplasmocitario conformando focos periacinares y periductales, 2/12 presentaron solo un foco linfoplasmocitario, 9/12 mostraron 2 o más focos linfoplasmocitarios y 1/12 con 2 o más focos y amplios sectores con destrucción acinar correspondiendo a estadíos II, III y IV de la clasificación de Chisholm et al15, respectivamente, constituyendo el grupo A de nuestro estudio. (fig. 1A).
Microfotografías representativas de glándulas salivares menores de pacientes con síndrome de Sjögren (SSp). A) Paciente del grupo A, en donde se observa infiltrado linfoplasmocitario focal y atrofia acinar. B) Paciente del grupo B, con sialoadenitis: infiltrado linfoplasmocitario disperso intersticial con presencia de polimorfonucleares. C) Paciente del grupo C, donde se observa glándula con características conservadas sin focos linfoplasmocitarios ni tampoco infiltrado intersticial. HE-40X.
De los 12 pacientes restantes, 7 mostraron infiltrado linfoplasmocitario intersticial disperso en escaso número y de polimorfonucleares neutrófilos realizándose el diagnóstico de sialoadenitis inespecífica y constituyeron el grupo B (fig. 1B) y 5 de ellos presentaron estructura glandular de características normales y constituyeron el grupo C.
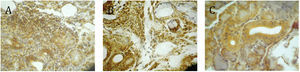
El estudio por inmunohistoquímica para evaluar al factor NF-κB mostró positividad nuclear en los pacientes del grupo A en los infiltrados linfoplasmocitarios y en las células epiteliales acinares y ductales adyacentes a los infiltrados (fig. 2A). No se observó translocación nuclear en los acinos y ductos alejados de los infiltrados, resultando la marcación positiva solo a nivel citoplasmático.
Inmunohistoquímica para factor NF-κB en glándulas salivares menores. A) Paciente del grupo A: se observa translocación nuclear en epitelio acinar y en células linfoplasmocitarias que forman los focos confluentes inflamatorios. B) Paciente grupo B, con sialoadenitis: translocación nuclear en componente inflamatorio intersticial y en el citoplasma del epitelio acinar y ductal. C) Paciente del grupo C: positividad citoplasmática en el epitelio acinar y ductal. (aumento 40×).
En los pacientes con sialoadenitis inespecífica (grupo B) se observó translocación nuclear solo en los leucocitos mononucleares intersticiales y no en los acinos y ductos, donde la positividad se observó en el citoplasma (fig. 2B).
Aquellos pacientes con estructura glandular normal (grupo C) no presentaron translocación nuclear, mostrando positividad solo a nivel citoplasmático (fig. 2C).
DiscusiónEn el presente estudio nosotros demostramos que las glándulas salivales menores de pacientes del grupo A presentan translocación nuclear del factor NF-κB en los linfocitos que forman parte de los focos inflamatorios y en las células epiteliales de los acinos y ductos adyacentes a los mismos, siendo la expresión de la translocación mayor a nivel acinar que ductal. En este grupo, en los acinos y ductos alejados de los focos inflamatorios no se observó translocación nuclear del factor NF-κB.
Los pacientes con igual sintomatología, pero que histológicamente correspondieron a sialadenitis inespecífica, mostraron translocación nuclear del factor NF-κB solo en los linfocitos presentes en el intersticio.
Ningún paciente con diagnóstico de SSp y glándula histológicamente normal mostró translocación nuclear del factor NF-κB.
Estos hallazgos describen la distribución topográfica celular y tisular del NF-κB en glándulas salivales de pacientes con SSp, poniendo en evidencia la importancia de la interacción linfocito célula epitelial a través de la producción de citoquinas linfocitarias y la activación de receptores epiteliales que conduce a la activación y translocación nuclear del NF-κB. Por el contrario, los acinos y ductos alejados del infiltrado inflamatorio no evidenciaron translocación nuclear del factor NF-κB.
En el SSp, el o los mecanismos que llevan a la destrucción progresiva de los acinos sin destrucción de los ductos aún no se conocen.
Numerosas señales son activadas en linfocitos B y T en respuesta a la activación de receptores de superficie (TNF-α, IL-1β, Toll-like) que llevan a la fosforilación y degración del I-kB16 conduciendo a la liberación citoplasmática del NF-κB y subsecuente translocación nuclear de este factor, donde se une a distintos sitios del ADN activando genes de transcripción, entre ellos los que llevan a la síntesis de citocinas (TNF-α, IL-1β, IL-6 e IL-8) así como también moléculas de adhesión, óxido nítrico, Cox2 y metaloproteinasas (MMP)17,18.
La expresión de receptores para TNF-α e IL-1β observada en los acinos, los ductos y en las células que forman parte de los infiltrados inflamatorios en las glándulas salivales menores humanas fue significativamente mayor en pacientes con SSp que en controles normales19.
El TNF-α, IL-1β y la proteína 1 cromosómica de alta movilidad (HMGB-1), están significativamente expresadas a nivel extracelular en relación a los infiltrados mononucleares en las glándulas salivales menores humanas de pacientes con SSp19. La expresión de estas citoquinas pro inflamatorias están mediadas por la activación del NF-κB12,20.
La producción de citoquinas pro inflamatorias por los linfocitos presentes en las glándulas de pacientes con SSp sugeriría que estas citoquinas actuarían sobre las células epiteliales de los acinos y ductos adyacentes induciendo la translocación nuclear del NF-κB.
Sin embargo, otros factores o citoquinas intervendrían en la translocación nuclear del NF-κB en los acinos y ductos de los pacientes con SSp, debido a que en los pacientes con sialoadenitis en donde observamos translocación nuclear del NF-κB en los infiltrados, no fue posible encontrar translocación nuclear del NF-κB en los acinos y ductos adyacentes. Nosotros hipotetizamos que los linfocitos presentes en las glándulas salivales menores de pacientes con SSp podrían ser autoreactivas mientras que los linfocitos presentes en la sialoadenitis no lo serían. Nosotros encontramos que la expresión de translocación nuclear del NF-κB en los acinos de las glándulas estudiadas es mayor que en los ductos. Estos resultados son coincidentes con lo encontrado por otros autores en humanos quienes observaron una mayor disminución de IKB-α y una mayor translocación nuclear del factor NF-κB en los acinos que en los ductos21.
Estos autores también mostraron una relación entre la producción de MMP y la translocación nuclear del factor NF-κB en los acinos inducidos por TNF-α y la IL-1β21. MMP y su inhibidor TIMP son expresadas por los acinos, interviniendo en la destrucción de la matriz extracelular por efectos proteolíticos de las mismas. La expresión y actividad de las MMP-9 y MMP-3 en la matriz extracelular de pacientes con SSp está aumentada, observándose un desbalance entre la actividad de las mismas y su inhibidor (TIMP). El daño acinar es mayor cuando la relación entre MMP/TIMP es alta, siendo independiente del número de focos inflamatorios21.
El factor NF-κB activa a genes asociados con la apoptosis tales como FAS ligando y p538,22. Asimismo, la apoptosis tendría un rol importante a través de la expresión de proteínas reguladoras de la apoptosis. Es de destacar la coexpresión del gen supresor p53 y su factor de transcripción p21 en el epitelio ductal que actuarían como mecanismos de defensa en las células ductales adyacentes a infiltrados linfocitarios previniendo la apoptosis de los mismos no expresados en las células acinares favoreciendo su daño.
Nosotros sugerimos que la translocación nuclear del factor NF-κB en los linfocitos que forman parte de los infiltrados inflamatorios característicos de las glándulas salivales menores de pacientes con SSp induciría la transcripción de genes de citoquinas proinflamatorias, como el TNF-α y el IL-1β con la correspondiente secreción de las mismas al espacio extracelular. Estas citoquinas actuarían sobre receptores en la membrana de las células acinares y ductales adyacentes a los infiltrados induciendo la translocación nuclear del NF-κB en dichas células. Estas citoquinas proinflamatorias no llegarían a activar a las células acinares y ductales distantes al foco inflamatorio.
Respecto a las células acinares y ductales adyacentes a los focos inflamatorios, nosotros también sugerimos que la destrucción acinar sin destrucción ductal podría ser explicada por la mayor producción de MMP en las células acinares respecto de las células ductales y la activación de FAS-FAS ligando en las células acinares, ambos mediados por la translocación del factor NF-κB que explicaría la destrucción progresiva de las células acinares y por otro lado, la integridad de las estructuras ductales estaría protegida por la coexpresión del gen supresor p53 y su factor de transcripción p21, ambos antiapoptóticos.
FinanciaciónUniversidad de Buenos Aires. UBA CyT 403.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Asistencia técnica de Graciela Zaccagnini.