La nefritis lúpica es una causa importante de morbilidad y mortalidad en los pacientes con lupus eritematoso sistémico. El tratamiento convencional de inducción de remisión en la nefritis lúpica grave se basa en la utilización de ciclofosfamida intravenosa mensual. Datos recientes han puesto de manifiesto que se consigue mantener la remisión de la nefritis lúpica con azatioprina o micofenolato, con un menor número de efectos secundarios que con la administración trimestral de ciclofosfamida intravenosa. En los últimos años se han publicado ensayos clínicos controlados y aleatorizados que plantean nuevas modalidades terapéuticas en la inducción de remisión en nefritis lúpica, como la utilización de pautas menos agresivas de ciclofosfamida intravenosa o el uso de micofenolato mofetilo. Son necesarios más estudios para establecer el tratamiento óptimo de los pacientes con nefritis lúpica grave.
Lupus nephritis is a relevant source of morbidity and mortality in patients with systemic lupus erythematosus. The standard therapy of remission induction in severe lupus nephritis is based on the use of monthly intravenous cyclophosphamide. Recent data have established that the maintenance of remission in lupus nephritis can be achieved with azathioprine or mycophenolate mofetil, with less adverse effects than quarterly intravenous cyclophosphamide. In recent years, a number of controlled randomized clinical trials have been published, opening new therapeutic options in the induction of remission in lupus nephritis, such as less aggressive regimens of intravenous cyclophosphamide or mycophenolate mofetil. Further studies are needed for establishing the optimal therapy of lupus nephritis patients.
El lupus eritematoso sistémico (LES) es una enfermedad autoinmunitaria sistémica cuya prevalencia varía con la edad, el sexo y la raza; afecta predominantemente a mujeres jóvenes en edad fértil, particularmente de origen afrocaribeño1,2. La prevalencia de la nefropatía en el momento del diagnóstico de LES es del 16%, y alcanza un 39% durante la evolución de la enfermedad3. La afección renal en el LES es una importante causa de morbimortalidad4,5. De hecho, a los 10 años del diagnóstico, un 5-10% de los pacientes han fallecido y otro 5-15% más han desarrollado insuficiencia renal terminal, incluso habiendo recibido tratamiento convencional6,7.
Ha habido diversos intentos de clasificar la nefritis lúpica (NL). La clasificación más usada es la de la Organización Mundial de la Salud (OMS), de aplicación tanto en ensayos clínicos como en la práctica clínica habitual8. Esta clasificación está basada en los hallazgos histológicos en el glomérulo y el intersticio, y en su progresión. La clasificación anatomopatológica de la NL es de la máxima importancia para definir el pronóstico, y la intensidad y la duración de la terapia necesaria para prevenir la evolución a insuficiencia renal terminal. La enfermedad renal leve (clases II y IIIa) afecta aproximadamente al 35-50%, mientras que las clases IIIb, IV y V afectan al 45-60%. En una minoría significativa de pacientes con NL de clase III (glomerulonefritis proliferativa focal y segmentaria) la función renal empeora y progresan a la clase IV9.
El objetivo en el tratamiento de la NL es suprimir la inflamación y preservar la estructura y la función renal para evitar la progresión a insuficiencia renal. Además, es muy importante minimizar los efectos secundarios. En una primera fase de inducción se pretende la remisión precoz del brote renal y evitar la cronicidad. En la fase de mantenimiento se debe evitar el desarrollo de nuevos brotes renales durante la evolución de la enfermedad.
Actualmente la terapia para la NL grave se basa en dosis altas de glucocorticoides (GC) y diversos fármacos inmunosupresores, de entre los cuales la ciclofosfamida (CF) ha sido el más utilizado.
Tratamiento de inducción de remisión con ciclofosfamidaTradicionalmente se ha considerado la pauta de CF intravenosa (iv) de los National Institutes of Health (NIH) como el tratamiento estándar de inducción para la NL. Esta pauta consiste en la administración de pulsos mensuales iv de 0,5-1g/m2 de superficie corporal durante 6 meses, seguida de dosis trimestrales hasta completar los 2 años de tratamiento, asociando una pauta descendente de GC.
Inicialmente, diversos ensayos clínicos aleatorizados y controlados de los NIH10–14 demostraron que la CF, administrada tanto oralmente como en pulsos iv, era una terapia efectiva en el tratamiento de la NL grave. Los resultados de estos estudios muestran que las pautas de tratamiento que incluyen CF preservan mejor la función renal y disminuyen más la probabilidad de progresión a insuficiencia renal que la monoterapia con GC, aunque no aumentan la supervivencia general de los pacientes. Esta superioridad de la CF sobre otros tratamientos (prednisona sola o prednisona más azatioprina) sólo se pudo observar tras 5 años de seguimiento.
Aún no se ha definido completamente la vía óptima de administración de la CF, su dosis y la duración del tratamiento. En los estudios de los NIH se demostró que la administración iv tenía más eficacia a largo plazo que la administración oral continua, pero la diferencia no fue significativa11. En otro estudio15, en el que se compararon prospectivamente 2 cohortes de pacientes con NL tratados con CF oral continua o en pulsos iv, se demostró que a los 6 y 24 meses tras el tratamiento la administración oral tendía a ser más efectiva, pero el limitado tamaño de la muestra y el corto período de observación no permitieron sacar conclusiones.
También han sido escasos los estudios que han comparado la toxicidad de la CF según la vía de administración. En el estudio de los NIH11 se demostró que la administración iv de CF se asociaba a menor incidencia de amenorrea, cistitis hemorrágica y tumores cuando se comparaba con la administración oral. Un estudio16 más reciente comparó las 2 vías de administración en 29 pacientes con NL, sin hallar diferencias significativas en cuanto a la eficacia y la toxicidad, probablemente debido al reducido tamaño de la muestra.
En los últimos años se ha introducido una nueva pauta de administración iv de CF que reduce la dosis acumulada a 3g, en un intento de disminuir los efectos secundarios del fármaco. En 2002 se publicaron los resultados del Euro-Lupus Nephritis Trial (ELNT)17, un estudio en el que se comparaba la pauta de administración iv de CF de los NIH con una pauta iv a dosis más bajas. Ésta consistía en la administración de 500mg de CF iv cada 15 días durante 3 meses, seguida de azatioprina (AZA) oral durante 2 años. La eficacia fue similar en ambos grupos en el seguimiento a corto17 y largo18 plazo (41 y 73 meses).
Los brotes renales son frecuentes, incluso en los pacientes que tuvieron una respuesta completa al tratamiento7,19,20, aunque no conducen necesariamente a una pérdida de función renal si son tratados nuevamente con fármacos inmunosupresores. Son predictores de nuevos brotes renales la raza negra, el sexo masculino, la edad joven, el bajo nivel socioeconómico, los altos índices de actividad y cronicidad, los valores bajos de complemento, los títulos altos de anticuerpos anti-ADN de doble hebra (anti-ADNdh), la creatinina elevada, la proteinuria en intervalo nefrótico, la anemia grave, la hipertensión y haber tenido una respuesta parcial a la terapia inmunosupresora frente a los que tuvieron una respuesta completa19–21. Es más difícil alcanzar la remisión en pacientes que han tenido un rebrote renal que en aquellos tratados por primera vez20.
La CF ha supuesto, por tanto, un gran avance en el tratamiento de la NL. En los años cincuenta, los pacientes con nefritis lúpica de clase IV raramente vivían más de 5 años, mientras que hoy en día más del 80% sobrevive con una buena función renal a los 10 años22. Sin embargo, su perfil de toxicidad y la falta de respuesta en algunos pacientes hacen necesario buscar nuevas alternativas de tratamiento para la NL. Una revisión sistemática23 concluyó que el principal efecto secundario del tratamiento con CF era la insuficiencia ovárica prematura, que afecta al 47% de las mujeres tratadas con CF y GC, seguido de las infecciones, que aparecían hasta en un 20%. Tampoco se observó que la terapia con CF y GC fuera enteramente efectiva, ya que un 24% dobló la cifra de creatinina, un 16% desarrolló insuficiencia renal terminal y un 21% falleció.
Papel de otros inmunosupresores en la inducción de remisiónMicofenolato mofetiloEl micofenolato mofetilo (MMF) es un potente inmunosupresor que inhibe de manera reversible la inosina monofosfato deshidrogenasa (IMPDH), enzima limitante en la síntesis de novo de purinas, y que se une con gran afinidad a la isoforma de la IMPDH presente en los linfocitos activados. De esta forma, tiene un efecto selectivo en los linfocitos, y por lo tanto, menos potencial de toxicidad hematológica24. Se trata de un fármaco ampliamente utilizado en la prevención del rechazo en trasplante renal. Inicialmente, su uso en NL se reservaba para pacientes que no habían respondido a GC y CF, o que habían presentado una toxicidad inaceptable. Hasta hace pocos años sólo se había publicado algunos estudios no controlados del uso del MMF en la NL25–31. Posteriormente se ha publicado diversos ensayos clínicos aleatorizados en que se compara la eficacia del MMF con la CF como terapia de inducción en la NL 32-36.
Chan et al32 aleatorizaron a 42 pacientes con NL proliferativa difusa a ser tratados con prednisolona y MMF durante 12 meses (21 pacientes) o prednisolona y CF durante 6 meses seguido de prednisolona y AZA durante otros 6 meses (21 pacientes). Se definió remisión completa como una proteinuria inferior a 0,3g en 24h, con sedimento urinario normal, albuminemia normal y valores de creatinina sérica y aclaramiento de creatinina por debajo de un 15% mayor que el valor basal. La remisión parcial fue definida como proteinuria entre 0,3 y 2,9g en 24h, albuminemia de al menos 30g/l y función renal estable. La incidencia de la remisión, completa o parcial, y la duración del tratamiento antes de alcanzar la remisión completa fueron similares en ambos grupos. De los 21 pacientes tratados con MMF y prednisolona, el 81% alcanzó una remisión completa y el 14%, una remisión parcial, comparados con el 76 y el 14%, respectivamente, del grupo tratado con CF y prednisolona seguido de AZA y prednisolona. La mejoría en el grado de proteinuria y en la concentración sérica de albúmina y creatinina fue similar en ambos grupos. La incidencia de infecciones, que también fue similar en los 2 grupos, ocurrió en el 19% de los pacientes tratados con MMF y en el 33% de los tratados con CF (p = 0,29). Otros efectos adversos, como amenorrea (23%), alopecia (19%), leucocitopenia (10%) y muerte (10%), sólo se observaron en el grupo tratado con CF. La tasa de recaídas fue del 15% en el grupo MMF y del 11% en el grupo CF-AZA. Todas ocurrieron pasados los primeros 9 meses, cuando los pacientes estaban recibiendo la terapia de mantenimiento. Posteriormente, los mismos autores publicaron los resultados de un seguimiento a largo plazo33 con 64 pacientes y una media de seguimiento de 63 meses. Más del 90% de los sujetos de cada grupo respondieron favorablemente al tratamiento de inducción (remisión parcial o completa) y ambos grupos mostraron una creatinina sérica estable y comparable a lo largo del tiempo. La proteinuria descendió en ambos grupos, sin diferencias significativas. Tampoco hubo diferencias significativas en cuanto al porcentaje de pacientes que doblaron las cifras de creatinina inicial, desarrollaron insuficiencia renal terminal o tuvieron recaídas. Menos pacientes del grupo MMF tuvieron infecciones que requiriesen tratamiento antibiótico u hospitalización, a pesar de recibir idénticas dosis de corticoides; esta diferencia fue significativa. Nuevamente, sólo se observó insuficiencia renal terminal, muerte, leucocitopenia y alopecia en el grupo CFAZA. Los autores concluyeron que el tratamiento con MMF y prednisolona es seguro, bien tolerado y eficaz como terapia de inducción y mantenimiento en la NL proliferativa difusa.
Hu et al34 diseñaron un ensayo clínico en el que compararon el MMF con la CF iv en 46 pacientes con NL proliferativa difusa de clase IV, durante 6 meses. Los 23 pacientes del grupo MMF no habían respondido o habían recaído tras ser tratados con CF y GC. Se comparó la eficacia clínica y la diferencia en las alteraciones histológicas después del tratamiento. Se hallaron diferencias significativas en cuanto a la reducción de la proteinuria y la hematuria; el MMF fue más eficaz. Tras 3-6 meses de tratamiento, una nueva biopsia renal demostró que el MMF reducía sustancialmente el índice de actividad comparado con la CF. Con respecto a los efectos secundarios, el MMF resultó ser más seguro que la CF.
Ong et al35 también compararon el MMF con la CF iv como terapia de inducción para la NL proliferativa. Incluyeron a 44 pacientes con diagnóstico reciente de NL de clase III o IV y los aleatorizaron a recibir durante 6 meses 2g/día de MMF o 0,75-1g/m2 de CF iv, asociando GC a ambos inmunosupresores. El 52% de los pacientes del grupo CF alcanzaron la remisión frente al 58% del grupo MMF (p = 0,70). Tres (12%) pacientes del grupo CF y 5 (26%) del grupo MMF alcanzaron la remisión completa (p = 0,22). En ambos grupos se redujo la proteinuria y la creatinina sérica se mantuvo estable. Al final del tratamiento se realizaron 24 biopsias renales de seguimiento que mostraron una reducción significativa del índice de actividad en ambos grupos. El índice de cronicidad se incrementó significativamente tras 6 meses en el grupo CF iv, pero no en el MMF. No hubo diferencias en la tasa de efectos adversos entre ambos grupos (p = 0,18).
En el ensayo con mayor número de pacientes publicado hasta el momento en NL proliferativa, Ginzler et al36 compararon el tratamiento con MMF oral (dosis inicial, 1.000mg/día; dosis máxima, 3.000mg/día) con CF iv mensual (0,5g/m2; dosis máxima, 1g/m2) como terapia de inducción para NL activa durante 6 meses. En el análisis por intención de tratar, 16 (22,5%) de los 71 pacientes que recibieron MMF y 4 (5,8%) de los 69 del grupo CF iv alcanzaron la remisión completa (p = 0,005), definida como una mejoría en los valores de creatinina sérica, proteinuria y sedimento hasta alcanzar el 10% de los valores normales. No hubo diferencias en cuanto a la remisión parcial (MMF, 29,6%; CF, 24,6%; p = 0,51) y, durante el seguimiento, tampoco hubo diferencias significativas en la tasa de nuevos brotes renales, insuficiencia renal terminal ni muerte. Se registraron menos infecciones graves y hospitalizaciones en el grupo de pacientes que recibieron MMF. Los investigadores concluyeron, por tanto, que el MMF era más eficaz que la CF iv como terapia de inducción en la NL y que tenía mejor perfil de seguridad.
Un reciente metaanálisis37, en el que se incluyeron estudios aleatorizados con MMF en NL y estudios de cohortes en pacientes con LES y pacientes con LES y NL, concluyó que el tratamiento con MMF oral diario es más efectivo que la CF oral o iv. El tratamiento con MMF consiguió más remisiones (completas y parciales) y produjo menor mortalidad, menos hospitalizaciones y menos efectos secundarios graves, como las infecciones. Además, prácticamente no se registraron casos de amenorrea ni alopecia con el MMF. Este metaanálisis, sin embargo, no proporciona ninguna información sobre qué tipo de pacientes responderán mejor al MMF u otros inmunosupresores, ya que los pacientes más graves fueron excluidos de todos los estudios y la distribución por razas y clase OMS de NL no fue homogénea. Tampoco se puede sacar conclusiones sobre el tratamiento de mantenimiento, al no haber información del seguimiento a largo plazo.
Actualmente se está llevando a cabo el Aspreva Lupus Management Study (ALMS)38, un estudio multicéntrico prospectivo de fase III, aleatorizado y controlado que pretende evaluar la eficacia y la seguridad del MMF tanto como terapia de inducción como de mantenimiento en más de 350 pacientes. En la fase de inducción los pacientes han sido aleatorizados a recibir MMF oral o CF iv asociados a GC durante 24 semanas. En una segunda fase, los pacientes que han presentado una remisión parcial o completa han sido nuevamente aleatorizados a recibir MMF o AZA como terapia de mantenimiento. Los resultados de este estudio probablemente permitirán caracterizar mejor qué grupo de pacientes es susceptible de alcanzar una mejor respuesta al tratamiento con MMF.
AzatioprinaLa AZA es un inmunosupresor relativamente seguro y ampliamente utilizado como ahorrador de esteroides para diferentes manifestaciones del LES, incluida la nefritis lúpica. Tiene la ventaja de que puede ser utilizado durante la gestación, a diferencia de la CF y el MMF. Este inmunosupresor también se ha propuesto como terapia de inducción en la NL, aunque la experiencia es mucho más escasa que con la CF.
Flanc et al23 publicaron en 2004 un metaanálisis de los ensayos aleatorizados y controlados en NL. En su análisis encontraron que la AZA reducía globalmente la mortalidad en pacientes con NL, aunque no disminuía el riesgo de insuficiencia renal terminal. Probablemente este hallazgo se deba a que sólo se incluyeron 3 ensayos39–41 con 78 pacientes en los que se comparaba AZA con GC y, además, estos ensayos fueron realizados en los años setenta, cuando la mortalidad por NL era mucho más alta que en la actualidad. Estudios posteriores no han podido demostrar una diferencia en la mortalidad, probablemente porque la supervivencia de pacientes con NL ha mejorado gracias a la diálisis y el trasplante11. El análisis no encontró relación de la AZA con un incremento en la frecuencia de infecciones graves ni herpes zoster.
Más recientemente, Grootscholten et al42 han publicado los resultados de un ensayo aleatorizado en el que comparaban AZA oral (2mg/kg/día durante 2 años combinados con pulsos iv de metilprednisolona) con pulsos iv de CF (0,75g/m2; 13 pulsos en 2 años) como terapia de inducción en 87 pacientes con NL proliferativa. Durante los primeros 2 años de seguimiento no hubo diferencias en cuanto a la tasa de remisión. Tampoco hubo diferencias entre ambos grupos en cuanto a insuficiencia ovárica prematura, aunque las infecciones, como el herpes zoster, fueron más frecuentes en el grupo AZA. Tras una media de 5,7 años de seguimiento, más pacientes del grupo AZA doblaron la cifra de creatinina inicial, aunque la diferencia entre ambos grupos no fue significativa. Sí hubo diferencias significativas en cuanto a las recaídas, que fueron más frecuentes en el grupo AZA, con un riesgo relativo de 8,8 (intervalo de confianza del 95%, 1,5-31,8). Las biopsias renales realizadas tras 2 años de tratamiento mostraron que la CF retrasaba la progresión de las lesiones crónicas de manera más eficaz que la AZA (p = 0,05)43.
Mantenimiento de remisiónUna vez alcanzada la remisión en pacientes con NL, el objetivo principal es mantenerla, evitando las recaídas y el desarrollo de insuficiencia renal terminal. Actualmente se considera que para mantener la remisión en NL es necesario continuar con terapia inmunosupresora, dado que la tasa de recaídas tras la suspensión de la CF se sitúa en un 10-66% de los pacientes12,20,44,45. Según los estudios de los NIH, la probabilidad acumulada de no desarrollar insuficiencia renal terminal a los 72 meses de seguimiento, después de haber recibido una pauta larga de tratamiento con CF iv, está en el 75-100%10–12,14. Teniendo en cuenta la toxicidad de la CF, principalmente la insuficiencia ovárica prematura46, el grupo de los NIH comparó la eficacia y la seguridad de una pauta corta de CF iv en 6 pulsos mensuales con la misma pauta seguida de aproximadamente 12 pulsos trimestrales más como terapia de mantenimiento. Aunque la incidencia de amenorrea en el grupo de la pauta corta de CF iv fue menor (p = 0,03), la probabilidad acumulada de no desarrollar nuevos brotes renales también fue menor en los pacientes que sólo habían recibido terapia de mantenimiento con GC (el 40 frente al 87%; p < 0,01).
En la última década, se ha constatado que es posible mantener la remisión con otros inmunosupresores, tras administrar una pauta corta inicial con CF iv. Recientemente, Chan et al47 han demostrado que el tratamiento de inducción con CF oral y GC seguido de prednisona a dosis bajas y AZA como mantenimiento también se relaciona con una alta incidencia de remisión completa (el 82% de los 66 pacientes incluidos en el estudio) y mantenimiento de la función renal normal en la población china.
En el ELNT17,18, en que se incluyó principalmente población caucásica, se compararon 2 regímenes de tratamiento de inducción con CF iv (vide supra) seguidos de AZA (2mg/kg/día vía oral) y GC (5–7,5mg/día de prednisolona) como terapia de mantenimiento durante al menos 30 meses. En el seguimiento a 73 meses se vio que la función renal seguía conservada en el 79% de los pacientes (el 80% en los que habían recibido la pauta ELNT de CF y el 77% en los que habían recibido la pauta NIH).
El MMF es también un fármaco útil como terapia de mantenimiento en NL grave tras un régimen de inducción con CF iv. Contreras et al48,49 incluyeron a 59 pacientes, mayoritariamente hispanos y afroamericanos, con NL (12 en clase OMS III, 46 en clase IV y 1 en clase Vb) que recibieron terapia de inducción con CF iv mensual (0,5-1g/m2) y GC. Posteriormente, los pacientes fueron aleatorizados a recibir uno de 3 regímenes de mantenimiento posibles: CF iv trimestral (0,5-1g/m2), AZA oral (1–3mg/kg/día) o MMF oral (500-3.000mg/día) durante 1–3 años. Durante el seguimiento, 4 pacientes fallecieron en el grupo CF y 1 en el grupo MMF. Tres pacientes del grupo CF y uno en cada uno de los otros 2 grupos desarrollaron insuficiencia renal terminal. En el seguimiento a los 72 meses, la probabilidad de muerte o insuficiencia renal terminal fue menor en los grupos MMF y AZA que en el grupo CF (p = 0,05 y p = 0,009, respectivamente). Además, la tasa de supervivencia libre de recaídas fue significativamente mayor en el grupo MMF que en el grupo CF (p = 0,02). Con respecto a la incidencia de efectos adversos, las hospitalizaciones, amenorrea, infecciones, náuseas y los vómitos fueron significativamente más frecuentes en el grupo CF. Los autores concluyeron que, en pacientes con NL proliferativa, la terapia de mantenimiento con MMF o AZA parece ser más eficaz y segura que una pauta larga de tratamiento con CF iv.
Inhibidores de calcineurinaLa ciclosporina A (CsA) y el tacrolimus bloquean la transcripción de la interleucina 2, y así inhiben la activación del linfocito T. Son fármacos desarrollados para la inmunosupresión en órganos trasplantados. La experiencia en NL es todavía muy limitada, por lo que su papel está aún por definir.
Generalmente, la CsA se reserva para casos resistentes a otros inmunosupresores o para los pacientes que han desarrollado una toxicidad grave50,51. Parece ser un fármaco eficaz en el tratamiento de la NL membranosa, ya que mejora la proteinuria y la albúmina sérica52. En un estudio abierto, en el que se incluyó a 11 pacientes con NL de clases III-V, de los que 8 no habían respondido a CF o AZA, se observó una mejoría en la proteinuria y en los títulos de anti-ADNdh tras 1 año de tratamiento50. Tam et al53 trataron a 17 pacientes con NL de clase IV con CsA durante una media de 43,2 meses. De ellos, 7 no habían respondido a CF y 2 a AZA. Observaron reducción de la proteinuria y elevación significativa de la albúmina sérica tras el primer mes de tratamiento. A los 12 meses, la repetición de las biopsias renales mostró mejoría histológica, con cambios tipo OMS II y reducción de los índices de actividad en los 17 pacientes. Más recientemente, Moroni et al54 han publicado los resultados de un ensayo aleatorizado en el que compararon la CsA con la AZA como terapia de mantenimiento en 75 pacientes con NL proliferativa. Los pacientes recibieron GC y CF oral como terapia de inducción y posteriormente fueron aleatorizados a recibir CsA o AZA durante 2 años. Durante el seguimiento a 4 años hubo 7 nuevos brotes en el grupo CsA y 8 en el grupo AZA. Ningún paciente falleció ni desarrolló insuficiencia renal terminal. En ambos grupos se redujo la proteinuria y, en las biopsias renales, hubo una reducción en los índices de actividad y un incremento en los de cronicidad. Los autores concluyeron que tanto la AZA como la CsA son útiles en la terapia de mantenimiento de la NL.
Los posibles efectos secundarios de la CsA incluyen hipertensión, empeoramiento transitorio de la función renal, hirsutismo, hiperplasia gingival, temblores y parestesias52; pero aun así, es un fármaco mejor tolerado que la CF y aproximadamente igual que el MMF54.
El tacrolimus es otro inhibidor de la calcineurina que ha demostrado una potencia de 10 a 100 veces superior a la CsA55. Mok et al56 publicaron en 2005 un estudio abierto sobre el uso del tacrolimus en 9 pacientes con NL proliferativa difusa. A los 6 meses de tratamiento, 6 (67%) alcanzaron remisión completa y 2 (22%) remisión parcial. Se observó una mejoría significativa en proteinuria, hemoglobina, albúmina sérica y C3 en comparación con los valores basales a partir del segundo mes. No se registraron efectos adversos graves. El tacrolimus también se ha probado en pacientes con NL membranosa, con unos prometedores resultados preliminares57.
LeflunomidaLa leflunomida es un inhibidor de la síntesis de novo de pirimidina y de la proliferación de linfocitos T aprobado para el tratamiento de la artritis reumatoide y de la artritis psoriásica. También inhibe la producción de citocinas proinflamatorias como el factor de necrosis tumoral (TNF) alfa y la interleucina 1b58. Se ha visto que es eficaz mejorando la actividad del LES en pequeños estudios retrospectivos y controlados con placebo59,60. En un ensayo prospectivo controlado en el que se incluyó a 47 pacientes con LES de reciente diagnóstico y NL proliferativa confirmada por biopsia se comparó la eficacia de la leflunomida oral con la CF iv en el seguimiento a 6 meses. Ningún paciente había recibido tratamiento inmunosupresor previamente. No se vieron diferencias estadísticamente significativas entre ambos grupos en cuanto a la tasa de remisión completa (el 40% en el grupo leflunomida y el 25% en el grupo CF iv) ni parcial (el 80 y el 75%, respectivamente)61. Un estudio no controlado más reciente demostró que el tratamiento con leflunomida durante un año reducía la proteinuria en 17 pacientes con diferentes clases de NL que no habían respondido a tratamiento con CF, CsA o AZA62. A pesar de estos resultados, se debe tener en cuenta que la leflunomida puede provocar lupus inducido o precipitar lupus cutáneo subagudo55.
Terapia biológicaAbetimus (LJP 394)El LJP 394 fue diseñado para prevenir la recurrencia de brotes renales en pacientes con NL establecida; su mecanismo de acción sería la adsorción selectiva de los anticuerpos anti-ADNdh circulantes y, presumiblemente, patógenos. Es un compuesto sintético formado por 4 secuencias de desoxirribonucleótidos unidas a un núcleo de trietilenglicol63,64. El primer estudio de eficacia, denominado LJP-90-05, se diseñó para evaluar la capacidad del abetimus sódico de prolongar el tiempo transcurrido hasta el siguiente brote renal en una población de pacientes con lupus con un mayor riesgo de brotes renales65. Se incluyó a 230 pacientes con antecedentes de nefritis, que habían experimentado brotes renales en los 4 años precedentes a la inclusión y que tenían anticuerpos anti-ADNdh. Se utilizó una fase de inducción de 16 semanas, en la que los pacientes fueron aleatorizados en una proporción 1:1 a recibir semanalmente 100mg del fármaco o placebo. Esta fase fue seguida por un período de 8 semanas sin fármaco, tras el cual los pacientes recibieron 50mg del fármaco o placebo durante 12 semanas. El estudio continuó durante 18 meses, con 8 semanas sin fármaco tras cada fase de mantenimiento de 12 semanas de tratamiento activo. El tiempo transcurrido hasta un nuevo brote renal y el número de brotes renales no fueron significativamente diferentes en los 2 grupos de tratamiento y el ensayo se interrumpió antes de tiempo. Se observó que los títulos de anticuerpos anti-ADNdh disminuían significativamente más en el grupo tratado con abetimus, con una correlación inversa con los valores de C3. Un análisis de subgrupo en pacientes con anticuerpos de alta afinidad para abetimus puso de manifiesto un período significativamente mayor hasta el nuevo brote renal, con menor número de brotes y disminución de la necesidad de tratamiento posterior con CF iv entre los pacientes tratados con abetimus, en comparación con el grupo placebo. Los efectos secundarios fueron parecidos en ambos grupos. Posteriormente, se diseñó un ensayo parecido en el que se eliminaron los períodos sin tratamiento, y se mantuvo la dosis de 100mg a lo largo de todo el estudio66. En el análisis por intención de tratar se observó que, en la población con anticuerpos de alta afinidad al inicio, el tiempo hasta un nuevo brote renal fue mayor que en el grupo placebo (123 frente a 89 meses, respectivamente) y hubo una reducción del 25% en el número de brotes renales, sin ser estas diferencias estadísticamente significativas. Sí hubo una reducción significativa de los anticuerpos anti-ADNdh en el grupo de tratamiento, mientras que no hubo cambios en el grupo placebo (p < 0,001). Esta reducción se correlacionaba con el aumento de los valores de C3 (p < 0,001). La incidencia de reacciones adversas fue similar entre los 2 grupos. Los resultados de estos 2 estudios indican que los pacientes con LES y con reducción de las concentraciones de anticuerpos anti-ADNdh tienen más probabilidades de presentar menos brotes renales que los pacientes con títulos estables o en aumento de los anticuerpos anti-ADNdh. Además, la reducción mantenida de los títulos de anticuerpos fue aproximadamente de 2 a 4 veces más probable en el grupo tratado con abetimus que en el grupo placebo67. También se han descrito los efectos beneficiosos del abetimus sódico en la calidad de vida68.
Actualmente se está llevando a cabo un nuevo ensayo (LJP 90–014) con abetimus en el que se ha añadido un grupo de tratamiento con dosis de 300mg. Unos resultados positivos de este estudio quizá podrían conllevar la aprobación definitiva del fármaco para el tratamiento de la NL.
InfliximabLas concentraciones de TNFα se correlacionan con la actividad del lupus. El TNFα se expresa en los tejidos renales de pacientes con NL55. En un estudio abierto en el que se incluyó a 6 pacientes con LES (4 de ellos con NL) se vio que la infusión de 4 dosis de 300mg de infliximab mejoraba significativamente la proteinuria69. Sin embargo, las concentraciones de anticuerpos anti-ADNdh y anticardiolipina se elevaron, sin asociarse a un descenso en los valores de complemento. A pesar de ello, no se observó un aumento de la actividad del LES ni de efectos adversos. El mismo grupo ha puesto en marcha un nuevo estudio aleatorizado, a doble ciego y controlado con placebo con infliximab y azatioprina en pacientes con NL membranosa.
Hasta la fecha no hay experiencia con otros anti-TNFα en NL. Se ha diseñado un estudio de fase II aleatorizado y controlado con placebo para evaluar la seguridad y la tolerabilidad del etanercept en pacientes con NL.
RituximabEl rituximab es un anticuerpo monoclonal quimérico dirigido contra el receptor CD20 presente en la superficie de los linfocitos B. Se han publicado numerosos casos anecdóticos y algunos estudios abiertos que indican que el rituximab es eficaz en el tratamiento del LES resistente. En un estudio abierto con 5 pacientes con LES, 3 de ellos con NL, se produjo una mejoría de los parámetros renales en 2 pacientes con una combinación de rituximab, CF y altas dosis de GC70. El mismo grupo publicó los resultados del tratamiento con rituximab en 24 pacientes con LES resistente a terapias convencionales71; 16 pacientes tenían NL proliferativa resistente a CF y MMF. Se vio mejoría en la actividad del LES, los títulos de anti-ADNdh, las concentraciones de C3 y el cociente proteína/creatinina, aunque este último cambio no fue estadísticamente significativo. Otro estudio abierto con 10 pacientes con NL proliferativa mostró respuesta renal en 8 pacientes (5 de ellos entraron en remisión completa a los 3 meses) tras una terapia combinada con rituximab y altas dosis de GC72. Vigna-Pérez et al73 publicaron un estudio abierto en el que incluyeron a 22 pacientes con NL resistente (principalmente de clases III y IV). Se les administró tratamiento con rituximab (0,5-1g en los días 1 y 15) añadido a la terapia inmunosupresora previa. Encontraron una reducción significativa de la actividad del LES (p < 0,05) y de la proteinuria (p < 0,05) a los 60 y 90 días de la primera infusión. No se encontraron diferencias significativas en los valores de complemento ni títulos de anti-ADNdh. Un paciente falleció a los 70 días por una histoplasmosis invasiva. En los demás pacientes no se registraron otros efectos adversos graves. Más recientemente, Gunnarsson et al74 han publicado los resultados de tratar a 7 pacientes con NL proliferativa resistente a CF con una combinación de rituximab y CF. A los 6 meses de tratamiento, se vio una mejoría clínica significativa, con una reducción en la puntuación SLEDAI y en las concentraciones de anticuerpos anti-ADNdh y anti-C1q. En las biopsias repetidas se observó una mejoría en la clase histopatológica de la nefritis en la mayoría de los pacientes y una reducción de los índices renales de actividad.
Aunque no se había observado en ninguno de estos estudios, en diciembre de 2006, la Food and Drug Administration (FDA) comunicó el fallecimiento de 2 pacientes con LES tratados con rituximab, debido a una leucoencefalopatía multifocal progresiva, una infección causada por el virus JC para la que no se dispone de tratamiento eficaz.
Teniendo en cuenta los datos disponibles hasta el momento, todavía son necesarios ensayos clínicos controlados para definir la pauta adecuada de rituximab en pacientes con lupus. Actualmente están en marcha los ensayos clínicos EXPLORER y LUNAR, 2 estudios aleatorizados y controlados con placebo que pretenden valorar la eficacia y la seguridad del rituximab, el primero en LES grave y el segundo en NL proliferativa. Otro pequeño estudio chino de fase II, que pretende incluir a 20 pacientes con LES, comparará 3 brazos de tratamiento: rituximab solo, rituximab + CF y CF sola.
Antiestimulador del linfocito BEl estimulador del linfocito B (BLyS) es un miembro de la familia de las citocinas del TNF que está presente en los linfocitos B. El LymphoStat-B es un anticuerpo monoclonal totalmente humanizado dirigido contra el BLyS. Recientemente se ha completado un ensayo multicéntrico a doble ciego de fase II en el que se compararon diferentes pautas del anticuerpo LymphoStat-B belimumab (1, 4 o 10mg/kg) con placebo en 449 pacientes con LES. Los resultados preliminares de seguimiento a 2 años y medio muestran que el belimumab consigue una mejoría sostenida de la actividad del LES independientemente del estado basal de anticuerpos. Asimismo reduce las concentraciones de autoanticuerpos y eleva los valores de complemento, sin haberse registrado un aumento de los efectos adversos respecto al placebo. Las diferentes dosis de belimumab produjeron una mejoría en la calidad de vida relacionada con la actividad en pacientes seropositivos75–78.
Actualmente se están llevando a cabo 2 nuevos ensayos clínicos de fase III aleatorizados, a doble ciego y controlados con placebo, de 52 y 76 semanas de duración, respectivamente, que evaluarán la eficacia y la seguridad del belimumab en pacientes con LES.
Inmunoglobulinas intravenosas a altas dosisLas inmunoglobulinas (Ig) de administración intravenosa tienen un efecto inmunomodulador mediante la interacción con varios receptores Fcγ, de tal manera que inhiben algunos Fcγ activadores (FcRIIA y FcRIIC) y estimulan otros Fcγ inhibidores (FcRIIB). Otros mecanismos de acción incluyen la inhibición del daño mediado por el complemento, la modulación de citocinas y antagonistas de las citocinas, la modulación de la función de los linfocitos T y B, la inducción de apoptosis en linfocitos y monocitos, la infrarregulación de la producción de autoanticuerpos y la neutralización de los anticuerpos anti-ADN patógenos79. Algunas series de casos indican un papel de las Ig iv en el tratamiento del LES. En el metaanálisis de Zandman-Goddard et al80 se concluyó que la tasa de respuesta al tratamiento con Ig iv en pacientes con LES estaba entre el 33 y el 100%. Se han tratado satisfactoriamente con Ig iv diversas manifestaciones del LES, como la anemia hemolítica autoinmunitaria, la enfermedad de Von Willebrand adquirida, la aplasia pura de células rojas, la aparición de inhibidores adquiridos del factor VIII, la trombocitopenia, la pancitopenia, la mielofibrosis, la neumonitis, el derrame pleural, la pericarditis, la miocarditis, el shock cardiogénico, la nefritis, la enfermedad renal terminal, la encefalitis, el lupus neuropsiquiátrico, la psicosis, las neuropatías periféricas, las polirradiculoneuropatías y la vasculitis. La experiencia en nefritis lúpica es la más extensa79–81. En un estudio aleatorizado con 14 pacientes con NL, la infusión mensual de Ig iv fue igual de eficaz en mantener la remisión a los 18 meses que la CF iv82. En otros estudios no controlados se ha visto que pueden ser efectivas en pacientes con NL membranosa y proliferativa resistente a terapias convencionales, mejorando la proteinuria y las concentraciones de creatinina83–85. El papel de las Ig iv en el tratamiento de la NL, así como su dosis y la duración del tratamiento, está todavía por establecer.
PlasmaféresisLa plasmaféresis se ha utilizado para el tratamiento de la NL proliferativa en asociación a la terapia convencional sin conseguir mejorar la respuesta clínica. En un estudio aleatorizado y controlado se incluyó a 86 pacientes con NL grave; 46 pacientes recibieron tratamiento estándar con CF y GC y otros 40 pacientes recibieron la terapia estándar más plasmaféresis. Aunque en los pacientes tratados con plasmaféresis hubo una reducción más rápida en los títulos de anti-ADNdh y crioglobulinas, en el seguimiento a 2 años, no se hallaron diferencias entre ambos grupos en cuanto a proteinuria, insuficiencia renal o muerte86. En otros ensayos más recientes tampoco se ha visto superioridad de la combinación de plasmaféresis-CF sobre la CF sola en el seguimiento a largo plazo en pacientes con NL, a pesar de que con la asociación de la plasmaféresis se consigue una remisión más rápida87,88.
Medidas adicionalesLos pacientes con NL tienen mayor prevalencia de hipertensión, hiperlipemia y anticuerpos antifosfolipídicos89; por ello, también son objetivos importantes en el tratamiento de la NL el abandono del tabaco, el control estricto de la presión arterial y la hiperlipemia y la reducción en la ingesta proteínica, ya que pueden retardar el deterioro de la función renal55. La proteinuria y la hipertensión han demostrado ser factores de riesgo independientes de daño renal progresivo en pacientes con NL90. Los inhibidores de la enzima de conversión de angiotensina y los antagonistas de los receptores de la angiotensina II disminuyen la presión y mejoran la proteinuria en pacientes con aparente NL quiescente91. El objetivo en pacientes con NL es mantener la presión arterial por debajo de 120/80 mmHg90. Por lo general, los pacientes con NL progresiva tienen elevación de triglicéridos y de colesterol de las lipoproteínas de baja densidad con una reducción en las lipoproteínas de alta densidad92. Se debe tratar la hiperlipemia para evitar un daño vascular acelerado, sobre todo en los pacientes con NL membranosa. Las estatinas, que ya han demostrado ser útiles en pacientes con artritis reumatoide, son la mejor opción, ya que, además de su capacidad para reducir las concentraciones de lípidos en suero, ayudan a mejorar la actividad del LES gracias a sus propiedades inmunomoduladoras55,93,94. Dentro del tratamiento no inmunosupresor de la NL también debe tenerse en cuenta la antiagregación y la anticoagulación, dada la prevalencia aumentada de trombosis arteriales95. Aunque hasta el momento no hay evidencia, se debe recomendar el tratamiento con dosis bajas de ácido acetilsalicílico a los pacientes con anticuerpos antifosfolipídicos o evidencia de nefropatía asociada al síndrome antifosfolipídico para prevenir la tromboembolia de la arteria renal. Los pacientes con síndrome nefrótico persistente resistente al tratamiento deben recibir anticoagulación, sobre todo si presentan anticuerpos antifosfolipídics55,93,96.
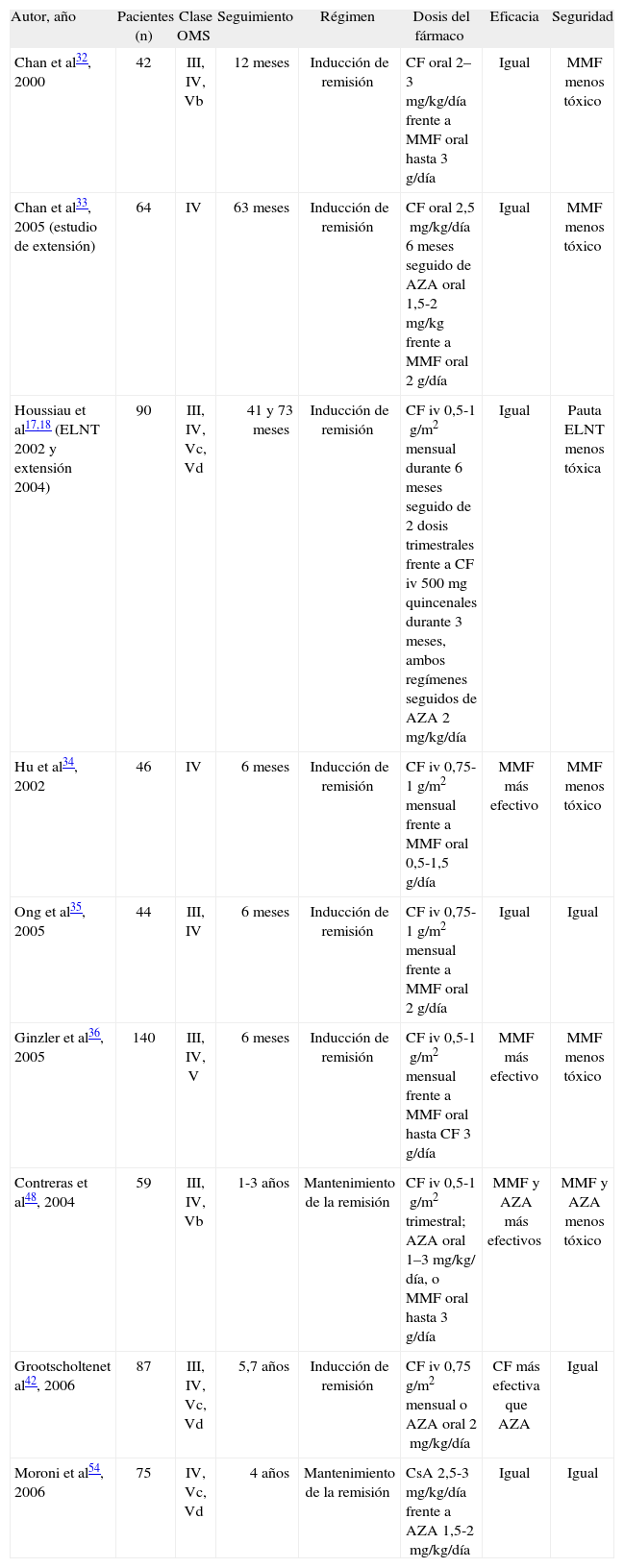
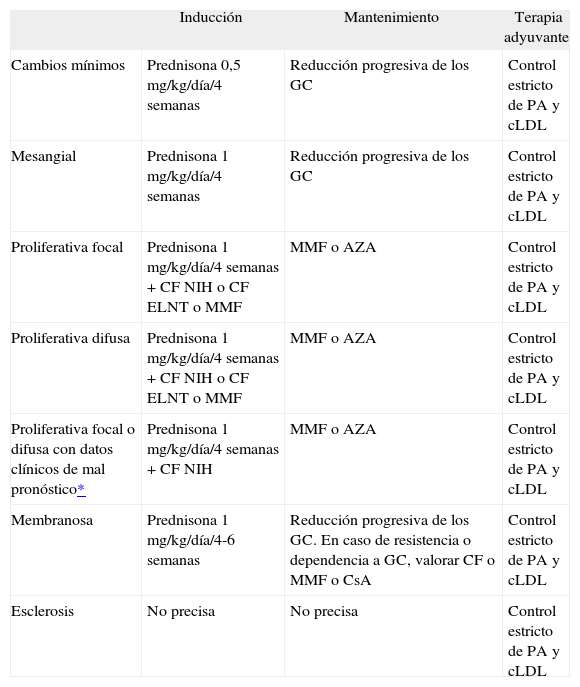
ConclusionesLa nefritis grave, proliferativa o membranosa, continúa siendo una causa frecuente de morbimortalidad en los pacientes con LES. Hasta hace pocos años, el tratamiento convencional de la NL grave consistía en la administración de CF intravenosa durante 2 años. Este tratamiento es eficaz en un significativo porcentaje de pacientes, pero no se encuentra exento de efectos secundarios serios y recidivas frecuentes de la afección renal. En los últimos años se ha publicado un considerable número de ensayos clínicos controlados en pacientes con NL; estos estudios han aportado valiosa información sobre alternativas terapéuticas a la CF intravenosa mensual. Actualmente la inducción de remisión en la nefritis lúpica grave puede conseguirse tanto con MMF como con CF, con la pauta convencional de los NIH o con la pauta europea del estudio ELNT (tabla 1). La elección de la terapia de inducción óptima debería basarse en una valoración cuidadosa de las características clínicas y anatomopatológicas de la NL (tabla 2). Tras alcanzar la remisión, ésta puede mantenerse de una forma eficaz y segura con la utilización durante 2 años de AZA o MMF (tabla 1). Numerosos agentes, como los inhibidores de calcineurina, la leflunomida, las inmunoglobulinas a dosis elevadas o los anticuerpos monoclonales antilinfocito B o anti-TNF podrían ser de utilidad en enfermos seleccionados, con resistencia a pautas de tratamientos más contrastadas, como la CF, la AZA o el MMF. El lugar de estas nuevas terapias en el arsenal terapéutico de la NL deberá precisarse mediante la realización de estudios controlados y aleatorizados. Aún permanecen sin contestar numerosas y esenciales preguntas, como cuál es la terapia de inducción y mantenimiento óptima, cuánto tiempo se deben mantener los diferentes agentes inmunosupresores, el papel de las biopsias renales repetidas en el diseño individualizado de las terapias de mantenimiento, el papel de los diferentes agentes biológicos que han irrumpido con fuerza en el escenario de la terapia del LES o la utilidad de la estratificación genotípica o fenotípica de los pacientes y sus implicaciones terapéuticas y pronósticas. Estamos asistiendo a una época fascinante en la que está cambiando nuestra forma de tratar la nefritis lúpica, mientras se abren nuevos interrogantes sobre el manejo óptimo de esta frecuente y grave manifestación del LES.
Nefritis lúpica: recientes ensayos aleatorizados y controlados de especial relevancia clínica
| Autor, año | Pacientes (n) | Clase OMS | Seguimiento | Régimen | Dosis del fármaco | Eficacia | Seguridad |
| Chan et al32, 2000 | 42 | III, IV, Vb | 12 meses | Inducción de remisión | CF oral 2–3mg/kg/día frente a MMF oral hasta 3g/día | Igual | MMF menos tóxico |
| Chan et al33, 2005 (estudio de extensión) | 64 | IV | 63 meses | Inducción de remisión | CF oral 2,5mg/kg/día 6 meses seguido de AZA oral 1,5-2mg/kg frente a MMF oral 2g/día | Igual | MMF menos tóxico |
| Houssiau et al17,18 (ELNT 2002 y extensión 2004) | 90 | III, IV, Vc, Vd | 41 y 73 meses | Inducción de remisión | CF iv 0,5-1g/m2 mensual durante 6 meses seguido de 2 dosis trimestrales frente a CF iv 500mg quincenales durante 3 meses, ambos regímenes seguidos de AZA 2mg/kg/día | Igual | Pauta ELNT menos tóxica |
| Hu et al34, 2002 | 46 | IV | 6 meses | Inducción de remisión | CF iv 0,75-1g/m2 mensual frente a MMF oral 0,5-1,5g/día | MMF más efectivo | MMF menos tóxico |
| Ong et al35, 2005 | 44 | III, IV | 6 meses | Inducción de remisión | CF iv 0,75-1g/m2 mensual frente a MMF oral 2g/día | Igual | Igual |
| Ginzler et al36, 2005 | 140 | III, IV, V | 6 meses | Inducción de remisión | CF iv 0,5-1g/m2 mensual frente a MMF oral hasta CF 3g/día | MMF más efectivo | MMF menos tóxico |
| Contreras et al48, 2004 | 59 | III, IV, Vb | 1-3 años | Mantenimiento de la remisión | CF iv 0,5-1g/m2 trimestral; AZA oral 1–3mg/kg/ día, o MMF oral hasta 3g/día | MMF y AZA más efectivos | MMF y AZA menos tóxico |
| Grootscholtenet al42, 2006 | 87 | III, IV, Vc, Vd | 5,7 años | Inducción de remisión | CF iv 0,75g/m2 mensual o AZA oral 2mg/kg/día | CF más efectiva que AZA | Igual |
| Moroni et al54, 2006 | 75 | IV, Vc, Vd | 4 años | Mantenimiento de la remisión | CsA 2,5-3mg/kg/día frente a AZA 1,5-2mg/kg/día | Igual | Igual |
AZA: azatioprina; CF: ciclofosfamida; CsA: ciclosporina A; ELNT: EuroLupus Nephritis Trial; iv: intravenoso MMF: micofenolato mofetilo. OMS: Organización Mundial de la Salud.
Propuesta de tratamiento de la nefritis lúpica según sus características clínicas y anatomopatológicas
| Inducción | Mantenimiento | Terapia adyuvante | |
| Cambios mínimos | Prednisona 0,5mg/kg/día/4 semanas | Reducción progresiva de los GC | Control estricto de PA y cLDL |
| Mesangial | Prednisona 1mg/kg/día/4 semanas | Reducción progresiva de los GC | Control estricto de PA y cLDL |
| Proliferativa focal | Prednisona 1mg/kg/día/4 semanas + CF NIH o CF ELNT o MMF | MMF o AZA | Control estricto de PA y cLDL |
| Proliferativa difusa | Prednisona 1mg/kg/día/4 semanas + CF NIH o CF ELNT o MMF | MMF o AZA | Control estricto de PA y cLDL |
| Proliferativa focal o difusa con datos clínicos de mal pronóstico* | Prednisona 1mg/kg/día/4 semanas + CF NIH | MMF o AZA | Control estricto de PA y cLDL |
| Membranosa | Prednisona 1mg/kg/día/4-6 semanas | Reducción progresiva de los GC. En caso de resistencia o dependencia a GC, valorar CF o MMF o CsA | Control estricto de PA y cLDL |
| Esclerosis | No precisa | No precisa | Control estricto de PA y cLDL |
AZA: azatioprina; CF: ciclofosfamida; cLDL: colesterol ligado a las lipoproteínas de baja densidad; CsA: ciclosporina A; ELNT: EuroLupus Nephritis Trial; GC: glucocorticoides; MMF: micofenolato mofetilo; NIH: National Institutes of Health; PA: presión arterial.
Lucía Silva Fernández ha recibido una beca de ayuda de la Fundación Española de Reumatología.