Evaluar la utilidad de la determinación de concentraciones séricas (Cs) de adalimumab (ADA) como factor predictor de la adherencia al fármaco medida a través de la tasa de posesión de medicación (TPM) y del test de Morisky Green (MG) en pacientes con enfermedades crónicas inflamatorias.
Material y métodoDiseño prospectivo, descriptivo de cohortes. Criterios de inclusión: pacientes adultos con artropatías inflamatorias (AI) o enfermedad inflamatoria intestinal (EII) en tratamiento con ADA. Criterios de exclusión: pacientes con anticuerpos anti-ADA. Variables: sexo, edad, diagnóstico, pauta posológica, Cs (μg/ml), TPM (TPM ≥ 80% adherentes), y resultado del test de MG (no adherente o adherente). El análisis estadístico se realizó mediante STATA v13.0.
ResultadosCuarenta y cinco pacientes (23 mujeres) con edad de 52,22 (14,39) años, 17 EII (37,78%), 26 AI (57,78%) y 2 con ambas enfermedades (4,44%) tratados con ADA cada 14 días (42/45,93,33%) o cada 7 días (3/45;6,67%).
Se detectaron Cs infraterapéuticas en el 22,22% pacientes (10/45): el 10% (1/10) se clasifican como no adherentes y el 90% (9/10) como adherentes según MG y TPM.
La Cs con la TPM, así como los métodos indirectos entre sí (TPM y MG) presentaron un índice de acuerdo débil, siendo la asociación ligeramente superior al relacionar los métodos indirectos entre sí (0,244 vs. 0,378).
ConclusiónLa determinación de Cs de ADA presenta, por sí sola, una utilidad limitada en la detección de pacientes no adherentes.
to evaluate the usefulness of serum concentrations (Sc) of adalimumab (ADA) as a predictor of medication adherence using the medication possession ratio (MPR) and Morisky Green test (MGT) in patients with chronic inflammatory diseases.
Material and methodDesign a prospective descriptive cohort study. Inclusion criteria: adult patients diagnosed with inflammatory arthropathy (IA) or inflammatory bowel disease (IBD) treated with ADA. Exclusion criteria: positive anti-adalimumab antibody. Variables: sex, age, diagnosis, dosage regimen, Sc (mg/mL), MPR (MPR ≥ 80% adherent) and MGT (non-adherent or adherent). Statistical analysis was performed using STATA v13.0.
ResultsForty-five patients (23 women) with an age of 52.22 (14.39) years, 17 IBD (37.78%), 26 IA (57.78%) and 2 with both conditions (4.44%) treated with 40mg ADA every 14 days (42/45; 93.33%) or every 7 days (3/45; 6.67%).
We detected subtherapeutic Sc in 22.22% of patients (10/45); 10% (1/10) were classified as non-adherent and 90% (9/10) as adherent according to MGT and MPR.
The quantification of Sc shows weak agreement with MPR, as was the case with the indirect methods of each (MPR and MGT). The association was slightly greater when the indirect methods were compared to each other (0.244 vs. 0.378).
Conclusionthe determination of Sc of ADA alone has limited utility in the detection of non-adherent patients.
Las artropatías inflamatorias (AI) y la enfermedad inflamatoria intestinal (EII) son enfermedades inflamatorias caracterizadas por su relativa alta prevalencia en la población, su curso crónico y su potencial discapacitante, originando un gran impacto en la calidad de vida y la funcionalidad de las personas que las presentan1. El manejo de estas enfermedades ha experimentado una revolución a raíz de la introducción de las terapias biológicas, en especial las dirigidas frente al factor de necrosis tumoral alfa (anti-TNF-α), que son con frecuencia autoadministradas por el paciente por vía subcutánea, en pautas posológicas de frecuencia semanal, quincenal, etc.
Según diversos autores, la adherencia al tratamiento se considera un factor clave en la respuesta al mismo, asociado con mayores tasas de efectividad2,3 y, por lo tanto, con un impacto directo en el control de estas enfermedades crónicas. La falta de adherencia a los tratamientos constituye un problema prioritario para la Organización Mundial de la Salud (OMS), debido a su elevada prevalencia y a su relación con un peor control de la enfermedad, un incremento de morbimortalidad4, una reducción de la calidad de vida de los pacientes y un incremento del gasto sanitario5. Las tasas de adherencia son muy variables entre los diferentes estudios6, oscilando entre un 70% en pacientes con artritis reumatoide (AR)7 y un 85% en enfermedad de Crohn (EC)8. Asimismo, se observa que la adherencia suele ser máxima al inicio de los tratamientos crónicos, existiendo peor cumplimiento cuanto más prolongado es el mismo9. Una revisión realizada por la colaboración Cochrane10 concluyó que una mejora en la adherencia al tratamiento puede presentar incluso un mayor impacto sobre los resultados clínicos que el tratamiento con un nuevo fármaco innovador. Conscientes de la relevancia de este factor clave, los equipos interdisciplinares en los que se integran los farmacéuticos hospitalarios, realizan campañas de fomento de la corresponsabilización del paciente en el cuidado de su salud (autocuidado, adherencia, etc.), en línea con las conclusiones del proyecto MAPEX11.
En la actualidad, no existe un método único que sea considerado de referencia en la medida de la adherencia, por lo que se deben utilizar varios de ellos con el fin de paliar las limitaciones que todos muestran12. Los métodos disponibles se dividen en: 1) objetivos directos, basados en la cuantificación de un fármaco en algún fluido biológico a través de la determinación de Cs de ADA; 2) objetivos indirectos, como la tasa de posesión de medicación (TPM), y 3) subjetivos indirectos, basados en técnicas de entrevista clínica a través de cuestionarios como el test de Morisky Green (MG)13.
Hasta el momento existen escasas evidencias en cuanto a la relación existente entre los diferentes métodos disponibles de medida de la adherencia. Así pues, el presente estudio se planteó con el objetivo de evaluar la utilidad de la determinación de concentraciones séricas (Cs) de adalimumab (ADA) como factor predictor de la adherencia al fármaco medida a través de la TPM y del test de MG, así como la concordancia entre ambos métodos indirectos entre sí, en pacientes con enfermedades crónicas inflamatorias.
Material y métodosEstudio prospectivo descriptivo de cohortes realizado en un hospital general universitario público perteneciente a un departamento de salud de 270.000 habitantes, con 129 pacientes tratados con terapias biológicas con indicación en EII y 331 en AI en el año 2015. La duración del estudio fue de 16 meses: desde noviembre del 2014, momento de inicio de la implantación de la determinación de Cs de fármacos biológicos, hasta febrero del 2016.
Se incluyó a pacientes adultos diagnosticados de AI (AR, artritis psoriásica [APs] o espondilitis anquilosante [EA]) o EII (enfermedad de Crohn [EC] o colitis ulcerosa [CU]) en tratamiento con ADA durante un mínimo de 6 meses y candidatos a determinación de Cs con base en criterios de efectividad, seguridad, eficiencia o sospecha de falta de adherencia al tratamiento, según criterio del facultativo prescriptor durante el periodo de duración del estudio.
Se excluyó a aquellos pacientes en los que no se disponía de valoración de la adherencia a través del test de MG, por falta de disponibilidad del mismo en el momento de la extracción de la muestra, así como a aquellos que presentaron anticuerpos anti-ADA positivos (> 10 ng/ml). En los pacientes con 2determinaciones de Cs durante el periodo de estudio, solo se incluyó el resultado de las variables estudiadas en la primera determinación.
Las variables demográficas recogidas fueron sexo y edad, así como el diagnóstico y las variables relacionadas con el tratamiento: línea de tratamiento biológico, tiempo en tratamiento con ADA, pauta posológica y tratamiento concomitante con inmunomoduladores (INM), derivados del ácido 5-aminosalicílico (5-ASA) o glucocorticoides.
Para la valoración de la adherencia se emplearon 3métodos:
- 1)
Determinación de Cs (objetivo directo): obtención de Cs de ADA (μg/ml) determinadas a través de ELISA test (Promonitor®, Progenika Biopharma Grifols S.A., España). El intervalo terapéutico (IT) se estableció en: 5-8 μg/ml14 en AI y 6-8 μg/ml15 en EII. Se consideraron concentraciones infraterapéuticas aquellas que se situaron por debajo de 5 μg/ml en pacientes con AI y por debajo de 6 μg/ml en pacientes con EII.
- 2)
TPM (objetivo indirecto) en los 6 meses previos al momento de la determinación de Cs, calculado como: número unidades dispensadas×intervalo posológico (días)/días transcurridos entre dispensaciones en un período aproximado de 6 meses previos al momento de la monitorización×100 (%). Se consideró pacientes adherentes al tratamiento a aquellos con un porcentaje de TPM ≥ 80%, y no adherentes a aquellos con un TPM <80%. En estos últimos se verificó, a través de la revisión de la historia clínica, la ausencia de motivos que impidieran la administración del tratamiento durante los 6 meses previos a la monitorización (p. ej., contraindicación del tratamiento por infección grave).
- 3)
Test de MG (subjetivo indirecto) en el momento de la monitorización. Se consideró a los pacientes no adherentes aquellos que contestaron «sí» al menos a una de las siguientes preguntas: a) «¿Olvida alguna vez tomar los medicamentos para tratar su enfermedad?»; b) «¿Olvida tomar los medicamentos a las horas indicadas?»; c) «Cuando se encuentra bien, ¿deja de tomar la medicación?», y d) «Si alguna vez le sienta mal, ¿deja usted de tomar la medicación?».
Las fuentes de información fueron: los resultados de las determinaciones de Cs registrados en i-GestLab® (Cointec Ingenieros y Consultores, S.L.), el registro de dispensaciones de tratamiento recogidos a partir de la historia farmacoterapéutica en el aplicativo Farmasyst® (APD, Algoritmos Procesos y Diseños S.A.), el cuaderno de recogida de datos en el que se incluía el test de MG, cumplimentado por el facultativo prescriptor y el personal de enfermería, así como la historia clínica electrónica del aplicativo informático Orion Clinic® (Everis Spain S.L.U.).
Las variables categóricas se describieron a través de frecuencias (%) y las cuantitativas a través de medias y desviaciones estándar (DE). Los resultados de la determinación de Cs se estudiaron como variable dicotómica: infraterapéuticas o dentro del IT/supraterapéuticas, comparándose con el resultado del MG (%) y de la TPM (%), también como variables dicotómicas, a través de una χ2 de Pearson. A continuación, se comparó la media de Cs para cada uno de los grupos, en función del resultado del MG (%) y de la TPM (%), a través de una t de Student.
Se determinaron los porcentajes de pacientes con Cs infraterapéuticas y no adherentes, a través de los diferentes métodos de medida, según sexo (comparándose a través de la χ2 de Pearson), edad y tiempo en tratamiento (a través de una t de Student).
Se consideró un nivel de significación de al menos 0,05 para todas las pruebas estadísticas. El análisis estadístico se realizó mediante el paquete estadístico STATA v13.0.
Con el fin de estudiar los índices de acuerdo entre los diferentes métodos de medida, se emplearon los índices de acuerdo global, específico positivo y negativo, así como el índice PABAK (equivalente al índice kappa ajustando por sesgo y prevalencia), que considera: <0,10 acuerdo ausente, 0,11-0,40 débil, 0,41-0,60 discreto, 0,61-0,80 moderado y 0,81-1 acuerdo perfecto16,17.
El presente estudio cumplió con la Declaración de Helsinki y sus revisiones posteriores. Todos los pacientes participantes fueron informados debidamente y cumplimentaron y firmaron por duplicado el consentimiento informado. Los investigadores asignaron un código de identificación a cada uno de sus pacientes para así mantener la confidencialidad de los datos de acuerdo con la normativa vigente (RD 1720/2007 que desarrolla la Ley Orgánica 15/1999, de 13 de diciembre, de Protección de datos de carácter personal). El proyecto fue aprobado por el Comité Ético de Investigación Clínica del hospital.
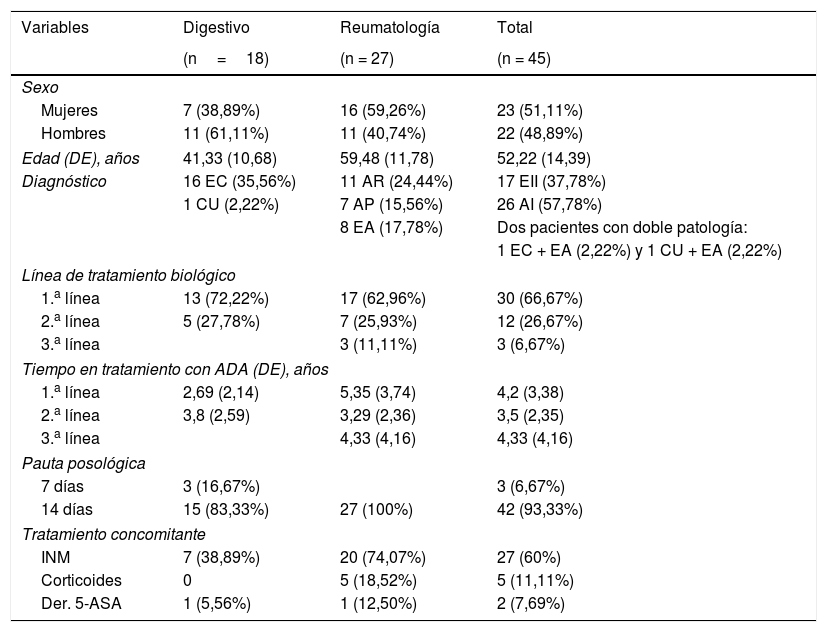
ResultadosDurante los 16 meses de duración del estudio se reclutó a 50 pacientes; 5 pacientes presentaron anticuerpos anti-ADA (> 10 ng/ml), por lo que fueron excluidos del estudio. Las características demográficas, diagnósticas y relacionadas con el tratamiento de los 45 pacientes incluidos se resumen en la tabla 1.
Variables demográficas, diagnósticas y relacionadas con el tratamiento
| Variables | Digestivo | Reumatología | Total |
|---|---|---|---|
| (n=18) | (n = 27) | (n = 45) | |
| Sexo | |||
| Mujeres | 7 (38,89%) | 16 (59,26%) | 23 (51,11%) |
| Hombres | 11 (61,11%) | 11 (40,74%) | 22 (48,89%) |
| Edad (DE), años | 41,33 (10,68) | 59,48 (11,78) | 52,22 (14,39) |
| Diagnóstico | 16 EC (35,56%) | 11 AR (24,44%) | 17 EII (37,78%) |
| 1 CU (2,22%) | 7 AP (15,56%) | 26 AI (57,78%) | |
| 8 EA (17,78%) | Dos pacientes con doble patología: | ||
| 1 EC + EA (2,22%) y 1 CU + EA (2,22%) | |||
| Línea de tratamiento biológico | |||
| 1.a línea | 13 (72,22%) | 17 (62,96%) | 30 (66,67%) |
| 2.a línea | 5 (27,78%) | 7 (25,93%) | 12 (26,67%) |
| 3.a línea | 3 (11,11%) | 3 (6,67%) | |
| Tiempo en tratamiento con ADA (DE), años | |||
| 1.a línea | 2,69 (2,14) | 5,35 (3,74) | 4,2 (3,38) |
| 2.a línea | 3,8 (2,59) | 3,29 (2,36) | 3,5 (2,35) |
| 3.a línea | 4,33 (4,16) | 4,33 (4,16) | |
| Pauta posológica | |||
| 7 días | 3 (16,67%) | 3 (6,67%) | |
| 14 días | 15 (83,33%) | 27 (100%) | 42 (93,33%) |
| Tratamiento concomitante | |||
| INM | 7 (38,89%) | 20 (74,07%) | 27 (60%) |
| Corticoides | 0 | 5 (18,52%) | 5 (11,11%) |
| Der. 5-ASA | 1 (5,56%) | 1 (12,50%) | 2 (7,69%) |
ADA: adalimumab; AI: artropatías inflamatorias; APs: artritis psoriásica; AR: artritis reumatoide; CU: colitis ulcerosa; DE: desviación estándar; Der. 5-ASA: derivados de ácido 5-aminosalicílico; EA: espondilitis anquilosante; EC: enfermedad de Crohn; EII: enfermedad inflamatoria intestinal; INM: inmunomoduladores.
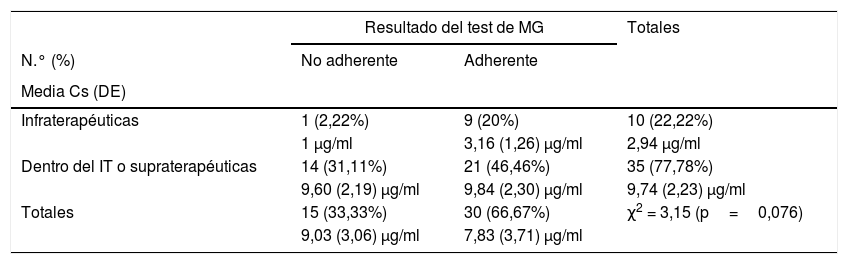
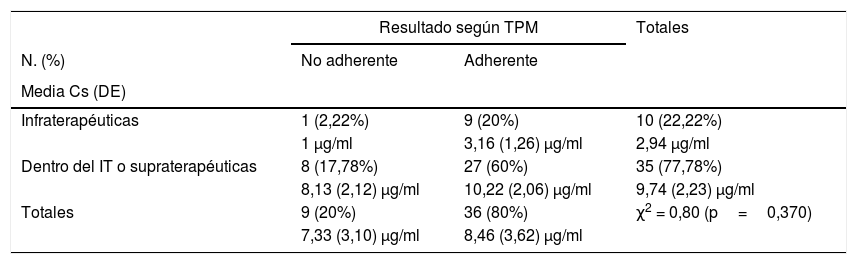
Se detectaron concentraciones infraterapéuticas de ADA en el 22,22% (10/45) de los pacientes, de los cuales solo uno (1/10; 10%) fue considerado como no adherente según el test de MG (χ2=3,15; p=0,076) y la TPM (χ2=0,80; p=0,370), tal y como se describe en las tablas 2 y 3. Dentro de este subgrupo, la Cs fue inferior en el paciente clasificado como no adherente (Cs 1 μg/ml) frente a aquellos clasificados como adherentes (3,16 [1,26] μg/ml) a través de cualquiera de los 2métodos indirectos empleados.
Resultados de la determinación de Cs (porcentaje de pacientes y concentraciones plasmáticas medias con desviación estándar) y del MG
| Resultado del test de MG | Totales | ||
|---|---|---|---|
| N.° (%) | No adherente | Adherente | |
| Media Cs (DE) | |||
| Infraterapéuticas | 1 (2,22%) | 9 (20%) | 10 (22,22%) |
| 1 μg/ml | 3,16 (1,26) μg/ml | 2,94 μg/ml | |
| Dentro del IT o supraterapéuticas | 14 (31,11%) | 21 (46,46%) | 35 (77,78%) |
| 9,60 (2,19) μg/ml | 9,84 (2,30) μg/ml | 9,74 (2,23) μg/ml | |
| Totales | 15 (33,33%) | 30 (66,67%) | χ2 = 3,15 (p=0,076) |
| 9,03 (3,06) μg/ml | 7,83 (3,71) μg/ml | ||
Cs: concentración sérica; DE: desviación estándar; IT: intervalo terapéutico; MG: test de Morisky Green (MG).
Resultados de la determinación de Cs (porcentaje de pacientes y concentraciones plasmáticas medias con desviación estándar) y de la TPM
| Resultado según TPM | Totales | ||
|---|---|---|---|
| N. (%) | No adherente | Adherente | |
| Media Cs (DE) | |||
| Infraterapéuticas | 1 (2,22%) | 9 (20%) | 10 (22,22%) |
| 1 μg/ml | 3,16 (1,26) μg/ml | 2,94 μg/ml | |
| Dentro del IT o supraterapéuticas | 8 (17,78%) | 27 (60%) | 35 (77,78%) |
| 8,13 (2,12) μg/ml | 10,22 (2,06) μg/ml | 9,74 (2,23) μg/ml | |
| Totales | 9 (20%) | 36 (80%) | χ2 = 0,80 (p=0,370) |
| 7,33 (3,10) μg/ml | 8,46 (3,62) μg/ml | ||
Cs: concentración sérica; DE: desviación estándar; IT: intervalo terapéutico; TPM: tasa de posesión de medicación.
Al estratificar según el número de respuestas que definieron a los pacientes como no adherentes según el test de MG (15/45; 33,33%), el 86,67% (13/15) fue clasificado como no adherentes por contestar «sí» a una de las preguntas, mientras que el 13,33% (2/15) restante contestó afirmativamente a 2 o 3 preguntas. De entre las 18 respuestas afirmativas, la distribución de cada una de ellas fue: pregunta b 61,11% (11/18), pregunta a 27,78% (5/18), pregunta c 5,56% (1/18) y pregunta d 5,56% (1/18). El único paciente con 3 respuestas afirmativas en el test de MG presentó concentraciones infraterapéuticas de ADA.
Estratificando por la variable sexo, 5 mujeres (21,74%) y 5 hombres (22,73%) presentaron Cs infraterapéuticas; resultados similares a los aportados por la TPM, siendo 4 mujeres (17,39%) y 5 hombres (22,73%) considerados como no adherentes a través de este método. Según el test de MG, el 26,67% (4/23) de las mujeres y el 50% (11/22) de los hombres fueron considerados como no adherentes (χ2 = 5,380; p = 0,020). Ni la edad del paciente ni el tiempo de tratamiento con el fármaco se relacionaron con los diferentes resultados de medida de la adherencia, excepto en el caso de la relación entre el tiempo de tratamiento con ADA y la TPM, que fue de 7,11 (3,14) años de tratamiento con ADA en el grupo de no adherentes vs. 3,25 (2,64) años en el grupo de adherentes (t=3,776; p=0,001).
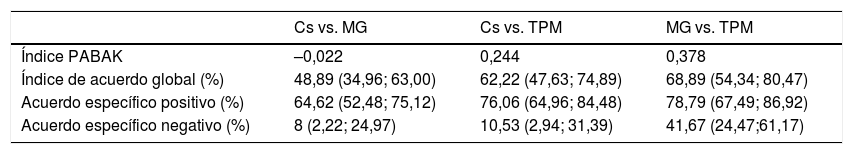
Los índices de acuerdo entre los diferentes métodos de medida de la adherencia se detallan en la tabla 4. La Cs con la TPM, así como los métodos indirectos entre sí (TMP y MG) presentaron un índice de acuerdo débil, siendo la asociación ligeramente superior al relacionar los métodos indirectos entre sí (0,244 vs. 0,378), lo cual coincide con un mayor índice de acuerdo global y específicos.
Resultados de los índices de acuerdo entre los diferentes métodos de medida de la adherencia
| Cs vs. MG | Cs vs. TPM | MG vs. TPM | |
|---|---|---|---|
| Índice PABAK | –0,022 | 0,244 | 0,378 |
| Índice de acuerdo global (%) | 48,89 (34,96; 63,00) | 62,22 (47,63; 74,89) | 68,89 (54,34; 80,47) |
| Acuerdo específico positivo (%) | 64,62 (52,48; 75,12) | 76,06 (64,96; 84,48) | 78,79 (67,49; 86,92) |
| Acuerdo específico negativo (%) | 8 (2,22; 24,97) | 10,53 (2,94; 31,39) | 41,67 (24,47;61,17) |
Cs: concentración sérica; MG: test de Morisky Green; TPM: tasa de posesión de medicación.
Resulta evidente que la adherencia condiciona la efectividad de los fármacos. No obstante, su medida resulta complicada y controvertida, puesto que no existe un método ideal que permita valorarla; por tanto, determinar el mejor método de medida de la adherencia en pacientes crónicos es una meta fundamental para los profesionales de la salud. En una revisión sistemática llevada a cabo en 2011 en pacientes con AR, según los autores, los métodos de medida de la adherencia eran poco claros y muy variables entre los diferentes estudios incluidos18, lo cual resulta de las diferentes concepciones de la adherencia que cada uno de ellos evalúa.
Se ha planteado que la mejor aproximación resulta de combinar métodos directos e indirectos de medida, cuyo uso simultáneo minimiza las limitaciones e incrementa la exactitud19. En el presente estudio evaluamos la relación entre la adherencia al fármaco medida a través de un método directo (Cs) y 2métodos indirectos (test de MG y TPM), a fin de establecer la utilidad de la determinación de Cs de ADA como factor predictor de la adherencia al tratamiento.
La medición de la adherencia, idealmente evaluada a través de la combinación de métodos directos e indirectos, debe formar parte del plan farmacoterapéutico de los pacientes en tratamiento con fármacos biológicos debido a la cronicidad de la patología, el riesgo de desarrollo de anticuerpos y el elevado coste de este tipo de terapias. A través de estos métodos de evaluación de la adherencia, junto con la evaluación de la respuesta clínica, se puede identificar a los pacientes poco adherentes e intervenir a través de un abordaje multidisciplinar a fin de no comprometer la efectividad, la seguridad y la eficiencia del tratamiento. Tal y como otros autores ya han destacado, una validación más amplia de los diferentes métodos de medida resultaría muy deseable, a fin de definir estándares que facilitaran el seguimiento de la adherencia de los pacientes y así poder optimizar las intervenciones en la práctica clínica18.
Recientemente se ha incorporado a la práctica clínica la determinación de Cs de terapias biológicas con el objetivo de individualizar las pautas posológicas según las características individuales de cada paciente, con impacto positivo en la efectividad, la seguridad14,20 y la eficiencia del tratamiento21. Sería de esperar que un método directo de medida de la adherencia fuese más objetivo y veraz que los métodos indirectos, basados en las declaraciones de los pacientes; sin embargo, ningún estudio ha planteado analizar la utilidad de la determinación de Cs de terapias biológicas como método directo y complementario con otros métodos indirectos de medida de la adherencia. Sin embargo, sí que se han estudiado las relaciones entre métodos de medida de la adherencia directos e indirectos (registros de dispensación) en otros fármacos, como la fenitoína y la digoxina. Al relacionar las Cs de ambos con medidas continuas de la adherencia se han obtenido resultados significativos, con coeficientes de correlación que oscilan entre 0,2 y 0,422,23, resultados similares a los obtenidos en nuestro centro (0,244) a pesar de la categorización de las variables utilizadas.
En nuestro estudio, el test de MG y la TPM presentaron un índice de acuerdo débil (0,378) pero superior al obtenido al relacionar las Cs con los métodos indirectos. De entre ellos, la asociación entre Cs y TPM fue superior (0,244), lo que nos indica una mayor fiabilidad de la TPM en la identificación de los pacientes no adherentes al tratamiento.
Entre las limitaciones que presentan los métodos directos de medida de la adherencia, debemos tener en cuenta que pueden obtenerse Cs dentro del IT en pacientes no adherentes, debido a que la determinación de Cs de una única muestra, como resulta ser en nuestro estudio, proporciona información sobre la adherencia reciente al tratamiento, y no sobre el régimen terapéutico completo. Del mismo modo, también pueden obtenerse Cs infraterapéuticas en pacientes adherentes debido a: procesos farmacocinéticos y farmacodinámicos, técnica de detección del fármaco, IT de referencia, etc., que también suponen importantes fuentes de variabilidad, llegando a condicionar los resultados de la monitorización24.
Según algunos autores, la tasa de pacientes con Cs infraterapéuticas de ADA en Reumatología llega a ser del 35,1% (excluyendo el porcentaje de pacientes con anticuerpos anti-ADA positivos)25, resultados superiores incluso a los obtenidos en nuestro centro (22% pacientes con Cs infraterapéuticas). También hemos de tener en cuenta que ADA presenta una elevada variabilidad interindividual26 que, según ficha técnica27, puede llegar a precisar de optimizaciones o intensificaciones de dosis, a fin de alcanzar la máxima efectividad del tratamiento.
Respecto a la utilización de métodos indirectos de medida de la adherencia, y con relación al uso de la TPM, hemos de considerar que la dispensación de la medicación desde la farmacia del hospital no implica el correcto cumplimiento del régimen terapéutico, por lo que este método tiende a sobrestimar la adherencia. En un estudio realizado en pacientes con AR en tratamiento con ADA, una TPM ≥ 80% solo se alcanzó en un 67% de la población28, mientras que la adherencia definida como «sin pérdidas ni retrasos de dosis en los últimos 3 meses» fue del 55% en un estudio en pacientes con EC29. Estas diferencias pueden estar condicionadas, entre otros motivos, por las frecuencias de dispensación, si tenemos en cuenta que un mayor número de dispensaciones puede mejorar el contacto facultativo-paciente y, con ello, la adherencia a la medicación30.
La medida de la adherencia cuantificada por el registro de dispensaciones indicó que el 90% de los pacientes con Cs infraterapéuticas de ADA eran adherentes, sin importantes diferencias en cuanto a sexo, edad y tiempo de tratamiento, obteniendo el mismo resultado a través del test de MG. En estudios en los que se habían relacionado diferentes métodos indirectos de medida de la adherencia, como son el cuestionario SMAQ y la TPM (entendiendo por adherentes aquellos con TPM ≥ 90%), los resultados obtenidos mostraron hasta un 20% de discordancia entre ambas medidas31. Si comparamos los resultados de adherencia del test de MG con una TPM ≥ 95%, los valores resultan similares en el total de pacientes incluidos (66,67% vs. 51,11%). Esta similitud es razonable, teniendo en cuenta que el MG fue validado en español para pacientes hipertensos en los que se exige una TPM de entre el 80 y el 100%, con una sensibilidad del 52% y una especificidad del 44,4%13.
Tampoco conocemos la veracidad con la que cada paciente contesta los cuestionarios de valoración de la adherencia, administrados generalmente por el personal sanitario y siempre tratados mediante sesgos de memoria y de respuesta. En un estudio realizado de forma prospectiva en pacientes con AR con evaluación de la adherencia a través del Compliance Questionnaire for Rheumatology, la adherencia medida a los 6 meses fue del 74,99% (10,40%)32. Otros autores obtuvieron un 68,7% de adherencia a través de este mismo test en pacientes con osteoporosis atendidos en atención primaria33, resultados similares a los obtenidos en nuestro estudio (66,67%). Recientemente, en nuestro país también se han correlacionado los resultados de este cuestionario con los del test de MG, obteniendo índices de acuerdo débiles entre ambos métodos indirectos (0,186)34, inferiores a los obtenidos en nuestro centro al correlacionarlos con la TPM (0,378).
Es de suponer que los factores que sesgan los diversos métodos de medida de la adherencia, entre los que se encuentran la valoración de una única Cs, así como el escaso tamaño muestral, han condicionado la obtención de índices de acuerdo débiles. También hubiera sido deseable estudiar la adherencia en cada una de las enfermedades individualmente y en pacientes con una situación clínica similar, puesto que el test de MG valora si el enfermo adopta actitudes correctas en relación con el tratamiento35 y estas pueden estar condicionadas por la enfermedad subyacente y por su estado en el momento de la realización del test.
Resulta destacable el hecho de que, por motivos ajenos a la presencia de anticuerpos, únicamente en un 10% de los pacientes la presencia de concentraciones infraterapéuticas se justifica debido a la falta de adherencia al tratamiento, mientras que en el 90% restante estas Cs están condicionadas por la elevada variabilidad interindividual del fármaco. Este hecho puede condicionar en la práctica clínica una menor probabilidad de alcanzar un estado de remisión clínica o de actividad mínima de la enfermedad36, desembocando en modificaciones individualizadas de pautas posológicas o en cambios de fármacos biológicos. En este contexto la determinación de Cs de ADA resulta ser una herramienta de gran utilidad en la toma de decisiones, debido a la elevada relación entre los niveles de fármaco y de anticuerpo con la respuesta clínica37. En la medida en la que se disponga de modelos farmacocinéticos-farmacodinámicos poblacionales que permitan manejar la variabilidad interindividual de los fármacos biológicos, incluyendo sus dianas moleculares, como el TNF-α, podremos discriminar si el motivo por el cual un paciente presenta concentraciones infraterapéuticas son la variabilidad poblacional u otros factores, como la adherencia, objeto de este estudio.
En conclusión, en nuestro estudio, la Cs de ADA con los métodos indirectos de medida de la adherencia presentaron un índice de acuerdo débil, siendo la asociación ligeramente superior al relacionar los métodos indirectos entre sí. Así pues, la determinación de Cs de ADA presenta, por sí sola, una utilidad limitada en la detección de pacientes con AI y EII no adherentes al tratamiento. Por tanto, solo en aquellos en los que exista una sospecha previa de no adherencia, la determinación de Cs puede ser una herramienta de utilidad a fin de confirmar o descartar este hecho, y aplicar medidas educativas y conductuales de mejora de la adherencia al tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.