Las enfermedades difusas del tejido conectivo con frecuencia desarrollan enfermedad pulmonar intersticial, lo que conlleva peor pronóstico y acorta la supervivencia. La tomografía axial computarizada de alta resolución es la prueba diagnóstica de elección, ya que esta es muy competitiva con la histopatología; sin embargo, el costo y la radiación pueden limitar su empleo, particularmente como escrutinio. El ultrasonido pulmonar, estudio rápido, de acceso fácil, reproducible y de menor costo, resulta muy atractivo para determinar la existencia de enfermedad pulmonar intersticial. Adicionalmente, se requiere de poca experiencia para determinar las alteraciones correlacionables con estos padecimientos pulmonares. Las líneas B y las irregularidades pleurales conforman el denominado síndrome intersticial ultrasonográfico, aunque debemos tener en mente que no es específico y estamos obligados a considerar anormalidades hemodinámicas, cardiovasculares e infecciosas. En esta revisión, exponemos la alta prevalencia de esta enfermedad pulmonar en los principales padecimientos reumatológicos, con énfasis en la utilidad del ultrasonido pulmonar, su facilidad de realización y alto desempeño diagnóstico.
Patients with diffuse connective tissue diseases frequently develop interstitial lung disease, which carries a worse prognosis and shortens survival. High-resolution computed tomography is the first-choice test, and is competitive with histopathology, however, the cost and radiation may limit its use, particularly for screening. Lung ultrasound is a rapid, accessible, reproducible, and inexpensive study that is useful for diagnosis of interstitial lung disease. Furthermore, extensive training is not required to identify the alterations associated with these lung diseases. B lines and pleural irregularities compose the ultrasonographic interstitial syndrome, although it must be kept in mind that it is not specific, and it is necessary to rule out haemodynamic, cardiovascular, and infectious abnormalities. This review highlights the elevated prevalence of this lung condition in the main rheumatological diseases, with emphasis on the usefulness of pulmonary ultrasound.
Las enfermedades pulmonares intersticiales (EPI) están conformadas por un conjunto heterogéneo de padecimientos del parénquima pulmonar con similitudes en mecanismos fisiopatológicos, presentación clínica e imagen radiológica1. Se caracterizan por daño y engrosamiento del intersticio que causa alteración en el intercambio gaseoso; los síntomas más frecuentes son disnea progresiva y tos no productiva persistente2. Las EPI pueden ocasionarse por diversas enfermedades primarias (sarcoidosis, linfangioleiomiomatosis pulmonar, proteinosis alveolar), exposición ambiental, toxicidad por medicamentos o radioterapia, asociarse a alguna enfermedad difusa del tejido conectivo (EDTC) o no tener causa identificable; en este caso se las denomina neumonías intersticiales idiopáticas (NII)3.
La clasificación internacional multidisciplinaria ATS/ERS de las NII se estableció en 20024 y fue actualizada en 2013; de acuerdo con la más reciente, se clasifican en NII mayores, NII raras (NII linfoide y fibroelastosis pleuroparenquimatosa idiopática) y NII no clasificables. A su vez, las mayores se subdividen en fibrosantes crónicas (fibrosis pulmonar idiopática y neumonía intersticial no especifica), relacionadas con tabaquismo (neumonía intersticial descamativa y EPI asociada con bronquiolitis respiratoria) y aguda/subaguda (neumonía organizada criptogénica y neumonía intersticial aguda)5. Aunque no hay una clasificación elaborada específicamente para EPI-EDTC, los patrones histopatológicos/radiológicos descritos en las NII pueden observarse en EPI-EDTC, por lo que se usan los mismos patrones para describirlas6,7.
A nivel mundial, la mayoría de los estudios apuntan a fibrosis pulmonar idiopática y sarcoidosis como las 2 causas más frecuentes de EPI, responsables de casi la mitad de los casos, mientras que aquellas asociadas a EDTC representan la tercera causa más frecuente (7-19,7%)8. En población mexicana, un estudio prospectivo señaló a las EDTC como la principal causa de EPI (58% de 110 pacientes)9.
Relevancia de la enfermedad pulmonar intersticial en enfermedades difusas del tejido conectivoPacientes con EDTC tienen un riesgo mayor de desarrollar EPI. Un estudio de cohorte basado en población nacional taiwanesa, del grupo de Ng et al., describió en pacientes recién diagnosticados con esclerosis sistémica (SSc) un cociente de riesgo de 172,6 para desarrollo de EPI, al comparar frente a pacientes sin EDTC emparejados por sexo y edad; de manera similar, el cociente de riesgo fue de 119; 84,9; 32,8 y 8,29 para pacientes con dermatomiositis, polimiositis, lupus eritematoso sistémico (LES) y artritis reumatoide (AR), respectivamente10.
El impacto en la morbimortalidad también es muy relevante: EPI representa la principal causa de muerte en pacientes con SSc11; en miopatías inflamatorias idiopáticas se asocia con menor calidad de vida y peor pronóstico, especialmente en pacientes con anticuerpos contra MDA5 y aminoacil ARNt sintetasa12; en AR con EPI la mortalidad es de 2 a 10 veces mayor, al compararse con controles con AR sin EPI emparejados por sexo y edad13.
Diagnóstico de enfermedad pulmonar intersticial asociada a enfermedades difusas del tejido conectivoEl estándar de oro para diagnóstico de EPI-EDTC es la biopsia pulmonar; permite determinar el patrón histológico de acuerdo con la clasificación ATS/ERS y descartar otros diagnósticos diferenciales7. No obstante, por lo invasivo del método y la elevada morbimortalidad asociada con el procedimiento, especialmente alta en pacientes con EDTC, suele evitarse o se restringe para duda diagnóstica o diagnóstico diferencial14. Actualmente el método diagnóstico de elección es la tomografía axial computarizada de alta resolución (TACAR), con mejor sensibilidad que la radiografía de tórax; esta permite distinguir los patrones radiológicos, que tienen aceptable correlación con el patrón histológico, hecho de suma importancia para la toma de decisiones terapéuticas y el pronóstico7,15.
El inconveniente más importante de la TACAR es la necesidad de exponer al paciente a radiaciones ionizantes; debido a esto, incluso en enfermedades reumatológicas con alta prevalencia de EPI como las miopatías inflamatorias idiopáticas, algunos expertos no la recomiendan como método de tamizaje16. La búsqueda de métodos de detección de EPI de bajo costo, fácil acceso y que no expongan al paciente a radiaciones ionizantes ha incrementado el interés por el ultrasonido pulmonar (USP)17.
Ultrasonido pulmonarLas primeras descripciones de USP fueron realizadas por Lichtenstein y Axler en 199318. En años posteriores, su uso de manera paulatina se generalizó principalmente en salas de terapia intensiva y urgencias, debido a que demostró tener mayor sensibilidad que la convencional telerradiografía de tórax para detectar entidades como neumotórax, consolidación pulmonar, síndrome intersticial y derrame pleural19–21. El USP al pie de la cama del paciente críticamente enfermo puede identificar rápidamente la causa de falla respiratoria aguda como lo puntualizó el protocolo BLUE22, y orientar a la causa de falla circulatoria aguda en conjunto con ecocardioscopia a través del protocolo FALLS23. Hasta años más recientes no se empezó a estudiar la utilidad del USP en el diagnóstico de las EPI.
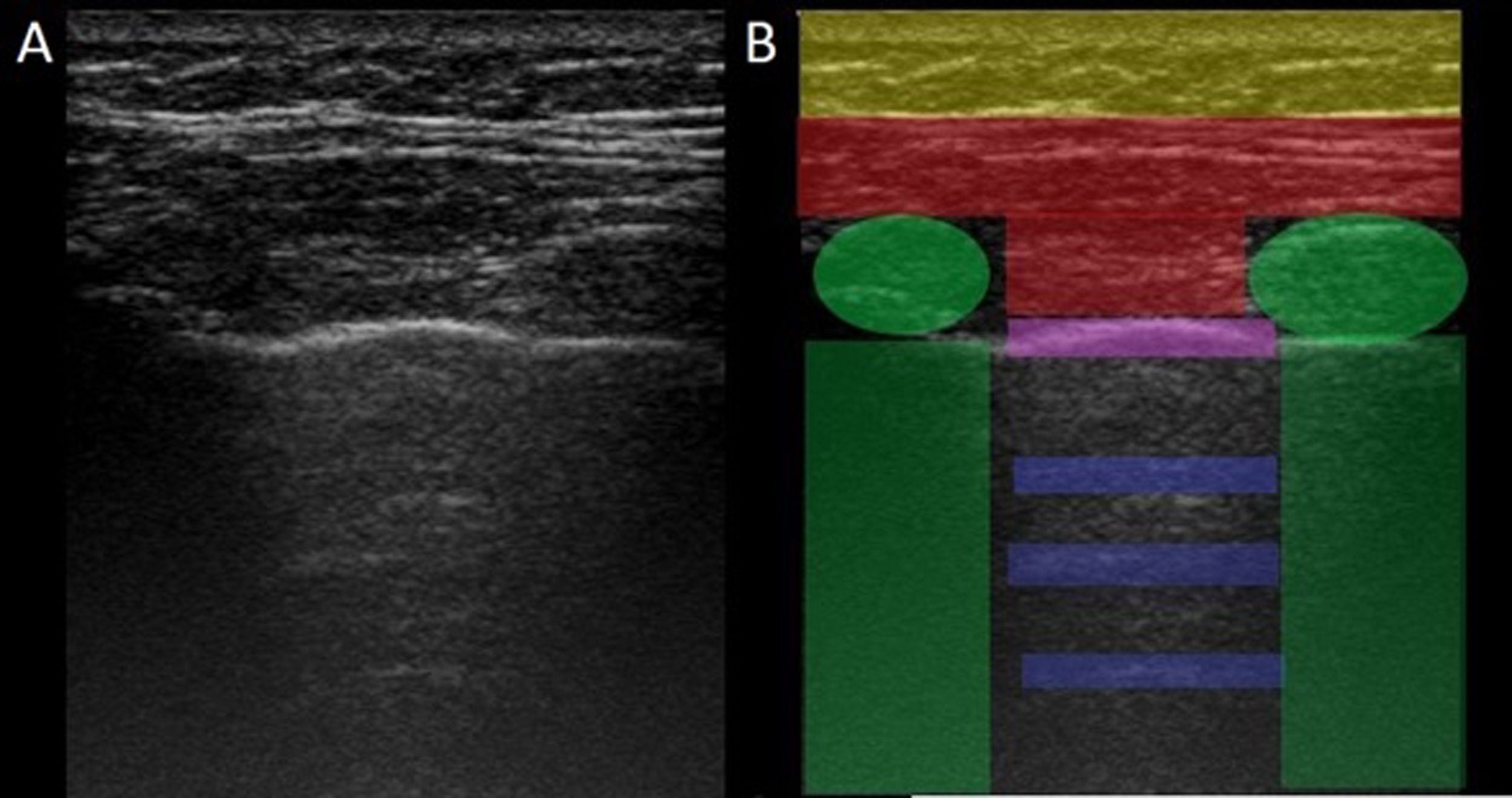
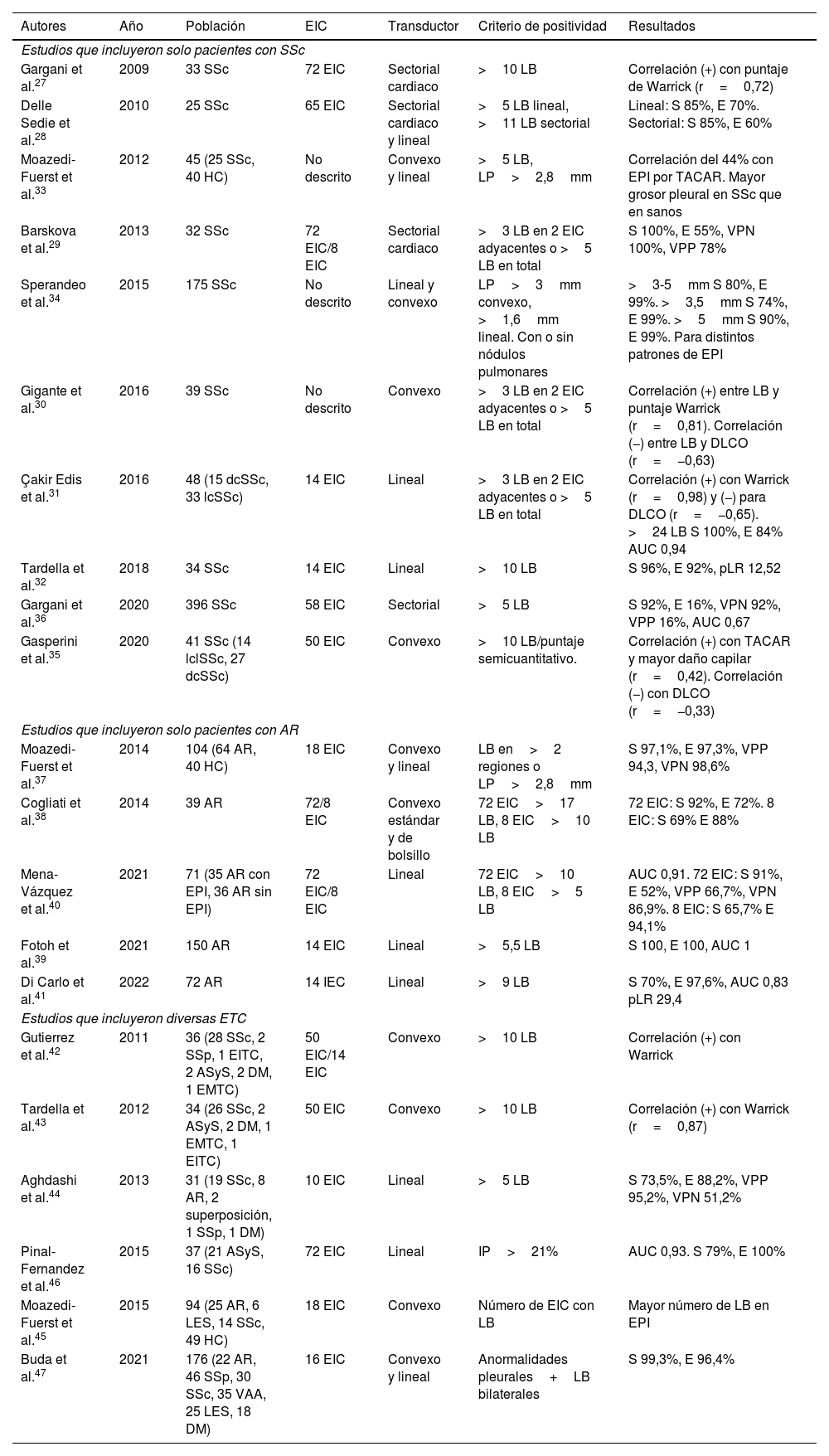
El USP se realiza a través de los espacios intercostales con la sonda perpendicular a la superficie torácica en posición longitudinal, apoyando sus extremos proximal y caudal sobre las costillas superior e inferior que delimitan el espacio intercostal. Las referencias óseas son las crestas óseas costales. La pleura visceral y parietal se representan como una sola línea ubicada 0,5cm por debajo de las crestas costales, llamada «línea pleural». La apariencia de las 2 imágenes costales con la línea pleural intermedia se conoce como el «signo del murciélago» (fig. 1).
Imagen de ultrasonido normal realizado en paciente sano, obtenida con equipo GE Logiq 3 con transductor lineal multifrecuencia de 10-14MHz, en el tercer espacio intercostal derecho, con paciente en posición decúbito supino y transductor en orientación longitudinal. A) Imagen original. B) Resaltado en amarillo piel y tejido celular subcutáneo; en rojo, capas miofasciales; en verde, costillas y la sombra acústica qgenran; en morado, línea pleural, y en azul, líneas A.
En el pulmón normal, debido a la gran diferencia de impedancia acústica entre el aire y los tejidos blandos circundantes, la pleura se comporta como reflector casi perfecto de las ondas de ultrasonido; produce múltiples fenómenos de reverberación entre la línea pleural y la sonda. La línea pleural se visualiza hiperecoica, brillante, delgada y regular, con movimiento deslizante suave y sincrónico con la respiración llamado «deslizamiento pulmonar». Debajo de la línea pleural hay artefactos horizontales característicos: «líneas A», que son réplicas de la línea pleural dispuestas de forma equidistante entre sí debido a la reverberación del ultrasonido en la línea pleural y artefactos resultantes de las capas miofasciales de la pared torácica debido a fenómenos de reverberación menores y efectos de espejo24.
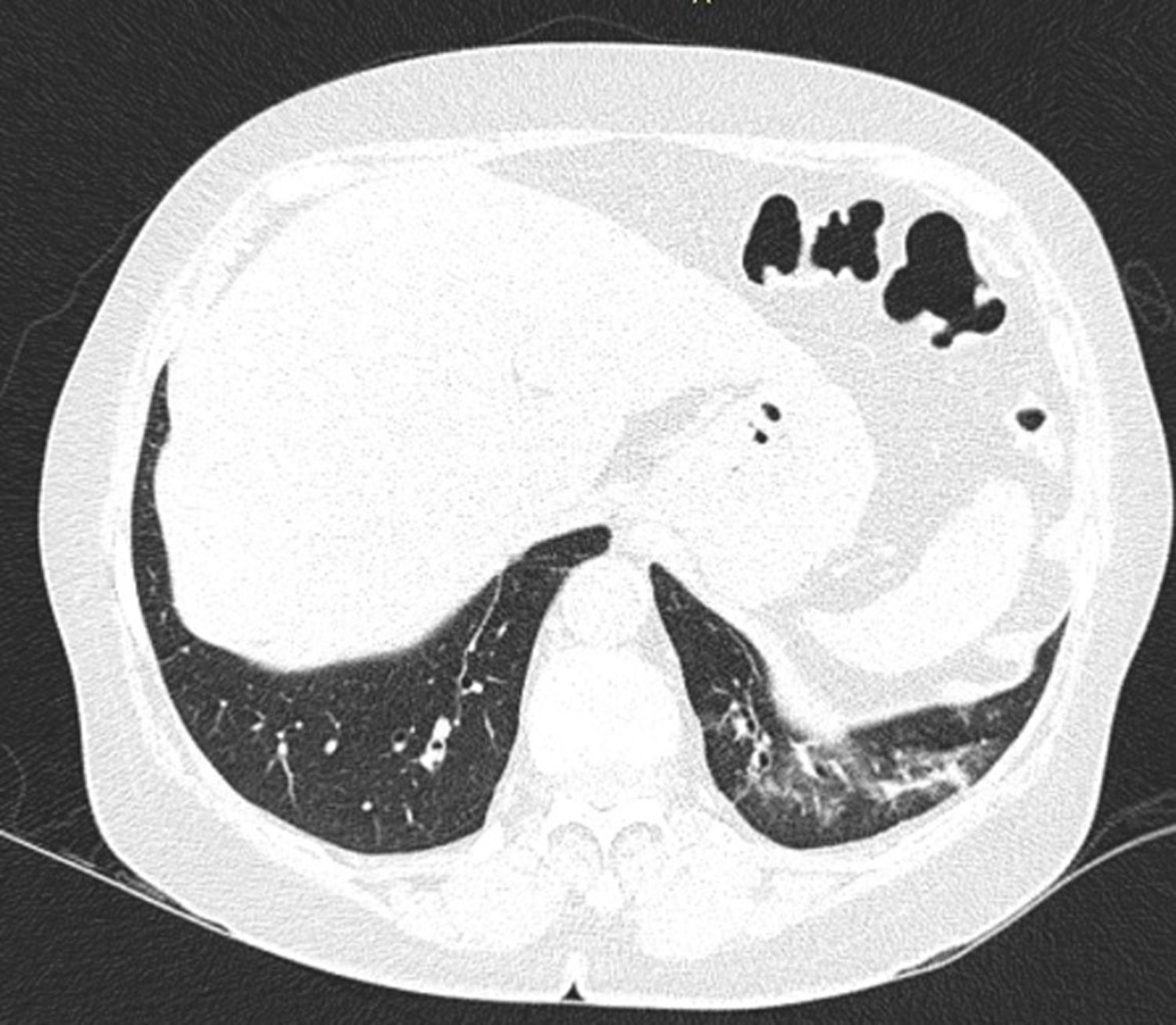
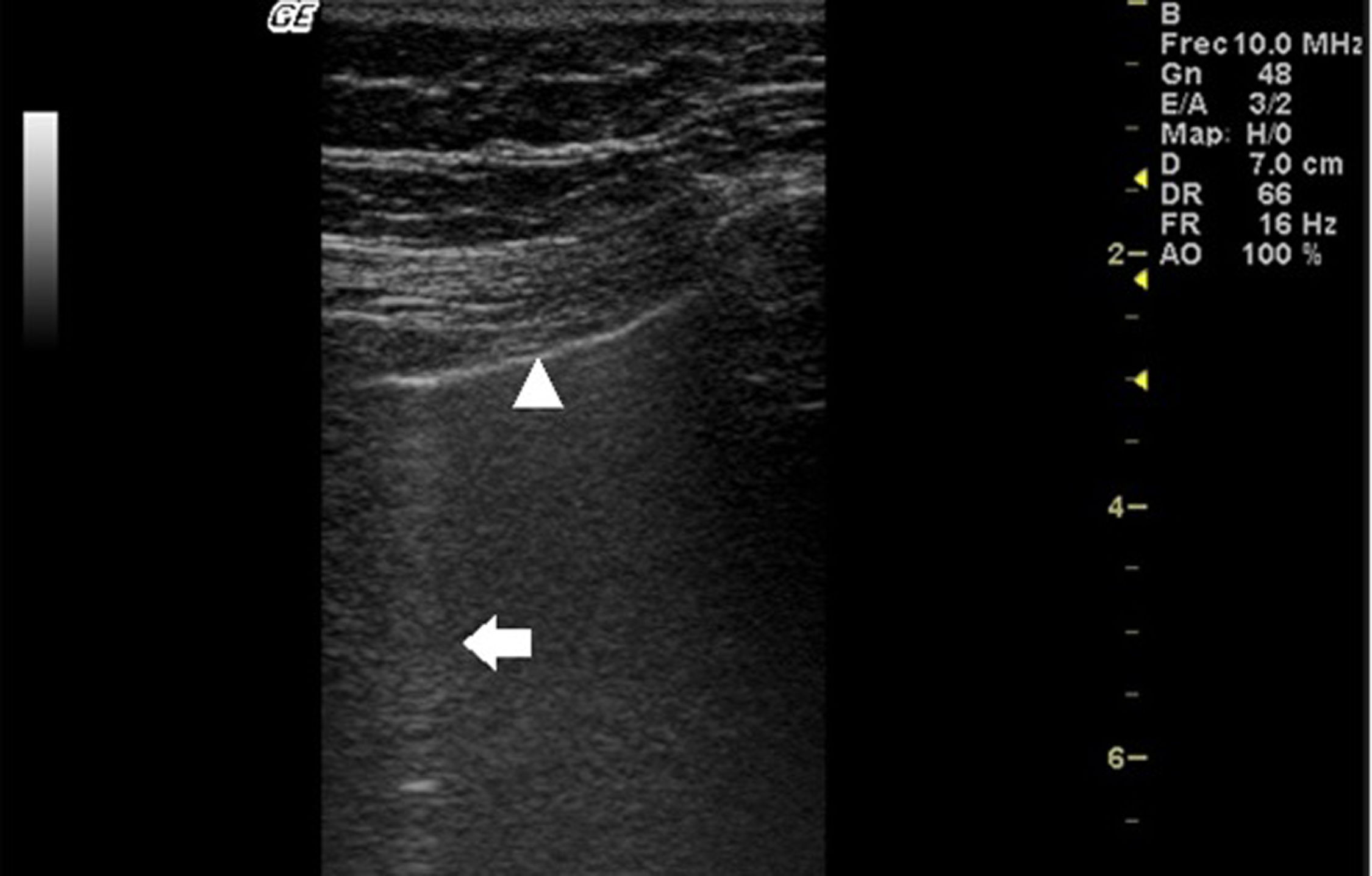
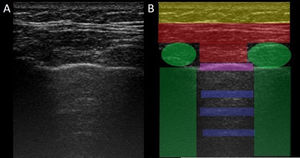
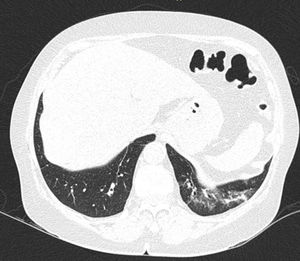
En la EPI se produce disminución de la impedancia acústica entre el aire pulmonar y los tejidos blandos de la pared torácica, porque parte del espacio inicialmente ocupado por el volumen de aire es sustituido por infiltración de células inflamatorias o tejido conectivo, provocando la aparición de alteraciones en la línea pleural y artefactos verticales llamados «líneas B». Las líneas B son indicativas de aumento de la densidad pulmonar subpleural antes de la consolidación y pueden estar causadas por la existencia, aunque no exclusivamente, de enfermedad intersticial25. La línea pleural se vuelve irregular y engrosada y puede aparecer borrosa y fragmentada. Las líneas B se muestran como artefactos verticales en forma de rayo hiperecoico que surgen de la línea pleural y se extienden hasta el final de la pantalla sin desvanecerse, borran las líneas A y se mueven sincrónicamente con el deslizamiento pleural. La presencia de múltiples líneas B es el signo ecográfico que define al «síndrome intersticial»26. En la figura 2 se muestra la TACAR de un paciente con AR y EPI; en la figura 3, los hallazgos de ultrasonido.
Ultrasonido pulmonar realizado a la misma paciente de la figura 2 con equipo GE Logiq 3, con transductor lineal multifrecuencia de 10-14MHz, con la paciente en posición sentada y transductor en orientación longitudinal. La flecha señala una línea B. El triángulo señala la línea pleural, que se observa de aspecto irregular. Nótese la ausencia de líneas A.
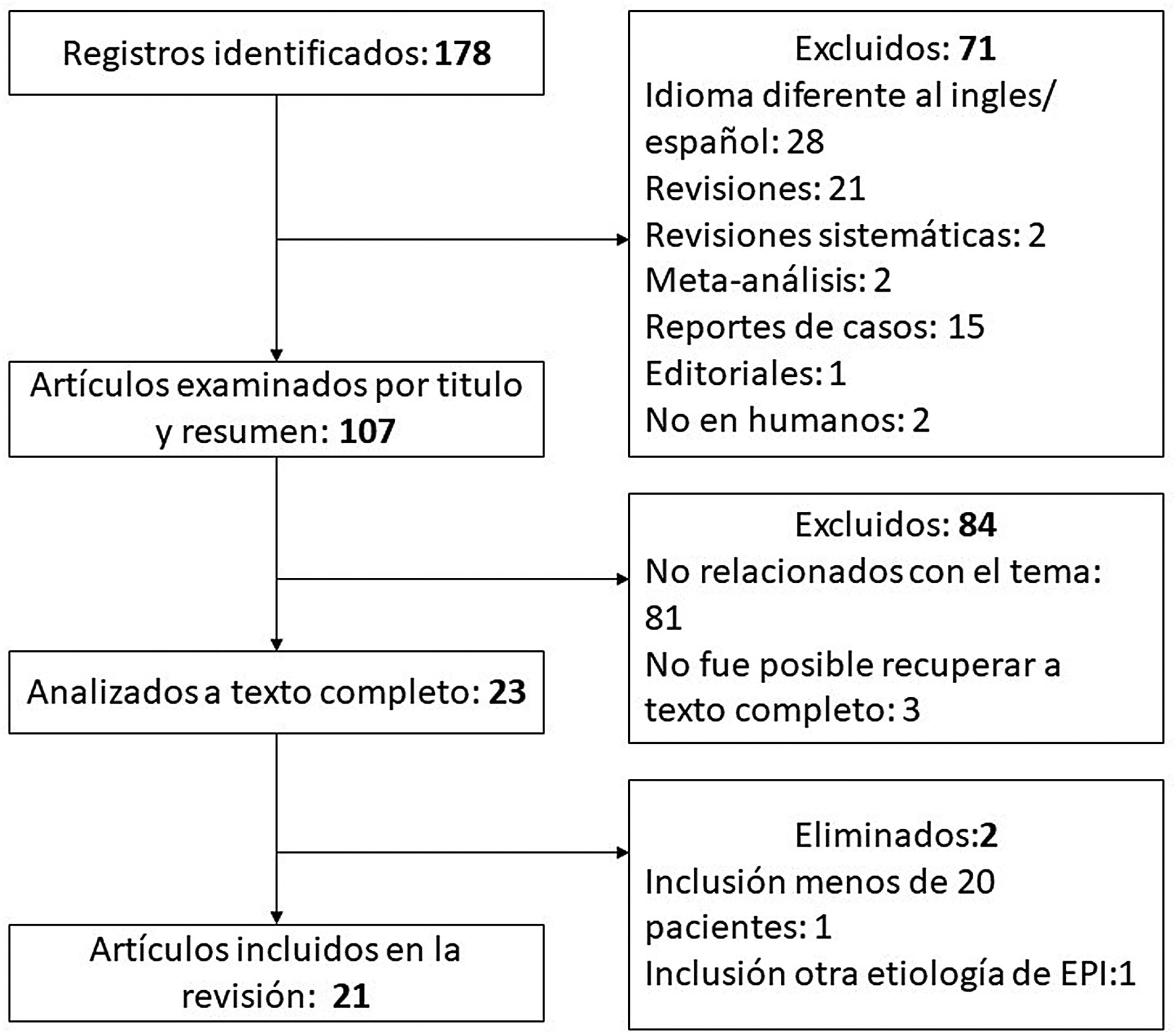
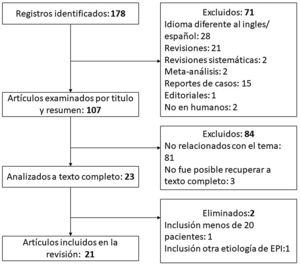
Para identificar artículos relevantes que evaluaran la utilidad del USP en pacientes con EDTC se realizó una búsqueda en el metabuscador especializado en salud PubMed. Los términos MeSH utilizados fueron «Ultrasonography», «Lung Diseases, Interstitial» y «Connective Tissue Diseases». Se construyó la estrategia de búsqueda con los descriptores y sus sinónimos usando los operadores booleanos «OR» y «AND»; en el anexo se encuentra la estrategia completa. Solo se incluyeron artículos originales. Se excluyeron duplicados, artículos de revisión, carteles y resúmenes de congresos, artículos con título/resumen no relacionado con el tema, idioma distinto al inglés o español y aquellos en los que no fue posible obtener el texto completo. Se eliminaron artículos con población pequeña (menos de 20 pacientes) y aquellos que incluyeron otras etiologías de EPI además de EDTC. La búsqueda realizada el 01/04/22 arrojó 178 registros; después de aplicar los criterios de exclusión y eliminación (proceso detallado en el flujograma que se muestra en la figura 4), el total de artículos incluidos fue 21. En la tabla 1 se resumen las características más relevantes.
Resumen de los artículos incluidos
| Autores | Año | Población | EIC | Transductor | Criterio de positividad | Resultados |
|---|---|---|---|---|---|---|
| Estudios que incluyeron solo pacientes con SSc | ||||||
| Gargani et al.27 | 2009 | 33 SSc | 72 EIC | Sectorial cardiaco | >10 LB | Correlación (+) con puntaje de Warrick (r=0,72) |
| Delle Sedie et al.28 | 2010 | 25 SSc | 65 EIC | Sectorial cardiaco y lineal | >5 LB lineal, >11 LB sectorial | Lineal: S 85%, E 70%. Sectorial: S 85%, E 60% |
| Moazedi-Fuerst et al.33 | 2012 | 45 (25 SSc, 40 HC) | No descrito | Convexo y lineal | >5 LB, LP>2,8mm | Correlación del 44% con EPI por TACAR. Mayor grosor pleural en SSc que en sanos |
| Barskova et al.29 | 2013 | 32 SSc | 72 EIC/8 EIC | Sectorial cardiaco | >3 LB en 2 EIC adyacentes o >5 LB en total | S 100%, E 55%, VPN 100%, VPP 78% |
| Sperandeo et al.34 | 2015 | 175 SSc | No descrito | Lineal y convexo | LP>3mm convexo, >1,6mm lineal. Con o sin nódulos pulmonares | >3-5mm S 80%, E 99%. >3,5mm S 74%, E 99%. >5mm S 90%, E 99%. Para distintos patrones de EPI |
| Gigante et al.30 | 2016 | 39 SSc | No descrito | Convexo | >3 LB en 2 EIC adyacentes o >5 LB en total | Correlación (+) entre LB y puntaje Warrick (r=0,81). Correlación (−) entre LB y DLCO (r=−0,63) |
| Çakir Edis et al.31 | 2016 | 48 (15 dcSSc, 33 lcSSc) | 14 EIC | Lineal | >3 LB en 2 EIC adyacentes o >5 LB en total | Correlación (+) con Warrick (r=0,98) y (−) para DLCO (r=−0,65). >24 LB S 100%, E 84% AUC 0,94 |
| Tardella et al.32 | 2018 | 34 SSc | 14 EIC | Lineal | >10 LB | S 96%, E 92%, pLR 12,52 |
| Gargani et al.36 | 2020 | 396 SSc | 58 EIC | Sectorial | >5 LB | S 92%, E 16%, VPN 92%, VPP 16%, AUC 0,67 |
| Gasperini et al.35 | 2020 | 41 SSc (14 lclSSc, 27 dcSSc) | 50 EIC | Convexo | >10 LB/puntaje semicuantitativo. | Correlación (+) con TACAR y mayor daño capilar (r=0,42). Correlación (−) con DLCO (r=−0,33) |
| Estudios que incluyeron solo pacientes con AR | ||||||
| Moazedi-Fuerst et al.37 | 2014 | 104 (64 AR, 40 HC) | 18 EIC | Convexo y lineal | LB en>2 regiones o LP>2,8mm | S 97,1%, E 97,3%, VPP 94,3, VPN 98,6% |
| Cogliati et al.38 | 2014 | 39 AR | 72/8 EIC | Convexo estándar y de bolsillo | 72 EIC>17 LB, 8 EIC>10 LB | 72 EIC: S 92%, E 72%. 8 EIC: S 69% E 88% |
| Mena-Vázquez et al.40 | 2021 | 71 (35 AR con EPI, 36 AR sin EPI) | 72 EIC/8 EIC | Lineal | 72 EIC>10 LB, 8 EIC>5 LB | AUC 0,91. 72 EIC: S 91%, E 52%, VPP 66,7%, VPN 86,9%. 8 EIC: S 65,7% E 94,1% |
| Fotoh et al.39 | 2021 | 150 AR | 14 EIC | Lineal | >5,5 LB | S 100, E 100, AUC 1 |
| Di Carlo et al.41 | 2022 | 72 AR | 14 IEC | Lineal | >9 LB | S 70%, E 97,6%, AUC 0,83 pLR 29,4 |
| Estudios que incluyeron diversas ETC | ||||||
| Gutierrez et al.42 | 2011 | 36 (28 SSc, 2 SSp, 1 EITC, 2 ASyS, 2 DM, 1 EMTC) | 50 EIC/14 EIC | Convexo | >10 LB | Correlación (+) con Warrick |
| Tardella et al.43 | 2012 | 34 (26 SSc, 2 ASyS, 2 DM, 1 EMTC, 1 EITC) | 50 EIC | Convexo | >10 LB | Correlación (+) con Warrick (r=0,87) |
| Aghdashi et al.44 | 2013 | 31 (19 SSc, 8 AR, 2 superposición, 1 SSp, 1 DM) | 10 EIC | Lineal | >5 LB | S 73,5%, E 88,2%, VPP 95,2%, VPN 51,2% |
| Pinal-Fernandez et al.46 | 2015 | 37 (21 ASyS, 16 SSc) | 72 EIC | Lineal | IP>21% | AUC 0,93. S 79%, E 100% |
| Moazedi-Fuerst et al.45 | 2015 | 94 (25 AR, 6 LES, 14 SSc, 49 HC) | 18 EIC | Convexo | Número de EIC con LB | Mayor número de LB en EPI |
| Buda et al.47 | 2021 | 176 (22 AR, 46 SSp, 30 SSc, 35 VAA, 25 LES, 18 DM) | 16 EIC | Convexo y lineal | Anormalidades pleurales+LB bilaterales | S 99,3%, E 96,4% |
AR: artritis reumatoide; ASyS: síndrome antisintetasa; AUC: área bajo la curva; dcSSc: esclerosis sistémica cutánea difusa; DM: dermatomiositis; E: especificidad; EIC: espacios intercostales; EITC: enfermedad indiferenciada del tejido conectivo; EMTC: enfermedad mixta del tejido conectivo; HC: controles sanos; IP: irregularidad pleural; LB: líneas B; lcSSc: esclerosis sistémica cutánea limitada; LES: lupus eritematoso sistémico; LP: línea pleural; pLR: razón de verosimilitud positiva; r: rho; S: sensibilidad; SSc: esclerosis sistémica; SSp: síndrome de Sjögren primario; TACAR: tomografía axial computarizada de alta resolución; VAA: vasculitis asociada a anticuerpos anticitoplasma de neutrófilos; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
El primer estudio que exploró la validez del USP para el diagnóstico de EPI asociada a SSc fue publicado por Gargani et al. en 2009. En este se incluyeron 33 pacientes con diagnóstico de SSc a los que realizaron USP con transductor sectorial, mediante protocolo de exploración de 72 espacios intercostales (EIC) en tórax anterior y posterior, además de TACAR, pruebas de función respiratoria (PFT) y determinación de la capacidad pulmonar y la difusión de monóxido de carbono (DLCO). Definieron como positivo el hallazgo de 10 o más líneas B en la suma de los EIC evaluados; el 51% de los pacientes fueron positivos a este criterio y encontraron correlación positiva entre el puntaje ecográfico (número de líneas B) y la puntuación de Warrick (puntaje que evalúa la gravedad y la extensión de la EPI por tomografía) (r=0,72). También describieron una correlación inversa entre el número de líneas B y los valores de DLCO (r=−0,60). Cabe señalar que el tiempo empleado en el USP fue corto (<10min), factible y reproducible en todos los pacientes27. Posteriormente publicaron un segundo estudio, conformado por 23 de los 33 pacientes de la cohorte original, a los que realizaron TACAR y USP con transductor sectorial y lineal; el protocolo fue con 62 EIC, que demostraron una buena correlación intraclase para el número de líneas B detectadas por ambos transductores (0,68). Además, confirmaron la correlación entre el número de líneas B y la puntuación de Warrick. Esta vez se calculó la sensibilidad (S) y la especificidad (E) y se usó como estándar de oro el resultado de la tomografía para el diagnóstico de EPI; se definieron distintos puntos de corte para el número de líneas B identificadas con el transductor sectorial (>5) y lineal (>11), debido a que el ancho del segundo puede aumentar el conteo de líneas B. Con dichos puntos de corte, el sectorial mostró S: 85% y E: 70%, comparable al desempeño del transductor lineal (S: 85% y E: 60%)28.
En un diseño similar al de Gargani et al., Barskova et al. realizaron USP con transductor cardiaco y el mismo protocolo de EIC, TACAR, ecocardiograma transtorácico y PFT a 55 pacientes con SSc. Definieron USP positiva para EPI ante la presencia de más de 3 líneas B en EIC contiguos o más de 5 líneas B en total. Confirmaron la factibilidad del USP al ser realizable en todos los pacientes y describieron variabilidad intra e interobservador aceptable: 5,1 y 7,4%, respectivamente. Encontraron una tasa de concordancia para el diagnóstico de EPI por TACAR y USP del 83%; todos los casos discordantes resultaron ser falsos positivos. Con TACAR como estándar de referencia, el 88% de los pacientes se diagnosticaron con EPI. Para determinar la utilidad del USP como método diagnóstico, realizaron curva ROC y cálculo del área bajo la curva (AUC) con un resultado de 0,94. La S y E del USP fueron de 100 y 55%, respectivamente, el valor predictivo positivo (VPP) de 78% y el valor predictivo negativo (VPN) de 100%29.
En 2016 se publicó un estudio con 39 pacientes que corroboró la correlación entre el número de líneas B y la puntuación de Warrick, así como la correlación inversa de estas con la DLCO. Cabe señalar que, a diferencia de estudios previos, se usó un transductor convexo, no se exploraron regiones posteriores del tórax y se incluyeron hallazgos de capilaroscopia al análisis; pacientes con mayor daño en la capilaroscopia mostraban más líneas B30. En la corriente de explorar menos EIC y con transductor lineal, podemos englobar los estudios publicados por Çakir Edis et al. en 2016 con 48 pacientes y Tardella et al. en 2018 con 34 pacientes. En ambos se usó protocolo de USP de 14 EIC. En el primero destacó que aun en protocolo reducido se mantiene una alta correlación entre el número de líneas B y el puntaje tomográfico de Warrick (r=0,89), además de una correlación inversa con DLCO y capacidad vital forzada. Calcularon un AUC de 0,94, usando los mismos criterios para considerar EPI por USP que Barskova et al., con observación de un rendimiento aún mayor: S del 100%, E del 84%, VPP del 90,6% y VPN del 100%31. Tardella et al. buscaron describir la utilidad del USP para el diagnóstico de EPI clínicamente relevante, lo que definieron como una puntuación de Warrick>7 por ser el punto de corte que correlaciona con alteración en las PFT en un estudio previo. Con el criterio de más de 10 líneas B, observaron: S del 96,3%, E del 92,3% y razón de verosimilitud de 12,5232.
Detección de anormalidades pleurales para diagnóstico de EPIMoazedi-Fuerst et al. describieron en 2012 una mayor frecuencia de alteraciones en USP en pacientes con SSc, que incluyó engrosamiento en línea pleural y apariencia fragmentada, al comparar con controles sanos33. El trabajo de Sperandeo et al. profundizó en esta área y realizaron USP con transductor convexo en tórax anterior y lateral, TACAR y PFT a 175 pacientes con SSc. El análisis de USP se enfocó en detectar alteraciones de la línea pleural; cuando se encontró>3mm, se calificó como engrosamiento, y>5mm como engrosamiento grave. Para establecer este punto de corte previamente se realizó USP en 200 controles sanos, con obtención de un grosor medio de la línea pleural de 1,4±1,1mm. Se probó la utilidad de USP para detectar distintos patrones de EPI por tomografía; para el patrón reticular se describió un AUC de 0,95, S del 80% y E del 99%, y para el patrón reticulonodular con panalización, AUC de 0,99, S del 74% y E del 99%. El mejor rendimiento fue para solo panalización: AUC de 0,99, S del 90,1% y E del 99%34.
Ultrasonido pulmonar para pronósticoEn 2020 se publicaron los resultados de un estudio con 39 pacientes con SSc; el número de líneas B evaluadas al inicio correlacionó con el cambio en DLCO observado a 12 meses, con potencial predicción de empeoramiento de la EPI35. En el mismo año, Gargani et al. enfatizaron la posible utilidad del USP en el pronóstico. Incluyeron 396 pacientes con SSc a los que realizaron USP en protocolo de 58 EIC con transductor sectorial. Tras el seguimiento medio de 28 meses, 50 pacientes desarrollaron EPI o tuvieron un empeoramiento de una EPI ya diagnosticada. El número de líneas B en el tórax posterior mostró ser de utilidad moderada para predecir alguno de estos eventos; se calculó un AUC de 0,67 y el punto de corte de más de 5 líneas B mostró S del 92%, E del 16%, VPN del 92% y VPP del 16%. La presencia de más de 5 líneas B en el tórax posterior confirió un cociente de riesgo (HR) de 5,5 para desarrollo o empeoramiento de EPI. En el análisis multivariado persistió relevante y estadísticamente significativo (HR 3,37), incluso mayor que el HR conferido por positividad para anticuerpos contra topoisomerasa 1 (HR 2,98)36.
Ultrasonido pulmonar en artritis reumatoideMoazedi-Fuerst et al. publicaron en 2014 un estudio piloto en esta población. Incluyeron 64 pacientes con AR sin síntomas respiratorios, realizaron PFT que resultaron normales en todos los sujetos, el USP se realizó en 18 regiones, utilizaron un transductor convexo para evaluar las líneas B y un transductor lineal para las características de la línea pleural. Definieron EPI por USP a la presencia de líneas B en 2 o más regiones, así como engrosamiento pleural>2,8mm. Fueron positivos a este criterio 18 (28%) de los 64 pacientes con AR; al realizar TACAR a todos los pacientes, el diagnóstico de EPI se confirmó en 17 de los 18 identificados por USP. De modo paralelo estudiaron 40 voluntarios sanos; solo se describieron alteraciones en el USP en 3 (7%) de ellos, no realizaron TACAR en este grupo por motivos éticos. Se calculó una S del 97,1%, E del 97,3%, VPP del 94,3% y VPN del 98,6%37. En el mismo año, Cogliati et al. confirmaron la utilidad del USP, describiendo que el rendimiento no disminuye significativamente cuando se realiza por un médico con poco entrenamiento (2 sesiones de 3h para reconocer líneas B) o al usar equipo de ultrasonido portátil comparado con un médico experto y el uso de equipo estándar, ni al realizar un protocolo de EIC reducido (8 regiones en tórax anterior y lateral) contra protocolo extendido de 72 EIC38.
En 2021, en un estudio de casos y controles, Fotoh et al. estudiaron 75 pacientes con AR+EPI previamente diagnosticada por TACAR y 75 pacientes con AR sin EPI, emparejados por sexo y edad. Realizaron USP con protocolo de 14 EIC; el análisis de AUC mostró un rendimiento excepcional (AUC=1) al establecer el punto de corte>5,5 líneas B con S del 100% y E del 100%. En seguimiento a un año, el 33% de los pacientes del grupo EPI+AR fallecieron; en el análisis multivariado identificaron una razón de momios de 1,53 para mortalidad en pacientes con más de 28 líneas B. Adicionalmente, estudiaron un marcador sérico de daño pulmonar (Krebs von den Lungen-6) y encontraron concordancia alta (r=0,96) entre los niveles de este y el conteo de líneas B por USP39. En el mismo año y con el mismo diseño, pero con menor número de pacientes (35 AR+EPI y 36 AR sin EPI), se describió un índice simplificado, en el que tomaron en cuenta el conteo de líneas B solo en 8 EIC, que fue desarrollado a partir de explorar por USP 72 EIC y seleccionar solo los espacios que mostraron mayor correlación con EPI40.
El estudio más reciente que aborda la EPI en AR se publicó en 2022 y se enfocó en detectar EPI clínicamente relevante, lo que definieron como porcentaje de área pulmonar afectada por fibrosis>10,7% en TACAR mediante método semiautomatizado por ordenador. En este protocolo que explora 14 EIC encontraron un buen rendimiento, con AUC de 0,83; el punto de corte de mayor rendimiento diagnóstico (más de 9 líneas B) obtuvo S del 70%, E del 97% y razón de verosimilitud de 2941.
Ultrasonido pulmonar en grupos con diversas enfermedades reumáticasPoco tiempo después de que se demostrara la utilidad del USP para el diagnóstico de EPI en pacientes con SSc se comenzó a estudiar en otras cohortes, que se conformaban con diversas enfermedades reumáticas. En 2011 se publicó el primer estudio de este tipo, que incluyó 36 pacientes con SSc, síndrome antisintetasa, dermatomiositis, enfermedad mixta del tejido conectivo y enfermedad indiferenciada del tejido conectivo, en el que describieron por primera vez el protocolo de USP explorando 14 EIC. Derivado de la exploración más extensa y tras seleccionar los EIC de mayor accesibilidad y que con mayor frecuencia mostraban anomalías, confirmaron que en este grupo heterogéneo de pacientes también hubo correlación entre puntuación de USP y puntuación de daño observado por tomografía; de manera adicional, demostraron buena correlación entre lo observado mediante el protocolo extendido y reducido de EIC, mientras que este último es más rápido de realizar (8,3 vs. 23,3min)42. En 2012 Tardella et al. confirmaron la correlación entre puntuaciones de USP y TACAR en otro grupo de pacientes similar en el que exploraron 50 EIC43. Con menos pacientes y diversidad de enfermedades (31 pacientes con SSc, AR, dermatomiositis, síndrome de superposición), en 2013 Aghdashi et al. determinaron S del 73% y E del 88,2% al explorar solo 10 EIC; tomaron como punto de corte más de 5 líneas B44. En 2015 se publicaron 2 estudios extra que igualmente apuntaron alta S y E del USP en población similar45,46. Finalmente, en 2021 Buda et al. informaron uno de los estudios con mayor número de pacientes y diversidad; incluyeron 180 pacientes con AR, LES, SSc, vasculitis asociada a anticuerpos anticitoplasma de neutrófilos y síndrome de Sjögren. Al combinar alteraciones en la línea pleural con presencia de líneas B obtuvieron S del 99,3% y E del 96,4% para el diagnóstico de EPI47.
Otras posibles causas de síndrome intersticial ultrasonográfico en pacientes con enfermedades reumáticasCon la evidencia existente sobre la utilidad del USP en EDTC y EPI, es indispensable reconocer que los cambios identificados no son del todo específicos. El síndrome intersticial que implica la aparición de múltiples líneas B, con punto de corte variable según el equipo y el tipo de transductor empleado, traduce alteraciones tisulares inespecíficas, como cambios en el depósito de matriz extracelular, aumento de la permeabilidad vascular y edema o aumento de la celularidad, independientemente de si se trata o no de contexto inflamatorio. En este sentido, enfermedades como insuficiencia cardiaca congestiva y procesos infecciosos podrían originar cambios imagenológicos indistinguibles de lo descrito en EPI25,48.
Enfermedades reumáticas se relacionan con déficit de la función inmunológica tanto por mecanismos propios de la enfermedad como por el tratamiento con fármacos modificadores de la enfermedad sintéticos convencionales y biológicos. En artropatías inflamatorias el uso de metotrexato y leflunomida ha demostrado un incremento del riesgo de infecciones, desde un 20% hasta un 40-60% con el uso de glucocorticoides. Los fármacos modificadores de la enfermedad biológicos, principalmente inhibidores del factor de necrosis tumoral, incrementan el riesgo de neumonía bacteriana sobre todo en el primer año de empleo49. En SSc, el 30% de las causas de muerte no atribuible a la enfermedad son de etiología infecciosa50, mientras que en LES las enfermedades infecciosas pulmonares son la principal causa de hospitalización, con un incremento de la mortalidad del 36% asociado a neumonía grave en unidades de cuidados intensivos51,52.
El USP ha demostrado una S del 77% para la detección de neumonía en los departamentos de urgencias, un 25% más que la radiografía de tórax convencional53. Existen protocolos de evaluación con distintas zonas de exploración pulmonar ultrasonográfica que pueden alcanzar una S de hasta el 97%. Los principales cambios observados incluyen consolidaciones, síndrome intersticial y anomalías de la línea pleural54.
Estos patrones ultrasonográficos son variables según el tiempo de evolución del cuadro y el patógeno involucrado. Síndrome intersticial se ha descrito específicamente en neumonía por Chlamydia, Pneumocystis, sarampión y virus de la influenza. En los últimos 2 años y tras el impacto de la pandemia por COVID-19, el USP ganó mayor auge en la detección oportuna de la enfermedad, dirección de procedimientos y toma de decisiones en sitios hospitalarios de atención respiratoria. En etapas iniciales la infección por SARS-CoV-2 suele manifestarse con líneas B multifocales, que con el paso del tiempo se vuelven confluentes y más tarde pueden formar consolidaciones subpleurales55.
Otro diferencial por considerar en síndrome intersticial ultrasonográfico incluye los cambios producidos por congestión pulmonar en falla cardiaca. Enfermedades reumáticas, principalmente AR, tienen amplia evidencia del riesgo asociado con morbimortalidad cardiovascular. Pacientes con AR tienen el doble de riesgo de falla cardiaca que la población general, incluso en ausencia de cardiopatía isquémica56. Disfunción endotelial, inflamación miocárdica y ateroesclerosis acelerada forman parte del proceso fisiopatológico de la falla cardiaca relacionada con esta y otras enfermedades autoinmunes e inflamatorias crónicas como LES, SSc y enfermedad mixta del tejido conectivo57.
Estudios comparativos entre la afectación pulmonar por falla cardiaca y el síndrome de insuficiencia respiratoria aguda por USP demostraron que, en ambos, es frecuente la observación de líneas B confluentes, con ausencia de anomalías de la línea pleural y consolidaciones en caso de falla cardiaca58, por lo que el cuadro clínico y las características del paciente son aún mandatorios para una evaluación diagnóstica apropiada.
ConclusionesEl USP se posiciona como herramienta útil para el diagnóstico de EPI en diversas EDTC; es de fácil acceso y bajo costo, con rendimiento diagnóstico cercano al actual estándar de oro, con la ventaja de evitar la exposición a radiaciones ionizantes. Ha demostrado mayor sensibilidad que otros métodos de bajo costo, como la radiografía de tórax y PFT. Actualmente no se ha llegado a un consenso para establecer el protocolo de exploración estándar, sin embargo, diversos estudios han señalado un desempeño comparable entre protocolos extendidos de más de 50 EIC y los de exploración reducida de 14 y 10 EIC que consumen menos tiempo. Como ventaja adicional cabe resaltar que incluso cuando el estudio es realizado por personal con poco tiempo de entrenamiento, el rendimiento diagnóstico no se ve afectado de forma significativa. La detección de líneas B es el signo más estudiado, pero el considerar en la evaluación alteraciones pleurales y nódulos subpleurales parece aumentar S y E.
Una de las principales desventajas a considerar es que ante un USP positivo aún se requiere realizar TACAR para identificar el patrón imagenológico por la correlación con patrones histológicos y la implicación terapéutica y pronóstica que esto conlleva. Así mismo, existen otras entidades que pueden causar síndrome intersticial ultrasonográfico con el aumento de líneas B que lo caracteriza y fueron excluidas sistemáticamente en todos los estudios, por lo que se deben tener en cuenta en la práctica real como posibles causas de falsos positivos.
Tomando en cuenta el rendimiento diagnóstico y las ventajas y desventajas expuestas, podemos considerar que la mayor utilidad del USP es como método de tamizaje para EPI en pacientes con EDTC. Existe menor evidencia de su utilidad para pronóstico y falta evaluar su potencial como herramienta de seguimiento en pacientes con EPI ya establecida.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
(((((Connective Tissue Diseases[MeSH Terms]) OR (Connective Tissue Diseases[Title/Abstract])) OR (Disease, Connective Tissue[Title/Abstract])) OR (Diseases, Connective Tissue[Title/Abstract])) AND (((((((((((((((Lung Diseases, Interstitial[MeSH Terms]) OR (Lung Diseases, Interstitial[Title/Abstract])) OR (Diffuse Parenchymal Lung Disease[Title/Abstract])) OR (Interstitial Lung Diseases[Title/Abstract])) OR (Diffuse Parenchymal Lung Diseases[Title/Abstract])) OR (Interstitial Lung Disease[Title/Abstract])) OR (Lung Disease, Interstitial[Title/Abstract])) OR (Pneumonia, Interstitial[Title/Abstract])) OR (Interstitial Pneumonia[Title/Abstract])) OR (Interstitial Pneumonias[Title/Abstract])) OR (Pneumonias, Interstitial[Title/Abstract])) OR (Pneumonitis, Interstitial[Title/Abstract])) OR (Interstitial Pneumonitides[Title/Abstract])) OR (Interstitial Pneumonitis[Title/Abstract])) OR (Pneumonitides, Interstitial[Title/Abstract]))) AND ((((Ultrasonography[MeSH Terms]) OR (Ultrasonography[Title/Abstract])) OR (Diagnostic Ultrasound[Title/Abstract] OR Diagnostic Ultrasounds[Title/Abstract] OR Ultrasound, Diagnostic[Title/Abstract] OR Ultrasounds, Diagnostic[Title/Abstract] OR Ultrasound Imaging[Title/Abstract] OR Imaging, Ultrasound[Title/Abstract] OR Imagings, Ultrasound[Title/Abstract] OR Echotomography[Title/Abstract] OR Ultrasonic Imaging[Title/Abstract] OR Imaging, Ultrasonic[Title/Abstract] OR Sonography, Medical[Title/Abstract] OR Medical Sonography[Title/Abstract] OR Ultrasonographic Imaging[Title/Abstract] OR Imaging, Ultrasonographic[Title/Abstract] OR Imagings, Ultrasonographic[Title/Abstract] OR Ultrasonographic Imagings Echography[Title/Abstract] OR Diagnosis, Ultrasonic[Title/Abstract] OR Diagnoses, Ultrasonic[Title/Abstract] OR Ultrasonic Diagnoses[Title/Abstract] OR Ultrasonic Diagnosis[Title/Abstract] OR Echotomography, Computer[Title/Abstract] OR Computer Echotomography[Title/Abstract] OR Tomography, Ultrasonic[Title/Abstract] OR Ultrasonic Tomography[Title/Abstract])))