Dado el creciente avance en el diagnóstico como evaluación y tratamiento de la osteoporosis, y la incorporación de nuevas herramientas y medicamentos, desde la Sociedad Española de Reumatología (SER) se ha impulsado el desarrollo de recomendaciones basadas en la mejor evidencia posible. Estas deben de servir de referencia para reumatólogos y otros profesionales de la salud implicados en el tratamiento de pacientes con osteoporosis.
MétodosLas recomendaciones se emitieron siguiendo la metodología de grupos nominales. El nivel de evidencia y el grado de recomendación se clasificaron según el modelo del Center for Evidence Based Medicine de Oxford y el grado de acuerdo se extrajo por técnica Delphi. Se utilizó toda la información de consensos previos y guías de práctica clínica disponibles.
ResultadosSe realizan recomendaciones sobre el diagnóstico, la evaluación y el tratamiento en pacientes con osteoporosis. Estas recomendaciones incluyen la osteoporosis secundaria a glucocorticoides, la osteoporosis premenopáusica y la del varón.
ConclusionesSe presentan las recomendaciones SER sobre el diagnóstico, la evaluación y el manejo de pacientes con osteoporosis.
Due to increasing improvement in the diagnosis, evaluation and management of osteoporosis and the development of new tools and drugs, the Spanish Society of Rheumatology (SER) has promoted the development of recommendations based on the best evidence available. These recommendations should be a reference to rheumatologists and other health professionals involved in the treatment of patients with osteoporosis.
MethodsRecommendations were developed following a nominal group methodology and based on a systematic review. The level of evidence and degree of recommendation were classified according to the model proposed by the Center for Evidence Based Medicine at Oxford. The level of agreement was established through Delphi technique. Evidence from previous consensus and available clinical guidelines was used.
ResultsWe have produced recommendations on diagnosis, evaluation and management of osteoporosis. These recommendations include the glucocorticoid-induced osteoporosis, premenopausal and male osteoporosis.
ConclusionsWe present the SER recommendations related to the biologic therapy risk management.
La actualización del conocimiento sobre los distintos aspectos de la osteoporosis (OP) sigue siendo una necesidad por su alta prevalencia, sus complicaciones y el gasto sanitario y social asociado. En un momento en el que la necesidad del uso racional de los recursos es máxima, este documento es en realidad una reflexión corporativa, en el que analizamos las nuevas aportaciones sobre el diagnóstico, los factores de riesgo de fractura, el seguimiento y el tratamiento de la OP.
Las recomendaciones que se proponen pretenden servir de referencia para ayudar en la toma de decisiones terapéuticas a los reumatólogos y a todos aquellos profesionales que, desde diversos niveles asistenciales o gestores, estén implicados en el tratamiento de la OP.
MetodologíaToda la elaboración del documento se realizó por distribución de tareas y comentarios a las partes. La estructura del documento se basa en preguntas relevantes sobre la práctica clínica de la OP.
Primero se asignó a cada panelista uno o varios apartados del consenso para su redacción. Una vez completado, se distribuyó a todo el panel para realizar comentarios. Tras ello, miembros de la Unidad de Investigación (UI) de la Sociedad Española de Reumatología (SER) unificaron, categorizaron, clasificaron y resumieron todos los comentarios para su valoración previa a la reunión del panel.
Se realizó una reunión de grupo nominal moderada por miembros de la UI de la SER. En esta reunión, se discutieron propuestas de modificaciones al documento en relación con el formato y contenido, incluidas las recomendaciones.
Posteriormente, mediante una encuesta Delphi (por vía online de forma anónima) se votaron las recomendaciones del consenso. Los resultados agregados se mostraron a todos los panelistas (Delphi modificado). Las recomendaciones con grado de acuerdo (GA) inferior al 70% fueron reeditadas y votadas en una segunda ronda. Se entiende que existe acuerdo si el panelista vota en una escala de 1 (totalmente en desacuerdo) a 10 (totalmente de acuerdo), 7 o más de 7. El nivel de evidencia (NE) y el grado de recomendación (GR) se clasificaron de acuerdo con el modelo del Center for Evidence Based Medicine de Oxford1 por miembros de la unidad de investigación de la SER.
Con toda esta información se redactó el documento definitivo.
ResultadosDiagnóstico y evaluación¿Qué es la osteoporosis?La OP, según se ha definido en la conferencia de consenso del National Institute of Health, es una enfermedad esquelética caracterizada por una resistencia ósea disminuida que predispone al aumento del riesgo de fractura (NE 5; GR D; GA 100%).
La resistencia ósea refleja la integración de la densidad y la calidad óseas. A su vez, la densidad ósea está determinada por el valor máximo de masa ósea y la magnitud de su pérdida, mientras que la calidad ósea depende de la arquitectura, el recambio óseo, la acumulación de microlesiones y la mineralización2.
¿Cuándo debo sospechar de un caso de osteoporosis?Hasta ahora no hay un protocolo de cribado poblacional aceptado de forma universal para identificar personas con OP. Los pacientes se identifican de forma oportunista mediante una estrategia de búsqueda de caso basada en el antecedente de una o más fracturas por fragilidad, o la presencia de factores de riesgo clínicos significativos3.
En determinados grupos de pacientes, principalmente ancianos y mujeres posmenopáusicas, debemos mantener un alto grado de sospecha y realizar la búsqueda de factores de riesgo de forma activa (NE 5; GR D; GA 100%).
¿Qué se considera fractura osteoporótica?Se considera fractura osteoporótica o por fragilidad ósea la ocasionada por un traumatismo de bajo impacto. Una caída estando de pie a nivel del suelo o en sedestación está incluida en este concepto. Se excluyen las fracturas que ocurren como consecuencia de una práctica deportiva o un accidente (NE 5; GR D; GA 100%).
Se estima que cerca del 40% de las mujeres caucásicas tendrán al menos una fractura osteoporótica después de los 50 años4-9. Las más frecuentes y relevantes son las del fémur proximal, la columna vertebral y el antebrazo distal. Por otro lado, debemos señalar que normalmente se excluyen de esta definición las fracturas de cráneo o cara10.
¿Qué es riesgo alto de fractura osteoporótica?Al igual que con la OP, hasta ahora no hay un protocolo de cribado aceptado de forma universal para identificar la población con riesgo alto de fractura.
El riesgo de fractura osteoporótica viene determinado por la presencia de uno o más factores de riesgo incluida la densidad mineral ósea (DMO) baja. La combinación del riesgo que confiere una DMO baja con los factores de riesgo de fractura clínicos11 proporciona la mejor estimación del riesgo. Consideraremos alto riesgo de fractura cuando al menos existen dos factores de riesgo alto (tabla 1). Disponer de una herramienta de cálculo del riesgo de fractura osteoporótica permitiría identificar a las personas con un riesgo alto, tributarias de intervención precoz, y disminuir el número de tratamientos innecesarios por administrarse a pacientes con un riesgo bajo.
Factores de riesgo de fractura
| De riesgo alto (≥ 2) |
| 1. Edad avanzada (65 años) |
| 2. Peso bajo (IMC < 20 kg/m2) |
| 3. Antecedente personal de fractura/s |
| 4. Antecedente materno de fractura de fémur |
| 5. Corticoidesa |
| 6. Caídasb |
| De riesgo moderado (> 1< 2) |
| 7. Consumo de tabaco y/o alcoholc |
| 8. Menopausia precoz (45 años) |
| 9. Amenorrea primaria y secundaria |
| 10. Hipogonadismo en el varón |
| 11. Enfermedades y fármacos con capacidad de disminuir la DMO: artritis reumatoide y otras artropatías inflamatorias, patología intestinal inflamatoria, celiaquía, malabsorción, hepatopatías, hiperparatiroidismo, hipertiroidismo, anorexia y bulimiad, pacientes con trasplantes sólidos, hidantoínas, retrovirales, anticomiciales, etc.) |
| 12. Factores relacionados con las caídas: trastornos de la visión, psicofármacos, ACV, enfermedad de Parkinson |
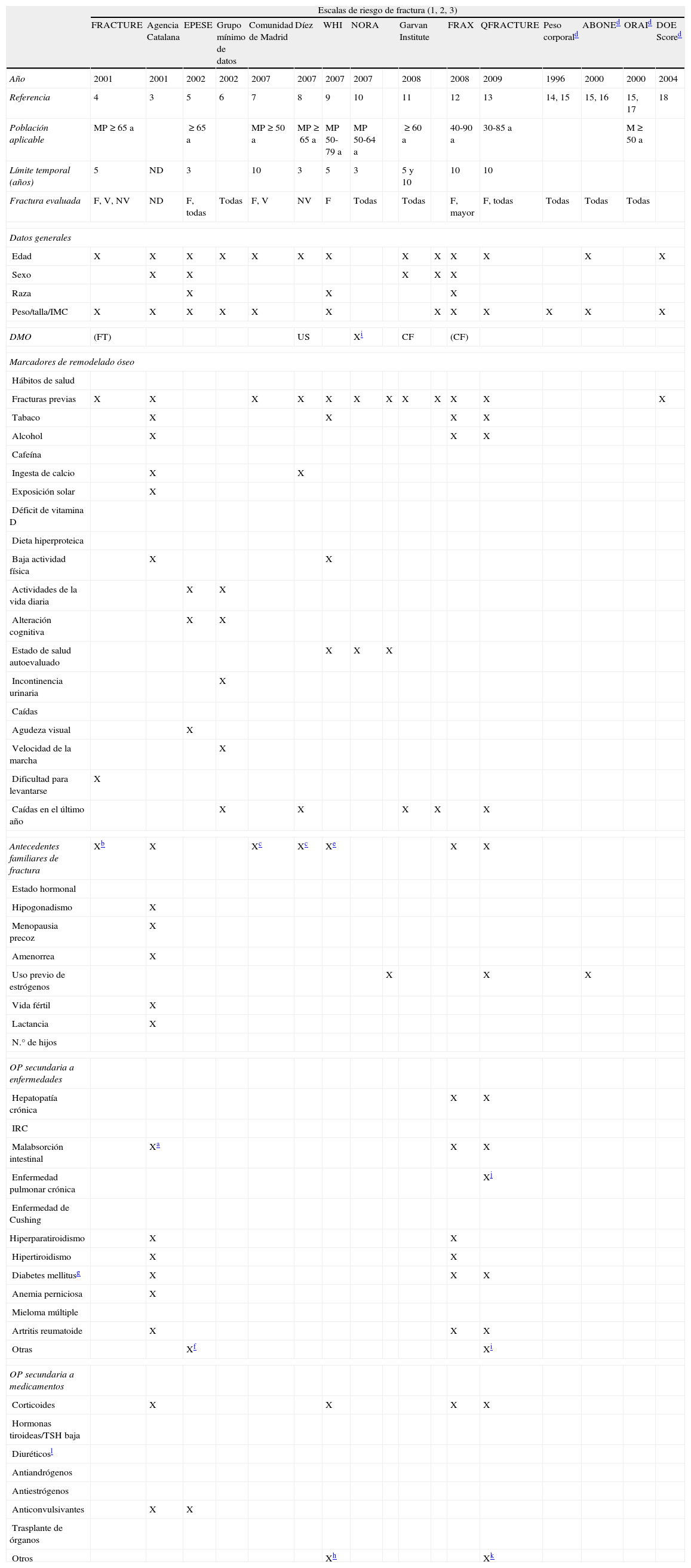
Se han desarrollado distintos instrumentos para estimar el riesgo de fractura sobre la base de los factores de riesgo (tabla 2). De ellos destacamos la herramienta FRAX©, que es una aplicación informática patrocinada por la OMS12, que se puede aplicar con y sin DMO. Los algoritmos del FRAX® calculan la probabilidad absoluta de fractura a 10 años en un grupo de «fracturas mayores» (fractura clínica vertebral, antebrazo, cadera y húmero) y para la fractura de cadera en solitario. Actualmente, es el instrumento más recomendado para el cálculo del riesgo de fractura osteoporótica. Sin embargo, como todo ellos, tiene limitaciones y el juicio clínico del médico sigue siendo fundamental. Un riesgo de fractura mayor calculado por FRAX© en población española superior al 15% es muy especifico de osteoporosis.
Características de las distintas escalas de riesgo de fractura osteoporótica
| Escalas de riesgo de fractura (1, 2, 3) | |||||||||||||||||
| FRACTURE | Agencia Catalana | EPESE | Grupo mínimo de datos | Comunidad de Madrid | Díez | WHI | NORA | Garvan Institute | FRAX | QFRACTURE | Peso corporald | ABONEd | ORAId | DOE Scored | |||
| Año | 2001 | 2001 | 2002 | 2002 | 2007 | 2007 | 2007 | 2007 | 2008 | 2008 | 2009 | 1996 | 2000 | 2000 | 2004 | ||
| Referencia | 4 | 3 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14, 15 | 15, 16 | 15, 17 | 18 | ||
| Población aplicable | MP≥65 a | ≥65 a | MP≥50 a | MP≥65 a | MP 50-79 a | MP 50-64 a | ≥60 a | 40-90 a | 30-85 a | M≥50 a | |||||||
| Límite temporal (años) | 5 | ND | 3 | 10 | 3 | 5 | 3 | 5 y 10 | 10 | 10 | |||||||
| Fractura evaluada | F, V, NV | ND | F, todas | Todas | F, V | NV | F | Todas | Todas | F, mayor | F, todas | Todas | Todas | Todas | |||
| Datos generales | |||||||||||||||||
| Edad | X | X | X | X | X | X | X | X | X | X | X | X | X | ||||
| Sexo | X | X | X | X | X | ||||||||||||
| Raza | X | X | X | ||||||||||||||
| Peso/talla/IMC | X | X | X | X | X | X | X | X | X | X | X | X | |||||
| DMO | (FT) | US | Xi | CF | (CF) | ||||||||||||
| Marcadores de remodelado óseo | |||||||||||||||||
| Hábitos de salud | |||||||||||||||||
| Fracturas previas | X | X | X | X | X | X | X | X | X | X | X | X | |||||
| Tabaco | X | X | X | X | |||||||||||||
| Alcohol | X | X | X | ||||||||||||||
| Cafeína | |||||||||||||||||
| Ingesta de calcio | X | X | |||||||||||||||
| Exposición solar | X | ||||||||||||||||
| Déficit de vitamina D | |||||||||||||||||
| Dieta hiperproteica | |||||||||||||||||
| Baja actividad física | X | X | |||||||||||||||
| Actividades de la vida diaria | X | X | |||||||||||||||
| Alteración cognitiva | X | X | |||||||||||||||
| Estado de salud autoevaluado | X | X | X | ||||||||||||||
| Incontinencia urinaria | X | ||||||||||||||||
| Caídas | |||||||||||||||||
| Agudeza visual | X | ||||||||||||||||
| Velocidad de la marcha | X | ||||||||||||||||
| Dificultad para levantarse | X | ||||||||||||||||
| Caídas en el último año | X | X | X | X | X | ||||||||||||
| Antecedentes familiares de fractura | Xb | X | Xc | Xc | Xe | X | X | ||||||||||
| Estado hormonal | |||||||||||||||||
| Hipogonadismo | X | ||||||||||||||||
| Menopausia precoz | X | ||||||||||||||||
| Amenorrea | X | ||||||||||||||||
| Uso previo de estrógenos | X | X | X | ||||||||||||||
| Vida fértil | X | ||||||||||||||||
| Lactancia | X | ||||||||||||||||
| N.° de hijos | |||||||||||||||||
| OP secundaria a enfermedades | |||||||||||||||||
| Hepatopatía crónica | X | X | |||||||||||||||
| IRC | |||||||||||||||||
| Malabsorción intestinal | Xa | X | X | ||||||||||||||
| Enfermedad pulmonar crónica | Xj | ||||||||||||||||
| Enfermedad de Cushing | |||||||||||||||||
| Hiperparatiroidismo | X | X | |||||||||||||||
| Hipertiroidismo | X | X | |||||||||||||||
| Diabetes mellitusg | X | X | X | ||||||||||||||
| Anemia perniciosa | X | ||||||||||||||||
| Mieloma múltiple | |||||||||||||||||
| Artritis reumatoide | X | X | X | ||||||||||||||
| Otras | Xf | Xi | |||||||||||||||
| OP secundaria a medicamentos | |||||||||||||||||
| Corticoides | X | X | X | X | |||||||||||||
| Hormonas tiroideas/TSH baja | |||||||||||||||||
| Diuréticosl | |||||||||||||||||
| Antiandrógenos | |||||||||||||||||
| Antiestrógenos | |||||||||||||||||
| Anticonvulsivantes | X | X | |||||||||||||||
| Trasplante de órganos | |||||||||||||||||
| Otros | Xh | Xk | |||||||||||||||
CF: cuello de fémur; DMO: densitometría ósea; F: fractura de fémur; FT: fémur total; FV: fractura vertebral; H: fractura de húmero; IRC: insuficiencia renal crónica; MP: mujeres posmenopáusicas; ND: no definida/no determinada; NV: fractura no vertebral; OP: osteoporosis; R: fractura de tercio distal de radio; US: ultrasonidos.
No existe un consenso en la literatura médica sobre el umbral por encima del cual un riesgo de fractura se consideraría «alto» en la población española. Una aproximación sería:
- –
Riesgo absoluto de fractura a 10 años<10%: bajo.
- –
Riesgo absoluto de fractura a 10 años ≥ 10% y<20%: moderado.
- –
Riesgo absoluto de fractura a 10 años ≥ 20%: alto.
En caso de utilizar el FRAX©, se recomienda aplicarlo de forma sistemática en los pacientes en los que: a) se esté valorando la indicación de una DMO; b) se esté valorando iniciar un tratamiento para la OP, y c) sean mayores de 65 años.
¿Qué datos de la anamnesis y exploración física son importantes?Ante la sospecha de OP, con objeto de valorar el riesgo de fractura y la causa de la OP, recomendamos recoger durante la anamnesis: edad, raza, antecedentes referidos a: hábitos tóxicos (tabaco, alcohol), ingesta dietética de calcio y vitamina D, grado de exposición a la luz solar, historia menstrual (edad de la menopausia y la menarquia), historia obstétrica (embarazos, partos y lactancia), historia ginecológica (intervenciones, menopausia quirúrgica, hipogonadismo), enfermedades y fármacos osteopenizantes, traumatismos previos, historia familiar/personal de fracturas por fragilidad y condiciones facilitadoras de las caídas, y datos de posibles fracturas recientes o previas (NE 5; GR D; GA 95%).
Se evaluará la presencia de fracturas recientes o previas, valorando episodios de dolor agudo y/o crónico de espalda, disminución progresiva de la talla, etc.13,14. Conviene recordar que la OP es asintomática y que más de la mitad de las fracturas vertebrales también lo son15.
En la exploración física recomendamos recoger: peso, la talla, existencia de deformidades esqueléticas y debe realizarse palpación/percusión de la columna (NE 5; GR D; GA 90%).
Es conocida la relación entre el índice de masa corporal y la DMO16. La posible existencia de deformidades esqueléticas se valorará por la presencia de cifosis dorsal, disminución de la distancia costillas-pelvis, etc., y la palpación/percusión se dirigirá a localizar zonas dolorosas del aparato locomotor14. La exploración física general puede aportar datos acerca de otras enfermedades que se asocian a disminución de la masa ósea.
¿Qué datos de laboratorio son importantes?Las pruebas de laboratorio se realizan para identificar procesos asociados y realizar el diagnóstico diferencial con otras enfermedades que cursan con fragilidad ósea17-21.
Ante una sospecha de OP o paciente con OP, se recomienda solicitar: hemograma, fosfatasa alcalina, creatinina, proteinograma, velocidad de sedimentación globular, calcio y fósforo en suero, y calciuria en orina de 24 h (NE 5; GR D; GA 100%).
Es aconsejable en la evaluación inicial del paciente con OP, analizar los valores de 25-hidroxivitamina D (25-[OH]-D3), parathormona (PTH) y hormona tirostimulante (NE 5; GR D; GA 80%).
En caso de sospecha de una enfermedad asociada se realizarán las pruebas de laboratorio pertinentes (NE 5; GR D; GA 95%).
No se recomienda la determinación sistemática de los marcadores óseos en el diagnóstico y la evaluación de la paciente con OP. Su medición puede ser útil para ayudar a identificar a sujetos con un mayor riesgo de fractura, y especialmente para valorar de forma precoz la respuesta a un tratamiento, tanto antirresortivo como osteoformador (NE 2c; GR C; GA 80%).
Los marcadores de remodelado óseo proporcionan información adicional y complementaria al estudio de la DMO. Destacan como marcadores de formación la osteocalcina, la fosfatasa alcalina ósea y el propéptido aminoterminal del procolágeno tipo I y entre los de resorción, las piridolinas, los telopéptidos carboxi y aminoterminal del colágeno tipo I (CTX en suero y NTX en orina) y la fosfatasa ácida resistente al tartrato 5b. Estos marcadores superan en sensibilidad y especificidad a los marcadores clásicos, fosfatasa alcalina total e hidroxiprolina. Para su correcta interpretación hay que tener en cuenta su variabilidad biológica y recordar que tienen un ritmo circadiano y, por ello, es necesario fijar un horario adecuado para la obtención de las muestras22-24.
¿Cuándo es aconsejable solicitar radiografías de columna?Las radiografías de columna no son útiles para valorar la disminución de la DMO, pero permiten el diagnóstico de fracturas, incluidas las asintomáticas. Debemos recordar que la presencia de fractura vertebral previa es un factor de riesgo relevante para nueva fractura, tanto vertebral como no vertebral25-29.
En pacientes con sospecha o diagnosticados de OP, se recomienda disponer de una radiografía de columna inicial para la detección de fracturas (NE 2b; GR B; GA 95%).
Durante el seguimiento, si existe una sospecha de fractura vertebral, se recomienda realizar una radiografía de columna (NE 2b; GR B; GA 100%).
El panel considera que para el diagnóstico de fractura vertebral es suficiente la proyección lateral de columna dorsal y lumbar, con el foco en D8 y L2, respectivamente30 (NE 2a; GR C; GA 100%).
Las proyecciones anteroposteriores no son imprescindibles para el diagnóstico, pero pueden aportar información adicional.
¿Cuándo realizar una densitometría ósea?El cribado densitométrico de la población general no es coste efectivo31 y existe una gran variabilidad en cuanto a las indicaciones de la densitometía3,32-37. Hasta el momento, no disponemos de herramientas validadas que nos cuantifiquen satisfactoriamente el riesgo de fractura, ni de una definición consensuada del dintel del riesgo de fractura que determine una acción terapéutica. La valoración de la DMO junto con otros factores de riesgo es útil para el diagnóstico y el seguimiento de los pacientes.
La indicación de realizar una densitometría debe basarse en criterios clínicos que nos permitan seleccionar a los pacientes en los que la utilización de esta tecnología resulte eficiente (NE 2b; GR B; GA 95%).
Antes de solicitarla, es esencial tener la seguridad de que el resultado de esta vaya a determinar la decisión terapéutica que se va a tomar38.
Se recomienda realizar una densitometría basal en (NE 5; GR D; GA 75%):
- 1.
Mujeres con menopausia precoz con algún factor mayor de riesgo de fractura.
- 2.
Mujeres posmenopáusicas de cualquier edad y varones de más de 50 años con al menos un factor mayor de riesgo de fractura.
- 3.
Antecedentes de fractura por fragilidad por encima de los 50 años.
- 4.
Enfermedad subyacente o tratamiento crónico con medicación que se asocie a pérdida ósea, especialmente glucocorticoides.
- 5.
Mujeres con más de 65 años y varones con > 70 años, aún sin factores de riesgo conocidos, al menos en una ocasión, si el paciente lo solicita.
- 6.
Evaluación de tratamiento farmacológico.
- 7.
En caso de utilizar el FRAX©, se recomienda realizar una densitometría a las mujeres de 65 años en adelante y a las de menos edad que tengan un riesgo de fractura mayor, según el FRAX©, equivalente al de una mujer de 65 años sin factores de riesgo (FRAX español 3,6%)39,40.
Para detectar cambios significativos con un intervalo de confianza (IC) del 95%, estos deben ser, como mínimo, 2,8 veces el coeficiente de variación (cambio mínimo significativo). En la práctica clínica su aplicación es difícil, pues se requieren medidas de precisión muy estrictas41. La utilización de otro concepto más pragmático, «la diferencia más pequeña detectable» que se establece en un 2% (cambio de la DMO lumbar±0,05g/cm2, fémur total±0,04g/cm2)42. Aunque los mayores cambios en la DMO se detectan en columna lumbar, es útil monitorizar también la cadera pues es menos dependiente de artefactos provocados por cambios degenerativos.
¿Qué técnica densitométrica es la más adecuada?Se recomienda, como técnica de referencia para medir la DMO, la absorciometría radiográfica de doble energía (dual energy x-ray absorciometry [DXA]) (NE 2b; GR B; GA 100%).
La DXA es una técnica con una buena precisión, baja exposición radiológica y que permite la medición de la DMO tanto en el esqueleto axial como periférico. Está considerada como la mejor técnica para evaluar la DMO28,41,42.
¿Para qué sirve la absorciometría radiográfica de doble energía?Los resultados de la DMO obtenidos mediante DXA predicen el riesgo futuro de fractura por OP, tanto en mujeres posmenopáusicas como en varones de edad avanzada43-49. Pero además, según la OMS, para realizar el diagnóstico de OP es necesario conocer el valor de la DMO en fémur y columna lumbar mediante DXA central50,51. Actualmente, la DXA central es la única técnica validada en el seguimiento y en la evaluación de la respuesta terapéutica.
Para realizar el diagnóstico de OP, se recomienda realizar una DXA, siempre que sea posible, en la cadera y en la columna lumbar (NE 2b; GR B; GA 95%).
La proyección lateral de la columna no debe utilizarse para el diagnóstico de OP.
Si no es posible realizar una DXA en la columna lumbar o en la cadera, se recomienda realizar la DXA en el tercio distal del radio del antebrazo no dominante (NE 2b; GR B; GA 90%).
Esto puede suceder en caso de alteraciones anatómicas (grandes escoliosis, trastornos degenerativos, fracturas vertebrales múltiples, obesidad mórbida) o problemas de tipo técnico (presencia de elementos de tipo metálico por cirugía del raquis, artroplastia de cadera)52.
Cuando sea necesario, se recomienda realizar la DXA de control en cadera y en columna lumbar; a ser posible la medición debe realizarse con el mismo equipo (NE 1b; GR A; GA 90%).
La precisión o reproducibilidad a largo plazo de la DXA, expresada como coeficiente de variación, varía según la zona de medición y el aparato utilizado entre el 1 y el 2%53-55. En mujeres que realizan tratamiento por una OP posmenopáusica, se recomienda realizar los controles densitométricos cada 2-3 años32. En general, no se recomienda realizar los controles densitométricos antes de los 2 años, ya que se ha observado que algunas pacientes tratadas pierden masa ósea el primer año pero pueden ganarla durante el segundo año55.
Los ultrasonidos, los equipos DXA periféricos y la tomografía computarizada cuantitativa central o periférica son útiles para predecir un riesgo elevado de fractura pero no deben utilizarse para el diagnóstico, el seguimiento o la evaluación de la respuesta terapéutica en pacientes con OP (NE 1a; GR A; GA 95%).
Existen otras técnicas para medir la DMO en el esqueleto periférico, como la DXA de falange, rodilla y calcáneo, y los ultrasonidos en calcáneo. Son más baratas, de fácil manejo y mayor rapidez en comparación con la DXA central, pero, entre otras limitaciones, su precisión es baja49,52,56,57. Son útiles para predecir el riesgo futuro de fractura y pueden tener algún valor cuando no es posible realizar una DXA central49,52,56. La tomografía computarizada cuantitativa periférica es una técnica radiológica en rápido desarrollo. Permite medir la DMO volumétrica en columna lumbar, cadera y radio distal, pero sus resultados no son comparables con los obtenidos mediante equipos DXA58.
¿Cómo se diagnostica la osteoporosis?El diagnóstico de OP se basa en los criterios densitométricos establecidos por la OMS para mujeres posmenopáusicas de raza blanca (valores de DMO inferiores a –2,5 desviaciones estándar (DE) (T-score inferior a –2,5) y/o en la presencia de fracturas por fragilidad (NE 2c; GR B; GA 90%).
Los niveles o puntos de corte de la DMO medida por DXA en columna lumbar y cadera59-61 corresponden a normal, valores de DMO > –1 DE en relación con la media de adultos jóvenes (T-score > –1); osteopenia o masa ósea baja, valores de DMO entre –1 y –2,5 DE (T-score entre –1 y –2,5); OP, valores de DMO< –2,5 DE (T-score<–2,5), y OP establecida cuando a las condiciones previas se asocia ≥ 1 fractura osteoporótica. Para los varones adultos se han propuesto estos mismos puntos de corte60.
Tratamiento¿Qué medidas no farmacológicas debemos utilizar?Las siguientes medidas generales se deben recomendar a toda la población, con especial énfasis a los pacientes osteoporóticos: práctica de ejercicio físico, eliminación de hábitos tóxicos, dieta equilibrada, aporte adecuado de calcio y vitamina D, prevención de caídas (NE 1a; GR A; GA 100%).
El ejercicio físico moderado-intenso incrementa la masa ósea de los jóvenes62-66, y también en los adultos, aunque de forma menos intensa67. No existe evidencia consistente del efecto sobre la masa ósea en ancianos, pero su realización reduce el riesgo de fracturas, probablemente disminuyendo las caídas68-70.
Se recomienda evitar el sedentarismo y realizar una actividad física moderada, específica para cada individuo, teniendo en cuenta su edad, estado físico y la presencia de otras enfermedades (NE 5; GR D; GA 100%).
Se recomienda una dieta equilibrada con una ingesta adecuada de proteínas, evitar el exceso de sal y una exposición solar moderada (NE 5; GR D; GA 100%).
Se recomienda una ingesta diaria de calcio de 1.000mg y unos niveles séricos de 25-OH vitamina D ≥ 30 ng/ml (75 mmol/l) (NE 5; GR D; GA 100%).
A veces, la dieta habitual no aporta estos requerimientos cálcicos, por lo que en ocasiones hay que modificarla o añadir suplementos de calcio farmacológicos, aunque, administrados de forma aislada, no han demostrado efecto significativo sobre la reducción de fracturas en la OP posmenopáusica, pero sí logran reducir la pérdida de masa ósea71-73. En mujeres sanas, se ha sugerido que pueden incrementar el riesgo cardiovascular74,75 y la litiasis renal76, pero este tema es muy controvertido y no está claro.
Alrededor del 50% de la población osteoporótica presenta concentraciones séricas bajas de vitamina D y se aconseja suplementar con 800-1.000 U de vitamina D a todos estos pacientes. La eficacia de los suplementos de vitamina D en la prevención de fracturas es controvertida77-82. Existe evidencia de la reducción de fracturas en ancianos de instituciones asistenciales cuando se administra junto con calcio77-82. Adicionalmente, algunos estudios indican que los suplementos de vitamina D pueden reducir las caídas81 y otros no82.
En pacientes que reciben tratamiento anticatabólico se recomienda un aporte de 1.000mg de calcio y de 800-1.000 U de vitamina D al día (NE 1a; GR A; GA 95%).
En los ancianos se deben extremar las medidas encaminadas a reducir el riesgo de caídas, promoviendo el uso de bastones, evitando los psicofármacos, corrigiendo las alteraciones visuales y adaptando la vivienda. En poblaciones de riesgo alto de caída, se pueden utilizar protectores de cadera83-85.
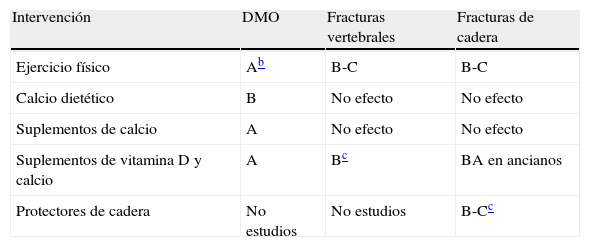
Para más información, consúltese la tabla 3.
Grado de recomendación de las intervenciones no farmacológicasa
| Intervención | DMO | Fracturas vertebrales | Fracturas de cadera |
| Ejercicio físico | Ab | B-C | B-C |
| Calcio dietético | B | No efecto | No efecto |
| Suplementos de calcio | A | No efecto | No efecto |
| Suplementos de vitamina D y calcio | A | Bc | BA en ancianos |
| Protectores de cadera | No estudios | No estudios | B-Cc |
DMO: densidad mineral ósea.
Los objetivos principales del tratamiento de una fractura vertebral aguda son el control del dolor y la recuperación funcional (NE 2b; GR B; GA 100%).
Es muy importante informar a los pacientes que las fracturas pueden tardar hasta 3 meses en consolidar y que el dolor irá paulatinamente disminuyendo y la función, mejorando86.
Los analgésicos por vía oral, el reposo relativo, las ortesis y la rehabilitación son los pilares fundamentales del tratamiento (NE 2b; GR B; GA 90%).
Los analgésicos por vía oral son los fármacos de primera línea para reducir el dolor de las fracturas vertebrales. La elección debe ser adecuada a la magnitud del dolor. En los casos en que el dolor alcance una intensidad relevante y hayan fracasado los analgésicos convencionales, se aconseja utilizar opioides87,88.
Si se indica reposo absoluto, se debe intentar la reincorporación a la sedestación y a la marcha en el mínimo tiempo posible. Durante el episodio agudo puede estar indicada la prescripción de ortesis y, una vez conseguido el control del dolor agudo, puede ser útil la realización de rehabilitación (NE 5; GR B; GA 95%).
Las ortesis se deberán utilizar con precaución, pues una inmovilidad raquídea excesiva podría incrementar la OP89, y la rehabilitación debe dirigirla el especialista correspondiente90.
En pacientes con fractura vertebral aguda cuyo dolor no responde a las medidas anteriores, puede valorarse la indicación de vertebroplastia o cifoplastia (NE 1c; GR B; GA 95%).
Diferentes estudios observacionales han demostrado un rápido efecto analgésico y una reducción del periodo de inmovilización en un elevado porcentaje de pacientes a corto-medio plazo, sin por ello estar exentas de efectos secundarios91-96. Recientemente, 2 ensayos clínicos controlados no demostraron que la vertebroplastia fuera más eficaz que otras opciones más conservadores97,98. Otro ensayo controlado sí que ha encontrado beneficio con el uso de la vertebroplastia en un subgrupo de pacientes con síntomas persistentes e intensos99. Sobre la base de lo anteriormente expuesto, hay que seleccionar bien a los pacientes a los que se les va a indicar estas intervenciones100.
Actualmente, no se puede recomendar la generalización de la vertebroplastia o la cifoplastia para el tratamiento de las fracturas vertebrales osteoporóticas (NA 5; GR D; GA 100%).
¿Qué fármacos se pueden recomendar en la osteoporosis?El objetivo del tratamiento farmacológico de la OP es reducir el riesgo de fractura (NE 1a; GR A; GA 100%).
La intervención farmacológica se realiza con agentes terapéuticos capaces de actuar en las dos fases del remodelado óseo. En el momento actual, existen tres categorías de fármacos antiosteoporóticos: antirresortivos o anticatabólicos, que inhiben la resorción ósea actuando sobre los osteoclastos o sus precursores, disminuyen la tasa de activación del remodelado óseo, incrementan la densidad mineral ósea y preservan la microarquitectura del hueso; anabólicos, que actuando sobre los osteoblastos o sus precursores producen un aumento del remodelado óseo, con un incremento de la formación de hueso en mayor medida que la resorción, lo que aumenta la masa y la resistencia del hueso, y los agentes de doble acción, en los que existe una combinación de ambos mecanismos101,102.
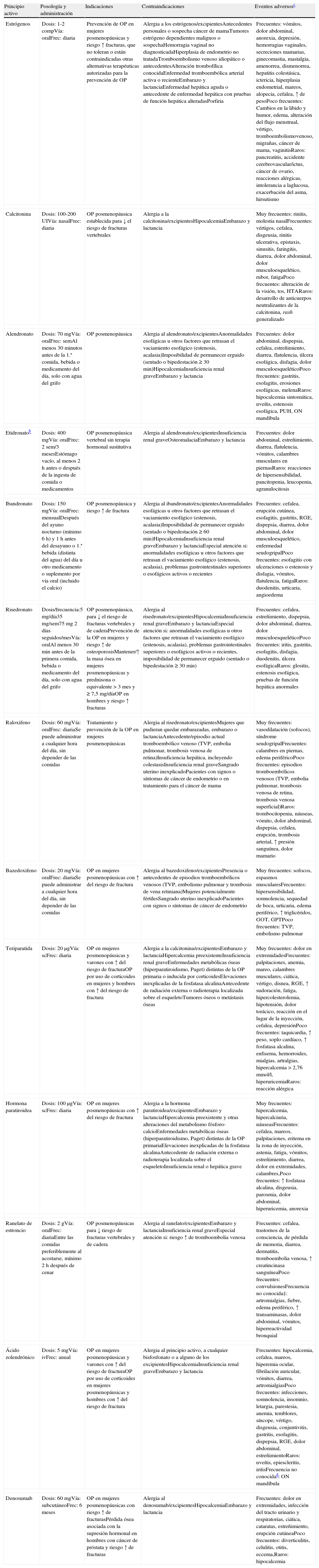
Para más información en cuanto a la indicación, la eficacia en relación con la prevención de fracturas y los eventos adversos, consúltese las tablas 4 y 5.
Características de los principales fármacos comercializados para la osteoporosis en España (según ficha técnica, actualizado a enero de 2010)a
| Principio activo | Posología y administración | Indicaciones | Contraindicaciones | Eventos adversosc |
| Estrógenos | Dosis: 1-2 compVía: oralFrec: diaria | Prevención de OP en mujeres posmenopáusicas y riesgo ↑ fracturas, que no toleran o están contraindicadas otras alternativas terapéuticas autorizadas para la prevención de OP | Alergia a los estrógenos/excipientesAntecedentes personales o sospecha cáncer de mamaTumores estrógeno dependientes malignos o sospechaHemorragia vaginal no diagnosticadaHiperplasia de endometrio no tratadaTromboembolismo venoso idiopático o antecedentesAlteración trombofílica conocidaEnfermedad tromboembólica arterial activa o recienteEmbarazo y lactanciaEnfermedad hepática aguda o antecedente de enfermedad hepática con pruebas de función hepática alteradasPorfiria | Frecuentes: vómitos, dolor abdominal, anorexia, depresión, hemorragias vaginales, secreciones mamarias, ginecomastia, mastalgia, amenorrea, dismenorrea, hepatitis colestásica, ictericia, hiperplasia endometrial, mareos, alopecia, cefalea, ↑ de pesoPoco frecuentes: Cambios en la libido y humor, edema, alteración del flujo menstrual, vértigo, tromboembolismovenoso, migrañas, cáncer de mama, vaginitisRaros: pancreatitis, accidente cerebrovascular/ictus, cáncer de ovario, reacciones alérgicas, intolerancia a laglucosa, exacerbación del asma, hirsutismo |
| Calcitonina | Dosis: 100-200 UIVía: nasalFrec: diaria | OP posmenopáusica establecida para ↓ el riesgo de fracturas vertebrales | Alergia a la calcitonina/excipientesHipocalcemiaEmbarazo y lactancia | Muy frecuentes: rinitis, molestia nasalFrecuentes: vértigos, cefalea, disgeusia, rinitis ulcerativa, epistaxis, sinusitis, faringitis, diarrea, dolor abdominal, dolor musculoesquelético, rubor, fatigaPoco frecuentes: alteración de la visión, tos, HTARaros: desarrollo de anticuerpos neutralizantes de la calcitonina, rash generalizado |
| Alendronato | Dosis: 70 mgVía: oralFrec: semAl menos 30 minutos antes de la 1.ª comida, bebida o medicamento del día, solo con agua del grifo | OP posmenopáusica | Alergia al alendronato/excipientesAnormalidades esofágicas u otros factores que retrasan el vaciamiento esofágico (estenosis, acalasia)Imposibilidad de permanecer erguido (sentado o bipedestación ≥ 30 min)HipocalcemiaInsuficiencia renal graveEmbarazo y lactancia | Frecuentes: dolor abdominal, dispepsia, cefalea, estreñimiento, diarrea, flatulencia, úlcera esofágica, disfagia, dolor musculoesqueléticoPoco frecuentes: gastritis, esofagitis, erosiones esofágicas, melenaRaros: hipocalcemia sintomática, uveítis, estenosis esofágica, PUH, ON mandíbula |
| Etidronatob | Dosis: 400 mgVía: oralFrec: 2 sem/3 mesesEstómago vacío, al menos 2 h antes o después de la ingesta de comida o medicamentos | OP posmenopáusica vertebral sin terapia hormonal sustitutiva | Alergia al alendronato/excipientesInsuficiencia renal graveOsteomalaciaEmbarazo y lactancia | Frecuentes: dolor abdominal, estreñimiento, diarrea, flatulencia, vómitos, calambres musculares en piernasRaros: reacciones de hipersensibilidad, pancitopenia, leucopenia, agranulocitosis |
| Ibandronato | Dosis: 150 mgVía: oralFrec: mensualDespués del ayuno nocturno (mínimo 6 h) y 1 h antes del desayuno o 1.ª bebida (distinta del agua) del día u otro medicamento o suplemento por vía oral (incluido el calcio) | OP posmenopáusica y riesgo ↑ de fractura | Alergia al ibandronato/excipientesAnormalidades esofágicas u otros factores que retrasan el vaciamiento esofágico (estenosis, acalasia)Imposibilidad de permanecer erguido (sentado o bipedestación ≥ 60 min)HipocalcemiaInsuficiencia renal graveEmbarazo y lactanciaEspecial atención si: anormalidades esofágicas u otros factores que retrasan el vaciamiento esofágico (estenosis, acalasia), problemas gastrointestinales superiores o esofágicos activos o recientes | Frecuentes: cefalea, erupción cutánea, esofagitis, gastritis, RGE, dispepsia, diarrea, dolor abdominal, dolor musculoesquelético, enfermedad seudogripalPoco frecuentes: esofagitis con ulceraciones o estenosis y disfagia, vómitos, flatulencia, fatigaRaros: duodenitis, urticaria, angioedema |
| Risedronato | Dosis/frecuencia:5 mg/día35 mg/sem75mg 2 días seguidos/mesVía: oralAl menos 30 min antes de la primera comida, bebida o medicamento del día, solo con agua del grifo | OP posmenopáusica, para ↓ el riesgo de fracturas vertebrales y de caderaPrevención de la OP en mujeres y riesgo ↑ de osteoporosisMantener/↑ la masa ósea en mujeres posmenopáusicas y prednisona o equivalente > 3 mes y ≥ 7,5 mg/díaOP en hombres y riesgo ↑ fracturas | Alergia al risedronato/excipientesHipocalcemiaInsuficiencia renal graveEmbarazo y lactanciaEspecial atención si: anormalidades esofágicas u otros factores que retrasan el vaciamiento esofágico (estenosis, acalasia), problemas gastrointestinales superiores o esofágicos activos o recientes, imposibilidad de permanecer erguido (sentado o bipedestación ≥ 30 min) | Frecuentes: cefalea, estreñimiento, dispepsia, dolor abdominal, diarrea, dolor musculoesqueléticoPoco frecuentes: iritis, gastritis, esofagitis, disfagia, duodenitis, úlcera esofágicaRaros: glositis, estenosis esofágica, pruebas de función hepática anormales |
| Raloxifeno | Dosis: 60 mgVía: oralFrec: diariaSe puede administrar a cualquier hora del día, sin depender de las comidas | Tratamiento y prevención de la OP en mujeres posmenopáusicas | Alergia al risedronato/excipientesMujeres que pudieran quedar embarazadas, embarazo o lactanciaAntecedente/episodio actual tromboembólico venoso (TVP, embolia pulmonar, trombosis venosa de retina)Insuficiencia hepática, incluyendo colestasisInsuficiencia renal graveSangrado uterino inexplicadoPacientes con signos o síntomas de cáncer de endometrio o en tratamiento para el cáncer de mama | Muy frecuentes: vasodilatación (sofocos), síndrome seudogripalFrecuentes: calambres en piernas, edema periféricoPoco frecuentes: episodios tromboembólicos venosos (TVP, embolia pulmonar, trombosis venosa de retina, trombosis venosa superficial)Raros: trombocitopenia, náuseas, vómito, dolor abdominal, dispepsia, cefalea, erupción, trombosis arterial, ↑ presión sanguínea, dolor mamario |
| Bazedoxifeno | Dosis: 20 mgVía: oralFrec: diariaSe puede administrar a cualquier hora del día, sin depender de las comidas | OP en mujeres posmenopáusicas con ↑ del riesgo de fractura | Alergia al bazedoxifeno/excipientesPresencia o antecedentes de episodios tromboembólicos venosos (TVP, embolismo pulmonar y trombosis de vena retiniana)Mujeres potencialmente fértilesSangrado uterino inexplicadoPacientes con signos o síntomas de cáncer de endometrio | Muy frecuentes: sofocos, espasmos muscularesFrecuentes: hipersensibilidad, somnolencia, sequedad de boca, urticaria, edema periférico, ↑ triglicéridos, GOT, GPTPoco frecuentes: TVP, embolismo pulmonar |
| Teriparatida | Dosis: 20μgVía: scFrec: diaria | OP en mujeres posmenopáusicas y varones con ↑ del riesgo de fracturaOP por uso de corticoides en mujeres y hombres con ↑ del riesgo de fractura | Alergia a la calcitonina/excipientesEmbarazo y lactanciaHipercalcemia preexistenteInsuficiencia renal graveEnfermedades metabólicas óseas (hiperparatiroidismo, Paget) distintas de la OP primaria o inducida por corticoidesElevaciones inexplicadas de la fosfatasa alcalinaAntecedente de radiación externa o radioterapia localizada sobre el esqueletoTumores óseos o metástasis óseas | Muy frecuentes: dolor en extremidadesFrecuentes: palpitaciones, anemia, mareo, calambres musculares, ciática, vértigo, disnea, RGE, ↑ sudoración, fatiga, hipercolesterolemia, hipotensión, dolor torácico, reacción en el lugar de la inyección, cefalea, depresiónPoco frecuentes: taquicardia, ↑ peso, soplo cardíaco, ↑ fosfatasa alcalina, enfisema, hemorroides, mialgias, artralgias, hipercalcemia > 2,76 mmol/l, hiperuricemiaRaros: reacción alérgica |
| Hormona paratiroidea | Dosis: 100μgVía: scFrec: diaria | OP en mujeres posmenopáusicas con ↑ del riesgo de fractura | Alergia a la hormona paratiroidea/excipientesEmbarazo y lactanciaHipercalcemia preexistente y otras alteraciones del metabolismo fósforo-calcioEnfermedades metabólicas óseas (hiperparatiroidismo, Paget) distintas de la OP primariaElevaciones inexplicadas de la fosfatasa alcalinaAntecedente de radiación externa o radioterapia localizada sobre el esqueletoInsuficiencia renal o hepática grave | Muy frecuentes: hipercalcemia, hipercalciuria, náuseasFrecuentes: cefalea, mareos, palpitaciones, eritema en la zona de inyección, astenia, fatiga, vómitos, estreñimiento, diarrea, dolor en extremidades, calambres,Poco frecuentes: ↑ fosfatasa alcalina, disgeusia, parosmia, dolor abdominal, hiperuricemia, anorexia |
| Ranelato de estroncio | Dosis: 2 gVía: oralFrec: diariaEntre las comidas preferiblemente al acostarse, mínimo 2 h después de cenar | OP posmenopáusicas para ↓ riesgo de fracturas vertebrales y de cadera | Alergia al ranelato/excipientesEmbarazo y lactanciaInsuficiencia renal graveEspecial atención si: riesgo ↑ de tromboembolia venosa | Frecuentes: cefalea, trastornos de la consciencia, de pérdida de memoria, diarrea, dermatitis, tromboembolia venosa, ↑ creatincinasa sanguíneaPoco frecuentes: convulsionesFrecuencia no conocida‡: artromialgias, fiebre, edema periférico, ↑ transaminasas, dolor abdominal, vómitos, hiperreactividad bronquial |
| Ácido zolendrónico | Dosis: 5 mgVía: ivFrec: anual | OP en mujeres posmenopáusicas y varones con ↑ del riesgo de fracturaOP por uso de corticoides en mujeres posmenopáusicas y hombres con ↑ del riesgo de fractura | Alergia al principio activo, a cualquier bisfosfonato o a alguno de los excipientesHipocalcemiaInsuficiencia renal graveEmbarazo y lactancia | Frecuentes: hipocalcemia, cefalea, mareos, hiperemia ocular, fibrilación auricular, vómitos, diarrea, artromialgiasPoco frecuentes: infecciones, somnolencia, insomnio, letargia, parestesia, anemia, temblores, síncope, vértigo, disgeusia, conjuntivitis, gastritis, esofagitis, dispepsia, RGE, dolor abdominal, estreñimientoRaros: uveítis, epiescleritis, iritisFrecuencia no conocidad: ON mandíbula |
| Denosumab | Dosis: 60 mgVía: subcutáneoFrec: 6 meses | OP en mujeres posmenopáusicas con riesgo ↑ de fracturasPérdida ósea asociada con la supresión hormonal en hombres con cáncer de próstata y riesgo ↑ de fracturas | Alergia al denosumab/excipientesHipocalcemiaEmbarazo y lactancia | Frecuentes: dolor en extremidades, infección del tracto urinario y respiratorias, ciática, cataratas, estreñimiento, erupción cutáneaPoco frecuentes: diverticulitis, celulitis, otitis, eccema,Raros: hipocalcemia |
Comp: comprimidos; Frec: frecuencia; HTA: hipertensión arterial; iv: intravenosa; mg: miligramo; μg: microgramo; sem: semanal; ON: osteonecrosis; OP: osteoporosis; PUH: perforación, úlceras, hemorragia; RGE: reflujo gastroesofágico; sc: subcutánea; TVP: trombosis venosa profunda.
Los datos de la presente tabla están obtenidos de la ficha técnica de la Agencia Española del Medicamento.
Información no disponible en ficha técnica. Consultado en Vademecum, Food and Drug Administration (FDA).
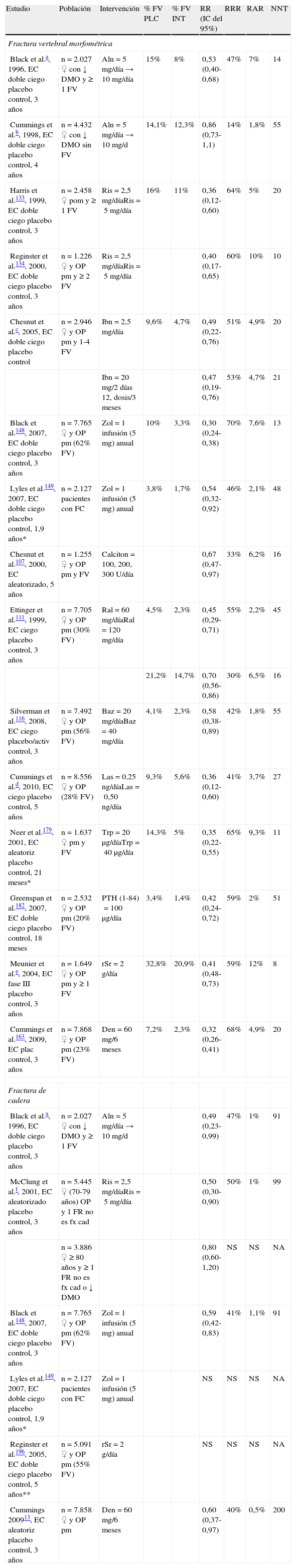
Eficacia antifractura de los fármacos antiosteoporóticos
| Estudio | Población | Intervención | % FV PLC | % FV INT | RR (IC del 95%) | RRR | RAR | NNT |
| Fractura vertebral morfométrica | ||||||||
| Black et al.a, 1996, EC doble ciego placebo control, 3 años | n=2.027 ♀ con ↓ DMO y ≥ 1 FV | Aln=5 mg/día → 10 mg/día | 15% | 8% | 0,53 (0,40-0,68) | 47% | 7% | 14 |
| Cummings et al.b, 1998, EC doble ciego placebo control, 4 años | n=4.432 ♀ con ↓ DMO sin FV | Aln=5 mg/día → 10 mg/d | 14,1% | 12,3% | 0,86 (0,73-1,1) | 14% | 1,8% | 55 |
| Harris et al.133, 1999, EC doble ciego placebo control, 3 años | n=2.458 ♀ pom y ≥ 1 FV | Ris=2,5 mg/díaRis=5 mg/día | 16% | 11% | 0,36 (0,12-0,60) | 64% | 5% | 20 |
| Reginster et al.134, 2000, EC doble ciego placebo control, 3 años | n=1.226 ♀ y OP pm y ≥ 2 FV | Ris=2,5 mg/díaRis=5 mg/día | 0,40 (0,17-0,65) | 60% | 10% | 10 | ||
| Chesnut et al.c, 2005, EC doble ciego placebo control | n=2.946 ♀ y OP pm y 1-4 FV | Ibn=2,5 mg/día | 9,6% | 4,7% | 0,49 (0,22-0,76) | 51% | 4,9% | 20 |
| Ibn=20 mg/2 días 12, dosis/3 meses | 0,47 (0,19-0,76) | 53% | 4,7% | 21 | ||||
| Black et al.148, 2007, EC doble ciego placebo control, 3 años | n=7.765 ♀ y OP pm (62% FV) | Zol=1 infusión (5 mg) anual | 10% | 3,3% | 0,30 (0,24-0,38) | 70% | 7,6% | 13 |
| Lyles et al.149, 2007, EC doble ciego placebo control, 1,9 años* | n=2.127 pacientes con FC | Zol=1 infusión (5 mg) anual | 3,8% | 1,7% | 0,54 (0,32-0,92) | 46% | 2,1% | 48 |
| Chesnut et al.107, 2000, EC aleatorizado, 5 años | n=1.255 ♀ y OP pm y FV | Calciton=100, 200, 300 U/día | 0,67 (0,47-0,97) | 33% | 6,2% | 16 | ||
| Ettinger et al.111, 1999, EC ciego placebo control, 3 años | n=7.705 ♀ y OP pm (30% FV) | Ral=60 mg/díaRal=120 mg/día | 4,5% | 2,3% | 0,45 (0,29-0,71) | 55% | 2,2% | 45 |
| 21,2% | 14,7% | 0,70 (0,56-0,86) | 30% | 6,5% | 16 | |||
| Silverman et al.116, 2008, EC ciego placebo/activ control, 3 años | n=7.492 ♀ y OP pm (56% FV) | Baz=20 mg/díaBaz=40 mg/día | 4,1% | 2,3% | 0,58 (0,38-0,89) | 42% | 1,8% | 55 |
| Cummings et al.d, 2010, EC ciego placebo control, 5 años | n=8.556 ♀ y OP (28% FV) | Las=0,25 ng/díaLas=0,50 ng/día | 9,3% | 5,6% | 0,36 (0,12-0,60) | 41% | 3,7% | 27 |
| Neer et al.179, 2001, EC aleatoriz placebo control, 21 meses* | n=1.637 ♀ pm y FV | Trp=20μg/díaTrp=40μg/día | 14,3% | 5% | 0,35 (0,22-0,55) | 65% | 9,3% | 11 |
| Greenspan et al.182, 2007, EC doble ciego placebo control, 18 meses | n=2.532 ♀ y OP pm (20% FV) | PTH (1-84)=100μg/día | 3,4% | 1,4% | 0,42 (0,24-0,72) | 59% | 2% | 51 |
| Meunier et al.e, 2004, EC fase III placebo control, 3 años | n=1.649 ♀ y OP pm y ≥ 1 FV | rSr=2 g/día | 32,8% | 20,9% | 0,41 (0,48-0,73) | 59% | 12% | 8 |
| Cummings et al.163, 2009, EC plac control, 3 años | n=7.868 ♀ y OP pm (23% FV) | Den=60 mg/6 meses | 7,2% | 2,3% | 0,32 (0,26-0,41) | 68% | 4,9% | 20 |
| Fractura de cadera | ||||||||
| Black et al.a, 1996, EC doble ciego placebo control, 3 años | n=2.027 ♀ con ↓ DMO y ≥ 1 FV | Aln=5 mg/día → 10 mg/d | 0,49 (0,23-0,99) | 47% | 1% | 91 | ||
| McClung et al.f, 2001, EC aleatorizado placebo control, 3 años | n=5.445 ♀ (70-79 años) OP y 1 FR no es fx cad | Ris=2,5 mg/díaRis=5 mg/día | 0,50 (0,30-0,90) | 50% | 1% | 99 | ||
| n=3.886 ♀ ≥ 80 años y ≥ 1 FR no es fx cad o ↓ DMO | 0,80 (0,60-1,20) | NS | NS | NA | ||||
| Black et al.148, 2007, EC doble ciego placebo control, 3 años | n=7.765 ♀ y OP pm (62% FV) | Zol=1 infusión (5 mg) anual | 0,59 (0,42-0,83) | 41% | 1,1% | 91 | ||
| Lyles et al.149, 2007, EC doble ciego placebo control, 1,9 años* | n=2.127 pacientes con FC | Zol=1 infusión (5 mg) anual | NS | NS | NS | NA | ||
| Reginster et al.196, 2005, EC doble ciego placebo control, 5 años** | n=5.091 ♀ y OP pm (55% FV) | rSr=2 g/día | NS | NS | NS | NA | ||
| Cummings 200913, EC aleatoriz placebo control, 3 años | n=7.858 ♀ y OP pm | Den=60 mg/6 meses | 0,60 (0,37-0,97) | 40% | 0,5% | 200 | ||
Aln: alendronato; Baz: bazadoxifeno; Calciton: calcitonina; DMO: densidad mineral ósea; EC: ensayo clínico; FC: fractura de cadera; FR no es fx cad: factor de riesgo no esquelético de fractura de cadera; FV: fractura vertebral; IC: intervalo de confianza; INT: intervención; mg: miligramo; μg: microgramo; ng: nanogramo; Las: lasofoxifeno; NA: no aplicable; NNT: número necesario de pacientes que se deben tratar para evitar un evento; NS: no diferencias estadísticamente significativas; OP: osteoporosis; PLC: placebo; pm: posmenopáusica; Ral: raloxifeno; Ris: risedronato; RR: riesgo relativo; RRA: reducción absoluta del riesgo; RRR: reducción relativa del riesgo; rSr: ranelato de estroncio; Trp: teriparatida; Zol: zoledronato.
RR: incidencia en expuestos/incidencia en no expuestos; la probabilidad de que ocurra un evento (p. ej., fracturas). Si es < 1, la intervención es protectora del evento.
RRR: (1-RR) * 100; si una intervención reduce el riesgo de un evento, el RRR expresaría el porcentaje en el que la intervención contribuiría a disminuir el riesgo del evento relativo al que ha ocurrido en el grupo control.
RAR: (incidencia en no expuestos – incidencia en expuestos) * 100; se refiere al porcentaje de eventos que podríamos evitar con la intervención. Si esta es 0,40 (es decir el 40%), de cada 100 personas tratadas con la intervención podemos evitar 40 eventos.
NNT: 1/RAR; número necesario de pacientes que se deben tratar para evitar un evento.
*Media del seguimiento.
**En un subgrupo de 1.977 mujeres con riesgo muy elevado de fractura de cadera (edad media 80 años) hubo una reducción del riesgo de un 36% (p=0,046).
Black DM, Cummings SR, Karpf DB, Cauley JA, Thompson DE, Nevitt MC, et al. Randomised trial of effect of alendronate on risk of fracture in women with existing vertebral fractures. Fracture Intervention Trial Research Group. Lancet. 1996;348:1535-1541.
Cummings SR, Black DM, Thompson DE, Applegate WB, Barrett-Connor E, Musliner TA, et al. Effect of alendronate on risk of fracture in women with low bone density but without vertebral fractures: results from the Fracture Intervention Trial. JAMA. 1998;280:2077-2082.
Chesnut CH, Ettinger MP, Miller PD, Baylink DJ, Emkey R, Harris ST, et al. Ibandronate produces significant, similar antifracture efficacy in North American and European women: new clinical findings from BONE. Curr Med Res Opin. 2005;21:391-401.
Cummings SR, Ensrud K, Delmas PD, LaCroix AZ, Vukicevic S, Reid DM, et al. Lasofoxifene in postmenopausal women with osteoporosis. N Engl J Med. 2010;362:686-96.
Actualmente, la THS no se debe recomendar para el tratamiento de la OP posmenopáusica, excepto en el caso de mujeres con menopausia precoz, con intensa sintomatología climatérica o en el caso de no poderse administrar otros fármacos para la OP por efectos adversos o ineficacia (NE 1c; GR B; GA 95%).
Los estrógenos pueden reducir la incidencia de fracturas vertebrales y periféricas, aunque fármacos como el alendronato son superiores103,104. Pero existe evidencia de que la terapia hormonal sustitutiva (THS) aumenta el riesgo de cáncer de mama, cardiopatía isquémica, accidente vascular cerebral y tromboembolismo venoso105.
CalcitoninaLa calcitonina se puede administrar de forma preventiva y como una segunda línea de tratamiento de la OP posmenopáusica, después de los bisfosfonatos, y puede estar indicada en el tratamiento de las fracturas vertebrales recientes y sintomáticas (NE 1c; GR B; GA 70%).
La calcitonina previene la pérdida de DMO en la columna106, reduce el riesgo de nuevas fracturas vertebrales en mujeres posmenopáusicas con fracturas vertebrales previas, pero no el riesgo de fracturas periféricas107. Además, tiene un efecto analgésico en pacientes con fracturas vertebrales108. Su eficacia parece mantenerse a largo plazo.
RaloxifenoEl raloxifeno se recomienda como segunda línea de tratamiento de la OP posmenopáusica (NE 1a; GR A; GA 90%).
El raloxifeno109 disminuye la pérdida de DMO y reduce el riesgo de fracturas vertebrales en mujeres con OP posmenopáusica con y sin fracturas, pero no reduce el riesgo de fracturas no vertebrales110,111. Además, disminuye los niveles séricos de colesterol y de colesterol unido a lipoproteínas de baja densidad, si bien no parece reducir el riesgo de enfermedad coronaria. También disminuye la incidencia de cáncer de mama con receptor estrogénico positivo112, pero se relaciona con un incremento de fenómenos tromboembólicos113,114.
BazedoxifenoEl bazedoxifeno constituye una alternativa al raloxifeno en el tratamiento de la OP posmenopáusica (NE 1c; GR B; GA 83%).
El bazedoxifeno ha demostrado su acción protectora en la pérdida de DMO y la reducción de fracturas vertebrales en mujeres con OP posmenopáusica y, al igual que el raloxifeno, no ha demostrado eficacia en la reducción de fracturas no vertebrales, excepto en población con alto riesgo de fractura (post hoc). A la dosis de 20mg, los efectos secundarios más frecuentes, como los calambres y sofocaciones, se equipararon al raloxifeno y la tasa de trombosis venosa profunda observada fue del 0,4 y el 0,2% para el bazedoxifeno y el placebo, respectivamente115,116.
BisfosfonatosEl panel recomienda los bisfosfonatos (BF) como fármacos de primera línea en el tratamiento de la OP (NE 1a; GR A; GA 100%).
Los BF son actualmente los fármacos más utilizados en el tratamiento de la OP117. Su eficacia antifractura ha quedado ampliamente demostrada118-121 y en general son bien tolerados. Por otro lado, la tasa de adhesión al tratamiento a medio o largo plazo (1 año) es baja, entre el 47% en los preparados mensuales y un 30% en los semanales. Por ello, se deberán implementar medidas dirigidas a mejorar el cumplimiento terapéutico122.
No disponemos de suficiente evidencia para recomendar un fármaco en vez de otro, por lo que la elección se basará en otros factores como la posología, las características y las preferencias del paciente, así como la experiencia del médico con el uso de los BF.
No existe un acuerdo general sobre la duración óptima del tratamiento, aunque se aconseja un periodo medio de 5 años, a partir del cual se deberá evaluar la continuación, la suspensión temporal o definitiva del tratamiento o su sustitución por otro fármaco, teniendo en cuenta el riesgo residual de fractura estimado en ese momento123.
Antes de iniciar el tratamiento se debe asegurar un adecuado aporte de calcio y vitamina D, así como seguir indicaciones básicas: los BF deben tomarse por las mañanas (en bipedestación o sedestación con un vaso de 200ml de agua del grifo), en ayunas desde la cena del día anterior y esperar al menos media hora (1 h para la presentación mensual) para consumir alimentos sólidos o líquidos (excepto agua corriente).
A continuación, se analizan los diferentes BF aprobados para su utilización en la OP. Para más información, consúltese las tablas 4 y 5.
EtidronatoEl etidronato incrementa la masa ósea y reduce moderadamente el riesgo de fracturas vertebrales en mujeres con OP, con una duración de hasta 4 años124,125, pero no reduce significativamente el riesgo de fracturas de cadera y no vertebrales. Su uso continuado puede provocar osteomalacia126.
AlendronatoEl alendronato reduce de forma significativa el riesgo de fracturas vertebrales y no vertebrales, incluidas las de cadera. Actualmente, la forma más común de administración es una dosis única semanal de 70mg. Aunque se desconoce la duración óptima del tratamiento, se ha observado127 que al suspender el fármaco tras 5 años de tratamiento, 5 años después, aparece una reducción en la DMO lumbar y de cadera, de un 3,7 y un 2,4% en comparación con la continuación del mismo durante 10 años; los marcadores del remodelado se incrementan, sin que existan diferencias en la incidencia de fracturas entre grupos (excepto las fracturas vertebrales clínicas), por lo que se puede mantener el tratamiento a 10 años128, pero también abre la posibilidad de realizar unas «vacaciones terapéuticas» a los 5 años, debido al efecto residual del fármaco en el riesgo de fractura.
Existe una presentación que contiene alendronato y vitamina D, y también alendronato sódico genérico, con una teórica bioequivalencia similar con el producto de marca. Se han observado ligeras diferencias en la desintegración in vitro129 y en el tránsito esofágico130, generando dudas sobre algunas presentaciones genéricas, que podrían tener menor biodisponibilidad y potencia, así como mayor capacidad de provocar efectos adversos esofágicos131. Debido a que la prescripción de genéricos constituye un objetivo básico de los sistemas de salud, es necesario realizar estudios independientes de calidad para que el clínico pueda prescribir el genérico sin ningún género de dudas132.
RisedronatoEl risedronato es eficaz en la reducción del riesgo de fracturas vertebrales y no vertebrales, incluidas las de cadera, en mujeres posmenopáusicas y OP con y sin fracturas previas133-137. La posología más utilizada es la de 35mg/semanal por vía oral138, existiendo además una presentación que permite su administración mensual en dosis de 75mg durante 2 días consecutivos. También disponemos de un preparado genérico.
IbandronatoEl ibandronato es eficaz en la prevención de fracturas vertebrales a dosis de 2,5mg/día por vía oral en mujeres posmenopáusicas con OP con y sin fracturas previas. La eficacia en las fracturas no vertebrales es significativa únicamente en el subgrupo con riesgo más alto. No presenta eficacia en la fractura de cadera. Se utiliza una dosis bioquivalente de 150mg en toma única mensual120,139-144. También se puede administrar en una inyección por vía intravenosa de 3mg cada trimestre o cada 3 meses145, cuyo perfil de seguridad es aceptable y puede realizarse ambulatoriamente146, siendo una opción interesante para pacientes con riesgo evidente de incumplimiento terapéutico147.
ZoledronatoEs un BF comercializado para uso exclusivo por vía intravenosa. Se pauta en una dosis anual de 5mg, en régimen de hospital de día. Es eficaz para reducir la incidencia de fracturas vertebrales clínicas, morfométricas, no vertebrales y de cadera durante 3 años148. También reduce la mortalidad global en los pacientes con fractura de cadera149, sin que exista una explicación clara a este respecto150. Constituye una alternativa para pacientes con OP y riesgo elevado de fracturas o en aquellos que no toleren o en los que estén contraindicados los BF por vía oral.
Eventos adversos de los bisfosfonatosEl perfil general de seguridad de los BF es aceptable (véase la tabla 4). Sin embargo, se ha comunicado una serie de eventos adversos, potencialmente relacionadas con los BF, que pueden ser graves151. Aunque no es el objetivo de este documento realizar una revisión exhaustiva sobre el tema, sí comentaremos algunos aspectos relevantes.
El panel, sobre la base de la evidencia disponible, no cree necesario suspender los BF en caso de procedimientos dentales por el riesgo de osteonecrosis (NE 2a; GR B; GA 95%).
Se han comunicado casos de osteonecrosis de los maxilares (OM), pero su incidencia en pacientes con OP es muy baja (1/10.000 e incluso 1/100.000), y se ha asociado al uso prolongado de BF152,153. Entre las recomendaciones publicadas en este sentido, destacamos las de la AEMyPS (tabla 6), a la que remitimos al lector154. Estas incluyen una higiene y revisión bucal correcta, y en caso de procedimiento odontológico invasivo (exodoncia o implante), se recomienda esperar a que finalice el proceso de cicatrización para pautar un BF. Por otro lado, existe controversia sobre la actitud que se debe seguir en aquellos pacientes que ya estén tomando BF. El panel considera que se debe valorar individualmente, sopesando riesgos y beneficios, la interrupción del tratamiento 3-6 meses, ya que el beneficio de esta práctica no ha sido evaluado científicamente. También se ha sugerido el uso del marcador CTX, que por encima de un umbral determinado podría estar asociado con mayor riesgo de OM155; sin embargo, no existe una evidencia consistente que lo avale156.
Medidas preventivas de la osteonecrosis de maxilares de la Agencia Española de Medicamentos y Productos Sanitarios
| Es importante que la decisión de iniciar tratamiento con BF se realice una vez evaluados los beneficios (prevención de fracturas por fragilidad ósea) y riesgos para el paciente individual, teniendo en cuenta que normalmente el tratamiento debe mantenerse a largo plazo, situación que puede ser un factor de riesgo para la OM |
| Deben tenerse en cuenta las recomendaciones de las guías clínicas actuales publicadas por los servicios de salud de las CC. AA. y las sociedades científicas |
| Una vez decidida la necesidad de tratamiento con BF, se deberán llevar a cabo las medidas preventivas dentales correspondientes: |
| – Se debe realizar una valoración inicial del estado de su salud buco-dental del paciente y revisiones odontológicas con regularidad. Además, deberá acudir a consulta odontológica tan pronto como presente síntomas tales como dolor o inflamación orales |
| – Cuando sean necesarias intervenciones dentales, éstas deberán ser tan conservadoras como sea posible (mantenimiento de la pieza) |
| – Si son necesarias extracciones o procedimientos invasivos, se recomienda que el odontólogo refiera al enfermo a centros con experiencia en este tipo de pacientes |
| Los pacientes que desarrollen una OM, deberá recibir el tratamiento apropiado por profesionales con experiencia en esta patología |
| Para la aplicación efectiva de estas recomendaciones, es fundamental el desarrollo de guías y protocolos locales, compartidos por los diferentes medios y niveles asistenciales implicados en el seguimiento del paciente |
BF: bifosfonatos; CC. AA.: comunidad autónoma; OM: osteonecrosis de maxilares.
Se debe prestar atención a la aparición de dolor en muslos, especialmente en pacientes con tratamientos prolongados con BF, y realizar radiografías para descartar fracturas de estrés (y tratar de evitar que progresen) o identificar fracturas atípicas (NE 2a; GR B; GA 95%).
Se han descrito casos de fracturas atípicas (subtrocantéreas/diafisarias de fémur), cuya incidencia también es muy baja (aunque pudiera estar infraestimada). Suelen ser bilaterales, muchas veces acompañadas de pródromos (dolor en muslos y/o ingle), y a veces se asocian a algunas comorbilidades y/o la toma de medicamentos como: THS, inhibidores de la bomba de protones o glucocorticoides157-159.
No se ha demostrado una asociación entre el desarrollo de fibrilación auricular y el uso de zoledronato por vía intravenosa. Existen casos aislados de cáncer de esófago en pacientes con BF por vía oral, aunque no se ha confirmado esta asociación. El dolor osteomuscular, el daño renal y la hepatotoxicidad de los BF son excepcionales y rara vez ocasionarán la retirada del fármaco160.
En caso de evento adverso relevante con el uso de BF, el panel recomienda suspender el BF y valorar la indicación de un fármaco con mecanismo de acción diferente (NE 5; GR D; GA 95%).
En caso de evento adverso relevante, como la OM, y aunque no existe evidencia científica que indique que la retirada del fármaco mejore la evolución del proceso, es prudente suspenderlo y valorar la indicación de fármacos con un mecanismo de acción diferente del de los BF.
DenosumabDenosumab se puede recomendar como fármaco de primera línea para el tratamiento de la OP postmenopáusica con riesgo de fractura (NE 1b; GR A; GA 95%).
Denosumab es un anticuerpo monoclonal que inhibe la formación, activación y supervivencia de los osteoclastos. Es, por lo tanto, un fármaco antirresortivo autorizado para el tratamiento de la OP posmenopáusica con riesgo alto de fractura a la dosis de 60mg/6 meses por vía subcutánea161,162 (tabla 4).
Se ha publicado que reduce el riesgo de nuevas fracturas vertebrales un 68% frente a placebo a los 3 años de tratamiento (RR = 0,32; IC del 95%, 0,26-0,41), el riesgo de fracturas de cadera en un 40% (RR = 0,60; IC del 95%, 0,37-0,97), el de fracturas no vertebrales en un 20% (RR = 0,80; IC del 95%, 0,67-0,95) y el de fracturas múltiples (≥ 2)163 (véase la tabla 5). Su efecto es reversible, dado que la inhibición que produce en la resorción ósea desaparece rápidamente conforme declinan sus niveles séricos164,165. Es eficaz en pacientes previamente tratados con alendronato, aun sin intervalo de descanso166, y reduce los niveles de los biomarcadores de remodelado óseo, especialmente los de resorción, más rápida e intensamente que el alendronato167,168. También produce incrementos marcados de DMO en columna lumbar, cadera total y cuello femoral, radio distal y cuerpo total, desde los 12 meses de tratamiento, mayores que con el alendronato y muy superiores a placebo163,164,167-171.
La incidencia global de eventos adversos es similar a la de placebo en cuanto a infecciones en general, cáncer, hipocalcemia y eventos cardiovasculares163,164,167-170, aunque se ha descrito un leve aumento de infecciones urinarias y cutáneas163,172 (véase la tabla 4).
Fármacos anabólicosAnálogos de parathormonaLos análogos de PTH se pueden recomendar como fármacos de primera línea para el tratamiento de la OP con elevado riesgo de fractura (NE 1b; GR A; GA 90%).
La PTH tiene efectos osteoformadores173,174, puede prolongar la vida de los osteoblastos, tanto si se administra completa175 o sólo la fracción aminoterminal176. Existen comercializadas dos moléculas (véase la tabla 4): la teriparatida (Trp) o rhPTH 1-34 usada a dosis 20μg/día por vía subcutánea, y la rhPTH 1-84 (PTH 1-84) a dosis de 100μg/día por vía subcutánea. Son, por lo tanto, fármacos osteoformadores, cuyo efecto es fundamentalmente anabólico. La principal diferencia farmacocinética es que la Trp se mantiene elevada menos de 3 h, mientras que la PTH 1-84 lo hace hasta 9 h177,178.
La PTH 1-34 reduce la incidencia de fracturas vertebrales y no vertebrales, aunque no las fracturas de cadera, tanto en monoterapia179 como asociada a THS180,181. La PTH 1-84 presenta efectividad en la reducción de las fracturas vertebrales en mujeres sin y con fractura previa182. Ambas son superiores al alendronato en el incremento de la DMO183-186 (tabla 5).
Existe limitación de la duración del tratamiento a 2 años, tanto con Trp como con PTH 1-84, debido a la aparición de osteosarcomas en ratas Fischer en tratamiento con Trp durante 2 años179,187, aunque en humanos no está demostrada esta asociación188-190.
Las reacciones adversas, en general, no son graves con ambos fármacos. Destacan la hipercalcemia e hipercalciuria177-179,182,191,192, por lo que se aconseja estudiar los niveles de calcio en sangre y orina en los pacientes que inicien tratamiento. La monitorización de la calcemia y la calciuria durante el tratamiento solo es necesaria con la PTH 1-84. Para más información, consúltese la tabla 4.
Fármacos de acción mixtaRanelato de estroncioEl ranelato de estroncio (rSr) se puede recomendar como fármaco de primera línea para el tratamiento de la OP posmenopáusica para reducir el riesgo de fracturas vertebrales y no vertebrales y las fracturas de cadera en un subgrupo de alto riesgo (> 70 años y DXA cuello femoral T ≤ 3 DE) (NE 1b; GR A; GA 90%).
El rSr produce un aumento de la formación y una disminución de la resorción ósea, de forma moderada, que se traduce en un incremento real de la masa ósea y de la resistencia ósea193-195. Está indicado en el tratamiento de la OP en mujeres posmenopáusicas (tabla 4).
Aumenta la DMO del 12,7 al 14,4% en la columna lumbar, un 5,7-8,2% en el cuello de fémur y un 7,1-9,8% en la cadera total196,197. Sin embargo, parte de este aumento se debe al depósito de estroncio en el hueso, por lo que el incremento es un 50% de los referidos. Este efecto se mantiene a los 5 años198. El rSr a los 3 años de tratamiento reduce las fracturas vertebrales un 41% (efecto detectado en el primer año), las no vertebrales en un 16%, las fracturas no vertebrales mayores en un 19% y las fracturas de cadera en un 36% en un subgrupo de riesgo alto (tabla 5). A los 8 años se mantiene este beneficio199.
Aunque se ha señalado la posibilidad de que aumente la tendencia a la trombosis venosa profunda y el embolismo pulmonar, no está claramente demostrado200. La ficha técnica recomienda extremar las precauciones en pacientes en riesgo de desarrollar estos eventos. Se han descrito también casos de síndrome de DRESS201,202 y, aunque es muy infrecuente, se recomienda que los pacientes sean informados para que abandonen el tratamiento si aparece un exantema y buscar atención médica. En cuanto al resto de los eventos adversos, son, en general, moderados y transitorios203 (véase la tabla 4).
Fármacos en fase de desarrolloEn la tabla 7 se muestran los fármacos que potencialmente pueden aumentar el arsenal actualmente disponible frente a OP. El desarrollo de los fármacos antirresortivos está en una fase más avanzada que el de los fármacos anabólicos.
Fármacos en desarrollo
| Fármacos inhibidores de la resorción |
| 1. Inhibición de la catepsina K |
| Odanacatib |
| Relacatib |
| MK-0674 |
| 2. Inhibición de las integrinas |
| 3. Inhibición de la Src-quinasa |
| 4. Inhibición de los mecanismos de acidificación |
| Fármacos anabólicos |
| 1. Modulación de la vía de señalización Wnt |
| Anticuerpos anti-esclerostina (AMG-785) |
| Inhibidor de la sFRP |
| 2. Inhibición de las activinas (ACE-011) |
Algunos parecen inhibir de forma rápida, selectiva y reversible a la catepsina K, cuya función principal es degradar la matriz ósea: odanacatib204-206 y MK-0674207.
También se están desarrollando fármacos con capacidad de inhibir a las integrinas208 o a la Src-quinasa209 o de interferir con el proceso de acidificación (canales de cloro, ATP-asa vacuolar)210.
Los fármacos anabólicos en desarrollo actúan sobre dos elementos reguladores de la actividad osteoblástica: la vía de señalización Wnt y las activinas211-217.
Terapia combinada y secuencialSe recomienda instaurar el tratamiento antirresortivo al finalizar el ciclo de 24 meses con el fármaco anabólico y no se aconseja su administración de forma concomitante con BF (NE 1b; GR A; GA 100%).
Los análogos de la PTH pueden ser administrados de forma secuencial con inhibidores de la resorción ósea o con fármacos de acción mixta180,181,184,218-222. No obstante, la utilización con raloxifeno220 o estrógenos180,181 no parece inhibir su acción. El hecho de haber recibido tratamiento previo con antirresortivos no parece modificar el efecto anabólico de la Trp223,224.
El tratamiento combinado con antirresortivos no puede recomendarse de forma generalizada, aunque su uso podría estar justificado en casos muy seleccionados (NE 5; GR D; GA 85%).
Se han ensayado múltiples asociaciones: estrógenos con etidronato225, alendronato226, risedronato227 o Trp180,221; alendronato con raloxifeno109, Trp228 o PTH (1-84)184,218 y Trp con raloxifeno220. La administración combinada de estos fármacos consigue, en la mayor parte de los casos, un mayor incremento de la DMO que la monoterapia, pero no hay evidencia de que mejore claramente la eficacia antifractura. Tan solo el uso concomitante de estrógenos y Tpr ha demostrado una reducción significativa de nuevas fracturas vertebrales180. No obstante, las combinaciones de estos fármacos son bien toleradas y no tienen efectos negativos en el tejido óseo.
¿En qué pacientes está indicada la instauración de un tratamiento farmacológico?Iniciaremos un tratamiento farmacológico en (NE 5; GR D; GA 74%):
- 1.
Mujeres posmenopáusicas con:
- –
Fractura por traumatismo de baja intensidad, independientemente del valor de DMO.
- –
OP (DMO inferior a –2,5 DE en la puntuación T, en columna y/o fémur) con o sin fracturas, valorando los factores de riesgo.
- –
La utilización del algoritmo FRAX© puede ayudarnos en la toma de decisión cuando consideremos la instauración de un tratamiento farmacológico
- –
Valoraremos el tratamiento farmacológico:
- –
Menopausia precoz (< 45 años) según DXA y/o otros factores de riesgo.
- –
Osteopenia (DMO entre –1 y –2,5 DE en la puntuación T) El tratamiento se reservará a casos muy concretos, como serían las osteopenias intensas cercanas a la OP en las mujeres más jóvenes y con factores de riesgo alto de fractura.
En la tabla 1 se exponen los factores de riesgo más importantes12; algunos pueden ser en sí mismo una indicación de tratamiento, como la administración de glucocorticoides en dosis superiores a 5mg/día durante más de 3 meses.
¿Durante cuánto tiempo se debe mantener el tratamiento y cómo se valora su eficacia?El tratamiento de la OP, salvo contraindicación, debe mantenerse durante años (NE 5; GR D; GA 100%).
Las dos análogos de PTH solo pueden administrarse durante 24 meses. El resto ha mantenido su eficacia y seguridad durante periodos variables: alendronato hasta 10 años, risedronato y etidronato hasta 7 años, ibandronato hasta 3 años139,148, raloxifeno 8 años229, zoledronato 6 años230 calcitonina 5 años107, denosumab 3 años163, y rSr hasta 8 años199. Debemos recordar que se han descrito casos de fracturas atípicas con los tratamientos prolongados con BF231.
Los fármacos antiosteoporóticos reducen pero no anulan el riesgo de nuevas fracturas, por lo que el tratamiento puede ser eficaz a pesar de que el paciente presente nuevas fracturas.
Se recomienda evaluar la respuesta al tratamiento mediante DXA central cada 2-3 años, independientemente del tipo de fármaco (NE 5; GR D; GA 75%).
Al inicio del tratamiento puede ser conveniente repetir la DXA central al año y en situaciones de riesgo alto de fractura, como pacientes trasplantados, corticoterapia a dosis altas y fracturas vertebrales múltiples, cada 6 o 12 meses (NE 5; GR D; GA 75%).
Los marcadores de remodelado óseo pueden ser útiles para valorar precozmente la eficacia del tratamiento y para ayudar a mejorar la persistencia de éste (NE 2c; GR C; GA 80%).
Se recomienda evaluar la respuesta terapéutica a los fármacos antiosteoporóticos con una DXA central, teniendo en cuenta también las características de cada paciente22,23,232-235. Los marcadores de remodelado óseo pueden ser útiles para valorar precozmente la eficacia del tratamiento22-24.
La aparición de nuevas fracturas junto a un descenso de los valores de DMO superior al 2%, que corresponde al mínimo cambio significativo después de al menos un año de tratamiento, se puede considerar como una respuesta terapéutica inadecuada. Si solo se da una de esas dos situaciones, estaremos ante una probable respuesta inadecuada. Por el contrario, la respuesta adecuada al tratamiento vendrá definida por la ausencia de estas dos circunstancias negativas24.
¿Cuál es el fármaco antiosteoporótico más indicado?La selección del fármaco específico para un paciente con OP debe basarse en: a) evidencia de la eficacia en pacientes de sus características; b) ausencia de contraindicaciones; c) potencialidad real de cumplimentación; d) eventos adversos, y e) eficiencia de su prescripción.
Debe considerarse la eficiencia de la prescripción en su globalidad y no solo el precio del fármaco, dado que factores como los costes asociados a la administración o su eficacia antifracturaria inciden en los costes de tratar. La prescripción ha de ser viable y tener en cuenta los otros tratamientos asociados (plurimedicación) y la autonomía del paciente para conseguir su cumplimiento óptimo.
El paciente debe recibir información y participar en la toma de decisiones en lo referente a la selección de un determinado fármaco (NE 5; GR D; GA 100%).
Osteoporosis del varónEn el varón, para el diagnóstico de OP se recomienda el mismo criterio densitométrico que en las mujeres (NE 5; GR D; GA 95%).
La OP masculina es una entidad frecuente, y con una morbimortalidad similar o superior a la de la mujer. La prevalencia de OP densitométrica en varones españoles > 20 años se estimado entre un 2,5 y un 4,2%236,237, la de de fracturas vertebrales radiológicas en el 20% en los hombres de<65 años y en el 25% en los de > 65 años238, y la incidencia de fractura de cadera entre 73-115/100.000 habitantes > 50 años239,240. Sin embargo, su sospecha diagnóstica es habitualmente baja, salvo que existan claros factores de riesgo (corticoides, hepatopatía crónica, enfermedad pulmonar obstructiva crónica, etc.).
En el varón, se aconseja realizar un estudio básico de las causas más frecuentes de OP secundaria mediante historia clínica y las exploraciones complementarias que se requieran (NE 5; GR D; GA 100%).
Existen diferencias etiopatogénicas241 y factores de riesgo entre hombres y mujeres. Las OP secundarias son más frecuentes en el varón241-244. En España, la causa más frecuente es el hipogonadismo (10-20%)242, seguido de la corticoterapia crónica y el enolismo, habitualmente asociado a enfermedad hepática245,246.
En el tratamiento de la OP del varón se recomiendan las mismas medidas generales que en la mujer, el uso de fármacos aprobados para ese fin (NE 5; GR D; GA 75%).
Actualmente, los fármacos que tienen indicación para la OP masculina son: risedronato247 zoledronato248 y Trp249, con la misma dosificación y pauta que en la OP de la mujer.
Se recomienda realizar el seguimiento, la evaluación y la duración del tratamiento como en la OP en la mujer (NE 5; GR D; GA 95%).
Osteoporosis premenopáusicaEn la mujer premenopáusica, los criterios de diagnóstico según la DXA son distintos. Así, el valor de la DMO se debe aplicar utilizando la escala-Z y el diagnóstico de «masa ósea baja» se establece si escala-Z es<–2 DE. La presencia de fracturas por fragilidad, particularmente asociadas a una masa ósea baja, permite establecer el diagnóstico de OP (NE 5; GR D; GA 87%)250,251.
Considerando que en cerca del 50% de los casos existen procesos asociados, se recomienda un estudio exhaustivo y dirigido para identificar una causa subyacente (NE 5; GR D; GA 91%).
Las causas más frecuentes son: tratamiento con glucocorticoides o enfermedad de Cushing, asociación al embarazo, osteogénesis imperfecta o déficit estrogénico, anorexia nerviosa y/o enfermedades malabsortivas intestinales. Además, se sabe que en las formas idiopáticas es frecuente la asociación a hipercalciuria y a antecedentes familiares de OP.
El abordaje terapéutico incluye una ingesta adecuada de calcio y vitamina D, ejercicio físico, evitar el consumo de tabaco y alcohol252, y el tratamiento de la causa subyacente.
En pacientes que únicamente presentan una disminución de la DMO sin otros factores de riesgo asociados, no suele ser necesaria la intervención farmacológica, aunque es recomendable realizar un seguimiento de estas pacientes (NE 5; GR D; GA 96%).
El tratamiento farmacológico se considerará en casos concretos como en las pacientes con fracturas o en aquéllas que presentan factores asociados, especialmente el tratamiento con glucocorticoides y el hipogonadismo. En estos casos, pueden estar indicados los BF, los estrógenos o la calcitonina, o bien, el tratamiento con PTH o Trp.
Los BF en las mujeres fértiles deben utilizarse con cautela, ya que existen pocos datos sobre su seguridad (NE 5; GR D; GA 96%).
Por ello, deberán indicarse medidas anticonceptivas en las pacientes que siguen dicho tratamiento7,253.
Osteoporosis inducida por glucocorticoidesLa OP por glucocorticoides (GC) es la causa más frecuente de OP secundaria, llegando a suponer hasta un 25% de todos los casos de OP254. Se estima además que se producirán fracturas en un tercio de los tratados al año de tratamiento y en un 50% en algún momento de su evolución255.
El riesgo de fractura producida por los GC depende de varios factores: la DMO al comienzo del tratamiento, la dosis diaria y acumulada, y la enfermedad subyacente. La pérdida de DMO es rápida, sobre todo durante el primer año, incluso con dosis bajas, el hueso trabecular es el más afectado256. Existen unas características individuales que los hacen más vulnerables, pacientes con menos dosis de corticoides desarrollan más osteoporosis que otros con dosis más altas257. Debido a la gran alteración que producen sobre la microarquitectura, las fracturas producidas por los GC aparecen con valores de DMO mayores que en otros tipos de OP, por lo que el umbral de intervención se debe situar por encima de la puntuación T de la OP posmenopáusica.
La prevención y el tratamiento de la OP se iniciarán tan pronto como sea posible. Se debe indicar medidas preventivas a los pacientes que vayan a tomar dosis equivalentes ≥ 5mg/día de prednisona durante más de 3 meses. Si hay antecedentes de fractura por fragilidad y en los pacientes de más de 65 años, se recomienda iniciar tratamiento farmacológico. En aquellos que no presenten fracturas y tengan menos de 65 años, se realizará una DXA y si esta presenta una T < –1,5 DE también está indicado el tratamiento farmacológico258.
Medidas preventivas: en los pacientes que vayan a tomar de forma prolongada GC se debe considerar: a) la dosis más baja posible y el menor tiempo posible; b) evitar el consumo de tabaco/alcohol, dieta equilibrada con ingesta adecuada de calcio, etc.; c) prevención de la pérdida muscular y de las caídas con un programa de nutrición y ejercicio físico adecuados, d) suplementación con calcio y vitamina D (NE 5; GR D; GA 90%).
Tratamiento farmacológico: los BF (alendronato, risedronato o zoledronato) y la Trp han demostrado su eficacia en la prevención y el tratamiento de la OP por GC258-267. Todos los tratamientos deben ser siempre suplementados con dosis adecuadas de calcio y vitamina D. En los pacientes con riesgo alto de fractura, se puede iniciar un tratamiento con osteoformadores (Trp) seguido de BF. Ha de considerarse el tratamiento con tiazidas (25mg/día) en aquellos pacientes que presenten hipercalciuria.
Según las fichas técnicas, los fármacos que tienen indicación en la OP corticoidea son Trp, risedronato y zoledronato (véase la tabla 4).
DiscusiónComo ya hemos comentamos en la introducción, el objetivo de este documento ha sido la puesta al día de los nuevos avances en los distintos aspectos de la osteoporosis relacionados con la práctica clínica: diagnóstico, valoración, seguimiento y tratamiento. Esta ha sido una tarea conjunta entre los miembros del panel y la UI de la SER que, junto con revisores de la SER, ha efectuado un amplio trabajo de revisión sistemática sobre distintos temas de interés y ha proporcionado la rigurosidad científica necesaria para poder efectuar la recomendaciones con su grado de evidencia y también el grado de consenso de las mismas, para proporcionar al lector la valoración más objetiva de estas recomendaciones.
En este documento destaca una serie de nuevas aportaciones en el campo de actuación de los anteriores y la inclusión de unas tablas que complementan las diversas recomendaciones. Por un lado, se han ampliado los campos de interés clínico con la osteoporosis premenopáusica, del varón y la secundaria a los corticoides. Por otro, se han incorporado dos nuevos fármacos antirresortivos: el bazedoxifeno y el denosumab. También se ha incluido el resultado de las revisiones sistémicas encaminadas a responder las siguientes preguntas: la relación de los BF con la osteonecrosis de mandíbula y las fracturas atípicas del fémur, la relación de los suplementos con calcio y la aparición de litiasis renal, y el grado de evidencia de diferentes algoritmos para calcular el riesgo de fractura. Y, finalmente, se han incorporado tablas que resumen la eficacia de los diferentes fármacos en la reducción de fracturas y también de las indicaciones actuales aprobadas (fichas técnicas), dosificación, acontecimientos adversos e interacciones con otros fármacos.
También es importante destacar algunas observaciones de este documento que nos parecen necesarias. La primera es que la valoración del riesgo de fractura es uno de los temas que ha presentado más debate entre los miembros del panel, ya que se planteaba seguir con el criterio utilizado en los anteriores documentos o bien la utilización del algoritmo FRAX©. La resolución del panel ha consistido en la exposición de ambos planteamientos para que el lector pueda tener la información más amplia posible y que sirva de ayuda en la identificación de los pacientes con riesgo de osteoporosis.
El grado de evidencia de los diferentes fármacos se basa en sus «estudios principales» y en la mayoría el objetivo primario propuesto ha sido la reducción de las fracturas vertebrales, por lo que la eficacia en la reducción de fracturas no vertebrales y de cadera no presenta el mismo grado de evidencia. Únicamente el rSr y el risedronato han efectuado estudios en los que el objetivo primario ha sido las fracturas no vertebrales y las de cadera, respectivamente.
Como consta en el documento, y según la Agencia Europea del medicamento, las indicaciones del bazedoxifeno y el denosumab son para mujeres con riesgo algo de fractura, lo que contrasta con el análisis de sus estudios principales que se basan en poblaciones con una mayoría de pacientes sin fractura osteoporótica previa. por lo que los podemos considerar de riesgo moderado. Es necesario tener en cuenta esta consideración en la elección del fármaco adecuado.
Para concluir, podemos decir que las recomendaciones de este documento constituyen un marco base de consulta en el manejo de la OP. Son normas generales que precisan la individualización de cada caso y este es el papel que debemos asumir como profesionales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.