El examen general de orina es una de las pruebas más solicitadas dentro del laboratorio de análisis clínicos e incluye el análisis físico, químico y análisis microscópico. En este último, se analiza el sedimento urinario en búsqueda de distintos elementos formes (leucocitos, cilindros, etc.) con diferente utilidad diagnóstica. El análisis de sedimento urinario se puede valorar mediante métodos manuales y automatizados. En el diagnóstico por el laboratorio de las enfermedades autoinmunes el análisis de sedimento urinario esta principalmente orientada hacia el apoyo y valoración renal en pacientes con nefritis lúpica, una de las manifestaciones clínicas más frecuentes en pacientes con lupus eritematoso generalizado. Adicionalmente, su utilidad radica fundamentalmente en su valoración en la mayoría de los criterios diagnósticos y de afección renal, así como en los diferentes índices de daño en pacientes con lupus eritematoso generalizado. En los últimos años, diversos grupos de investigación han buscado nuevos biomarcadores urinarios de afección renal en pacientes con lupus eritematoso generalizado, sin embargo se requiere un mayor número de estudios para determinar su verdadero valor diagnóstico en este grupo de pacientes.
Urinary analysis is one of the most requested tests in the clinical laboratory. This test includes the physical, chemical and microscopic analysis of urine. This last one allows for the observation of urinary sediment (US) in search of formed elements (cellular cast, leukocytes, etc.), with different diagnostic uses. Urinary analysis can be assessed by manual or automated methods. In the laboratory diagnosis of autoimmune diseases, US analysis is mainly oriented towards the assessment of renal function in patients with lupus nephritis (LN) as this is a common clinical manifestation associated to systemic lupus erythematosus (SLE). Additionally, its value lies mainly for diagnostic criteria and evaluation of kidney injury, as well as for several damage indexes directed to patients with SLE. In the last years, several groups have sought to establish new urinary biomarkers of kidney damage in patients with SLE; however, this requires a greater number of studies to determine their true diagnostic value in this patients group.
Desde el punto de vista del laboratorio clínico una de las pruebas más solicitadas de manera rutinaria es el examen general de orina (EGO), en el cual se realiza el análisis químico (pH, glucosa, urobilinógeno, etc.), análisis físico (color, aspecto) y de manera conjunta el análisis microscópico del sedimento urinario (SU) en busca de elementos formes (eritrocitos, leucocitos, bacterias, cilindros, etc.)1. Si bien es una prueba considerada «de rutina» es de suma importancia su adecuada interpretación ya que nos proporciona datos sumamente importantes. El objetivo de la presente revisión será enfocada al análisis del SU como herramienta de apoyo al diagnóstico y seguimiento en pacientes con lupus eritematoso generalizado (LEG) debido a la alta frecuencia de daño renal en este grupo de pacientes, en base a una descripción de utilidad para el personal clínico y de laboratorio. De manera conjunta se presenta una breve descripción de su importancia clínica y finalmente evidencias que apoyan hacía la búsqueda de nuevos biomarcadores útiles para el diagnóstico y seguimiento de afección renal en pacientes con LEG.
El análisis del SU es una de las pruebas de laboratorio más solicitada para el estudio y/o valoración de pacientes con padecimientos renales. De manera general, las enfermedades renales y de las vías urinarias representan un problema de salud pública importante y su diagnóstico tardío afecta la calidad de vida del paciente, llegando en los casos más severos a incapacidad y/o muerte2. En relación a las enfermedades reumáticas, el LEG es un padecimiento de origen multifactorial (vg. genético, infecciones) en el cual existen títulos altos de anticuerpos dirigidos contra DNAcd3, lo anterior puede generar la formación de complejos inmunes antígeno anticuerpo y el subsecuente depósito de los mismos a nivel renal provocando la activación y el consumo de proteínas del complemento4. Este escenario tiene como desenlace final la nefritis lúpica siendo una de las complicaciones más frecuentes en este grupo de pacientes.
Por otro lado, cabe mencionar que el riñón cuenta con una gran reserva funcional lo que le permite soportar un daño hasta en el 75% de las nefronas2. Sin embargo, debido a su alta complejidad y delicada estructura, una afección mayor al 75% de su totalidad lleva a la presencia de manifestaciones clínicas súbitas y pérdida de la función renal.
Métodos para el análisis del sedimento urinarioActualmente existen diversos métodos para analizar el sedimento urinario5,6 y se pueden clasificar en: 1) tradicionales o manuales y 2) automatizados. El primero es relativamente fácil de realizar, semicuantitativo o cuantitativo, económico y prácticamente cualquier laboratorio los puede realizar, sin embargo, se requiere de una amplia experiencia para su lectura y análisis. Adicionalmente, los métodos manuales son tan sencillos que son poco valorados en la actualidad, en donde prevalecen técnicas bioquímicas avanzadas con una sofisticada y desarrollada tecnología. Con respecto a los métodos automatizados, estos se han desarrollado con la finalidad de disminuir la variabilidad interobservador y se realizan en equipos especiales mediante análisis citométrico diferencial6. Permite reportar parámetros de manera cuantitativa (vg. número de leucocitos/μL) y son relativamente caros comparados con los métodos tradicionales. Desde nuestro punto de vista, su principal desventaja radica en su bajo poder de discriminación entre algunos elementos formes presentes en el SU (vg. cilindros, levaduras, parásitos, etc.) y no debe sustituir al análisis microscópico tradicional en el cual podemos identificar prácticamente todos los elementos formes de utilidad diagnóstica (células epiteliales, eritrocitos, leucocitos, cilindros, cristales, etc.). Una opción viable es la combinación de ambas metodologías para la obtención de buenos resultados7 y evitar el mayor número de falsos positivos8.
Para la adecuada obtención y preparación de una muestra de orina es necesario tomar en cuenta algunos aspectos importantes con la finalidad de obtener un análisis representativo y fehaciente del mismo9,10. Debido a lo anterior, la orina se recogerá siempre en un recipiente perfectamente limpio y deberá examinarse dentro de las primeras 2 h de haberse realizado la micción, por lo cual es fundamental documentar la fecha y hora en la que se recolectó la muestra de orina. Adicionalmente, la orina puede ser recolectada por micción espontánea, técnica de chorro medio y/o cateterismo estéril.
La técnica para el análisis del SU la describimos de manera breve a continuación. Colocar ∼10ml de orina en un tubo para uroanálisis o en su defecto en un tubo de ensaye limpio, enseguida centrifugar a 3500rpm durante 3min. Posteriormente, decantar el sobrenadante y resuspender el SU mediante agitación mecánica manual. Colocar una gota sobre un portaobjetos limpio extendiéndolo de manera homogénea, finalmente colocar un cubreobjetos limpio y observar al microscopio convencional.
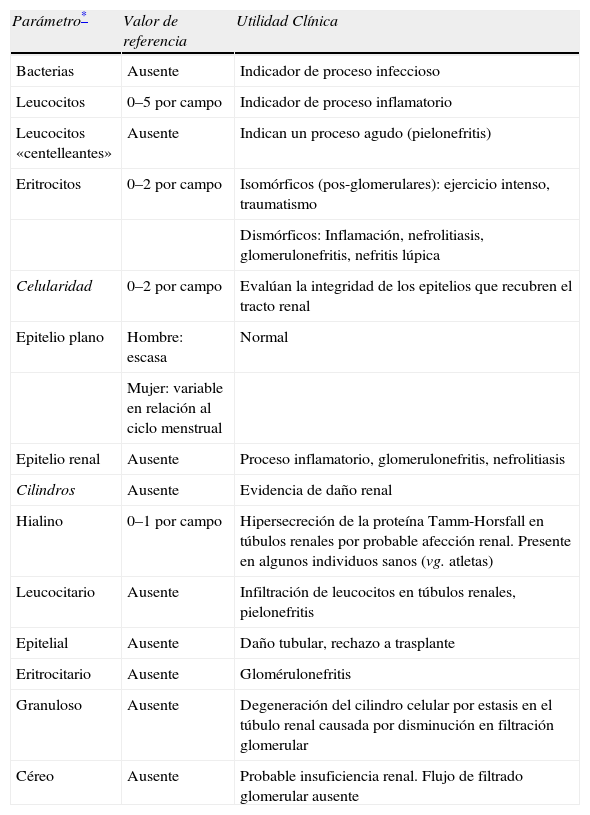
Análisis microscópico1,5,9,10Para el análisis microscópico se debe observar inicialmente la preparación con un aumento final 100× (emplear ocular 10× y objetivo 10×) para obtener una visión general del SU. Todos los elementos identificados deberán confirmarse en un aumento 400× (emplear ocular 10× y objetivo 40×) para evitar el reporte y/o lectura de múltiples artefactos. Con este aumento se deben reportar semi cuantitativamente y cuantitativamente los diferentes elementos formes observados. Los valores de referencia para los diferentes elementos observados en SU los mostramos en la tabla 1. A continuación describimos de manera breve los diferentes parámetros observados en el análisis del SU.
Diferentes parámetros observados en el análisis del SU
| Parámetro* | Valor de referencia | Utilidad Clínica |
| Bacterias | Ausente | Indicador de proceso infeccioso |
| Leucocitos | 0–5 por campo | Indicador de proceso inflamatorio |
| Leucocitos «centelleantes» | Ausente | Indican un proceso agudo (pielonefritis) |
| Eritrocitos | 0–2 por campo | Isomórficos (pos-glomerulares): ejercicio intenso, traumatismo |
| Dismórficos: Inflamación, nefrolitiasis, glomerulonefritis, nefritis lúpica | ||
| Celularidad | 0–2 por campo | Evalúan la integridad de los epitelios que recubren el tracto renal |
| Epitelio plano | Hombre: escasa | Normal |
| Mujer: variable en relación al ciclo menstrual | ||
| Epitelio renal | Ausente | Proceso inflamatorio, glomerulonefritis, nefrolitiasis |
| Cilindros | Ausente | Evidencia de daño renal |
| Hialino | 0–1 por campo | Hipersecreción de la proteína Tamm-Horsfall en túbulos renales por probable afección renal. Presente en algunos individuos sanos (vg. atletas) |
| Leucocitario | Ausente | Infiltración de leucocitos en túbulos renales, pielonefritis |
| Epitelial | Ausente | Daño tubular, rechazo a trasplante |
| Eritrocitario | Ausente | Glomérulonefritis |
| Granuloso | Ausente | Degeneración del cilindro celular por estasis en el túbulo renal causada por disminución en filtración glomerular |
| Céreo | Ausente | Probable insuficiencia renal. Flujo de filtrado glomerular ausente |
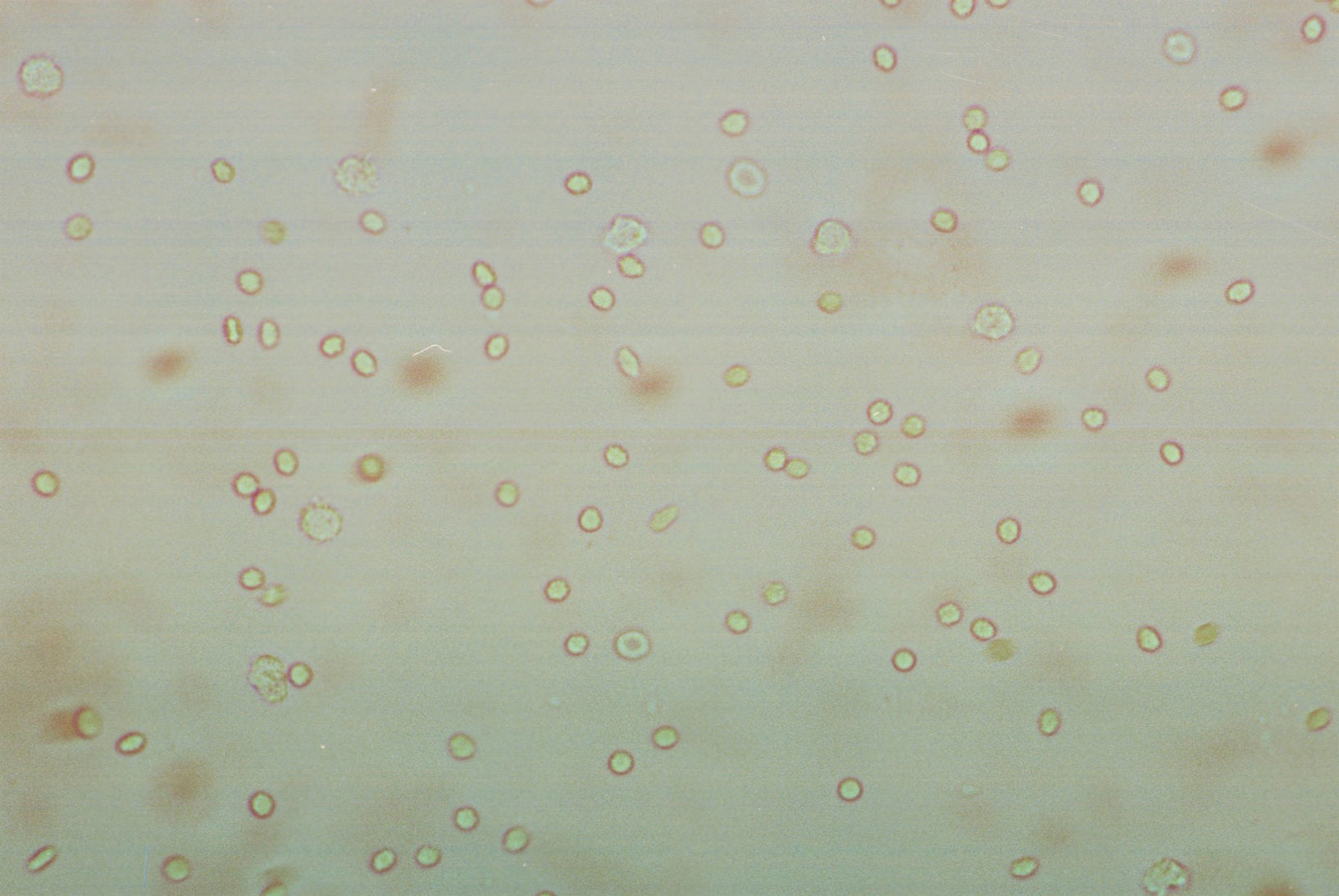
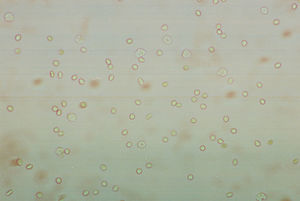
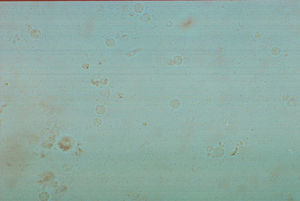
Eritrocitos. Su morfología es de suma importancia y aporta datos valiosos (fig. 1). La cantidad existente nos puede hablar de la cronicidad del proceso patológico. Se pueden detectar eritrocitos isomórficos (postglomerulares) y eritrocitos dismórficos (glomerulares). En condiciones no patológicas se pueden observar en cantidad reducida. Los eritrocitos dismórficos se observan con cierta frecuencia en los pacientes con nefritis lúpica activa.
Leucocitos. Su importancia radica en la cantidad o número en la que se encuentren y puede ser un indicador de daño o cronicidad del proceso patológico involucrado (fig. 2). Se pueden identificar piocitos también conocidas como células centellantes, las cuales son leucocitos que presentan en el citoplasma abundantes gránulos con movimiento y su presencia es indicador de una probable pielonefritis. En condiciones normales podemos observar hasta 5 leucocitos por campo.
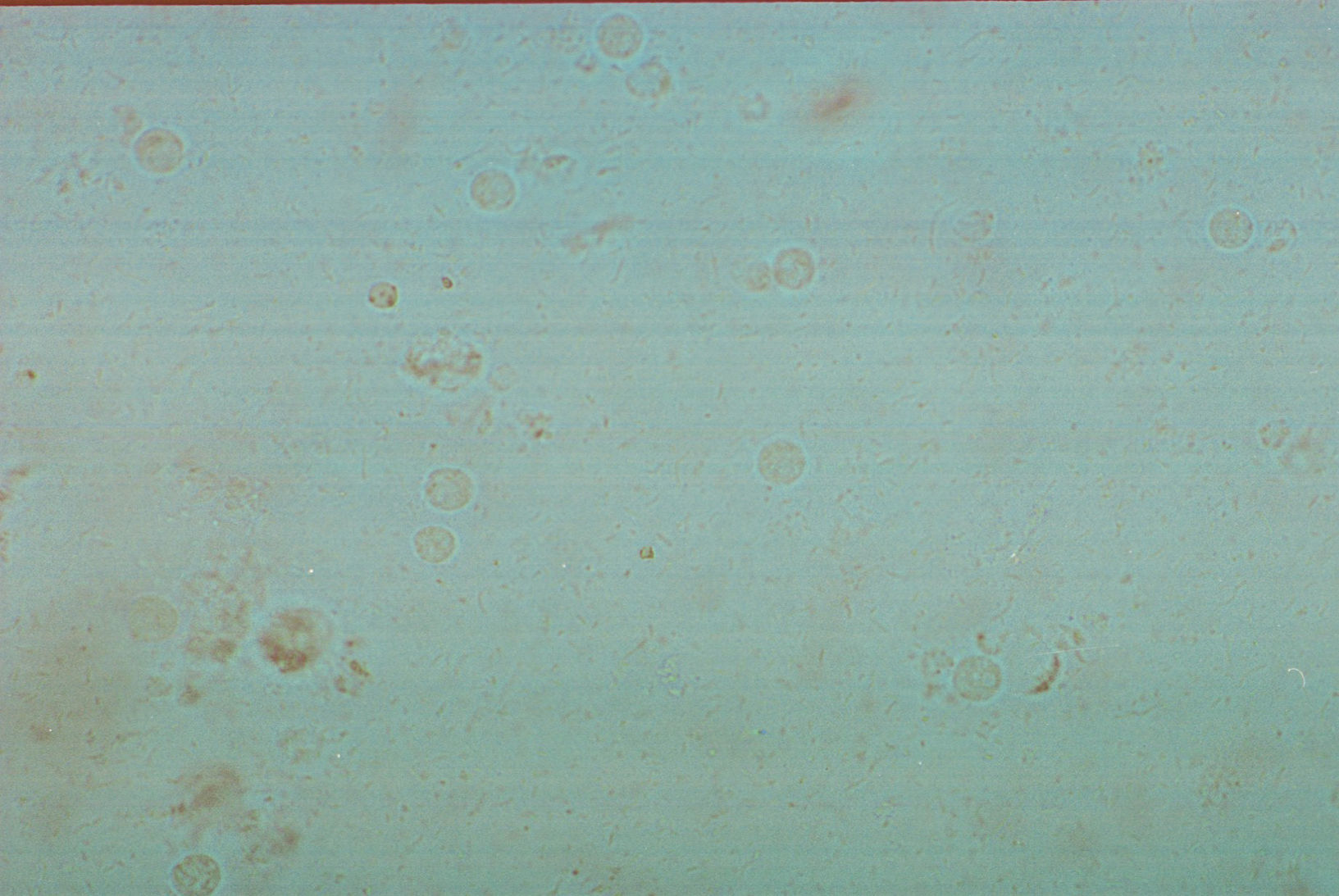
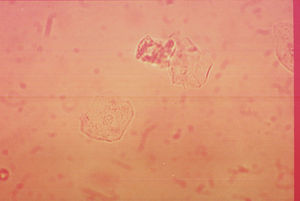
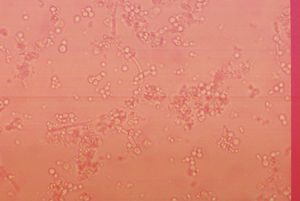
Células epiteliales. En condiciones normales se pueden observar en el sedimento urinario en mayor o menor cantidad lo que dependerá de las condiciones fisiológicas y el sexo del paciente (fig. 3). Las células epiteliales son de tamaño irregular, alargadas, presentan núcleo y granulación en el citoplasma. En condiciones normales se pueden observar de manera escasa en hombres, en tanto que en mujeres puede ser variable relacionado al ciclo menstrual. Otro tipo de células epiteliales que pueden ser encontradas son las célula renales o tubulares, las cuales son redondas, presentan un tamaño ligeramente mayor a un leucocito con un núcleo grande y redondeado. En condiciones normales este tipo de células no deben encontrase y su presencia es indicador de daño renal.
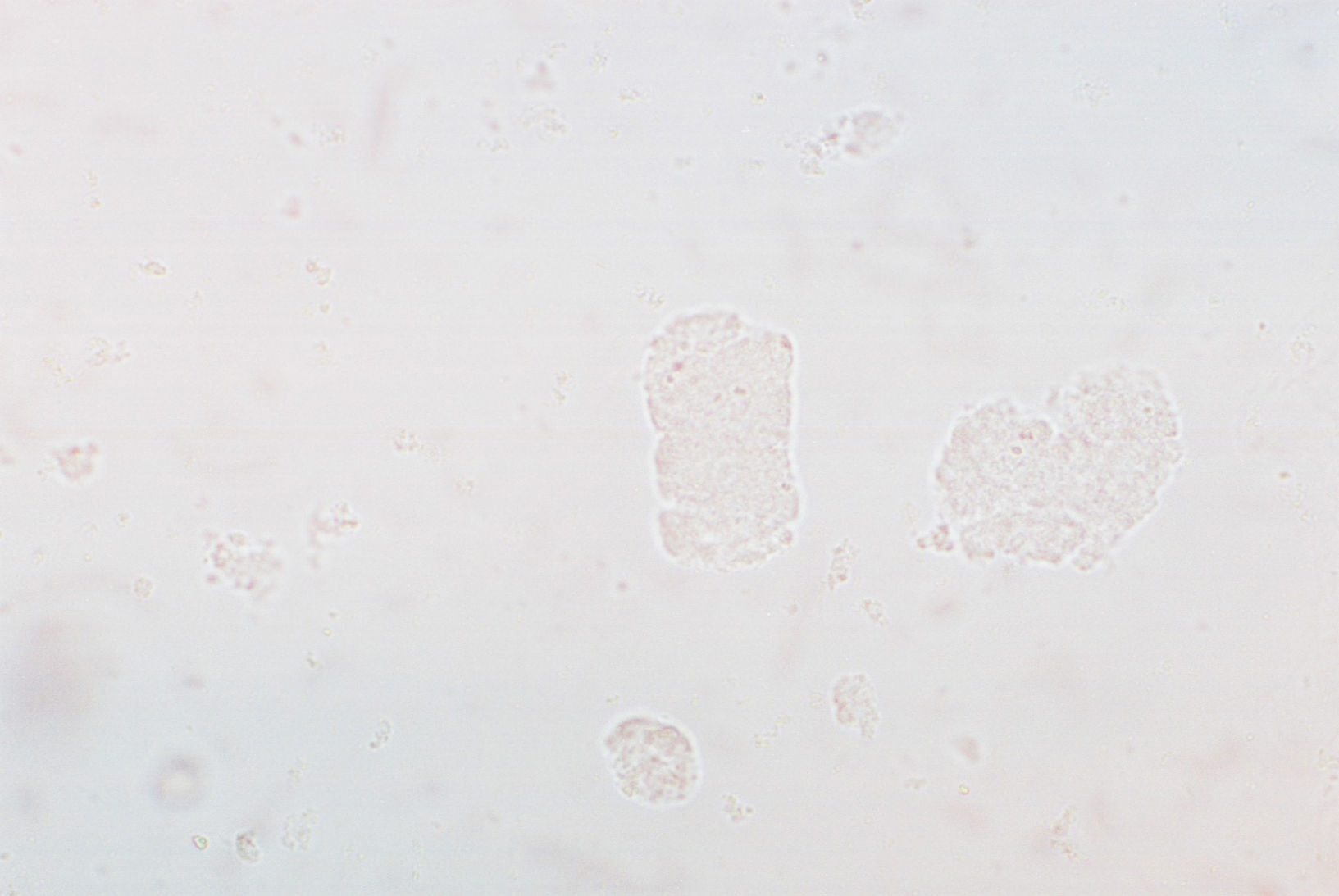
Cilindros. Los cilindros son producto de un proceso inflamatorio y destrucción epitelial. Su morfología está dada en función de su paso a través de los túbulo renales (distal, proximal y colector). La matriz fundamental de un cilindro está compuesta por una glicoproteína de alto peso molecular excretada exclusivamente por células del epitelio renal en la porción ascendente postasa de Henle del túbulo distal denominada proteína de Tamm-Horsfall11–13, cuya función fisiológica aun no ha sido bien establecida. Cabe mencionar que bajo condiciones no patológicas no deben existir cilindros en él SU con excepción de los cilindros hialinos, los cuales bajo ciertas circunstancias los podemos encontrar.
En el análisis del SU podemos encontrar diferentes tipos de cilindros, lo cuales detallamos brevemente a continuación:
Cilindro hialino. Son de morfología tubular con puntas redondeadas, alargados, transparentes y poco birrefringentes. Son consecuencia de un aumento en la permeabilidad del glomérulo, lo cual permite el paso de ciertas microproteínas las cuales se unen a la proteína de Tamm-Horsfall adquiriendo la morfología antes mencionada.
A esta matriz proteica probablemente se le pueden adherir o incluir toda una serie de elementos formes (eritrocitos, leucocitos, etc.) modificando su aspecto y nombre. Estos cilindros pueden hallarse en algunos individuos sanos después de haber realizado algún ejercicio intenso.
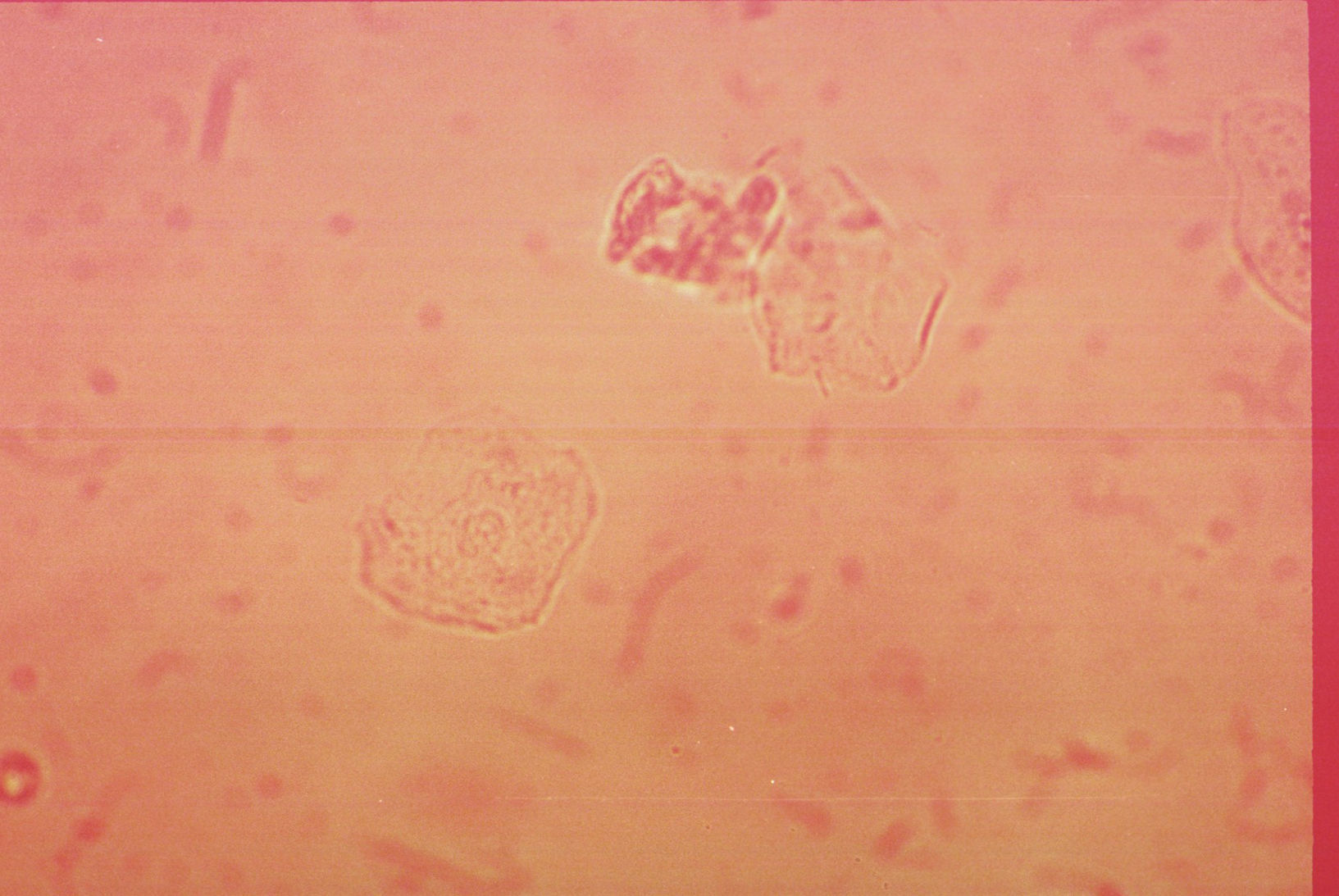
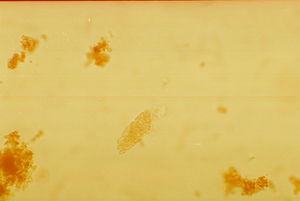
Cilindro granuloso. Es un cilindro hialino con diferentes grados de saturación por material granular de origen proteico y tamaño uniforme distribuido a lo largo del cilindro (fig. 4). Se pueden observan en pielonefritis, infección viral, intoxicación crónica por plomo, etc.
Cilindro eritrocitario. Su aspecto es la de un cilindro hialino con abundantes eritrocitos en su interior y es indicador de glomérulonefritis.
Cilindro leucocitario. Cilindro hialino con la presencia de abundantes leucocitos. Es indicador de pielonefritis.
Cilindro epitelial. Se observa un cilindro hialino cuyo contenido interno es de células epiteliales provenientes de los túbulos renales. Se presentan en nefrosis, eclampsia, amiloidosis, necrosis tubular aguda y en rechazo del trasplante renal. Cuando se observa la degeneración del material celular contenido dentro del cilindro se le conoce como cilindro granular o de granulación gruesa.
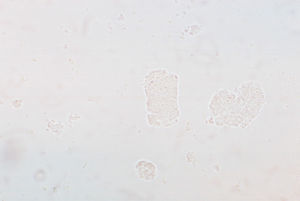
Cilindro céreo. Se forma como consecuencia de la falta de excreción de cilindros, lo cual permite la continua degeneración celular (fig. 5). Su aspecto asemeja un cilindro hialino con invaginaciones internas o muescas. Su presencia índica insuficiencia renal crónica.
Cristales. Los cristales pueden adoptar múltiples formas que dependen del compuesto químico y del pH de la orina. En el sedimento urinario podemos observar diferentes tipos de cristales (vg. ácido úrico, oxalato). En comparación con los elementos formes de la orina, los cristales solo poseen significado diagnostico en algunos casos como trastornos metabólicos y cálculos renales.
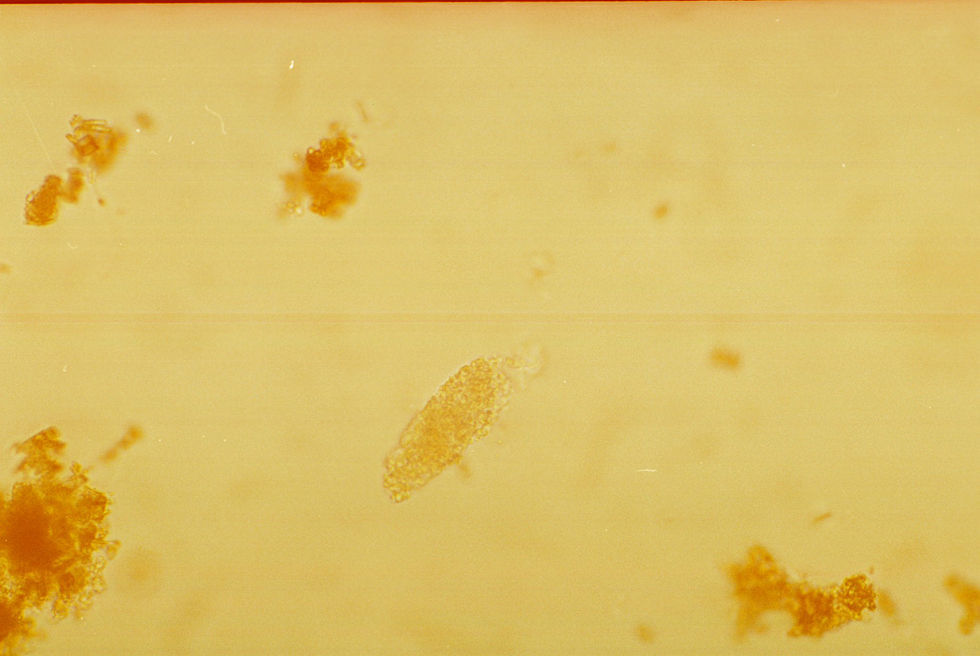
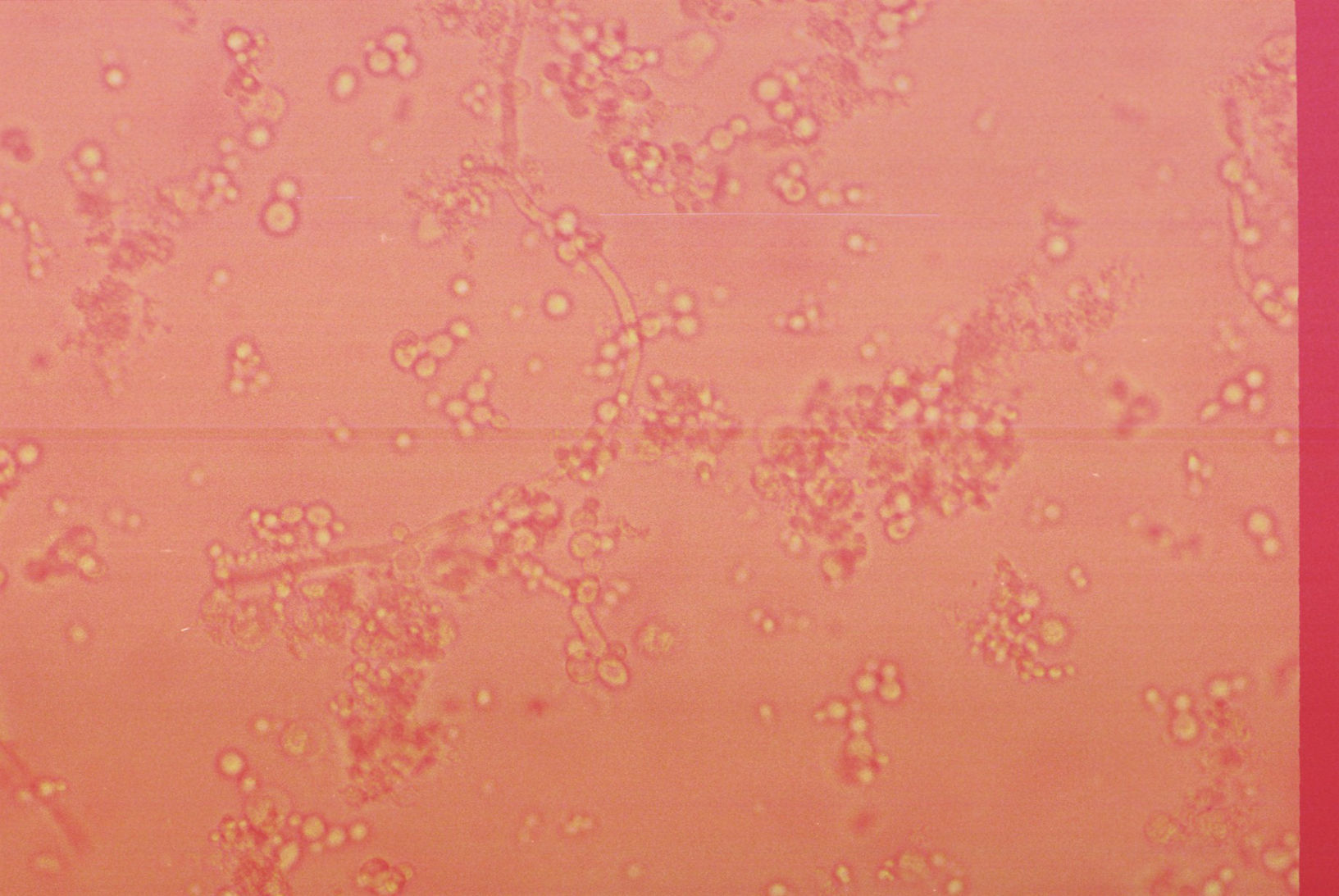
Levaduras. Son células incoloras, de forma ovoide con pared birrefringente y con frecuencia presentan gemación (fig. 6). En condiciones normales no se deben observar, la levadura más frecuentemente observada es Candida sp.
Parásitos. En orina podemos identificar Trichomonas vaginalis, el cual es un parásito protozoario flagelado cuya presencia debe informarse solo cuando se ha observado el movimiento característico debido a la presencia del flagelo. Su presencia indica tricomoniasis urogenital.
Bacterias. Se presentan frecuentemente en sedimentos urinarios a causa de contaminación uretral o vaginal. Su presencia en grandes cantidades sugiere un proceso infeccioso del tracto urinario.
Filamentos de moco. Son estructuras de irregulares de forma filamentosa, largas, delgadas. Estas estructuras carecen de significado patológico.
Utilidad del análisis del sedimento urinario en LEGLa utilidad del SU radica fundamentalmente en su valoración en la mayoría de los criterios diagnósticos y de afección renal3,14, así como en los diferentes índices de daño15–17 en pacientes lúpicos. En este contexto, dentro de los criterios o aspectos de laboratorio evaluados los de valoración renal incluyen el análisis de SU con especial énfasis en la presencia de eritrocitos y el hallazgo de cilindros.
Biomarcadores urinarios relacionados a nefropatía lúpicaLa nefritis lúpica es la forma más severa de daño renal en pacientes con LEG18–20 y está asociada directamente con la morbilidad y mortalidad en este grupo de pacientes. Debido a esto, actualmente existen diversos trabajos enfocados hacia la búsqueda de nuevos biomarcadores de daño renal en pacientes con LEG21,22, sin embargo, lo anterior ha carecido de éxito ya que no se ha logrado reportar convincentemente un biomarcador como predictor de daño o recaída renal. Cabe mencionar que resulta esencial encontrar nuevos biomarcadores con un adecuado valor pronóstico para reducir una de las entidades clínicas más frecuentes en pacientes con LEG. Una de las ventajas radica en ser una técnica no invasiva y la obtención de la muestra es sencilla y accesible, además serviría como una opción alterna a la biopsia renal (considerada la prueba de oro). Si bien existen diversos trabajos donde analizan la importancia clínica de los diferentes biomarcadores urinarios asociados a daño renal en pacientes con LEG, en la presente revisión solamente se mencionarán de manera breve y general.
En los últimos años, se han estudiado diferentes candidatos o biomarcadores urinarios asociados a nefropatía lupíca incluyendo desde proteinuria y microalbuminuria, mediadores de inflamación tales como interleucina-6, interleucina-8, interleucina-10, VCAM-1, P-selectina, quimiocinas como CXCL16, MCP-I, IP10 y otras como NGAL (lipocalina2), TWEAK (TNF-like weak inducer of apoptosis) entre otros22–24. En este contexto, interleucina 6 y 10 inicialmente mostraron asociación con actividad de la enfermedad en nefritis lúpica, sin embargo algunos estudios no muestran dicha asociación. MCP-1, ha sido encontrada en orina proveniente de pacientes con nefritis lúpica activa. Otros autores han reportado como biomarcador urinario Lipocalina-2, la cual muestra correlación con actividad de daño renal en pacientes con LEG.
Finalmente, diferentes biomarcadores urinarios han sido estudiados mostrando resultados alentadores en algunos casos, sin embargo ninguno de ellos ha sido completamente validado, requiriendo realizar más estudios (longitudinales y/o controlados) para evaluar el verdadero papel que desempeñan los diferentes biomarcadores urinarios asociados a daño renal en este grupo de pacientes24.
ConclusionesEl análisis del SU es una de las pruebas más solicitadas en el laboratorio clínico. Si bien es una técnica relativamente sencilla proporciona al clínico datos sumamente importantes como apoyo al diagnóstico de diversas patologías. Actualmente existen diferentes métodos para el análisis de SU (tradicionales o manuales y automatizados). En este sentido, si bien se cuenta con métodos automatizados no deben sustituir a la lectura microscópica del SU. Adicionalmente, el análisis microscópico de SU nos permite identificar diferentes elementos formes (cilindros, leucocitos,etc) con diferente relevancia diagnóstica. Desde el punto de vista de apoyo al diagnóstico por el laboratorio de las enfermedades autoinmunes, el análisis y la adecuada interpretación del SU resulta de gran utilidad como apoyo al diagnóstico y tratamiento en pacientes con LEG, especialmente en aquellos con nefropatía lúpica. Finalmente, en los últimos años se han estudiado diferentes biomarcadores urinarios como una opción alterna a la biopsia renal, sin embargo se requiere una mayor cantidad de estudios que aporten un adecuado valor diagnóstico y pronóstico en este grupo de pacientes.