La esclerosis tuberosa (ET), también llamada enfermedad de Pringle Bourneville, es una facomatosis con posible afectación dérmica, neurológica, renal y pulmonar. Se caracteriza por el desarrollo de proliferaciones benignas en numerosos órganos, que dan lugar a las diferentes manifestaciones clínicas. Se asocia a la mutación de 2 genes: TSC1 (hamartina) y TSC2 (tuberina), con la alteración funcional del complejo diana de la rapamicina (mTOR). La activación de la señal mTOR ha sido descrita recientemente en el lupus eritematoso sistémico (LES), y su inhibición podría resultar beneficiosa en pacientes con nefritis lúpica. Presentamos el caso de una paciente que 30 años después del inicio de LES con afectación renal grave (glomerulonefritis tipo IV), resuelta con pulsos intravenosos de ciclofosfamida, comenzó con manifestaciones clínicas del complejo esclerosis tuberosa (CET).
Consideramos de interés la coexistencia de estas 2 entidades, ya que solo hemos encontrado 2 casos similares en la literatura.
Tuberous sclerosis, also called Bourneville Pringle disease, is a phakomatosis with potential dermal, nerve, kidney and lung damage. It is characterized by the development of benign proliferations in many organs, which result in different clinical manifestations. It is associated with the mutation of two genes: TSC1 (hamartin) and TSC2 (tuberin), with the change in the functionality of the complex target of rapamycin (mTOR). MTOR activation signal has been recently described in systemic lupus erythematosus (SLE) and its inhibition could be beneficial in patients with lupus nephritis.
We report the case of a patient who began with clinical manifestations of tuberous sclerosis complex (TSC) 30 years after the onset of SLE with severe renal disease (tipe IV nephritis) who improved after treatment with iv pulses of cyclophosphamide.
We found only two similar cases in the literature, and hence considered the coexistence of these two entities of great interest.
El complejo esclerosis tuberosa (CET) es una enfermedad autosómica dominante, de expresividad variable y afectación multisistémica, caracterizada por el crecimiento de tumores benignos denominados hamartomas (neurofibromas y angiofibromas). Los órganos principalmente afectados son cerebro, piel, riñoñes, ojo, corazón y pulmones. Los síntomas de la ET pueden estar presentes en el momento del nacimiento o aparecer a edades más tardías. Existe variabilidad en el grado de la enfermedad, desde formas leves hasta las gravemente discapacitantes.
La prevalencia varía entre 1/6.000-1/10.000 de los niños nacidos vivos1. Resulta de la mutación de 2 genes: TSC1 (codifica hamartina) y TSC2 (codifica tuberina), lo que conlleva la alteración del complejo de la rapamicina (mTOR), con una activación continua y deficiente. También se ha descrito un posible papel de la alteración en el complejo mTOR en la patogenia del lupus eritematoso sistémico (LES). La vía mTOR estaría activada en el LES y su inhibición beneficiaría a los pacientes con nefritis lúpica.
Los pacientes con CET presentarían un riesgo elevado de desarrollar LES ya que la vía mTOR juega un papel clave en las células T y puede activar la autoinmunidad2. Además, el bloqueo de la señal mTOR con rapamicina ha sido eficaz en el tratamiento del LES en humanos3. Sin embargo, hasta nuestro conocimiento, solo se han comunicado 2 casos con asociación de CET y LES4,5. En ambos casos, se trataba de mujeres jóvenes diagnosticadas de ET, que posteriormente desarrollaron LES con afectación renal grave, con desenlace fatal en una de ellas, tras presentar convulsiones, sepsis, hemorragia gástrica y alveolar difusa, durante el tratamiento inductor de remisión5. En este último, los autores plantean la posibilidad de que la activación del mTOR por las mutaciones del CET pueda conducir a la activación del sistema inmunitario y al desarrollo de LES grave. En cambio, nuestra paciente, a pesar de iniciar con un cuadro de LES con nefropatía lúpica grave, ha presentado una evolución favorable, manteniendo la remisión completa de la afectación renal.
Caso clínicoMujer de 47 años, diagnosticada de LES a los 14 años de edad por presentar manifestaciones articulares (poliartritis), mucocutáneas (aftas orales, exantema malar y fotosensibilidad), renales (síndrome nefrótico), hematológicas (anemia hemolítica, leucopenia, linfopenia), serológicas (anticuerpos antinucleares positivos, 1:2.560, patrón homogéneo y anticuerpos anti-DNA positivos, 62UI/ml) e hipocomplementemia. La afectación renal fue clasificada mediante biopsia de glomerulonefritis proliferativa difusa (tipo IV de la OMS). Fue tratada con dosis altas de glucocorticoides (1mg/kg/día) y ciclofosfamida (750mg/m2 de superficie corporal), 6 pulsos mensuales para inducir la remisión, y posteriormente con pulsos trimestrales de ciclofosfamida durante 2 años, sin complicaciones, tras los cuales la paciente ha continuado con hidroxicloroquina y dosis bajas de glucocorticoides. La función renal ha permanecido normal hasta la actualidad. La paciente no ha vuelto a presentar manifestaciones graves del LES, ni alteraciones analíticas significativas, incluidos niveles de complemento y recuentos celulares. Los anticuerpos antinucleares se han mantenido positivos, con títulos de 1:640 y anticuerpos anti-DNA de doble cadena (ELISA) de 18UI/ml (normal hasta 15UI/ml, es decir, títulos positivos muy bajos).
En el año 2000 se realizó biopsia cutánea de las lesiones en la piel, compatibles con dermatofibromas pigmentados.
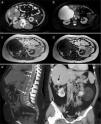
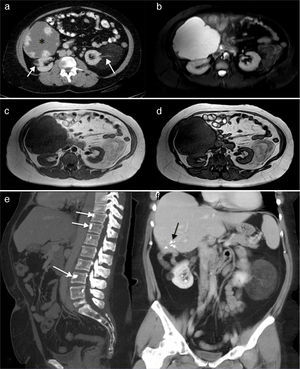
En febrero de 2012, a los 44 años de edad, sin antecedentes obstétricos de interés (ninguna historia de abortos y una gestación con hija viva y sana), fue estudiada por metrorragias abundantes secundarias a miomas uterinos y se encontraron de forma casual imágenes de angiomiolipomas renales bilaterales, un gran hemangioma hepático, pólipos rectales e islotes óseos en el esqueleto axial (fig. 1).
a). TC a la altura de los riñones donde se observa un hemangioma hepático gigante (*) y 2 angiomiolipomas renales bilaterales de baja densidad, similar a la grasa y pedículo vascular (flechas).
b). Imagen STIR axial. El hemangioma hepático es marcadamente hiperintenso y los angiomas renales muestran baja intensidad de la señal con algunas zonas hiperintensas en el izquierdo que representa la vascularización intratumoral.
c y d). Imagen eco de gradiente T1 en fase y fase opuesta. Se observa el angiomiolipoma renal izquierdo con intensidad similar a la grasa y áreas hipointensas en su interior que corresponden a las estructuras vasculares. En la imagen en fase opuesta (d) se aprecia como parte del tumor cancela su señal debido al contenido graso.
e). Reconstrucción MIP sagital de TC. Se observan imágenes redondeadas y densas en algunos cuerpos vertebrales que corresponden a islotes óseos (flechas).
f). Reconstrucción MIP coronal de TC. El hemangioma hepático ha sido resecado y en el lecho quirúrgico se aprecian los clíps tras la cirugía (flecha negra). Se evidencian con claridad los 2 angiomiolipomas renales.
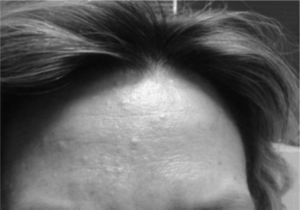
La presencia de angiomiolipomas renales, junto a angiofibromas faciales (fig. 2) permite el diagnóstico del CET, reuniendo 2 criterios mayores; además, la paciente presentó múltiples muescas en esmalte dental, pólipos rectales hamartomatosos y quistes óseos (considerados estos últimos criterios menores), lo que supone un diagnóstico definitivo según los criterios del CET (tabla 1)6. Nunca ha presentado crisis convulsivas ni otras manifestaciones neurológicas. Recibe tratamiento con everolimus, desde el diagnóstico de CET, y no ha presentado repercusión ni empeoramiento del LES.
Criterios diagnósticos del complejo esclerosis tuberosa6
| Criterios mayores | Criterios menores |
|---|---|
| 1. Angiofibromas faciales o placa frontal 2. Fibromas ungueales o periungueales no traumáticos 3. Manchas hipomelanóticas (3 o más) 4. Placa de Shagren 5. Hamartomas retinianos nodulares múltiples 6. Túberes corticales 7. Nódulos subependimarios 8. Astrocitoma subependimario de células gigantes 9. Rabdomioma cardiaco, único o múltiple 10. Linfangiomiomatosis pulmonar* 11. Angiomiolipoma renal* | 1. «Pits» múltiples en esmalte dentario 2. Pólipos rectales hamartomatosos (confirmación histológica) 3. Quistes óseos (confirmación radiográfica) 4. Tractos migratorios en la sustancia blanca cerebral** 5. Fibromas gingivales 6. Hamartoma no renal (confirmación histológica) 7. Placa acrómica en retina 8. Lesiones cutáneas en «confetti» 9. Quistes renales múltiples (confirmación histológica) |
Diagnóstico definitivo de CET: 2 criterios mayores o un criterio mayor y 2 menores.
Diagnóstico probable: un criterio mayor y uno menor.
Diagnóstico posible: un criterio mayor o 2 o más criterios menores.
Nuestra paciente, como en los 2 casos publicados hasta el momento4,5, presentó una afectación renal grave (glomerulonefritis proliferativa difusa) como manifestación inicial de LES. Mientras en los casos previos, el diagnóstico de CET precedió al de LES, en el nuestro se detectaron las manifestaciones clínicas de CET 30 años después del diagnóstico de LES. En la tabla 2 se resumen las características principales de los 3 casos.
Resumen con las principales características de los 3 casos
| Caso | Diagnóstico de LES | Diagnóstico de CET | Nefritis (OMS) | Tratamientos | Desenlace |
|---|---|---|---|---|---|
| Singh5, 2013 | Mujer, 22 años | Infancia (previo a LES*) | IV | Ciclofosfamida Plasmaféresis | Muerte (sepsis e insuficiencia respiratoria) |
| Katada4, 2012 | Mujer, 26 años | Infancia (previo a LES*) | IV | Prednisolona | Control clínico y biológico |
| Actual | Mujer, 14 años | Adulto (30 años después de LES) | IV | Metilprednisolona Ciclofosfamida | Control clínico y biológico |
Singh et al.5 presentaron un caso de asociación CET/LES, con desenlace catastrófico por complicaciones graves (convulsiones, hemorragia alveolar difusa, sepsis…). Según los autores, la aparición de LES en presencia de un ambiente CET, con un aumento de la señal mTOR, podría suponer una forma particularmente agresiva de LES, como el de la paciente que describen. Sugieren que los pacientes con CET, como consecuencia de la alteración de la señal mTOR, pueden presentar una autoinmunidad no detectada y se les deberían determinar anticuerpos antinucleares.
En el caso que presentamos, no disponemos de estudio genético. La paciente cumplía criterios clínicos6 (2 criterios mayores y 3 menores), por lo que se estableció el diagnóstico definitivo de CET. Los criterios genéticos1 no son imprescindibles para el diagnóstico.
La expresividad del CET es muy variable, por lo que sus manifestaciones y la edad de aparición en cada paciente pueden ser muy diferentes.
No disponemos, por otra parte, de la posibilidad de estudio de las mencionadas secuencias de genes ni de sus posibles mutaciones para poder demostrar los mecanismos por los que se ha podido producir la asociación de las 2 patologías. Sin embargo, nuestra paciente, a pesar de presentar manifestaciones graves y floridas de ambas entidades, ha seguido un curso estable con buena respuesta a terapias convencionales, como parece que ocurrió también en el caso de Katada et al.4.
ConclusiónLa alteración funcional de mTOR existente en el CET como consecuencia de las mutaciones de los genes TSC1 y TSC2, puede participar en la patogenia del LES, por lo que sería recomendable la búsqueda de autoanticuerpos en los pacientes con CET. La patogenia del LES es compleja y la coexistencia con el CET no necesariamente debe implicar una mayor gravedad del LES.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.