La artritis séptica es una urgencia médica y la artritis microcristalina es un factor de riesgo para su aparición. Si ambas cursan de forma simultánea, la identificación de microcristales puede enmascarar el diagnóstico de la infección y causar un retraso en la instauración del tratamiento antibiótico.
MétodoAnálisis retrospectivo de pacientes con coexistencia de artritis séptica y microcristalina. Se incluye únicamente a los enfermos con aislamiento del germen en líquido articular y/o hemocultivo e identificación de cristales en el líquido articular.
ResultadosSe identificaron un total de 25 pacientes (17 varones y 8 mujeres) con una media de edad de 67 años. La articulación que se afectó con mayor frecuencia fue la rodilla. Los cristales de urato monosódico fueron los que con mayor frecuencia se identificaron en el estudio citológico del líquido sinovial. Los factores de riesgo más frecuentes fueron la diabetes mellitus y la insuficiencia renal crónica. El germen aislado con mayor frecuencia fue el Staphylococcus aureus sensible a meticilina (48%), seguido del Staphylococcus aureus resistente a meticilina (12%) y Mycobacterium tuberculosis (12%). El 36% de los pacientes precisaron desbridamiento quirúrgico (excluyendo los causados por M. tuberculosis). La evolución fue favorable en el 56% de los pacientes, aunque la presencia de complicaciones intercurrentes fue habitual (40%). La mortalidad fue del 8%.
ConclusionesLa coexistencia de artritis séptica y microcristalina representa un reto diagnóstico y requiere un alto índice de sospecha. La artropatía por cristales de urato monosódico es la más prevalente y S. aureus el germen causal más frecuente, con una tasa elevada de infección por S. aureus resistente a meticilina. Si se instaura de forma precoz el tratamiento adecuado, la evolución suele ser favorable, por lo que el estudio microbiológico del líquido sinovial es imperativo.
Septic arthritis is a medical emergency and crystal-induced arthritis is a risk factor for its development. If both occur simultaneously, crystal-induced arthritis may mask the diagnosis of infection and delay antibiotic therapy.
MethodRetrospective analysis of patients with coexistence of septic and crystal-induced arthritis. We included only patients with isolation of crystals in synovial fluid analysis and positive culture of synovial fluid and/or blood culture.
ResultsA total of 25 patients (17 men and 8 women) with a mean age of 67 years. The most commonly affected joint was the knee. In synovial fluid cytological studies, the most frequently identified crystals were monosodium urate. Risk factors included diabetes and chronic renal failure. The most frequently isolated germs were methicillin-sensitive S. aureus (48%), methicillin-resistant S. aureus (12%) and Mycobacterium tuberculosis (12%). In all, 36% of subjects required surgical drainage (excluding those caused by M. tuberculosis). Clinical outcome was favorable in 56%, although intercurrent complications were usual (40%). Mortality was 8%.
ConclusionsCoexistence of septic and crystal-induced arthritis represents a diagnostic challenge and requires a high index of suspicion. Gout was the most prevalent crystal-induced arthritis. S. aureus was the most commonly causative pathogen, with a high rate of methicillin-resistant S. aureus infection. If treated early, the outcome is usually favorable, making synovial fluid microbiological study imperative.
La artritis séptica es considerada una urgencia médica por el rápido deterioro anatómico y funcional que causa sobre la articulación afectada. La artropatía por depósito de cristales es un factor de riesgo para su aparición. Si ambas cursan de forma simultánea, la artritis microcristalina puede enmascarar el diagnóstico de la infección y causar un retraso en la instauración del tratamiento antibiótico. Por ello, el estudio microbiológico del líquido sinovial (tinción de Gram y cultivos) es imprescindible en todo episodio de artritis aguda, aunque se detecte la presencia de cristales en el mismo. A pesar de que no es una situación frecuente en la práctica clínica, se debe tener siempre presente la posibilidad de una infección en toda artritis por depósito de cristales.
El objetivo de este trabajo es evaluar las características de los pacientes atendidos en nuestro hospital que presentaron artritis séptica y microcristalina de forma concomitante. En la literatura hispana hay 7 reportes de casos1–7, pero ninguna serie publicada; en la literatura médica anglosajona encontramos únicamente 2 series de casos8,9, hecho que justifica el presente estudio.
Pacientes y métodoSe ha realizado un análisis retrospectivo de las artritis sépticas y por depósito de cristales registradas en una sección de reumatología, en el ámbito de un hospital universitario que atiende a una población de referencia de unos 850.000 habitantes.
Se realizó un análisis de todas las artritis infecciosas (código IVA de la clasificación ACR)10 recogidas en el registro del servicio desde 1985 hasta 2015 (base de datos con codificación de diagnósticos). Se eligieron para los fines del estudio los casos con presencia de gérmenes en el estudio del líquido sinovial y/o en los hemocultivos. Se recopilaron un total de 113 pacientes, de los cuales se seleccionó a los que presentaban además una artritis por depósito de cristales (código VA)10 concomitante, definida por la presencia de cristales intracelulares en el líquido sinovial.
Las variables registradas incluyeron: edad, sexo, factores de riesgo de infección, localizaciones de la infección articular y del depósito de microcristales, fiebre (temperatura axilar superior a 37,5°C), tiempo transcurrido hasta el diagnóstico (días), tinción de Gram y cultivos del líquido articular, hemocultivos, reactantes de fase aguda al diagnóstico (velocidad de sedimentación globular y proteína C reactiva), celularidad del líquido articular, estudio citológico del líquido articular al microscopio óptico de luz polarizada, tratamiento antibiótico realizado (vía de administración y duración), realización de drenaje quirúrgico, evolución y complicaciones intercurrentes.
Se revisaron las radiografías o los informes radiológicos correspondientes al diagnóstico en los casos en que fue posible.
El método es descriptivo y se comparan los resultados con las principales referencias de la literatura médica.
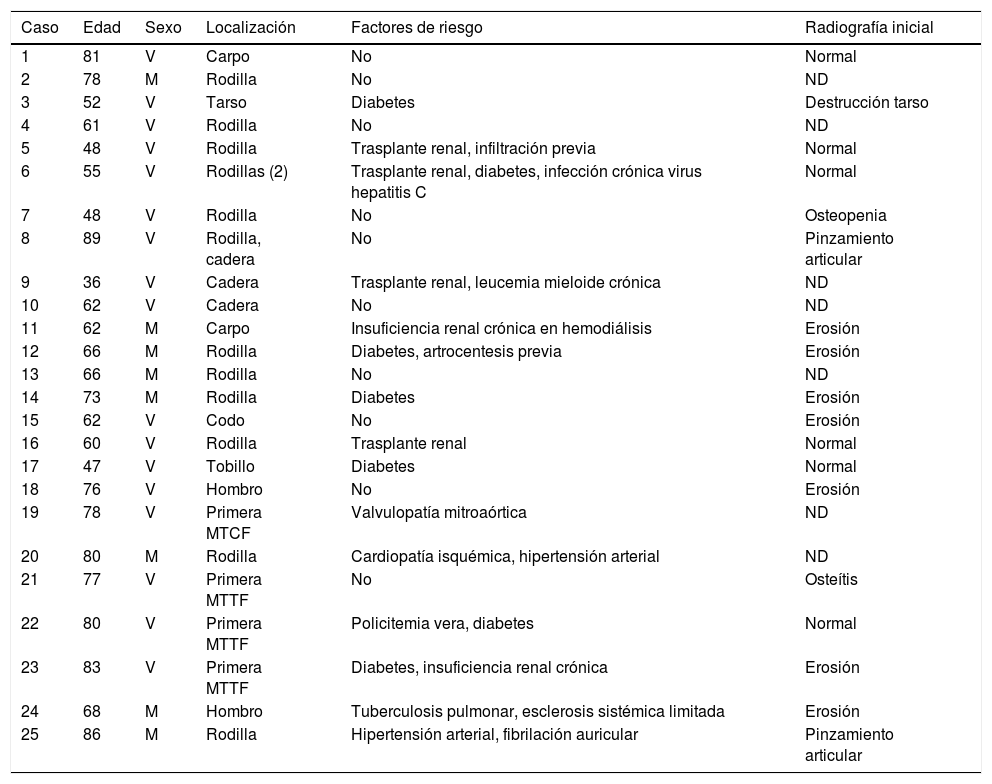
ResultadosEntre 1985 y diciembre de 2015, en la Sección de Reumatología del Hospital Universitario Germans Trias i Pujol de Badalona se registraron 25 enfermos con artritis microcristalina y séptica concomitantes. La distribución por sexos fue de 17 varones y 8 mujeres, con una media±desviación estándar (intervalo) de edad de 67±14 (36-89) años. La media±desviación estándar (intervalo) de tiempo transcurrido entre el inicio de los síntomas y el diagnóstico fue de 14±13 (1-45) días (dato disponible en 14 pacientes). La articulación que se afectó con mayor frecuencia fue la rodilla, seguida del pie y la cadera. En 2 casos estuvieron implicadas varias articulaciones a la vez (tabla 1). Las características generales de la serie, así como las características radiológicas al diagnóstico, quedan reflejadas en la tabla 1.
Descripción general de la serie y características radiológicas
| Caso | Edad | Sexo | Localización | Factores de riesgo | Radiografía inicial |
|---|---|---|---|---|---|
| 1 | 81 | V | Carpo | No | Normal |
| 2 | 78 | M | Rodilla | No | ND |
| 3 | 52 | V | Tarso | Diabetes | Destrucción tarso |
| 4 | 61 | V | Rodilla | No | ND |
| 5 | 48 | V | Rodilla | Trasplante renal, infiltración previa | Normal |
| 6 | 55 | V | Rodillas (2) | Trasplante renal, diabetes, infección crónica virus hepatitis C | Normal |
| 7 | 48 | V | Rodilla | No | Osteopenia |
| 8 | 89 | V | Rodilla, cadera | No | Pinzamiento articular |
| 9 | 36 | V | Cadera | Trasplante renal, leucemia mieloide crónica | ND |
| 10 | 62 | V | Cadera | No | ND |
| 11 | 62 | M | Carpo | Insuficiencia renal crónica en hemodiálisis | Erosión |
| 12 | 66 | M | Rodilla | Diabetes, artrocentesis previa | Erosión |
| 13 | 66 | M | Rodilla | No | ND |
| 14 | 73 | M | Rodilla | Diabetes | Erosión |
| 15 | 62 | V | Codo | No | Erosión |
| 16 | 60 | V | Rodilla | Trasplante renal | Normal |
| 17 | 47 | V | Tobillo | Diabetes | Normal |
| 18 | 76 | V | Hombro | No | Erosión |
| 19 | 78 | V | Primera MTCF | Valvulopatía mitroaórtica | ND |
| 20 | 80 | M | Rodilla | Cardiopatía isquémica, hipertensión arterial | ND |
| 21 | 77 | V | Primera MTTF | No | Osteítis |
| 22 | 80 | V | Primera MTTF | Policitemia vera, diabetes | Normal |
| 23 | 83 | V | Primera MTTF | Diabetes, insuficiencia renal crónica | Erosión |
| 24 | 68 | M | Hombro | Tuberculosis pulmonar, esclerosis sistémica limitada | Erosión |
| 25 | 86 | M | Rodilla | Hipertensión arterial, fibrilación auricular | Pinzamiento articular |
M: mujer; MTCF: metacarpofalángica; MTTF: metatarsofalángica; ND: no disponible; V: varón.
Los factores de riesgo más frecuentes fueron: diabetes mellitus (24%), insuficiencia renal crónica (16%), trasplante renal (16%), artrocentesis o infiltración previa (8%) e hipertensión arterial (8%). Algunos enfermos presentaban más de un factor de riesgo, mientras que en un 40% no se reconoció ninguno.
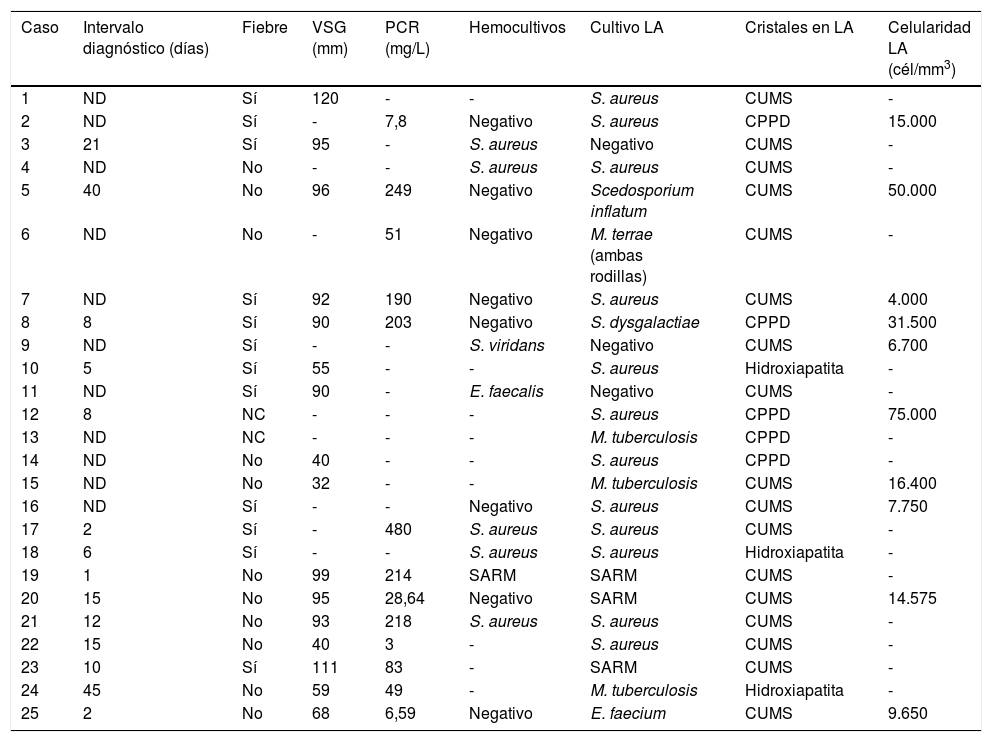
Los cristales de urato monosódico fueron los que con mayor frecuencia se identificaron en el estudio citológico del líquido sinovial (17 casos; 68%), seguidos de los cristales de pirofosfato cálcico dihidratado (CPPD) (5 casos; 20%) e hidroxiapatita (3 casos; 12%) (tabla 2).
Características clínicas, microbiológicas y radiológicas de la serie
| Caso | Intervalo diagnóstico (días) | Fiebre | VSG (mm) | PCR (mg/L) | Hemocultivos | Cultivo LA | Cristales en LA | Celularidad LA (cél/mm3) |
|---|---|---|---|---|---|---|---|---|
| 1 | ND | Sí | 120 | - | - | S. aureus | CUMS | - |
| 2 | ND | Sí | - | 7,8 | Negativo | S. aureus | CPPD | 15.000 |
| 3 | 21 | Sí | 95 | - | S. aureus | Negativo | CUMS | - |
| 4 | ND | No | - | - | S. aureus | S. aureus | CUMS | - |
| 5 | 40 | No | 96 | 249 | Negativo | Scedosporium inflatum | CUMS | 50.000 |
| 6 | ND | No | - | 51 | Negativo | M. terrae (ambas rodillas) | CUMS | - |
| 7 | ND | Sí | 92 | 190 | Negativo | S. aureus | CUMS | 4.000 |
| 8 | 8 | Sí | 90 | 203 | Negativo | S. dysgalactiae | CPPD | 31.500 |
| 9 | ND | Sí | - | - | S. viridans | Negativo | CUMS | 6.700 |
| 10 | 5 | Sí | 55 | - | - | S. aureus | Hidroxiapatita | - |
| 11 | ND | Sí | 90 | - | E. faecalis | Negativo | CUMS | - |
| 12 | 8 | NC | - | - | - | S. aureus | CPPD | 75.000 |
| 13 | ND | NC | - | - | - | M. tuberculosis | CPPD | - |
| 14 | ND | No | 40 | - | - | S. aureus | CPPD | - |
| 15 | ND | No | 32 | - | - | M. tuberculosis | CUMS | 16.400 |
| 16 | ND | Sí | - | - | Negativo | S. aureus | CUMS | 7.750 |
| 17 | 2 | Sí | - | 480 | S. aureus | S. aureus | CUMS | - |
| 18 | 6 | Sí | - | - | S. aureus | S. aureus | Hidroxiapatita | - |
| 19 | 1 | No | 99 | 214 | SARM | SARM | CUMS | - |
| 20 | 15 | No | 95 | 28,64 | Negativo | SARM | CUMS | 14.575 |
| 21 | 12 | No | 93 | 218 | S. aureus | S. aureus | CUMS | - |
| 22 | 15 | No | 40 | 3 | - | S. aureus | CUMS | - |
| 23 | 10 | Sí | 111 | 83 | - | SARM | CUMS | - |
| 24 | 45 | No | 59 | 49 | - | M. tuberculosis | Hidroxiapatita | - |
| 25 | 2 | No | 68 | 6,59 | Negativo | E. faecium | CUMS | 9.650 |
CPPD: cristales de pirofosfato cálcico dihidratado; CUMS: cristales de urato monosódico; LA: líquido articular; ND: no disponible; PCR: proteína C reactiva; SARM: Staphylococcus aureus resistente a meticilina; VSG: velocidad de sedimentación globular.
Los gérmenes aislados en el líquido sinovial fueron: Staphylococcus aureus sensible a meticilina (12 casos; 48%), S. aureus resistente a meticilina (3 casos; 12%), Mycobacterium tuberculosis (3 casos; 12%), Scedosporium inflatum, Mycobacterium terrae, Streptococcus dysgalactiae y Enterococcus faecium (un caso cada uno). El cultivo del líquido sinovial permitió la identificación del microorganismo en todos los casos excepto en 3 (12%), en los que fue negativo pero presentaron hemocultivos positivos (S. aureus, Streptococcus viridans y Enterococcus faecalis en un caso cada uno). En 5 casos (20%), los hemocultivos fueron positivos para el mismo agente aislado en el líquido articular. La media±desviación estándar (intervalo) de la celularidad del líquido sinovial (datos disponibles en 10 casos) fue de 23.057,5±22.903,74 (4.000-75.000) células/mm3. Doce pacientes (48%) presentaron fiebre al inicio del cuadro clínico y 2 (8%) un shock séptico en las primeras 72h de la llegada al hospital. Los reactantes de fase aguda en el momento del diagnóstico (proteína C reactiva y velocidad de sedimentación globular) fueron elevados en la mayoría de los casos: la media±desviación estándar (intervalo) de la velocidad de sedimentación globular fue de 79,69±26,90 (32-120) mm (datos disponibles en 16 casos), y la media±desviación estándar (intervalo) de la proteína C reactiva fue de 137,16±138,83 (3-480) mg/L (datos disponibles en 13 casos).
Se pudo recuperar información referente a las radiografías iniciales en 18 (72%) casos, siendo normal en 6 (24%), con erosiones en 7 (28%), con pinzamiento articular en 2 (8%), y con osteopenia aislada, osteítis y destrucción articular en un caso cada una (4%).
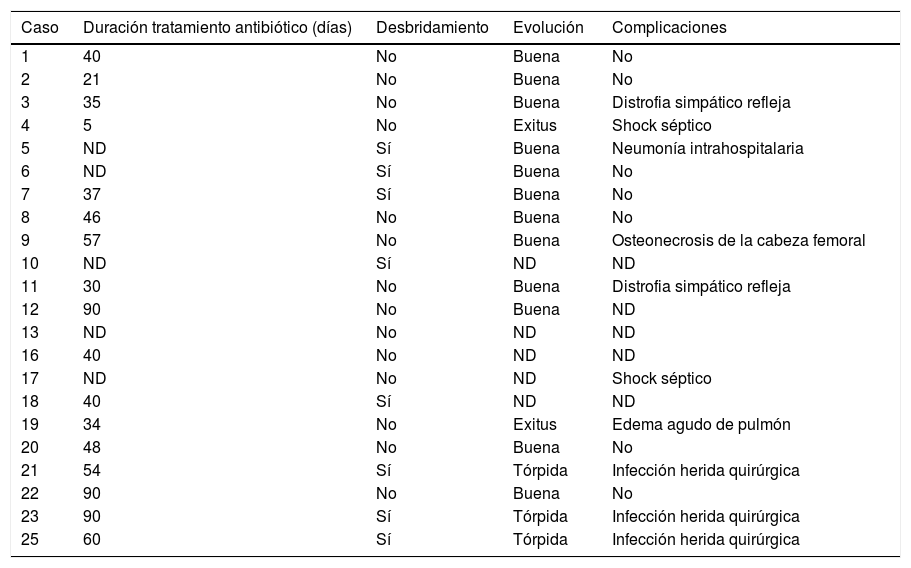
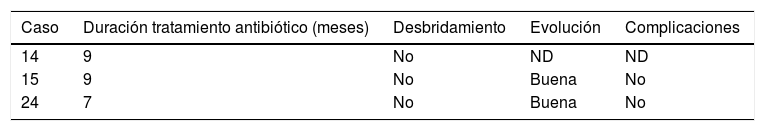
La duración media±desviación estándar (intervalo) del tratamiento antibiótico, excluidos los casos causados por M. tuberculosis, fue de 48±24 días (5-90) (tabla 3). La duración media±desviación estándar (intervalo) del tratamiento antibiótico en los causados por M. tuberculosis fue de 8,3±1 meses (7-9) (tabla 4).
Tratamiento y evolución de los casos (excluidos los producidos por Mycobacterium tuberculosis)
| Caso | Duración tratamiento antibiótico (días) | Desbridamiento | Evolución | Complicaciones |
|---|---|---|---|---|
| 1 | 40 | No | Buena | No |
| 2 | 21 | No | Buena | No |
| 3 | 35 | No | Buena | Distrofia simpático refleja |
| 4 | 5 | No | Exitus | Shock séptico |
| 5 | ND | Sí | Buena | Neumonía intrahospitalaria |
| 6 | ND | Sí | Buena | No |
| 7 | 37 | Sí | Buena | No |
| 8 | 46 | No | Buena | No |
| 9 | 57 | No | Buena | Osteonecrosis de la cabeza femoral |
| 10 | ND | Sí | ND | ND |
| 11 | 30 | No | Buena | Distrofia simpático refleja |
| 12 | 90 | No | Buena | ND |
| 13 | ND | No | ND | ND |
| 16 | 40 | No | ND | ND |
| 17 | ND | No | ND | Shock séptico |
| 18 | 40 | Sí | ND | ND |
| 19 | 34 | No | Exitus | Edema agudo de pulmón |
| 20 | 48 | No | Buena | No |
| 21 | 54 | Sí | Tórpida | Infección herida quirúrgica |
| 22 | 90 | No | Buena | No |
| 23 | 90 | Sí | Tórpida | Infección herida quirúrgica |
| 25 | 60 | Sí | Tórpida | Infección herida quirúrgica |
ND: no disponible.
La combinación terapéutica más utilizada en los días previos a la identificación definitiva del microorganismo fue la cloxacilina (2g por vía intravenosa cada 4h) junto con la gentamicina (5mg/kg/día en una dosis intravenosa) durante las primeras 48h.
La evolución de la infección articular fue satisfactoria en 14 (56%) casos, tórpida en 3 (12%) y se produjeron 2 muertes (8%): una (caso 4) atribuible a la infección (shock séptico) en un paciente sin factores de riego previos y otra (caso 19) por edema agudo de pulmón en un paciente con valvulopatía mitroaórtica previa. En 6 enfermos (24%) se perdió el seguimiento y no disponemos de los datos de la evolución clínica.
Se realizó artrotomía en 8 (36%) casos (excluyendo los producidos por M. tuberculosis); respecto a las complicaciones, 3 pacientes (12%) presentaron infecciones de la herida quirúrgica, 2 (8%) distrofia simpático refleja, 2 (8%) shock séptico, uno neumonía intrahospitalaria, otro osteonecrosis de la cabeza femoral y otro, edema agudo de pulmón. Nueve (36%) pacientes no presentaron ninguna complicación.
DiscusiónEl diagnóstico diferencial de la artritis séptica o por depósito de cristales es generalmente sencillo; sin embargo, se puede complicar cuando ambas entidades se presentan a la vez, algo que sucede con escasa frecuencia. Tanto los pacientes con artritis séptica como los que desarrollan una artritis microcristalina pueden manifestar fiebre, dolor, rubor y tumefacción articular, por lo que es imprescindible para llegar a un diagnóstico preciso la realización de una artrocentesis con estudio microbiológico del líquido sinovial. A pesar de que el recuento de leucocitos en el líquido sinovial no sea muy elevado, o la tinción de Gram no muestre microorganismos, es obligada la realización de cultivos (incluidos los de micobacterias en casos de curso más subagudo). Esto cobra mayor relevancia si cabe en los casos de pacientes inmunodeprimidos9.
Las referencias bibliográficas en torno a la coexistencia de artritis séptica y por depósito de cristales son escasas, siendo además la mayoría reportes de casos. Existen únicamente 2 series de casos publicadas, de población taiwanesa8,9. Tanto en la literatura como en la presente serie hay un predominio de varones (87-93% en las series descritas)8,9. En la nuestra, el porcentaje de varones es algo menor (68%). La media de edad de los pacientes es variable (63,7 y 52,8 en las 2 series descritas)8,9, sin embargo, en nuestra población es algo superior (67 años). Esto podría explicarse por la diferencia en la esperanza de vida entre la población de Taiwán y la española, que es un poco mayor.
Los factores de riesgo más frecuentemente descritos en la literatura son el depósito de tofos, la insuficiencia renal crónica, la diabetes mellitus y la cirrosis hepática8,9. En nuestra serie, además de estos factores, encontramos 4 casos con trasplante renal previo y 2 casos con artrocentesis o infiltración previa. Sin embargo, hay que destacar que cerca de la mitad de los enfermos (40%) no tenían factores de riesgo conocidos.
Tal como se describe en la literatura, un tercio de los pacientes están afebriles en el momento del diagnóstico8,9. En nuestra serie, un 48% se presentaron con fiebre. En la literatura, tan solo un 36-50% de los pacientes presentan hemocultivos positivos8,9, por lo que para el diagnóstico correcto se requiere un alto índice de sospecha.
Tanto la artritis séptica como la artritis por depósito de cristales pueden afectar cualquier articulación. Las más frecuentemente implicadas en la literatura son la rodilla y el tobillo1–9. Sin embargo, en esta serie, después de la rodilla, las articulaciones de los pies (primera metatarsofalángica y tarso) fueron las segundas más frecuentemente involucradas. En cuanto a la incidencia de afectación articular múltiple, los datos de las series descritas en la literatura son muy variables, con oligoartritis entre el 10-78% y poliartritis entre el 0-7%8,9. En la nuestra, hubo 2 casos (8%) con afectación oligoarticular y ninguno poliarticular.
Al igual que en la artritis séptica en población general, el S. aureus sensible a meticilina es el germen más frecuentemente implicado en la coexistencia de artritis microcristalina e infecciosa, entre el 53-79% en las series descritas8,9. En nuestro caso, S. aureus fue el responsable de un 48% de los casos. No obstante, el S. aureus resistente a meticilina está cobrando cada vez mayor importancia, siendo el responsable de un 12% de los casos en nuestra serie y del 7,18 al 23,3%9 en la literatura. Destaca el porcentaje de casos producidos por M. tuberculosis en nuestra serie (12%) respecto a los casos descritos en la literatura anglosajona, con tan solo 3 publicados de artritis infecciosa por M. tuberculosis y artritis por cristales de urato monosódico concurrente11–13 y ningún caso con artritis por CPPD. En nuestra serie encontramos 3 pacientes con infección por dicho microorganismo, uno con gota intercurrente, otro con artritis por CPPD y otro con cristales de hidroxiapatita en el estudio del líquido sinovial.
La mayoría de los casos descritos en la literatura (incluidas las 2 series de casos8,9) son de coexistencia de artritis gotosa e infección1,3–5,11–24. Hay un menor número de casos descritos con CPPD1,2,6,7,24–30. En nuestra serie, también la mayoría de los pacientes tenían cristales de urato monosódico en el estudio citológico (68%) y había un menor número con CPPD (20%) y cristales de hidroxiapatita (12%).
La evolución de la infección articular generalmente es satisfactoria si se instaura un tratamiento antibiótico precoz. En nuestros pacientes se produjeron 2 muertes (8%). En las series descritas, la mortalidad fue del 28,6 y 6,6%8,9. En ambas series se realizó desbridamiento quirúrgico en casi la mitad de los pacientes (43 y 46,6%)8,9, en tanto que en la nuestra se realizó en el 36% de los casos. Entre las complicaciones descritas en las series taiwanesas destacaron una amputación bilateral de tobillo8 y una amputación de la pierna debido a una fascitis necrosante9. No hubo complicaciones locales graves en nuestra serie.
Como conclusión, cabe señalar que la coexistencia de artritis séptica y microcristalina no es un hecho frecuente en nuestro medio, por lo que representa un reto diagnóstico y requiere un alto índice de sospecha para así instaurar de forma precoz el tratamiento adecuado y lograr una evolución satisfactoria. El estudio microbiológico del líquido sinovial es imperativo en todos los casos de artritis aguda o subaguda.
Conflicto de interesesLas autoras declaran no tener ningún conflicto de intereses.