Existe evidencia que muestra un aumento del riesgo cardiovascular en pacientes que padecen de enfermedades autoinmunes, en particular, de lupus eritematoso sistémico. Hasta el momento existen pocos estudios que evalúen el potencial beneficio de las estatinas en la incidencia de eventos cardiovasculares y en el perfil lipídico de pacientes con, y esta evidencia no ha sido sintetizada y evaluada en conjunto.
MétodosSe realizó una búsqueda de la literatura hasta agosto de 2016 (Embase, MEDLINE, Cochrane Library, SciELO, Clinical Evidence, DynaMed, registro de experimentos clínicos de Cochrane, LILACS), identificando ensayos clínicos controlados que evaluaran el impacto de las estatinas en mortalidad, eventos cardiovasculares, proteína C reactiva y perfil lipídico en pacientes con lupus eritematoso sistémico. Se evaluó la calidad de la información disponible y se metaanalizó utilizando un modelo de efectos aleatorios, utilizando el programa RevMan 5.3.
ResultadosUn total de 6 estudios y 412 pacientes fueron incluidos para el análisis. Se encontró que el uso de las estatinas en paciente con LES reduce significativamente los niveles de colesterol total (diferencia de medias [DM] −31,2mg/dL; IC 95% −41,9; −20,5), colesterol de baja densidad (DM −31,4mg/dL; IC 95% −43,0; −19,9), sin impacto en los niveles de triglicéridos (DM 4mg/dL; IC 95% 2,49; 6,21) y proteína C reactiva (DM −0,78; IC 95% −1,43; −0,13). No se encontró ninguna evidencia sobre impacto en el riesgo de mortalidad o eventos cardiovasculares.
ConclusiónLas estatinas tienen un impacto significativo en los niveles de colesterol total, colesterol unido a lipoproteínas de baja densidad y proteína C reactiva, sin embargo, son necesarios nuevos estudios aleatorizados controlados con seguimiento a largo plazo para evaluar el impacto en la mortalidad y el riesgo cardiovascular.
There is strong evidence of a rise in cardiovascular risk in patients suffering from autoimmune diseases, especially in those with Sistemic Lupus Erythematosus. Until now, there are a few trials that assess the potencial benefit of statins on the incidence of cardiovascular events and on lipid profile of patients with SLE. This evidence has not been synthesized and assessed altogether.
MethodsWe performed a search in databases of literature published until August of 2016 (Embase, MEDLINE, Cochrane Library, SciELO, Clinical Evidence, DynaMed, Cochrane Central Register of Controlled Trials, LILACS), identifying controlled clinical trials that could estimate the impact of statins on mortality, cardiovascular events, C-reactive protein and lipid profile in patients with Systemic Lupus Erythematosus. The quality of the information available was assessed with a meta-analysis, using a random effects model, employing the RevMan 5.3 software.
Results6 trials and 412 patients were included in the analysis. The use of statins in patients with SLE was found to significantly reduce the levels of serum total cholesterol (mean difference [MD] –31,4 mg/dL; CI 95% –43,0; –19,9), and serum low density cholesterol (MD –31,4 mg/dL; IC 95% –43,0; –19,9), but had no impact on levels of serum triglycerides (MD 4 mg/dL; IC 95% 2,49; 6,21) and C-reactive protein (MD –0,78; IC 95% –1,43; –0,13). No evidence was found about the impact on the risk of mortality or cardiovascular events.
ConclusionStatins have a significant effect on the levels of serum total cholesterol, LDL cholesterol and C-reactive protein, however, more randomized controlled trials with long-term follow-up are necessary to assess the impact on mortality and cardiovascular risk.
Existe evidencia del aumento de la morbimortalidad en pacientes con lupus eritematoso sistémico (LES) por causas cardiovasculares. En las 3 últimas décadas la mortalidad global ha disminuido; sin embargo, existe un aumento de la mortalidad específica de causa cardiovascular1.
El LES es el prototipo de enfermedad autoinmune. En los últimos años la enfermedad cardiovascular ha desplazado a las infecciones como primera causa de mortalidad en estos pacientes, principalmente por la utilización más racional de los corticoides y de medicamentos inmunosupresores, que se traduce en una mayor expectativa de vida1. Al parecer, la base fisiopatológica que explica la alta mortalidad cardiovascular radica en el desarrollo prematuro de una aterosclerosis acelerada2–4. En la puntuación del Systemic Lupus Erythematosus Disease Activity Index –SLEDAI–, que refleja la actividad de la enfermedad durante un año, mayores puntajes se correlacionan con un aumento del 5% en el riesgo de enfermedad cerebrovascular a 2 años y un incremento del riesgo de nefritis lúpica que se asocia con un aumento de hasta el 50% de eventos cardiovasculares5.
Las estatinas son consideradas como la estrategia farmacológica fundamental que ha demostrado disminuir el riesgo de eventos de índole cardiovascular. Las estatinas permiten la regulación del proceso inflamatorio asociado con el desarrollo de ateroesclerosis; además, presentan propiedades inmunomoduladoras, teniendo un impacto directo en la morbimortalidad en prevención primaria y secundaria6. Sin embargo, hasta el momento el uso de estatinas de forma sistemática en paciente con LES como modulador del riesgo cardiovascular no ha demostrado un impacto significativo en los eventos cardiovasculares en los estudios individuales, por lo que continúa siendo una estrategia controvertida6–8. Mediante una revisión sistemática se evaluará el impacto del uso de estatinas en pacientes con LES y la modificación del riesgo cardiovascular.
MétodosSe llevó a cabo una revisión sistemática con el fin de evaluar el impacto del uso de estatinas en el perfil lipídico, la proteína C reactiva (PCR) y la reducción de eventos cardiovasculares. Se seleccionaron estudios que incluyeran adultos mayores de 18 años, con diagnóstico de LES definido por el cumplimiento de 6 de los 11 criterios del American College of Rheumatology o 4 de los criterios del Systemic Lupus International Collaborating Clinics de 20129.
La intervención fue definida como el uso de estatinas (atorvastatina, rosuvastatina, pravastatina o simvastatina) en prevención primaria y secundaria. Como grupo control se aceptó el uso de placebo u otra estatina. Los desenlaces de interés fueron: muerte por cualquier causa, muerte de causa cardiovascular, infarto agudo de miocardio, accidente cerebrovascular, revascularización miocárdica, modificación de las fracciones lipídicas, en los niveles de PCR y la presencia de efectos secundarios o adversos.
La búsqueda se realizó en cada una de las bases de datos desde su inicio hasta agosto de 2016 (Embase, MEDLINE, Cochrane Library, SciELO, Clinical Evidence, DynaMed, registro de experimentos clínicos de Cochrane, LILACS), limitando los estudios a experimentos clínicos aleatorizados publicados en idiomas inglés y español. La estrategia de búsqueda se realizó mediante los siguientes términos MeSH: Lupus Erythematosus, Systemic, Hydroxymethylglutaryl-CoA Reductase Inhibitors, Pravastatin, Simvastatin, Rosuvastatin, atorvastatin.
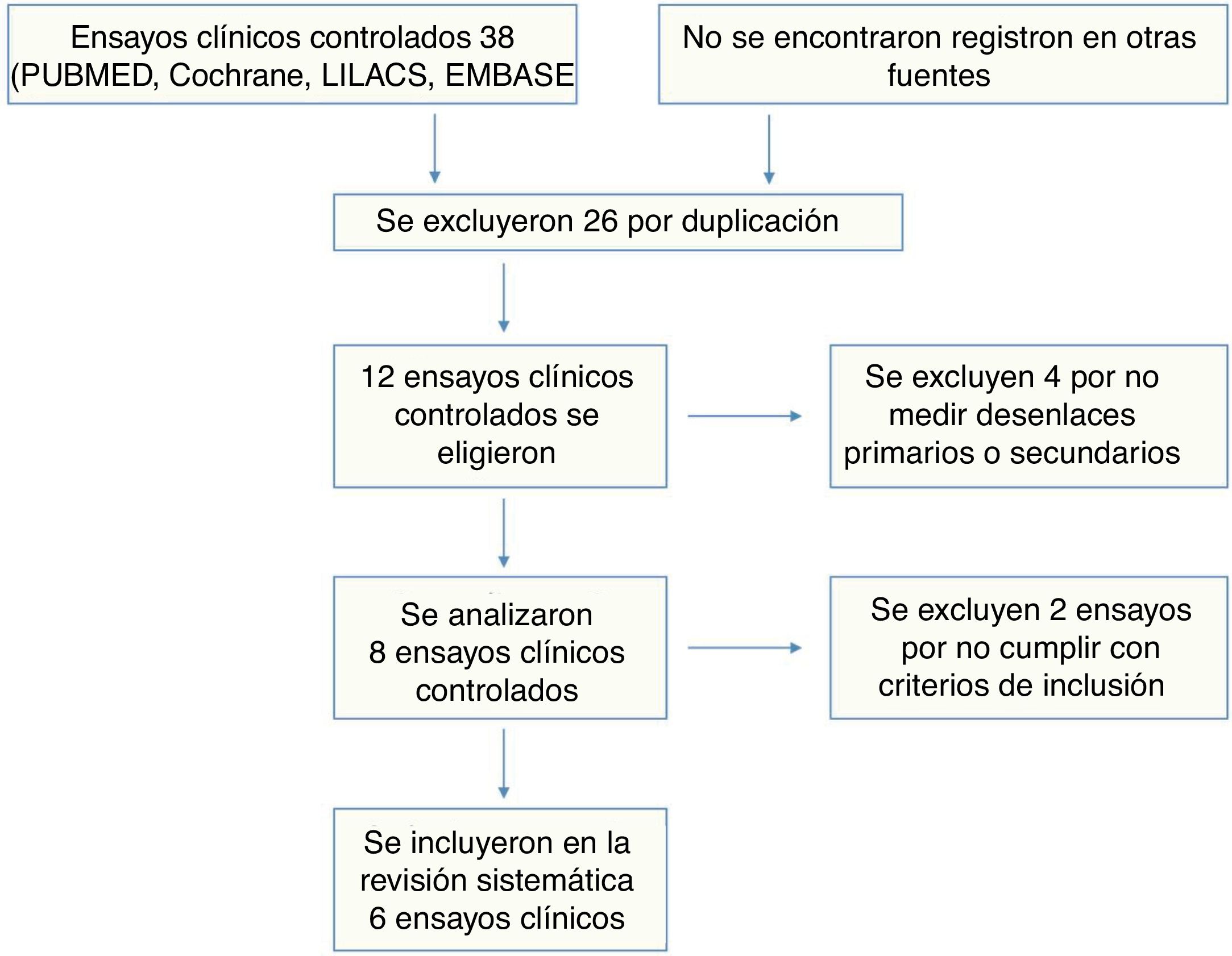
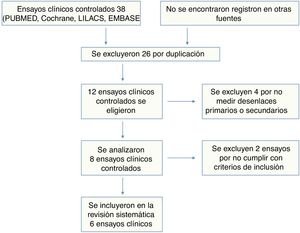
Los estudios fueron seleccionados a partir del análisis de títulos y abstracts por 2 revisores, y las diferencias fueron resueltas por un tercer evaluador. En la figura No 1 se presentan los resultados de la búsqueda. De igual forma, la extracción de los datos fue realizada independientemente por 2 investigadores (PS y ET), utilizando un formato estandarizado. Las discrepancias fueron resueltas por consenso, con la intervención de un tercer investigador (OMMV). Los investigadores recogieron los siguientes datos para cada estudio: tamaño de la muestra, características basales de la población, criterio utilizado para el diagnóstico de LES, presencia de comorbilidades (diabetes mellitus, hipertensión arterial, tabaquismo), medicamento utilizado y dosis, duración del seguimiento y resultados en los desenlaces, incluyendo el número de eventos y estimativo de resumen utilizado.
La calidad de los ensayos clínicos se evaluó de acuerdo con la lista de verificación del Scottish Intercollegiate Guidelines Network10. La probabilidad de cada uno de los potenciales sesgos fue evaluada por 2 revisores que trabajaron independientemente. Los desacuerdos fueron resueltos por discusión y participación de un tercer revisor.
Para el resumen y el metaanálisis de la información, así como para la estimación de la heterogeneidad (incluyendo el cálculo del I2), se utilizó el software Review Manager 5.3, recomendado por la Colaboración Cochrane. Se utilizó un modelo de efectos aleatorios que permite evaluar la heterogeneidad entre los diferentes estudios incluidos. De igual forma, se presenta el análisis clínico de la heterogeneidad encontrada cuando se consideró clínicamente relevante.
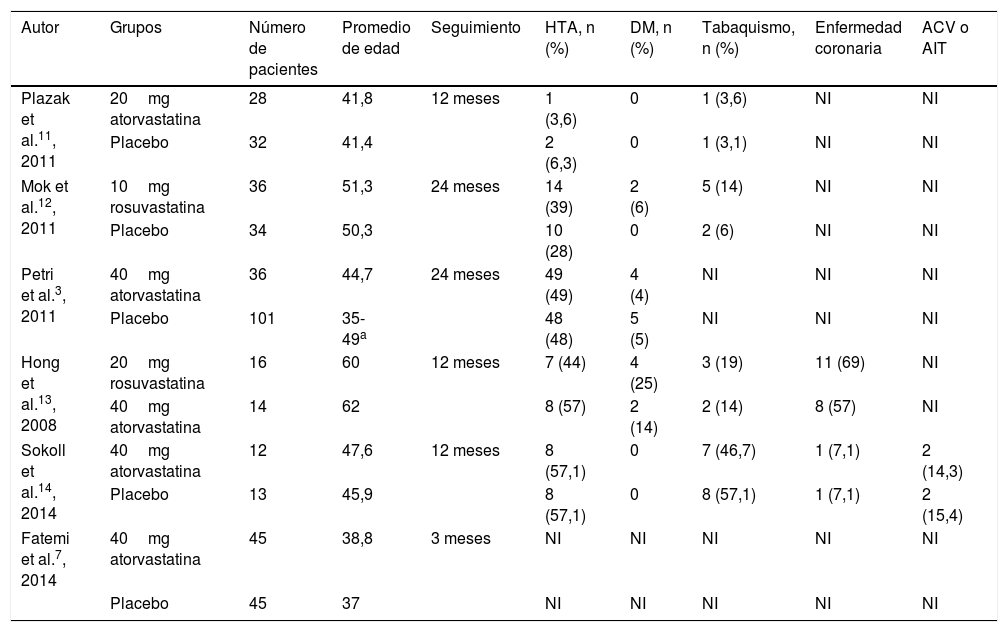
ResultadosUn total de 38 estudios fueron identificados, de los cuales se excluyeron 32 (26 correspondían a duplicados, 4 incluían pacientes menores de 18 años y 2 no reportaban ninguno de los desenlaces de interés). Seis estudios con un total de 412 pacientes incluidos fueron tenidos en cuenta para el análisis final3,7,11–14. Los 6 artículos corresponden a ensayos clínicos aleatorizados; 5 utilizaron estatinas de alta potencia (rosuvastatina o atorvastatina) comparadas con placebo y solo un estudio realizó comparación entre 2 estatinas13. Las características de los pacientes incluidos en cada uno de estos estudios, incluyendo la frecuencia de comorbilidades, se presentan en la tabla 1.
Estudios incluidos
| Autor | Grupos | Número de pacientes | Promedio de edad | Seguimiento | HTA, n (%) | DM, n (%) | Tabaquismo, n (%) | Enfermedad coronaria | ACV o AIT |
|---|---|---|---|---|---|---|---|---|---|
| Plazak et al.11, 2011 | 20mg atorvastatina | 28 | 41,8 | 12 meses | 1 (3,6) | 0 | 1 (3,6) | NI | NI |
| Placebo | 32 | 41,4 | 2 (6,3) | 0 | 1 (3,1) | NI | NI | ||
| Mok et al.12, 2011 | 10mg rosuvastatina | 36 | 51,3 | 24 meses | 14 (39) | 2 (6) | 5 (14) | NI | NI |
| Placebo | 34 | 50,3 | 10 (28) | 0 | 2 (6) | NI | NI | ||
| Petri et al.3, 2011 | 40mg atorvastatina | 36 | 44,7 | 24 meses | 49 (49) | 4 (4) | NI | NI | NI |
| Placebo | 101 | 35-49a | 48 (48) | 5 (5) | NI | NI | NI | ||
| Hong et al.13, 2008 | 20mg rosuvastatina | 16 | 60 | 12 meses | 7 (44) | 4 (25) | 3 (19) | 11 (69) | NI |
| 40mg atorvastatina | 14 | 62 | 8 (57) | 2 (14) | 2 (14) | 8 (57) | NI | ||
| Sokoll et al.14, 2014 | 40mg atorvastatina | 12 | 47,6 | 12 meses | 8 (57,1) | 0 | 7 (46,7) | 1 (7,1) | 2 (14,3) |
| Placebo | 13 | 45,9 | 8 (57,1) | 0 | 8 (57,1) | 1 (7,1) | 2 (15,4) | ||
| Fatemi et al.7, 2014 | 40mg atorvastatina | 45 | 38,8 | 3 meses | NI | NI | NI | NI | NI |
| Placebo | 45 | 37 | NI | NI | NI | NI | NI |
ACV: accidente cerebrovascular; AIT: accidente isquémico transitorio; DM: diabetes mellitus; HTA: hipertensión arterial; NI: no hay información disponible.
Pacientes con lupus eritematoso sistémico por criterios.
No se encontraron datos de mortalidad, IAM, ACV o requerimiento de revascularización miocárdica en ninguno de los estudios incluidos en el análisis. Cabe aclarar que el tiempo máximo de seguimiento en estos estudios fue de 24 meses.
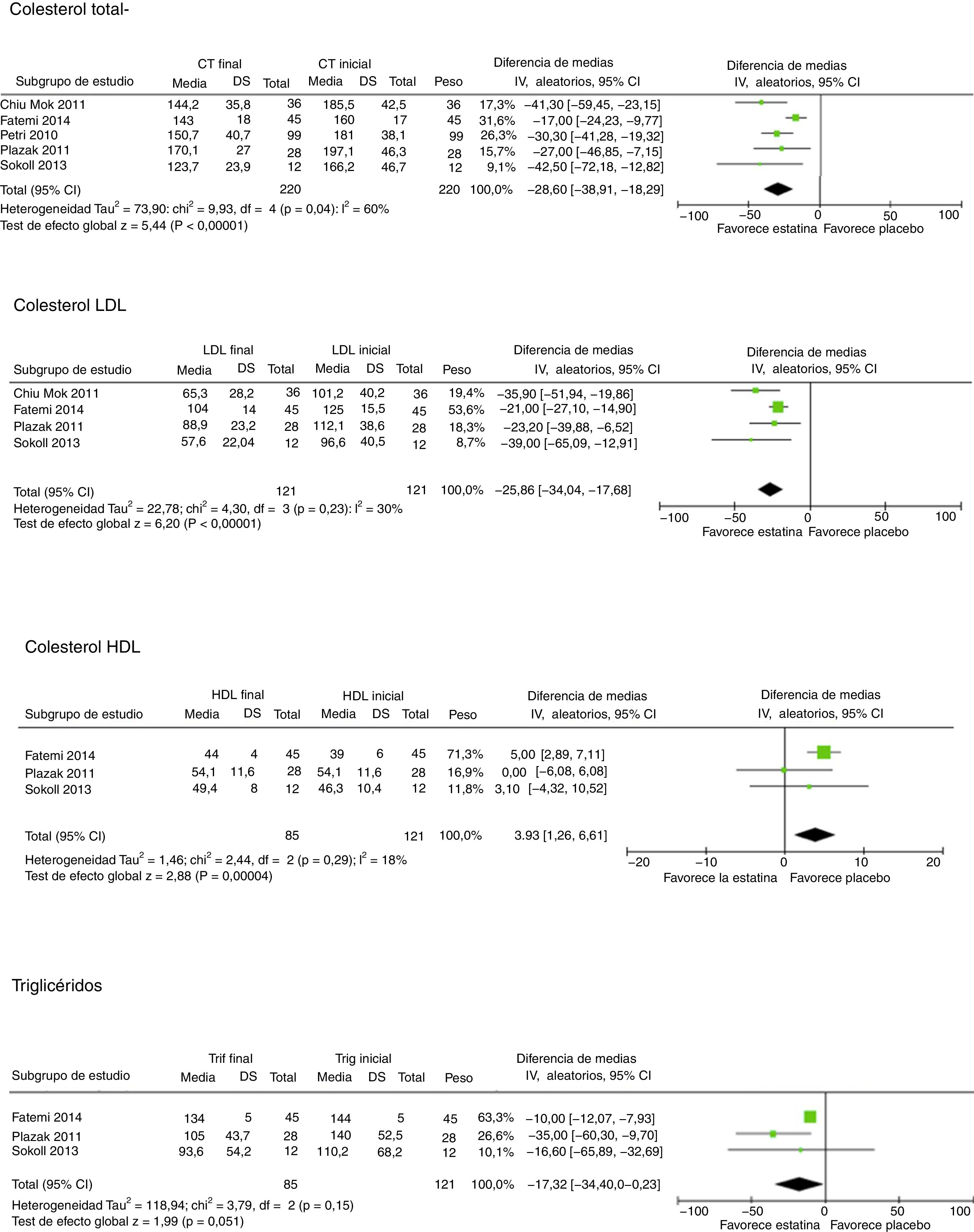
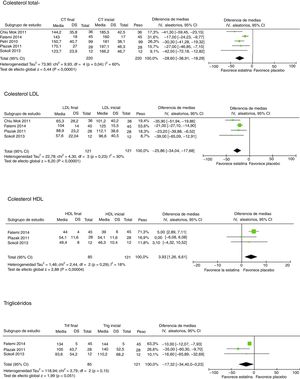
Fracciones lipídicas y nivel de proteína C reactivaCinco estudios evaluaron el impacto de las estatinas frente a placebo en el perfil lipídico3,7,11,12,14 (fig. 2). Todos ellos evaluaron el impacto en los niveles de colesterol total (CT). La reducción de CT media fue de 31,2mg/dL (IC 95% −41,9; −20,5; I2 60%), siendo consistente el hallazgo en todos los estudios. Cuatro estudios evaluaron el impacto de las estatinas en los niveles de colesterol ligado a lipoproteínas de baja densidad (c-LDL)7,11,13,14. Se evidenció una reducción significativa de 31,4mg/dL (IC 95%−43; −19,9; I2 30%). Con respecto a los niveles de colesterol unido a lipoproteínas de alta densidad (c-HDL), 3 estudios7,11,14 lo evaluaron, encontrando un incremento estadística mas no clínicamente significativo de 4mg/dL (IC 95% 2,49; 6,21; I2 18%), hallazgos que no tuvieron una heterogeneidad importante.
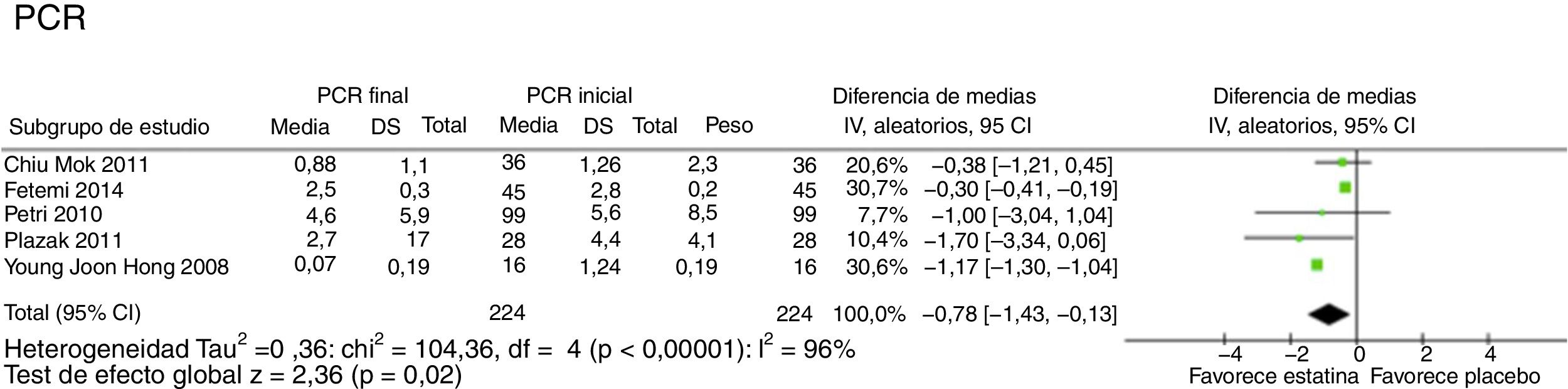
Cinco estudios evaluaron el impacto de las estatinas en los niveles de PCR3,7,11,12,14 (fig. 3), evidenciando una disminución estadística pero no clínicamente significativa de 0,78mg/dL (IC 95% −1,43; −0,13; I2 98%).
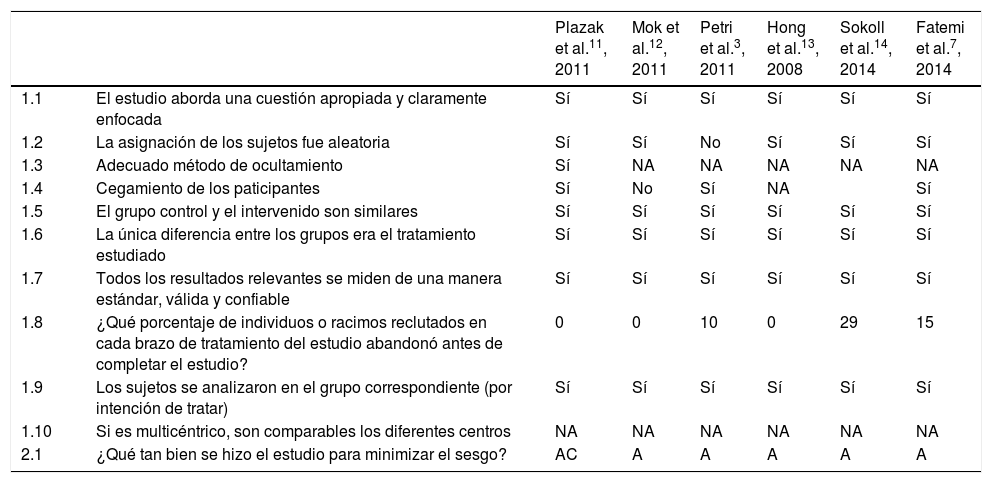
Calidad de los estudiosAl revisar la calidad de los estudios clínicos analizados para evaluar el impacto de las estatinas en el riesgo cardiovascular global, se evidenció que solo uno de ellos11 estableció un adecuado enmascaramiento de la aleatorización. En 3 de los estudios no hubo un cegamiento a los pacientes incluidos12–14. El estudio de Petri et al. de 20113 no registró el proceso de aleatorización (Tabla No 2).
Calidad de los estudios
| Plazak et al.11, 2011 | Mok et al.12, 2011 | Petri et al.3, 2011 | Hong et al.13, 2008 | Sokoll et al.14, 2014 | Fatemi et al.7, 2014 | ||
|---|---|---|---|---|---|---|---|
| 1.1 | El estudio aborda una cuestión apropiada y claramente enfocada | Sí | Sí | Sí | Sí | Sí | Sí |
| 1.2 | La asignación de los sujetos fue aleatoria | Sí | Sí | No | Sí | Sí | Sí |
| 1.3 | Adecuado método de ocultamiento | Sí | NA | NA | NA | NA | NA |
| 1.4 | Cegamiento de los paticipantes | Sí | No | Sí | NA | Sí | |
| 1.5 | El grupo control y el intervenido son similares | Sí | Sí | Sí | Sí | Sí | Sí |
| 1.6 | La única diferencia entre los grupos era el tratamiento estudiado | Sí | Sí | Sí | Sí | Sí | Sí |
| 1.7 | Todos los resultados relevantes se miden de una manera estándar, válida y confiable | Sí | Sí | Sí | Sí | Sí | Sí |
| 1.8 | ¿Qué porcentaje de individuos o racimos reclutados en cada brazo de tratamiento del estudio abandonó antes de completar el estudio? | 0 | 0 | 10 | 0 | 29 | 15 |
| 1.9 | Los sujetos se analizaron en el grupo correspondiente (por intención de tratar) | Sí | Sí | Sí | Sí | Sí | Sí |
| 1.10 | Si es multicéntrico, son comparables los diferentes centros | NA | NA | NA | NA | NA | NA |
| 2.1 | ¿Qué tan bien se hizo el estudio para minimizar el sesgo? | AC | A | A | A | A | A |
A: aceptable; AC: alta calidad; NA: no aplica.
Es evidente que las estatinas (atorvastatina y rosuvastatina) tienen un efecto benéfico clínica y estadísticamente significativo en la reducción de los valores de CT y c-LDL, hallazgo consistente con múltiples estudios que evalúan la eficacia de las estatinas15, con un incremento modesto en el c-HDL, cuya relevancia clínica no es conocida, si bien es estadísticamente significativo. Esta revisión sistemática no encontró ninguna información sobre eventos cardiovasculares y mortalidad en esta población específica debido posiblemente a la ausencia de estudios dirigidos a evaluar de forma específica los eventos cardiovasculares en esta población y la eventual reducción del riesgo de presentación con el uso de estatina, quizás debido a que corresponde a una población más joven y con un tiempo de exposición a factores de riesgo cardiovascular adquiridos menor. Así mismo, es notable que en los últimos años se ha logrado un mejor control de la enfermedad, con una disminución del número de episodios y de la severidad de las recaídas, que incrementa la supervivencia de los pacientes con LES y reduce la exposición a los procesos inflamatorios asociados con una menor exposición a terapias inmunosupresoras y antiinflamatorias y una menor dosis de esteroides, que a su vez disminuye el potencial incremento del riesgo cardiovascular en esta población.
Si bien existe información valiosa respecto al efecto favorable de las estatinas (efecto hipolipidemiante) en los niveles de las fracciones lipídicas, no existe evidencia sobre los potenciales pleiotrópicos (antiinflamatorios y antioxidantes), que podrían tener un papel fisiopatológico interesante en el control de la enfermedad y en la reducción de eventos cardiovasculares.
Dentro de las principales limitaciones del estudio encontramos el tiempo de seguimiento, que si bien es apropiado para demostrar el beneficio en la reducción de las fracciones lipídicas, es limitado para evaluar el impacto sobre la presentación de eventos cardiovasculares. Aunque en población de alto riesgo cardiovascular es conocido y se ha comprobado que «cuanto más bajo, mejor» en relación con los niveles de c-LDL, la información encontrada no permite confirmar dicha relación, pero la extrapolación de esta información a pacientes con perfiles de alto riesgo cardiovascular podría teóricamente ser factible e incierta para personas de bajo riesgo cardiovascular o riesgo cardiovascular dentro del promedio poblacional. Así mismo, no se reportó en todos los estudios la variación de todas las fracciones lipídicas (datos incompletos para c-HDL y TG).
Consideramos valioso el aporte de la revisión sistemática en cuanto a la gran brecha de investigación generada en un tópico tan importante como es el riesgo cardiovascular en el paciente con LES, situación que de ser impactada generaría un gran avance en la disminución de la morbimortalidad en los primeros años tras el diagnóstico del LES.
Sin duda alguna, el riesgo cardiovascular en el paciente con LES es una realidad actual. El impacto en la morbimortalidad asociada por eventos cardiovasculares es de tal magnitud que hoy en día se considera la principal causa de muerte luego de las complicaciones renales de la enfermedad en estadios iniciales. Si bien no existe información suficiente para avalar el uso rutinario de estatinas en el paciente con LES, se abre un gran camino en la búsqueda de respuestas que permitan minimizar el impacto del riesgo cardiovascular en este grupo de pacientes.
ConclusionesEl uso de estatinas en pacientes con LES tiene un efecto favorable y estadísticamente significativo en la reducción de CT y c-LDL, así como un discreto incremento en los niveles de c-HDL, sin encontrar efectos estadísticamente significativos en la reducción de la PCR. No existe suficiente información que permita realizar análisis sobre el efecto del uso de estatinas en la disminución de eventos cardiovasculares y mortalidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.