La enfermedad pulmonar intersticial difusa (EPID) es una manifestación frecuente en pacientes con artritis reumatoide (AR) y asocia una gran morbimortalidad. El objetivo de esta revisión fue identificar los distintos métodos de cribado de EPID en pacientes con AR.
MétodosSe realizó una búsqueda sistemática en Pubmed, Embase y Cochrane Library hasta abril de 2020 y una búsqueda manual en la bibliografía de los artículos recuperados. Se limitó a estudios en humanos y artículos publicados en inglés, francés o español. Se seleccionaron estudios de cualquier diseño en los que: a) la población a estudiar fuesen pacientes adultos con AR; b) la intervención consistiese en cualquier método de cribado de EPID; y c) se evaluase la validez o fiabilidad del método de cribado, o se describiesen criterios de cribado. Dos revisoras realizaron la selección por título y abstract de forma independiente y posteriormente extrajeron la información utilizando plantillas específicas.
ResultadosSe incluyeron 25 estudios con un total de 2.593 pacientes. La herramienta más frecuentemente utilizada para el cribado de EPID fue la tomografía computarizada de alta resolución (TCAR) pulmonar. También se evaluaron la auscultación electrónica, los marcadores bioquímicos, el lavado broncoalveolar (LBA), las pruebas de función respiratoria (PFR) y la ecografía pulmonar. En los diferentes estudios, la auscultación electrónica y la ecografía pulmonar alcanzaron mayor precisión que las PFR, el LBA y los marcadores bioquímicos.
ConclusionesLa TCAR ha demostrado ser la técnica más sensible para el cribado de EPID en pacientes con AR. Dada su inocuidad y su alta sensibilidad, es posible que la ecografía pulmonar se posicione como técnica de elección en un futuro.
Interstitial lung disease (ILD) is frequent in patients with rheumatoid arthritis (RA) and is associated with significant morbidity and mortality. The aim of this review was to identify the different screening methods for ILD in patients with RA.
MethodsWe ran a systematic search in Pubmed, Embase and Cochrane Library up to April 2020 and did a hand search of the references of the retrieved articles. The search was limited to humans and articles published in English, Spanish or French. We selected studies with any design where: a) the population included adult patients with RA; b) the intervention was any screening method for ILD; and c) validity or reliability of the screening method were evaluated, or a screening method was described. Two reviewers independently screened the articles by title and abstract and subsequently extracted the information using a specific data extraction form.
Results25 studies were included with a total of 2,593 patients. The most frequently used tool for ILD screening was high resolution computed tomography (HRCT) of the lung. Electronic auscultation, biochemical markers, bronchoalveolar lavage (BAL), pulmonary function tests (PFTs) and lung ultrasonography were also evaluated. Across the different studies, electronic auscultation and lung ultrasonography achieved higher accuracy than PFTs, BAL and biochemical markers.
ConclusionsHRCT resulted as the most sensitive tool for ILD screening in patients with RA. Given its harmlessness and high sensitivity, lung ultrasonography may become the first-choice tool in the future.
La afectación pulmonar es una manifestación extraarticular frecuente en la artritis reumatoide (AR), que puede ocurrir en el 60-80% de los pacientes1. Se han descrito distintos tipos de afectación pulmonar, entre los que se incluyen la enfermedad pulmonar intersticial difusa (EPID), la enfermedad pleural, los nódulos reumatoides, las bronquiectasias y la vasculitis1. En distintos estudios se ha estimado la prevalencia de EPID en AR entre el 1% y 58% dependiendo de la metodología utilizada2. Se ha observado que la incidencia acumulada de EPID clínicamente significativa (alteraciones en las pruebas de función respiratoria [PFR]: disminución de capacidad vital forzada [CVF] o de la difusión pulmonar de monóxido de carbono [DLCO] de 15% de valor normal) en pacientes con AR es del 5% a los 10 años3 y del 6,8% tras 30 años de seguimiento4. La EPID es una importante causa de morbilidad y mortalidad. En un estudio estadounidense, la mortalidad a los 5 años del diagnóstico fue del 35,9%5.
Una de las grandes dificultades para establecer la incidencia y prevalencia de la EPID se debe al infradiagnóstico. Se ha observado una alta prevalencia de EPID subclínica (19-57%)6,7, definida como aquella que se detecta incidentalmente en la tomografía computarizada de alta resolución (TCAR) y no produce síntomas. Estos hallazgos radiológicos son progresivos en la mitad de los pacientes8 y se asocian a la aparición posterior de síntomas respiratorios y alteraciones en las PFR9.
No se conoce con exactitud la relación entre la AR y la EPID pero se cree que están implicados tanto mecanismos genéticos como ambientales2. Se han propuesto dos vías de conexión entre la enfermedad articular y la pulmonar. Por un lado, es posible que la enfermedad comience en el tejido sinovial siguiendo una respuesta inmune contra proteínas citrulinadas, que posteriormente tendría una reacción cruzada con antígenos tisulares existentes en el pulmón10. El hecho de que en la mayoría de los pacientes la enfermedad articular aparezca antes que la pulmonar apoya esta teoría. Otra posibilidad es que la tolerancia inmune se pierda inicialmente en el pulmón y que la EPID genere una respuesta inmune contra proteínas citrulinadas que secundariamente se extendería a las articulaciones11. Esta idea se apoya en la observación de que la EPID puede preceder a otras manifestaciones extrapulmonares y en la existencia de un elevado número de péptidos citrulinados en el parénquima pulmonar de pacientes con AR-EPID6,8.
La relación temporal entre la enfermedad articular y la EPID es, por tanto, muy variable. Además, la gravedad de la afectación pulmonar no se correlaciona con la gravedad de la AR, aunque algunas características de esta, como un factor reumatoide elevado, son factores de riesgo de EPID. Algunos pacientes pueden estar asintomáticos a pesar de tener importante afectación radiológica12,13.
Dada la importante morbimortalidad asociada a AR-EPID, resulta crucial disponer de métodos de cribado para diagnosticar casos asintomáticos y ofrecer un tratamiento temprano. Como apoyo a la elaboración de unos criterios de cribado de EPID en pacientes con AR, se realizó una revisión sistemática con el objetivo de identificar los distintos métodos de cribado de enfermedad pulmonar intersticial utilizados en pacientes con AR.
MétodosPara la realización de esta revisión se siguieron las recomendaciones de las guías PRISMA.
Estrategia de búsquedaUna bibliotecaria especializada en ciencias de la salud (MGR) diseñó una estrategia de búsqueda sistemática en las bases de datos bibliográficas Pubmed (Medline), Embase (Elsevier) y Cochrane Library (Wiley). La búsqueda incluyó términos MeSH y texto libre con sus diferentes combinaciones referente a «artritis reumatoide», «enfermedad pulmonar intersticial» y «cribado» hasta abril de 2020 (anexo 1 del material adicional). Se limitó la búsqueda a estudios en humanos y artículos publicados en inglés, francés o español. Además, se realizó una búsqueda manual en las referencias de los artículos recuperados.
Selección de estudiosPara hacer el cribado de estudios se utilizó la herramienta para revisiones sistemáticas Covidence (www.covidence.org). Se seleccionaron estudios de cualquier diseño en los que se utilizasen métodos de cribado de enfermedad pulmonar intersticial en pacientes con AR. Según protocolo, se incluyeron estudios en los que: a) la población a estudiar fuesen pacientes adultos con AR; b) la intervención consistiese en cualquier método de cribado de EPID (cuestionario, exploración, pruebas complementarias…); y c) se evaluase la validez o fiabilidad del método de cribado, o se describiesen criterios de cribado. En primer lugar, dos revisoras (SGC y LSF) realizaron de forma independiente una selección por título y abstract. En caso de discrepancia, se resolvió por consenso. Posteriormente, los artículos seleccionados se evaluaron en detalle para realizar una selección de los finalmente incluidos en función de los criterios mencionados. En caso de desacuerdo sobre la inclusión entre las dos revisoras, un tercer revisor resolvió el conflicto (DSM). Se registró la razón de exclusión de todos los estudios descartados.
Extracción de datosLas dos revisoras extrajeron la información de los artículos de forma independiente utilizando plantillas específicas. Los artículos recuperados se clasificaron en función del método de cribado estudiado (TCAR, PFR, ecografía, etc). Se extrajeron las características de los estudios en cuanto a diseño, población incluida, método de cribado, patrón oro utilizado y resultados de la comparación. Se realizó una síntesis de la información recopilada de manera narrativa con una tabulación de las características y los resultados de cada estudio incluido. La calidad de los estudios se evaluó con la Escala de Niveles de Evidencia Científica y Formulación de Recomendaciones para Preguntas sobre Diagnóstico (Adaptación de NICE [National Institute for Health and Care Excellence]14 de los niveles de evidencia del Oxford Centre for Evidence Based Medicine y del Centre for Reviews and Dissemination15).
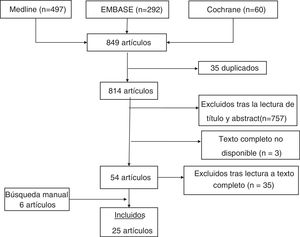
ResultadosEn el diagrama de la figura 1 se detallan los resultados de la búsqueda. La estrategia de búsqueda realizada identificó 849 estudios, de los cuales 35 estaban duplicados. La selección inicial por título y abstract descartó 757. De los 54 artículos revisados en detalle, 19 cumplían los criterios de inclusión. Además, se seleccionaron 6 artículos encontrados por búsqueda manual en la bibliografía de los artículos recuperados. Las características de los 25 artículos incluidos se describen en la tabla 1. Los resultados más relevantes de los estudios se exponen en la tabla 2. Los artículos excluidos y los motivos de exclusión se detallan en el anexo 2 del material adicional.
Relación de estudios incluidos en la revisión sistemática
| Estudio | Pacientes | Intervención | Desenlaces evaluados | Calidad de evidenciaa(NICE) |
|---|---|---|---|---|
| Pancaldi (2018)19Transversal | n=70 pacientes con AR (con y sin sintomatología respiratoria que se les hubiera solicitado TCAR)-AR no EPID: 43, mujeres 17, edad media: 66,8 ±10,5-AR EPID: 27, mujeres 23, edad media: 69,8±8,5 | Auscultación con estetoscopio electrónico (análisis con algoritmo VECTOR) TCAR pulmonar | Precisión, sensibilidad, especificidad, VVP y VPN del algoritmo VECTOR para diagnóstico de EPID | 2 |
| Manfredi (2019)24Transversal | n=137 pacientes con ARconsecutivos, que se les hubiera solicitado TCAR (síntomas respiratorios, alteraciones Rx, infección, control nódulos pulmonares)-AR No EPID: 78, mujeres 31, edad media: 66,5±10,3-AR EPID: 59, mujeres 45, edad media: 69,8±9,1 | Auscultación con estetoscopio electrónico (análisis con algoritmo VECTOR) TCAR pulmonar | Precisión, sensibilidad, especificidad, VVP y VPN del algoritmo VECTOR para diagnóstico de EPID | 2 |
| Abdel-Wahab (2016)18Transversal | n=50 pacientes con ARMujeres: 41Edad media: 51,1±9,6n=30 controlesMujeres: 23Edad media: 51±9,4 | Determinación IL-33TCAR pulmonar | Correlación entre IL-33 y EPID | 2 |
| Castellanos-Moreira (2020)28Transversal | n=179 pacientes con ARDiagnóstico previo de EPID: 31-AR no EPID: 142, mujeres 116, edad media: 57,7±12,9-AR EPID: 37, mujeres 25, edad media: 67,3±10,1 | Determinación Ac anti-proteínas carbamiladas: anti-FCS, anti-Fib, anti-CFFHP y anti-FCS-IgATCAR pacientes sin diagnóstico previo EPID | Correlación entre niveles de anticuerpos anti-proteína carbamilada y EPID | 3 |
| Chen (2015)22Transversal | n=133 pacientes con AR (cohorte de identificación, China) consecutivos independientemente de sintomatología respiratoriaAR No EPID: 50, mujeres 41, edad media: 43,4±15,54AR EPID indeterminada: 34, mujeres 34, edad media: 57,07±9,40AR EPID moderada-grave: 41, mujeres 29, edad media: 53,02±14,20n=86 pacientes con AR (cohorte replicación, EE.UU., diagnóstico previo EPID: 44%).AR No EPID: 22, mujeres 16, edad media: 50,32±7,82AR EPID indeterminada: 15, mujeres 15, edad media: 54,33±12,24AR EPID moderada-grave: 49, mujeres 18, edad media: 65,27±10,80 | TCAR y PFRDeterminación biomarcadores por ELISA MMP-7, IP-10, IFNγ, IL-8, IL-10, IL-15, IL-22, y receptor cadena α IL-2 | Correlación entre biomarcadores (MMP-7 e IP-10) y EPID y su gravedad | 2 |
| Wang (2015)26Transversal | n=41 pacientes con ARindependientemente de sintomatología respiratoria, que se les hubiera solicitado TCAR-AR no EPID: 16, mujeres 10, edad media: 56,19±12,11-AR EPID: 25, mujeres 11, edad media: 63,56±11,90 | TCAR, PFRAnalítica sanguínea: marcadores tumorales (CEA, CA125, CA19-9 y CA15-3)Anti-CCP, VSG, PCR | Correlación entre variables de función pulmonar asociadas a EPIDAsociación entre variables analíticas y presencia de EPID | 2 |
| Doyle (2015)29Transversal | n=113 pacientes con AR con TCAR realizada por motivos clínicos (cohorte BRASS)- AR No EPID: 29, mujeres 28, edad media: 53±12- AR EPID subclínica: 29, mujeres 23, edad media: 68±10- AR EPID clínica: 17, mujeres 13, edad media: 65±10- AR EPID indeterminada: 38 n=76 pacientes con AR (cohorte ACR)- AR no EPID: 22, mujeres 16, edad media: 50±8- AR EPID subclínica: 18, mujeres 13, edad media 65±8- AR EPID clínica: 21, mujeres 12, edad media: 64±14- AR EPID indeterminada: 15 | TCAR realizada con anterioridadDeterminación biomarcadores serológicos (MMP-7, PARC, proteína D surfactante) FR, anti-CCP | Correlación entre los biomarcadores y EPIDDesarrollo de un índice para identificación de EPID subclínica en AR | 3 |
| Tishlerb (1986)30Transversal | n=12 pacientes con ARsin síntomas respiratorios-AR no EPID: 8, mujeres 7, edad media: 52,5±14,5-AR EPID: 4, mujeres 1, edad media: 53,5±10,3 | Rx de tóraxPFRLBA, recuento celular | Distribución celular, en pacientes con AR según si tuvieron o no alteraciones en Rx de tórax | 3 |
| Gilliganb (1990)38Transversal | n=93 pacientes con AR, asintomáticos-AR no EPID: 79, mujeres 53, edad media: 51,2±10,1-AR EPID: 14, mujeres 7, edad media: 53,6±10,7n=11 pacientes con AR y EPID conocida=15 controles sanos | Rx de tóraxPFRLBA en los pacientes con afectación EPID subclínica | Niveles de neutrófilos, procolágeno N terminal tipo III y fibronectina en pacientes con EPID subclínica vs. EPID establecida | 3 |
| Gochuico (2008)8Cohorte | n=74 pacientes con AR asintomáticos- AR no EPID: 43, mujeres 36, edad media: 51,3±1,3-AR EPID preclínica: 31, mujeres 14, edad media: 55,6±2n=10 pacientes con AR y fibrosis pulmonarmujeres 7, edad media: 53,7±2,6 | TCAR pulmonarLBAPFR | Porcentaje de pacientes con EPID subclínicaPorcentaje de pacientes con EPID subclínica que progresanCuantificación de citoquinas y factores de crecimiento en LBA | 2 |
| Mohd (2009)34Transversal | n=63 pacientes con AR de más de 5 años de evolución, reclutados de forma consecutiva, independientemente de sintomatología respiratoria-AR no EPID: 35-AR EPID: 28 | TCARPFR | Evaluar diferencias clínicas y funcionales entre pacientes con AR-EPID y AR sin EPID | 3 |
| Zhang (2017)33Transversal | n=550 pacientes con AR independientemente de sintomatología respiratoria-AR no EPID: 313, mujeres 234, edad media: 47,7±14,5-AR EPID: 237, mujeres 151, edad media: 57,6±13,2 | TCARPFR | Comparación datos clínicos de pacientes con AR y EPID y AR sin EPIDCorrelación entre características clínicas/analíticas y presencia de EPID | 3 |
| Mori (2011)35Transversal | n=189 pacientes con AR consecutivos, independientemente de sintomatología respiratoria-AR no EPID: 155, mujeres 130, edad media: 60-AR EPID: 19, mujeres 13, edad media: 72-AR bronquiolitis: 15, mujeres 15, edad media: 63 | TCARPFR | Correlación entre características clínicas y las PFR en pacientes con y sin alteraciones en la TCAR | 3 |
| Yilmazer (2016)36Transversal | n=130 pacientes con AR independientemente de sintomatología respiratoria-AR no EPID: 70, mujeres 55, edad media: 54,2±10,7-AR EPID: 60, mujeres 36, edad media: 64,5±9,8 | TCAR (realizada por cualquier motivo)PFR | Correlación de daño y extensión radiológica medido por el índice de Warrick y variables clínicas, PFR | 3 |
| Leonel (2012)37Transversal | n=36 pacientes con ARconsecutivos, independientemente de sintomatología respiratoriaMujeres: 36Edad media: 46,7±10,9 | TCARPFR | Correlación PFR con la TCAR pulmonar en pacientes con AR | 3 |
| Cogliati (2014)16Transversal | n=39 pacientes con ARcon EPID conocida o sospecha-AR no EPID: 26, mujeres 21, edad media: 64,65±10-AR EPID: 13, mujeres 8, edad media: 65,31±10 | Ecografía pulmonar transtorácicaTCARPFR | Validez de la ecografía en diagnóstico de EPID | 1 |
| Moazedi-Fuerst (2014)17Transversal | n=64 pacientes con ARsin síntomas respiratoriosMujeres 54, edad media 59±12-AR no EPID: 46-AR EPID: 18n=40 controlesMujeres 25, edad media 52±22 | Ecografía pulmonar transtorácicaTCAR pulmonarPFR | Precisión diagnóstica, sensibilidad y especificidad de ecografía en diagnóstico de EPID | 1 |
| Moazedi-Fuerst (2015)20Transversal | n=45 pacientes con enfermedad reumática, sin síntomas respiratorios. Entre ellos, 25 pacientes con AR-AR no EPID: 18- AR EPID: 7n=40 controles sanos | Ecografía pulmonar transtorácicaTCAR pulmonarPFR | Validez de la ecografía en diagnóstico de EPID | 2 |
| Hassan (1995)25Transversal | n=20 pacientes con AR sin síntomas respiratorios y Rx tórax normalMujeres 18, edad media 59 | TCAR PFR Rx de torax | Frecuencia de hallazgos en TCAR de pacientes con AR | |
| Gabbay (1997)6Transversal | n=36 pacientes con AR (<2 años evolución) consecutivos-AR no EPID: 15, mujeres 11, edad media: 49,4±3,3-AR EPID subclínica: 16, mujeres 13, edad media: 52,4±3,3-AR EPID clínicamente significativa: 5, mujeres 1, edad media: 54,4±2,1 | TCAR, Rx de tóraxGammagrafía con Tc99 LBAPFRCuestionario modificado American Thoracic Society Respiratory Questionnaire | Prevalencia de EPID en pacientes con AR de <2 años de evolución; comparar las características entre pacientes con AR y EPID y AR sin EPID | 2 |
| Dawson (2001)27Transversal | n=150 pacientes con AR consecutivos independientemente de sintomatología respiratoria-AR no EPID: 122, mujeres 81, edad media: 58,3±10,6-AR EPID: 28, mujeres 19, edad media: 61,2±8,7 | TCAR PFRRx de tórax | Prevalencia de alveolitis fibrosante en pacientes con AR diagnosticada por TCAR | 2 |
| Raniga (2006)31Transversal | n=30 pacientes con AR, sin tener en cuenta sintomatología o cambios en Rx de tóraxMujeres 23-AR no EPID: 19-AR EPID: 11 | TCAR PFR Rx de tórax | Prevalencia de EPID en pacientes con AR y descripción de hallazgos en pruebas complementarias | 3 |
| Zayeni (2016)32Transversal | n=44 pacientes con AR consecutivosMujeres 35, edad media: 49±13 | TCAR PFR Rx de tórax | Prevalencia de EPID en pacientes con AR, descripción de características clínicas | 3 |
| Affara (2014)21Transversal | n=50 pacientes con AR asintomáticosMujeres 40 | TCAR PFR | Prevalencia de EPID subclínica en pacientes con AR | 2 |
| Chen (2013)23Transversal | n=103 pacientes con ARconsecutivos independientemente de sintomatología respiratoria-AR no EPID: 40, mujeres 30, edad media: 42,9±12,4-AR EPID: 63, mujeres 46, edad media: 53,0±14,8 | TCAR PFR | Comparación características clínicas y demográficas, de pacientes con AR y EPID vs. AR no EPID diagnosticados por TCAR y PFR | 2 |
Ac: anticuerpo; Anti-CFFHP: anticuerpos antipéptido homocitrulinado fibrina quimérica/filagrina; Anti-FCS: anticuerpos antisuero fetal bovino; Anti-Fib: anticuerpos antifibrinógeno; AR: artritis reumatoide; AUC: área bajo la curva; CA125: antígeno de carbohidrato-125; CA19-9: antígeno de carbohidrato 19-9; CA15-3: antígeno de carbohidrato 15-3; CEA: antígeno carcinoembrionario; CPT: capacidad pulmonar total; CV: capacidad vital; CVF: capacidad vital forzada; DLCO: capacidad de difusión del monóxido de carbono (en inglés: diffusing capacity for carbon monoxide); DLCO/VA: DLCO corregida por volumen alveolar; EPID: enfermedad pulmonar intersticial difusa; IFN: interferón; IL: interleucina; IP-10: proteína 10 inducida por interferón gamma; LBA: lavado broncoalveolar; MMP-7: metaloproteinasa de matriz 7; PFR: pruebas de función respiratoria; Rx: radiografía; TCAR: tomografía computarizada alta resolución; VPP: valor predictivo positivo; VPN: valor predictivo negativo.
Resultados de los estudios incluidos en la revisión sistemática
| Estudio | Resultados |
|---|---|
| Pancaldi (2018)19Transversal | Auscultación electrónica (VECTOR):Precisión: 90%; especificidad: 88,4%; sensibilidad: 92,6%; VPP: 83,3%; VPN: 95% |
| Manfredi (2019)24Transversal | Auscultación electrónica (VECTOR):Precisión: 83,9%; especificidad: 76,9%; sensibilidad: 93,2%; VPP: 75,3%; VPN: 93,75% |
| Abdel-Wahab (2016)18Transversal | Existe correlación entre los niveles de IL-33 y EPID (r=0,3; p=0,04) |
| Castellanos-Moreira (2020)28Transversal | -Anti-CarP EPID vs. no EPID:anti-FCS: 70% vs. 43%anti-Fib: 73% vs. 51%anti-CFFHP: 38% vs. 19%anti-FCS- IgA: 51% vs. 20%, p<0,05 para todas las comparaciones-Títulos medios de Ac fueron significativamente más altos en el grupo EPID-Regresión logística ajustada anti-FCS (OR: 3,42; IC del 95%: 1,13 a 10,40), anti-CFFHP (OR: 3,11; IC del 95%: 1,06 a 9,14) y anti-FCS- IgA (OR: 4,30; IC del 95%: 1,41 a 13,04) asociación independiente con EPID |
| Chen (2015)22Transversal | - Valores medios de MMP-7, EPID subclínica 5,94±3,46ng/ml y EPID clínicamente evidente 6,24±3,38ng/ml (p=0,0006 y p<0,0001, respectivamente, vs AR no EPID)- En ambas cohortes MMP-7 e IP-10 se correlacionan con la presencia y gravedad de la EPID, tras ajustar por edad y DAS28 |
| Wang (2015)26Transversal | - Niveles más altos de CA15-3 y CA125 en AR con EPID (p=0,01 y 0,03, respectivamente), CEA y CA19-9 no diferencias (p=0,47 y 0,19, respectivamente)- Modelo de regresión logística: solo DLCO (beta –0,06) tenía asociación estadísticamente significativa con AR con EPID. Curvas ROC para DLCO: AUC: 0,87 (IC 95% 0,76-0,98) (p<0,001). Para punto de corte DLCO 52,95% sensibilidad: 100%, especificidad: 60,87% |
| Doyle (2015)29Transversal | - Cohorte BRASS: MMP-7, AR no EPID: 5,7±2,5 y AR EPID subclínica 9,1±3,3 (p<0,05). PARC, AR No EPID 132±63 y EPID subclínica 277±187 (p<0,05). Proteína D surfactante, AR no EPID 11,9±7,9 y AR EPID subclínica 20,6±12 (p<0,05)- Cohorte ACR: MMP-7, AR no EPID 4,8±2 y AR EPID subclínica 10,0±5,4 (p<0,05). PARC, AR no EPID 129±49 y AR EPID subclínica 217±141 (p<0,05). Proteína D surfactante, AR no EPID 7,1±3,1 y AR EPID subclínica 18,4±13,7 (p<0,05) |
| Tishler (1986)30Transversal | LBA: porcentaje mayor de linfocitos 30,7±8,3% en grupo con alteraciones Rx comparado con 7,2±1,7% grupo Rx normal (p<0,001)PFR dentro de límites normales en ambos grupos |
| Gilligan (1990)38Transversal | - LBA: 11 pacientes con EPID establecida tenían incremento de neutrófilos, colagenasa (p<0,01) y procolágeno N-terminal tipo III (p<0,02). De los pacientes con EPID subclínica, 1 tenía incremento de neutrófilos y 2 de colagenasa |
| Gochuico (2008)8Cohorte | - TCAR seguimiento (media 1,5 años): Progresión de la enfermedad en 57% pacientes con AR-EPID subclínica (7 ya identificados basalmente y 5 de novo)- Las concentraciones de IFN gamma y TGF-β1 en el LBA más altas en sujetos que progresaron comparados con los que no (p=0,04 y p=0,03, respectivamente)- VEF1, CVF, CPT fueron normales en pacientes AR EPID subclínicaDLCO normal en AR EPID subclínica, pero % DLCO fue menor y el gradiente oxígeno alveolar-arterial fue significativamente mayor en sujetos AR EPID subclínica vs. sujetos con AR sin EPID (p=0,01 y p=0,004, respectivamente) |
| Mohd (2009)34Transversal | Clínica: 46/63 (73%) sin síntomas respiratoriosPFR: 60 (95,2%) tenían alteraciones: 42 (66,7%) patrón restrictivo, 12 (19%) características mixtas y 6 (9,5%) patrón obstructivo100% DLCO disminuida. Media en EPID 50,89±13,58% y en no EPID 48,31±10,22%, p=0,393; DLCO/VA en EPID 70,14±12,49% y en no EPID 69,11±13,57%, p=0,758 |
| Zhang (2017)33Transversal | - AR EPID: 59% EPID asintomáticos- Grupo AR EPID: 98% alteración en PFR: 28,3% patrón restrictivo, alteraciones DLCO 91,9%- Grupo AR no EPID: 88,7% alteración en PFR: 4,8% patron restrictivo, alteraciones DLCO 75,8%. --Frecuencia significativamente mayor en AR EPID vs. AR no EPID de alteraciones restrictivas y en difusión |
| Mori (2011)35Transversal | En pacientes con EPID, la mediana del % de los valores pronosticados para DLCO y DLCO/VA estuvo disminuida de forma significativa. AR no EPID: DLCO 103% (91,5, 116,5); AR EPID, DLCO 82,3% (72,6, 97,0); p<0,001. AR No EPID DLCO/VA, 82,3% (72,6, 93,7); AR EPID DLCO/VA 71,8% (57,4, 80,6); p<0,01 |
| Yilmazer (2016)36Transversal | Valores VEF1, DLCO y CPT en pacientes con TCAR normal versus TACAR anormal (VEF1% predicho 92±22,7 y 80,8±20,2 p=0,017; DLCO% predicho 79,5±25,3 y 66±241 p=0,016; TLC% predicho 87,3±14,8 y 78,2±18,2, p=0,043, respectivamente)Los valores DLCO <75% (OR=4,29, p=0,01) y los síntomas respiratorios (tos y/o disnea) (OR=5,51, p=0,02) contribuyen al daño pulmonar tras ajustar por género, positividad de FR y VEF1% |
| Leonel (2012)37Transversal | Pacientes con PFR alteradas: 12Pacientes con alteraciones en TCAR: 20Análisis curvas ROC mostró que el punto de corte de FEV1 en 81,7% tiene mejor balance sensibilidad (59%) - especificidad (83%) para detectar alteraciones en TCAR |
| Cogliati (2014)16Transversal | Ecografía pulmonar-Sensibilidad 92% (IC 95% 78-100)-Especificidad 56% (IC 95% 38-75)-Punto de corte de 17 líneas B en la ecografía: sensibilidad 92% (IC 95%78-100) y especificidad 72% (IC 95% 54-90) |
| Moazedi-Fuerst (2014)17Transversal | PFR normales en todos los casosEcografía:-Sensibilidad 97,1%-Especificidad 97,3%-VPP 94,3%, VPN 98,6% (p<0,001) |
| Moazedi-Fuerst (2015)20Transversal | Los patrones de ecografía patológicos fueron más frecuentes en el grupo EPID que en el grupo sin EPID (líneas B: 100% vs. 12%, p<0,001; nódulos subpleurales: 55% vs. 17%, p=0,006; engrosamiento pleural: 95% vs. 12,5%, p<0,001)Los nódulos subpleurales estaban presentes en el 100% de pacientes con AR |
| Hassan (1995)25Transversal | 1 paciente mostró signos de EPID (vidrio esmerilado) |
| Gabbay (1997)6Transversal | Grupo AR EPID subclínica: Alteraciones en PFR 4, (DLCO <75%) en TCAR 7, y una alveolitis en LBA en 10, 11 tuvieron alteración en 1 prueba, 4 en 2 pruebas y 1 en 3 pruebasAlteraciones en DLCO significativamente mayores en grupo AR EPID clínicamente significativa, DLCO 69%±5,7, AR EPID subclínica 87%±3,7, AR no EPID 86%±3,5 p<0,05FVC EPIC clínica 91%±8,1; EPID subclínica 111%±3,8; no EPID 113%±4,2; p<0,05) |
| Dawson (2001)27Transversal | Rx resultó muy poco sensible para el diagnóstico de EPIDEn el análisis univariante, la presencia de crepitantes bibasales (p<0,0001) VEF1/CVF (p=0,03) y DLCO (p=0,009) (OR 0,0875, IC 95% 0,0332-0,2301) se asociaron con alveolitis fibrosante en TCAR |
| Raniga (2006)31Transversal | 6/30 (20%) tenían síntomas respiratorios, 3/30 (10%) exploración física sugestiva, 8/30 (26,6%) tenían alteraciones espirométricas, 4/30 (13,3%) alteraciones Rx- 2/30 (6,66%) EPID en TCAR en ausencia de cambios clínicos, espirométricos o en Rx de tórax- 3/30 (10%) EPID en TCAR sin cambios clínicos o radiográficos- 6/30 (20%) EPID en TCAR sin hallazgos clínicos |
| Zayeni (2016)32Transversal | Rx tórax: 1/44 (2,9%) hallazgos anormalesTCAR: fibrosis 19 (44%)Pacientes asintomáticos: 15 (71,4%) TCAR alterado y 7 (33,3%) PFR anormalesNo relación entre síntomas respiratorios y hallazgos TCARSí relación entre PFR y síntomas respiratorios (p=0,659 y 0,016, respectivamente)No había relación entre el examen clínico respiratorio y hallazgos de TCAR (p=0,578). PFR sí tenían relación con el examen físico (p=0,009) |
| Affara (2014)21Transversal | 46% (23/50) diagnosticados de EPID subclínica |
| Chen (2013)23Transversal | - 63/103 (61%) EPID según TCAR y PFR- 57/63 (90%) EPID subclínica- VEF1, CVF, DLCO disminuidos en pacientes con EPID, correlacionado con TCAR- PFR AR EPID (47) y AR No EPID (36): VEF1 74,1±14,6 y 88±12,9 (p<0,001), respectivamente; CVF 74,9±12,2 y 86,9±11,3 (p<0,001), respectivamente, y DLCO 68,1±19,5 y 96,2±17,7 (p<0,001, respectivamente) CPT 87,7±15,7 y 98,4±11,3 (p=0,001) |
Ac: anticuerpo; Anti-CFFHP: anticuerpos antipéptido homocitrulinado fibrina quimérica/filagrina; Anti-FCS: anticuerpos antisuero fetal bovino; Anti-Fib: anticuerpos antifibrinógeno; AR: artritis reumatoide; AUC: área bajo la curva; CA125: antígeno de carbohidrato-125; CA19-9: antígeno de carbohidrato 19-9; CA15-3: antígeno de carbohidrato 15-3; CEA: antígeno carcinoembrionario; CPT: capacidad pulmonar total; CV: capacidad vital; CVF: capacidad vital forzada; DLCO: capacidad de difusión del monóxido de carbono (en inglés: diffusing capacity for carbon monoxide); DLCO/VA: DLCO corregida por volumen alveolar; EPID: enfermedad pulmonar intersticial difusa; FEV1: volumen espiratorio forzado en el primer segundo; IFN: interferón; IL: interleucina; IP-10: proteína 10 inducida por interferón gamma; LBA: lavado broncoalveolar; MMP-7: metaloproteinasa de matriz 7; PFR: pruebas de función respiratoria; Rx: radiografía; TCAR: tomografía computarizada alta resolución; TGF-β1: factor de crecimiento transformador beta 1; VPP: valor predictivo positivo; VPN: valor predictivo negativo.
Se incluyeron un total de 2.593 pacientes con AR sin un diagnóstico conocido de EPID. La población incluida fue en su mayoría mujeres (70%), con una edad media de 46-68 años y una duración media de la enfermedad entre 1 y 12 años.
La mayoría de los estudios incluidos tenían un diseño transversal, con excepción del estudio de Gochuico et al.8, que se trata de una cohorte prospectiva. Tras la evaluación de la calidad, 2 estudios resultaron de alta calidad16,17, 12 de calidad media6,8,18–27 y 11 de calidad baja28–38.
Con excepción de 2 estudios30,38, la herramienta más frecuentemente utilizada para el cribado de EPID fue la TCAR pulmonar. Algunos estudios utilizaron también otras herramientas como la auscultación electrónica, los marcadores bioquímicos, el lavado broncoalveolar (LBA), las pruebas de función respiratoria (PFR) o la ecografía pulmonar, según se detalla a continuación.
Auscultación electrónicaLos estudios de Pancaldi et al.19 y Manfredi et al.24 comparan el uso de un estetoscopio electrónico para detectar de forma automática crepitantes pulmonares tipo velcro con los hallazgos de una TCAR. Se realizó un análisis del audio digital recogido mediante un algoritmo (VECTOR) que clasificó los hallazgos de forma binaria. La población diana estaba comprendida por pacientes diagnosticados de AR a los que se les realizó TCAR por síntomas respiratorios, crepitantes en velcro, función pulmonar patológica o estudio de nódulos pulmonares. La auscultación electrónica alcanzó una precisión diagnóstica del 84-90%, una especificidad del 77-88%, una sensibilidad del 93%, valor predictivo positivo (VPP) 75-83% y valor predictivo negativo (VPN) 94-95% para la detección de EPID, siendo la precisión obtenida por la auscultación por un reumatólogo del 67,2%.
Marcadores bioquímicosEn el estudio de Abdel-Wahab et al. se establece una asociación significativa entre los niveles séricos de interleucina 33 (IL-33) y la presencia de EPID en pacientes con AR18. Castellanos-Moreira et al.28 valoraron la presencia de autoanticuerpos frente a 3 antígenos carbamilados: el suero fetal bovino (FCS), fibrinógeno (Fib) y péptido homocitrulinado fibrina quimérico/filagrina (CFFHP) en pacientes con AR. A los pacientes incluidos sin diagnóstico previo de EPID se les realizó un cribado con TCAR. Se evidenció que todos los anticuerpos anti-proteína carbamilada estudiados fueron más frecuentes y con títulos medios más altos en el grupo EPID. Además, se realizó una regresión logística ajustada por edad, duración de la AR, anticuerpos antipéptidos citrulinados cíclicos (anti-CCP), factor reumatoide (FR), sexo y dosis acumulada de tabaco, que mostró que anti-FCS, anti-CFFHP y anti-FCS-IgA estaban independientemente asociados con EPID. Otro estudio22 que evaluó diferentes biomarcadores séricos en una cohorte china (con posterior confirmación en una cohorte estadounidense) evidenció una asociación entre los niveles de metaloproteinasas de la matriz extracelular 7 (MMP-7) y proteína-10 inducida por IFNγ (IP-10) y la presencia de EPID (diagnosticada por TCAR) en pacientes con AR. Este hallazgo se confirmó tanto en pacientes con EPID clínica como en aquellos con EPID subclínica. Los niveles de los biomarcadores se relacionaron con la gravedad de la EPID. El área bajo la curva ROC (Receiver Operating Characteristic curve) de estos marcadores para el diagnóstico de EPID alcanzó valores entre 0,68 y 0,86. En un estudio26 con menor número de pacientes con AR a los que se les realizó TCAR pulmonar, se determinaron analíticamente niveles más altos de CA15-3 y CA125 en pacientes con EPID que en aquellos sin EPID. Por último, en el estudio de Doyle et al.29 se evidenció un aumento significativo de MMP-7, PARC y proteína D del surfactante en pacientes con EPID subclínica en dos cohortes distintas.
Lavado broncoalveolarLa búsqueda recuperó 2 estudios realizados a finales de la década de los 8030,38 en los que se utilizó el LBA para cribado de EPID en pacientes con AR. El diagnóstico de EPID se estableció mediante radiología simple de tórax y a los pacientes se les realizó LBA para análisis celular y bioquímico. El estudio de Tishler et al.30 evidenció que los pacientes con alteraciones radiológicas tenían un mayor porcentaje de linfocitos en el LBA que los pacientes con radiografía normal. Gilligan et al.38 detectaron EPID subclínica en un 15% de los pacientes mediante la realización de radiografía de tórax y PFR. En el LBA de los pacientes con EPID establecida se objetivó una diferencia significativa en la proporción de neutrófilos frente a los controles, así como un incremento de colagenasa y procolágeno N terminal tipo III. Gochuico et al.8 compararon los hallazgos en el LBA entre pacientes con AR y fibrosis pulmonar confirmada por biopsia, AR y EPID subclínica diagnosticada por TCAR y pacientes con AR sin patología pulmonar. Las concentraciones de factor de crecimiento derivado de plaquetas (PDGF)-AB y PDGF-BB fueron mayores en pacientes con EPID frente a aquellos con AR sin EPID. Además, se detectaron concentraciones significativamente mayores de interferón gamma y factor de crecimiento transformador beta 1 (TFG-β1) en pacientes con EPID que presentaron progresión del daño pulmonar frente a los que no.
Pruebas de función respiratoriaLas PFR se han evaluado en varios estudios para el diagnóstico de EPID. El estudio de Mohd Noor et al.34 estimó que existen alteraciones en PFR en el 95% de los pacientes con AR de más de 5 años de evolución, el 66,6% de ellos con patrón restrictivo. Zhang et al.33 observaron que los pacientes con EPID tenían significativamente más alteraciones en las PFR consistentes en un patrón restrictivo y disminución de la difusión. Mori et al.35 encontraron que los pacientes con EPID tenían valores de DLCO y DLCO/VA (DLCO corregida por volumen alveolar) significativamente menores que los pacientes sin EPID. Wang et al.26 propusieron un punto de corte de DLCO inferior al 52,95% para la detección de EPID confirmada por TCAR. Este método de cribado a través de la DLCO alcanzó una sensibilidad del 100% y una especificidad del 61%. Yilmazer et al.36 encontraron una asociación significativa entre los valores de DLCO <75% y los síntomas respiratorios con la presencia de EPID en el análisis multivariable. En el estudio de Leonel et al.37, las PFR resultaron estadísticamente significativas como predictoras de alteraciones en la TCAR en pacientes con AR. Manfredi et al.24 estudiaron la precisión de las PFR para el diagnóstico de EPID con puntos de corte de la CVF inferiores al 70% y DLCO menores del 47%. Reportaron una precisión del 52,8 y 54,9%, una sensibilidad del 20 y 30,8% y una especificidad del 82,1 y 80%, respectivamente.
Ecografía pulmonarLa utilidad de la ecografía pulmonar transtorácica en el cribado de EPID se evalúo en 3 estudios16,17,20. Cogliati et al.16 evaluaron la presencia de líneas B en 72 segmentos pulmonares (28 anteriores y 44 posteriores) siguiendo las líneas anatómicas. Se consideró diagnóstico de EPID la presencia de más de 10 líneas B en un mismo segmento. En este estudio, la sensibilidad de la ecografía con respecto a la TCAR fue del 92% y la especificidad del 56% en una población de pacientes con AR y sospecha de EPID. El grupo de Moazedi-Fuerst et al.17,20, además de las líneas B (patológico si más de dos líneas), tuvo en cuenta el engrosamiento pleural (patológico si más de 3mm) y la presencia de nódulos subpleurales (patológico si al menos un nódulo). Se estimó que la ecografía tenía una sensibilidad del 92-97%, una especificidad del 56-97%, VPP del 94% y VPN del 99% para el diagnóstico de EPID confirmada por TCAR en pacientes con AR consecutivos sin sintomatología respiratoria17,20.
Tomografía computarizada de alta resoluciónLa TCAR fue la técnica más sensible para el diagnóstico de EPID frente a radiografía de tórax o PFR en varios estudios, aunque no se ha podido establecer una relación entre los hallazgos en la TCAR y los síntomas respiratorios31,32. En la serie de Hassan et al.25 se detectó con la TCAR un 5% de EPID en pacientes con AR asintomáticos desde el punto de vista respiratorio. En el estudio de Gabbay et al.6 un 33% de los pacientes con AR de menos de 2 años de evolución tenían EPID en la TCAR, clínicamente no significativa en 3 de cada 4 pacientes. En el trabajo de Gochuico et al.8, un 33% de los pacientes tenían EPID subclínica, en el momento de inclusión en el estudio. Tras una media de seguimiento de 1,5 años, se objetivó que el 57% de estos pacientes habían tenido progresión del daño pulmonar evaluada por TCAR.
Combinación de varias pruebasLa combinación de TCAR y PFR detectó EPID subclínica en el 17-55% de pacientes con AR en los diferentes estudios6,8,21,23,27,33. Gabbay et al.6 evidenciaron que un 58% de los pacientes con AR de menos de 2 años de evolución tenían alguna alteración sugestiva de EPID en las pruebas realizadas (TCAR, radiografía de tórax, PFR, LBA, gammagrafía). Un 44% tenía EPID subclínica (alteraciones en TCAR, PFR y LBA de carácter leve).
Los estudios de Gabbay et al.6 y Dawson et al.27 concluyeron que la radiología simple es una técnica poco sensible para el diagnóstico de EPID en AR.
DiscusiónLa EPID es una manifestación extraarticular frecuente en pacientes con AR. Es responsable de un 7-20% de los fallecimientos, lo que la coloca como la segunda causa de muerte después de la enfermedad cardiovascular39,40. La prevalencia varía dependiendo de la cohorte estudiada y el método utilizado, y se sitúa entre el 5 y 61%. Se cree que entre el 5 y el 55% de los pacientes son asintomáticos6,8,21,23,25,27,33.
La relación temporal entre la afectación articular y la EPID es variable, si bien el diagnóstico de AR suele preceder al diagnóstico de la afectación pulmonar. Se han descrito varios factores de riesgo en pacientes con AR para el desarrollo de EPID. Las principales asociaciones se han encontrado con la edad avanzada, sexo masculino, historia de tabaquismo y la presencia de FR y anticuerpos anti-CCP2. La importancia del cribado de EPID en pacientes con AR radica en la morbimortalidad que conlleva. Por otro lado, la presencia de EPID condiciona los tratamientos para el control de la actividad articular y progresión del daño radiológico.
Los estudios incluidos en esta revisión evaluaron el uso de diferentes técnicas diagnósticas para cribado de EPID en pacientes con AR.
Una de las técnicas de aparición más reciente es la auscultación electrónica. Teniendo en cuenta que la auscultación pulmonar, junto con una anamnesis específica, es la herramienta clínica más útil para establecer una sospecha de EPID, el estudio INSPIRATE19,24 exploró la utilidad de un estetoscopio electrónico en la detección de crepitantes tipo velcro. La auscultación electrónica alcanzó una precisión del 84-90% en el diagnóstico de EPID en comparación con la TCAR. Dado que es una técnica no invasiva, estos resultados podrían posicionarla como una herramienta útil en el cribado de EPID.
Respecto al uso de marcadores bioquímicos séricos, se ha observado una relación de la presencia de EPID subclínica en pacientes con AR con marcadores como la IL-3318, MMP-722,29, IP-1022, PARC, proteína D del surfactante29 y los anticuerpos frente a los antígenos carbamilados FCS, Fib y CFFHP28; sin embargo, aún no se han establecido puntos de corte para la posible aplicación de estos marcadores en la práctica clínica. Aparte de como técnica de cribado, el uso de biomarcadores podría tener interés en la evaluación de la progresión y pronóstico de pacientes ya diagnosticados de EPID.
Dos estudios de baja calidad no han podido demostrar la utilidad del LBA en el cribado de EPID30,38. Desde la generalización del uso de la TCAR, el LBA ha caído en desuso para el diagnóstico de EPID y hoy en día se reserva para la exclusión de otras patologías (tumorales, infecciosas…). La utilidad de las PFR en el cribado de EPID se ha evaluado en varios estudios con resultados muy distintos. Las alteraciones más frecuentes fueron la disminución de DLCO y el patrón restrictivo26,33–35. Se ha encontrado una asociación entre la disminución de la DLCO y la presencia de EPID en la TCAR. La sensibilidad de las PFR para el diagnóstico de EPID se situó entre el 59 y 100%, y la especificidad entre el 61 y 83%. La disminución de la DLCO resultó ser la alteración más sensible26,36,37. Dado que se trata de una técnica no invasiva, las PFR resultan útiles como técnica complementaria de cribado.
Se incluyeron 3 estudios sobre el uso de la ecografía pulmonar transtorácica para el cribado de EPID16,17,20. Se encontró una buena asociación entre los hallazgos en la ecografía y en la TCAR, alcanzando la ecografía sensibilidades por encima del 90%16,17. Dado que la ecografía es una técnica de rápida realización, no invasiva, con menor coste que la TCAR y que evita someter al paciente a radiación adicional, puede ser considerada como una herramienta clave en el cribado de EPID durante el seguimiento de los pacientes con AR41. Sin embargo, la necesidad de una formación especializada puede limitar su accesibilidad.
La TCAR pulmonar resultó ser la técnica más sensible para la detección precoz en pacientes asintomáticos31,32. Se considera actualmente la prueba gold standard para el diagnóstico y clasificación del tipo de EPID en pacientes con AR y es el patrón oro utilizado en la mayoría de los estudios de validez de otras técnicas. Un único estudio llevó a cabo un seguimiento prospectivo en pacientes con EPID diagnosticada por TCAR8. Se evidenció progresión radiológica en un 57% de pacientes con EPID tras un seguimiento medio de año y medio.
Una de las limitaciones de esta revisión deriva de que la mayoría de los estudios incluidos no estaban diseñados específicamente para el cribado de EPID y la calidad metodológica fue generalmente baja. Además, las poblaciones incluidas eran muy heterogéneas, ya que incluían en las mismas cohortes pacientes asintomáticos desde el punto de vista respiratorio y pacientes muy sintomáticos. Esta heterogeneidad tanto en las poblaciones incluidas como en la metodología de los estudios no permitió hacer un metaanálisis.
En conclusión, la EPID es una manifestación frecuente en pacientes con AR. Dada la gran morbimortalidad que asocia, es importante disponer de técnicas que permitan su detección precoz. En nuestra revisión la TCAR ha demostrado ser la técnica más sensible y la radiología simple la que menor sensibilidad ofrece. En las PFR la disminución de la DLCO ha sido el parámetro más sensible para detección de EPID. Otros métodos como la auscultación electrónica, los biomarcadores y la ecografía pulmonar podrían posicionarse como métodos emergentes para el cribado de EPID, pero se necesitan más estudios para conocer su valor real en poblaciones de pacientes con AR más amplias y no seleccionadas.
FinanciaciónEsta revisión ha sido financiada por la Sociedad Española de Reumatología.
Conflicto de interesesLos autores declaran no tener conflictos de interés.