Los aminobisfosfonatos son fármacos que han sido utilizados con éxito en el tratamiento de la osteoporosis desde hace más de 20 años. Aunque en los estudios principales realizados para obtener la aprobación de su comercialización no se registraron efectos adversos relevantes, en los últimos años, y como resultado de la farmacovigilancia, se ha comunicado de manera irregular una serie de complicaciones, algunas potencialmente graves, que han puesto en duda la seguridad de estos fármacos, sobre todo en dosis elevadas como las que se utilizan en oncología y en tratamientos de larga duración, como los que se emplean en la osteoporosis. En la presente revisión, basada en el análisis de las pruebas científicas más relevantes procedentes de los ensayos clínicos, series de casos, estudios de cohortes y bases de datos publicados hasta el momento, se resumen las características clínicas y epidemiológicas de los efectos adversos de los bisfosfonatos.
Aminobisphosphonates are drugs that have been used successfully in the treatment of osteoporosis for more than 20 years. Although main registry studies found a scarcity of relevant adverse events, in recent years and as a result of pharmacovigilance, different complications have been reported, some potentially serious. This has raised questions on the safety of these drugs, especially in high doses, like those used in oncology and long-term treatment, as needed in patients with osteoporosis. In this review, based on the analysis of relevant scientific evidence from clinical trials, case series, cohort studies and databases published to date, we summarize the clinical and epidemiological characteristics of the adverse effects of these drugs.
Los bisfosfonatos (BF) son fármacos inhibidores de la resorción ósea cuya estructura química es relativamente simple, ya que está formada por dos moléculas de fosfato unidas a un átomo de carbono. Son análogos sintéticos de los pirofosfatos inorgánicos pero, a diferencia de éstos, cuyo átomo central es el oxígeno, aquellos disponen de un átomo puente de carbono que les proporciona resistencia a la hidrólisis enzimática digestiva. Además, los dos radicales del carbono que no están unidos a los fosfatos van a poder ligar cadenas de estructura variable, que están directamente relacionadas con la afinidad por el tejido óseo y la actividad antirresortiva de cada molécula1,2. La adición de un grupo amino a una de las cadenas ha permitido la síntesis de BP más potentes, que pueden utilizarse por vía oral en administración semanal o mensual (alendronato, risedronato e ibandronato) o por vía intravenosa (pamidronato, ibandronato y zoledronato).
Su uso en la osteoporosis se incrementó notablemente a partir de 1995, cuando fue aprobado el alendronato, primer aminobisfosfonato (ABF) activo por vía oral, aunque en realidad han sido utilizados en clínica desde hace más de 40 años. En el momento actual, son los fármacos de referencia en el tratamiento de la osteoporosis y enfermedad de Paget, y se están empezando a utilizar ampliamente en oncología. La generalización de su uso ha tenido un papel positivo sobre la salud global, ya que los BF, actuando de manera conjunta con otras medidas no farmacológicas, han sido incluidos entre las causas potenciales del descenso progresivo en la incidencia de fracturas de cadera que ha comenzado a detectarse desde los años finales del siglo pasado3,4.
A pesar de que los BF han mostrado un perfil de seguridad notable en los ensayos clínicos principales, realizados para la aprobación de su comercialización, en los últimos años han aparecido diferentes complicaciones, observadas en la práctica clínica, que han generado incertidumbre acerca de la seguridad de estos fármacos y que justifican plenamente la presente revisión.
Mecanismo de acción de los bifosfonatosLos ABF, los más utilizados en clínica en el momento actual, tienen una extraordinaria avidez por los cationes divalentes como el Ca++, lo que provoca que sean rápidamente captados, desde el torrente circulatorio, por las superficies mineralizadas sometidas a resorción por los osteoclastos5. Estas células, que son la diana principal de su acción farmacológica, internalizan el fármaco por endocitosis y experimentan la inhibición de una enzima de la vía del mevalonato, la farnesil pirofosfato sintetasa, necesaria para la formación de isoprenoides. Estos compuestos lipídicos son necesarios para la modificación postranslacional de una serie de proteínas, entre ellas las guanosín trifosfatasas, cuya acción sobre el tráfico de vesículas y la formación del ribete en cepillo osteoclástico queda interrumpida. De manera adicional a la interrupción de la vía metabólica citada, se produce el acúmulo de algunos precursores, sobre todo de isopentenil pirofosfato, un producto con capacidad de activar una subclase de linfocitos T, los denominados gamma-delta (γδ), que realizan acciones inmunorreguladoras de interés en oncología.
Los osteoclastos que han «ingerido» el BF situado en la superficie mineralizada sufren una pérdida de su función resortiva, con lo que, en enfermedades como la osteoporosis posmenopáusica, que se caracterizan por un balance de remodelado alterado en el que predomina la resorción, se va a producir un equilibrio que alcanza valores similares a los habituales en mujeres premenopáusicas. Aun no se conoce con suficiente claridad cuál es el destino de los osteoclastos «atacados» por los BF. Recientemente se ha observado que el número de estas células no disminuye, contrariamente a lo que se suponía anteriormente, y que su tamaño aumenta6. El significado de estos hallazgos no se conoce; no obstante, estos osteoclastos gigantes tienen su capacidad funcional seriamente afectada y son incapaces de ejercer su acción fisiológica.
Efectos adversos (tabla 1)Efectos adversos gastroesofágicosPoco después de la introducción de los BF orales en el tratamiento de la osteoporosis, se observaron efectos adversos asociados a la irritación de la mucosa gastroesofágica, tales como náuseas, vómitos y dispepsia. La aparición de varios casos de esofagitis y erosiones esofágicas en los estudios de farmacovigilancia7 indujo la generalización de medidas preventivas para reducir el riesgo de estas complicaciones (tomar el fármaco con un vaso de 180-240ml de agua en posición erguida evitando acostarse hasta que hayan transcurrido 30min y se haya ingerido el desayuno), con lo que su incidencia disminuyó drásticamente8. En el momento actual, tras 15 años desde la comercialización del alendronato y después de la introducción de otros ABF en la práctica clínica, las pruebas científicas acumuladas indican que el riesgo de efectos adversos digestivos es bajo, habiéndose observado un ligero incremento del riesgo de úlcera gastroduodenal (odds ratio=1,45, IC del 95%: 1,31-1,61) y de eventos esofágicos (odds ratio=1,86, IC del 95%, 1,49-2,32) en pacientes sin patología gastroesofágica previa y que no hay diferencias significativas entre los diferentes productos comercializados9–11.
Clasificación de los efectos adversos de los bisfosfonatos.
| 1. Efectos adversos extraóseos |
| Gastroesofágicos |
| Oculares |
| Renales |
| Hipocalcemia |
| Respuesta de fase aguda |
| Fibrilación auricular |
| Gestación y lactancia |
| Miscelánea |
| 2. Efectos adversos óseos |
| Dolor músculo-esquelético |
| Sobresupresión del remodelado |
| Fracturas atípicas |
| Osteonecrosis de los maxilares |
En 2009, la FDA comunicó una serie de 23 casos de cáncer esofágico en pacientes tratados con alendronato12. Un análisis del registro nacional danés demostró sorprendentemente una incidencia inferior a la de la población control13. Solomon14 confirmó estos resultados, al observar una tasa de cáncer esofágico de 0,27/1.000 beneficiarios de Medicare que seguían tratamiento con BP, frente a una tasa de 0,48/1.000 pacientes tratados con otros fármacos antiosteoporóticos. Estos hallazgos fueron sorprendentes ya que el perfil de efectos irritativos en la mucosa esofágica de los BF podría ser un factor que incrementara el riesgo, en lugar de reducirlo. En el momento actual, se sospecha la existencia de sesgos de selección, que podrían influir en un determinado sentido según la metodología empleada. Por un lado, los pacientes con historial de dispepsia o reflujo tendrían menos probabilidades de utilizar un BF y, al contrario, los que lo utilizan tendrían más probabilidades de realizar una endoscopia, lo que incrementaría la tasa de diagnósticos de cáncer. No obstante, y en espera de estudios más concluyentes, en pacientes con patología gastroesofágica previa es aconsejable tener precauciones, ya que en los ensayos clínicos realizados fueron excluidos.
Sobre la base de las consideraciones anteriores, podemos concluir que la presencia de antecedentes de hemorragia digestiva alta reciente, historia documentada de úlcera péptica activa o esófago de Barret constituye una contraindicación para el uso de BF por vía oral. Además, las enfermedades de la motilidad esofágica (estenosis, acalasia y esclerodermia), varices gástricas o esofágicas o enfermedad por reflujo gastroesofágico deberán considerarse contraindicaciones relativas y valorarse otras alternativas terapéuticas. Por último, si un paciente desarrolla dispepsia relacionada con el BF, se aconseja la vía intravenosa o el cambio de molécula, ya que no es aconsejable la utilización de inhibidores de la bomba de protones de forma prolongada porque incrementan el riesgo de fracturas15.
Efectos adversos ocularesLa conjuntivitis es el efecto adverso ocular más frecuente, aunque su incidencia real es muy baja16,17. En general, responde rápidamente a tratamiento tópico, incluso si mantenemos el fármaco, aunque es más prudente suspenderlo, al menos de forma temporal. Es probable que algunos casos de conjuntivitis inespecífica tengan relación indirecta con los BF que contienen la mayor parte de los jabones, tras su contacto al realizar el aseo personal. En cualquier caso, la conjuntivitis es de intensidad leve y generalmente autolimitada, incluso sin tratamiento.
Otra complicación, menos frecuente pero potencialmente más grave, es la uveítis18–27. Su incidencia es muy baja, entre 2 y 5 casos cada 10.000 pacientes tratados. En general, su localización es anterior, aunque hay descrito algún caso aislado de uveítis posterior. Su aparición es muy variable, con una mediana de días tras el inicio del fármaco de 70 días (entre 1 y 146) y su incidencia es mayor en pacientes tratados con ABF intravenosos. De patogenia desconocida, se ha relacionado con la respuesta de fase aguda provocada por liberación de IL-6 por los linfocitos T γδ activados. También se ha observado un aumento en la predisposición a sufrir uveítis en pacientes con enfermedades asociadas, como las espondiloartropatías, el síndrome de Behçet, la granulomatosis de Wegener o la sarcoidosis y/o que sigan tratamiento con determinados fármacos, en los que el BP actuaría de factor precipitante.
A lo largo de los últimos 17 años, desde la publicación del primer caso de iritis28, se ha comunicado en forma de casos clínicos aislados una gran diversidad de problemas oculares diferentes de la conjuntivitis y uveítis, relacionados con los BF: edema periorbital29, desprendimiento de retina30, miastenia ocular transitoria31, neuritis óptica32, etc. En algunas ocasiones, la asociación no está bien demostrada y podría ser un problema intercurrente y sin relación con el fármaco. En cualquier caso, el clínico debe actuar con precaución ante cualquier problema ocular que se produzca durante el tratamiento con BF.
Toxicidad renalLa toxicidad renal es infrecuente en pacientes con osteoporosis tratados con BF orales y los casos publicados son anecdóticos33. Sin embargo, no podemos asegurar lo mismo cuando se utilizan en pacientes con insuficiencia renal, ya que en los ensayos clínicos realizados este proceso era uno de los motivos de exclusión. La FDA recomienda utilizarlos con precaución en pacientes con aclaramiento de creatinina inferior a 30ml/min y no disponemos de directrices de uso de BF en pacientes con enfermedad renal crónica preexistente.
La mayoría de los casos de toxicidad renal publicados se observaron con el uso de BF intravenosos34–36. Los patrones más comúnmente descritos fueron la necrosis tubular aguda y la glomeruloesclerosis segmentaria y focal. Su incidencia real no se conoce, aunque existen varios factores que incrementan el riesgo de toxicidad37: nefropatía crónica preexistente, diabetes mellitus, hipertensión arterial, mieloma múltiple, hipercalcemia, quimioterapia y tratamiento previo con un BF38. En presencia de alguno de estos procesos, el BF intravenoso deberá usarse con precaución, e incluso debería estar contraindicado en determinados casos. Además, hay que tener en cuenta otros factores potenciadores de riesgo renal, como la dosis total acumulada, la velocidad de infusión y el intervalo entre dosis.
Teniendo en cuenta que los BF se utilizan con frecuencia en personas de edad avanzada, en los que la incidencia de compromiso grave de la función renal es relativamente frecuente (hasta un 54% en pacientes osteoporóticas mayores de 80 años), es aconsejable realizar controles de función renal antes y durante el tratamiento con BF orales39. Además, se deberán extremar las precauciones en pacientes sometidos a tratamiento por vía intravenosa.
HipocalcemiaLos ABF son potentes inhibidores de la resorción ósea y, como consecuencia de ello, pueden provocar un descenso de los niveles circulantes de calcio, sobre todo si se alcanzan concentraciones altas de manera brusca, como ocurre con su administración intravenosa. La incidencia de hipocalcemia sintomática es frecuente en los pacientes tratados con zoledronato intravenoso40, sobre todo en dosis e indicaciones oncológicas41, incluso si se realiza una adecuada administración profiláctica de calcio y vitamina D. Este efecto adverso es más frecuente en pacientes con factores de riesgo, como hipoparatiroidismo previo, deficiencia de vitamina D e insuficiencia renal. En estos pacientes se deberán extremar las precauciones y los controles postinfusión. En pacientes que siguen tratamiento con BF orales, la hipocalcemia es rara y se puede observar semanas después del inicio de la terapia42–44. Dado que, como mecanismo compensador, se produce un aumento de la secreción de PTH, que podría disminuir los efectos del BF sobre el hueso, se debe asegurar un adecuado consumo de calcio y normalizar los niveles o corregir el déficit de vitamina D, en todos los pacientes, antes y durante el tratamiento.
Respuesta de fase agudaLa respuesta de fase aguda (RFA), una reacción conocida desde hace más de 20 años45, se produce en algunos pacientes que inician tratamiento con ABF46. Clínicamente se caracteriza por un cuadro agudo y transitorio de fiebre y mialgias, que dura entre 1 y 3 días (ocasionalmente hasta 7-14 días), responde al paracetamol y cura sin secuelas. Es relativamente frecuente tras la primera infusión de los preparados intravenosos (incidencia variable, estimada entre el 10 y el 30%), disminuyendo drásticamente su producción en las infusiones sucesivas. De manera excepcional, también se ha descrito con ABF orales en dosis semanales o mensuales, pero nunca se produce en pacientes tratados con BF no aminados (etidronato, clodronato y tiludronato).
El mecanismo de la RFA ha sido parcialmente aclarado y parece relacionado con la liberación de factor de necrosis tumoral alfa e IL-6. Sin embargo, aún no se conoce el tipo de células efectoras que liberan estas citocinas y el proceso basal que provoca esta respuesta. Es conocido que las células T γδ participan de manera primordial en la inmunidad innata, desempeñando un papel destacado en la activación de células dendríticas y en su capacidad para la presentación de antígenos47. También pueden ser activadas por antígenos no peptídicos48, entre ellos, por fosfoantígenos naturales o extraños y también por el acúmulo de metabolitos intermedios de la vía del mevalonato49, sobre todo isopentenil pirofosfato (IPP). Los BF, actuando sobre esta vía y a través de la inhibición de la farnesil pirofosfato sintetasa, inducen una producción elevada de IPP, que es un potente activador de las células T γδ. Tras la activación de esta subclase de linfocitos T, las células dendríticas maduran, con lo que aumenta su actividad migratoria, se produce sobrerregulación de sus receptores de quimiocinas y se desencadena, finalmente, una respuesta inmunitaria Th150. Esta acción, específica de los ABF, ha sido contrarrestada por inhibidores de la HMG-Co A reductasa, mediante experimentos in vitro51,52, aunque la atorvastatina no redujo su incidencia en un estudio efectuado en niños tratados con ABF intravenosos53. Recientemente, en una pequeña muestra de pacientes tratados con zoledronato intravenoso54, se observó una relación inversa entre frecuencia de la RFA y niveles de 25-OH vitamina D3, cuyo alcance patogénico y práctico no se conoce, pero que deberá ser investigado en series más amplias.
Fibrilación auricularLa primera observación de este sorprendente efecto adverso se produjo al analizar los resultados del ensayo clínico principal de zoledronato, en administración por vía intravenosa anual para el tratamiento de la osteoporosis, el estudio HORIZON55. Los pacientes que recibían el fármaco activo mostraban una incidencia de fibrilación auricular (FA) definida como «grave» (episodio que provocara ingreso hospitalario o morbilidad significativa) superior a los del grupo placebo (riesgo absoluto: 1,3% frente al 0,5%; p<0,001), aunque la incidencia global no fue diferente entre ambos grupos. Al observarse este hallazgo, se pusieron en marcha varios estudios para tratar de aclarar su importancia. En un análisis retrospectivo56 del ensayo clínico principal de alendronato (Fractures Intervention Trial) se observó un incremento estadísticamente no significativo de la incidencia de FA «grave» en el grupo tratado con alendronato (RR=1,51, con un IC del 95% de 0,97 a 2,40).
En un estudio observacional realizado en Dinamarca57, en el que se incluyó una muestra de unos 13.000 pacientes con FA y más de 60.000 controles, los autores no observaron incremento significativo del riesgo de FA relacionado con BF orales (concretamente etidronato y alendronato), mientras que en un estudio de casos y controles58, con una muestra más reducida, realizado en Estados Unidos y centrado únicamente en alendronato, sí hubo diferencias, cuantificadas en una incidencia del 6,5% en pacientes tratados con alendronato oral frente a un 4,1% en el grupo control, lo que adjudicaba un riesgo relativo expresado como odds ratio de 1,86 (1,09-3,15). Una posible explicación a los acontecimientos del HORIZON era que la FA se produjera por la liberación de citocinas proinflamatorias (de forma similar a los cuadros seudogripales) o por hipocalcemias transitorias, tras la infusión. Sin embargo, un análisis posterior de los hechos mostró que la mayoría de los casos de FA ocurrió varios meses después de la infusión y los ECG realizados a 559 pacientes antes y 11 días después no mostraron diferencias entre los grupos59. En el momento actual y en espera de datos más completos, la FDA se ha pronunciado y ha considerado que el riesgo de FA con BF es muy bajo, si es que existe, y que los beneficios del tratamiento superarían claramente a los riesgos60. Dado que la incidencia global de episodios no difiere de la ocurrida en el grupo placebo y que solamente se han observado diferencias en la aparición de episodios graves, se sospecha que los BF no desencadenan FA sino que podrían agravar una alteración preexistente. Por ello, se aconseja extremar la vigilancia en pacientes de riesgo y realizar un control del pulso radial antes de prescribir el BF y durante el seguimiento clínico, y si es irregular, realizar un ECG; no es preciso modificar el resto de los patrones de práctica clínica actuales.
Dolor músculo-esqueléticoAunque era un hecho conocido por los clínicos y se habían publicado algunas series61,62, la aparición de este efecto adverso no cobró dimensión relevante hasta enero de 2008, cuando la FDA63 publicó una alerta en la que informaba de la posibilidad de aparición de dolor óseo, articular y/o muscular, ocasionalmente incapacitante, en pacientes tratados con BF. El comienzo del cuadro ocurre de forma muy variable, desde los primeros días del tratamiento hasta meses o incluso años después. La retirada del fármaco suele ser suficiente para el control del dolor, aunque en algunos pacientes la recuperación es lenta y raramente incompleta62. No debe confundirse con la respuesta de fase aguda, en la que, además de artromialgias, se producen otros síntomas seudogripales, como escalofríos y febrícula, que desaparecen por completo en dos o tres días, a pesar del mantenimiento del fármaco.
El dolor músculo-esquelético ha sido descrito con alendronato y risedronato, con una incidencia muy baja, pero desconocida hasta el momento. Es más frecuente con las dosis semanales y mucho más raro con las diarias, lo que sugiere que el tratamiento con dosis bajas diarias inicialmente podría «sensibilizar» al paciente y evitar la aparición de dolor63. No obstante, un reciente estudio realizado por investigadores de la Mayo Clinic64, en el que se incluyó una numerosa cohorte de pacientes, no mostró un incremento significativo de dolor músculo-esquelético relacionado con BF, cuando se tenían en cuenta los numerosos factores de confusión que pueden influir en la aparición de un síntoma tan prevalente en la población diana de estos fármacos.
A pesar de que los datos referidos son confusos, se debe tener precaución ante la aparición de dolor en pacientes tratados con BF. Son múltiples los factores patogénicos que pueden intervenir y que deben ser controlados. Por ejemplo, se han descrito varios casos de sinovitis asociada al uso de BF65,66 y un caso de poliartritis67, confirmadas con la reexposición al fármaco. Además, con frecuencia los pacientes con déficit de vitamina D que son sometidos a tratamiento con BF pueden sufrir una osteomalacia concomitante que cursa con dolor y que puede empeorar si no se trata con dosis suficientes de vitamina D. Por último, la aparición de dolor agudo en muslos podría ser el síntoma inicial de una fractura de estrés de fémur que puede evolucionar a una fractura diafisaria si no se toman medidas adecuadas. Por tanto, la aparición de dolor músculo-esquelético de reciente comienzo en pacientes tratados con BF es un hecho infrecuente pero relevante, que debe ser tenido en cuenta para tomar las medidas diagnósticas y terapéuticas necesarias.
Fracturas atípicas de la diáfisis femoralLos primeros casos fueron publicados en 200568. En este artículo, se presentaba una serie de 9 pacientes no seleccionados que habían sido tratados o continuaban en tratamiento con alendronato, durante un tiempo prolongado. En el estudio histomorfométrico se observó una marcada supresión de la formación ósea en las superficies trabeculares, con un número de osteoblastos muy reducido y una síntesis de la matriz marcadamente reducida, alteración evidenciada por la práctica desaparición de las líneas de doble marcaje con tetraciclinas en todos los pacientes. Las superficies osteoclásticas y las superficies de erosión también estaban muy por debajo de la normalidad. En las superficies endocorticales e intracorticales se observaban hallazgos similares. Este patrón histológico de «recambio óseo severamente suprimido» era similar al observado en la osteopatía adinámica que se produce en algunos pacientes sometidos a hemodiálisis de forma prolongada69.
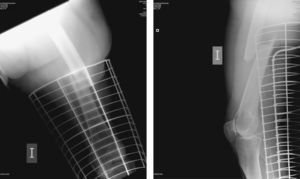
Desde entonces, se han descrito varios casos aislados y series de casos procedentes de estudios retrospectivos70-74, que se caracterizaban por la presencia frecuente de dolor en el muslo previo a la fractura, lo que sugería que podrían ser precedidas por fisuras de estrés cuya capacidad de curación estaba disminuida por el bajo recambio75. Además, se identificó un patrón radiográfico propio que se caracterizaba por corticales hipertróficas, que se observaban también en el fémur contralateral en algunos casos76. La línea de fractura era transversal u oblicua (fig. 1), frente a las fracturas diafisarias oligotraumáticas que ocurren en las personas de edad avanzada, que suelen ser espirales y conminutas. No obstante, la incidencia de esta posible complicación del tratamiento con BF es muy baja, estimándose en 7,8 por 100.000 personas-año para los pacientes mayores de 60 años. Un reciente análisis combinado de los ensayos clínicos FIT, FLEX y HORIZON confirmó estos resultados, no observándose un incremento del riesgo relativo significativo en ninguno de los 3 estudios77.
Podemos concluir que las fracturas diafisarias de fémur relacionadas con los BF son muy raras y que no afectan a la relación beneficio-riesgo conocida de estos fármacos cuando se utilizan en pacientes con osteoporosis establecida. No obstante, los clínicos deben prestar atención a la aparición de dolor en muslos durante el tratamiento prolongado, y realizar radiografías para descartar fracturas de estrés. Aunque son necesarios más estudios que definitivamente aclaren el problema, también consideramos prudente suspender el tratamiento si se produce una fractura femoral atípica y valorar la prescripción de otros fármacos, como las terapias anabólicas.
Osteonecrosis de los maxilaresDesde que, en 2002, la FDA recibió las primeras notificaciones de osteonecrosis maxilar (OM) en pacientes con cáncer tratados con ABF78, el número de artículos publicados en revistas médicas79–82 y también en periódicos de contenido general ha aumentado exponencialmente y su impacto social ha transcendido el entorno especializado, dificultando la toma de decisiones basadas en la realidad de las pruebas científicas. En 200783, un grupo de trabajo creado por la American Society for Bone and Mineral Research definió la OM como la «presencia de hueso expuesto en la región máxilo-facial que no cura tras 8 semanas desde la identificación por un profesional de la salud, en un paciente que sigue tratamiento o ha estado expuesto a los BP y no ha recibido radioterapia de la región» y señaló que la incidencia de este efecto adverso es rara en pacientes con osteoporosis y enfermedad de Paget, oscilando entre 1/10.000 y 1/100.000 pacientes-año de tratamiento. Aunque la existencia de una definición contribuyó a centrar el problema, la inclusión del BF como hecho obligatorio es un error desde el punto de vista epidemiológico, ya que se incluye el factor de riesgo (es decir, el BF) como requisito para el desenlace. Este problema, sumado a la inexistencia previa de un código específico ICD-9, ha provocado que no se conozca la incidencia en sujetos no expuestos, un dato imprescindible para conocer realmente el impacto de la exposición al fármaco84. En pacientes con cáncer tratados con altas dosis de BF intravenosos, el riesgo es mucho más evidente, habiéndose estimado una incidencia muy variable que se resume en la tabla 2.
Incidencia de la osteonecrosis maxilar asociada a bisfosfonatos.
| Fármaco | Indicación | Tipo de estudio | N.° | Casos (%) | Referencia |
| BF IV | MM | Descriptivo | 554 | 6 | Hoff, 200895 |
| BF IV | MM | Descriptivo | 80 | 28 | Boonyapakorn, 200896 |
| BF IV | MM | Cohortes | 1.621 | 8,5 | Vahtsevanos, 200997 |
| BF IV | Cáncer de mama | Cohortes | 1.621 | 3,1 | Vahtsevanos, 200997 |
| BF IV | Cáncer de mama | Descriptivo | 75 | 5,3 | Walter, 200998 |
| BF IV | Cáncer de próstata | Cohortes | 1.621 | 4,9 | Vahtsevanos, 200997 |
| BF IV | Cáncer de próstata | Ensayo clínico | 60 | 18,3 | Aragon-Ching, 200999 |
| BF IV | Cáncer de mama, colon y renal | Descriptivo | 3.560 | 0,9-2,4 | Guarneri, 2010100 |
| BF IV | Osteoporosis | Descriptivo | 622 | 0 | Jung, 2010101 |
| BF orales | Osteoporosis | Encuesta postal | 8.572 | 0,1 | Lo, 2010102 |
| BF orales | Osteoporosis | Encuesta postal | 0,01-0,04 | Mavrokokki, 2007103 | |
| BF orales | Osteoporosis | Descriptivo | 208 | 4 | Sedghizadeh, 2009104 |
BF: bisfosfonatos; IV: intravenosos; N: número de casos; MM: mieloma múltiple.
La OM se localiza con más frecuencia en la mandíbula (65% de los casos) y en dos tercios de los pacientes se constata el antecedente de extracción dental, implante o cualquier otro tipo de cirugía oral, siendo el resto de los casos de aparición espontánea. El comienzo de la sintomatología suele ser insidioso, con escaso o nulo dolor, aunque con el paso del tiempo suele producirse dolor en la zona e incluso manifestaciones generales, como fiebre y síndrome general, de difícil control82. No se conocen con exactitud los factores de riesgo para desarrollar OM, pero en las series publicadas se observa una mayor incidencia en pacientes con antecedentes de enfermedad periodontal o mala higiene oral, ausencia de piezas dentales y traumatismo local de repetición por prótesis mal situadas. Además, la presencia de una neoplasia avanzada y de tratamientos oncológicos, incluidos los corticoides, constituyen sin duda factores que se deben tener en cuenta en la evaluación del riesgo de OM y en el establecimiento de medidas preventivas adecuadas. En cuanto al fármaco asociado, algunas características, como la potencia antirresortiva (zoledronato es el más potente y con el que más casos se han descrito) y la larga duración del tratamiento, se asocian con un incremento del riesgo83.
El diagnóstico se realiza por inspección visual, observándose lesiones que pueden ser líticas, escleróticas o mixtas y pueden extenderse a tejidos blandos adyacentes, con sobreinfección asociada frecuente. La radiografía simple aporta, en general, poca información, y es necesario realizar otros estudios, como la resonancia magnética y la gammagrafía, para confirmar la existencia de OM y evaluar su extensión y características. Es imprescindible descartar otros procesos que pueden provocar una clínica similar, con la radionecrosis ósea en pacientes que han sido sometidos a radioterapia de cabeza y cuello y las metástasis maxilares85.
La patogenia de la OM es desconocida. Una de las teorías implicadas, derivada de la capacidad antirresortiva de los BF, sugiere que una supresión excesiva del remodelado provocaría microfracturas, apoptosis osteocitaria y necrosis de la matriz86. Los huesos alveolares son lugares de alto turnover, donde, al menos en teoría, se depositarían grandes cantidades de BF, sobre todo si se utilizan dosis elevadas y/o durante largos periodos. En maxilares de perros tratados con zoledronato se ha observado un remodelado cortical suprimido y acúmulo de osteocitos no viables, con áreas de necrosis de la matriz, hallazgos que podrían contribuir al retraso en la curación y al desarrollo de infecciones tras la extracción de una pieza dental87. Otros mecanismos que se han postulado serían los efectos de los BF sobre los queratinocitos88 y sobre la angiogénesis89. En un modelo murino90, desarrollado recientemente, que simula con bastante aproximación el cuadro clínico e histopatológico que se produce en humanos con mieloma tratados con altas dosis de BF intravenosos, se ha observado que la acción sinérgica antirresortiva, con formación de osteoclastos gigantes multinucleados, y antiangiogénica de estos fármacos podría ser la responsable de la aparición de las lesiones, un proceso que se ve favorecido por la terapia combinada con fármacos inmunosupresores y citostáticos. El desarrollo y estudio de este primer modelo animal obtenido podrá aportar las claves de la patogenia y del tratamiento que permitan el abordaje de esta complicación.
En la actualidad, un gran número de sociedades científicas y agencias reguladoras han elaborado sus propias recomendaciones, que, en general, coinciden en sus aspectos básicos. La Agencia Española de Medicamentos y Productos Sanitarios recomienda en su nota informativa 2009/1091 unas medidas preventivas dentales que se estratifican en función del riesgo del paciente y que se resumen a continuación:
- 1.
Es importante que la decisión de iniciar tratamiento con BF se realice una vez evaluados los beneficios (prevención de fracturas por fragilidad ósea) y riesgos para el paciente individual, teniendo en cuenta que normalmente el tratamiento debe mantenerse a largo plazo, situación que puede ser un factor de riesgo para la OM.
- 2.
Deben tenerse en cuenta las recomendaciones de las guías clínicas actuales publicadas por los respectivos servicios de salud de las CC. AA. y las sociedades científicas.
- 3.
Una vez decidida la necesidad de tratamiento con BF, se deberán llevar a cabo las medidas preventivas dentales correspondientes:
- –
Se debe realizar una valoración inicial del estado de salud buco-dental del paciente y revisiones odontológicas con regularidad. Además, deberá acudir a consulta odontológica tan pronto como presente síntomas tales como dolor o inflamación orales.
- –
Cuando sean necesarias intervenciones dentales, éstas deberán ser tan conservadoras como sea posible (mantenimiento de la pieza).
- –
Si son necesarias extracciones o procedimientos invasivos, se recomienda que el odontólogo refiera al enfermo a centros con experiencia en este tipo de pacientes.
- –
Los pacientes que desarrollen una OM deberán recibir el tratamiento apropiado por profesionales con experiencia en esta patología.
- –
- 4.
Para la aplicación efectiva de estas recomendaciones, es fundamental el desarrollo de Guías y Protocolos locales, compartidos por los diferentes medios y niveles asistenciales implicados en el seguimiento del paciente.
La seguridad de los BF en la gestación y lactancia no se ha estudiado con suficiente rigor debido a que la mayor parte de pacientes tratadas se encuentra en la etapa posmenopáusica. Sin embargo, existe la posibilidad de prescribirlos en mujeres en edad fértil (osteoporosis premenopáusica de cualquier origen, osteogénesis imperfecta, etc.), por lo que es preciso conocer la situación actual acerca de este problema.
No se conoce si existe paso trasplacentario de los BF ni si afectan a la fertilidad. Hasta el momento, y a dosis terapéuticas, no se ha observado teratogenia en humanos ni tampoco en modelos animales, aunque un estudio mostró reducción en el crecimiento óseo y en el peso fetal en ratas expuestas a BF durante la gestación105. Se han comunicado varios casos de uso de BF durante la gestación en mujeres, en los que se produjo hipocalcemia transitoria en el recién nacido, sin relevancia clínica106. Por último, no se ha observado paso de BF a la leche materna107 y no se han objetivado efectos adversos en este período, aunque los estudios son muy escasos y, por tanto, deben utilizarse con precaución. La FDA clasifica a los BF dentro del grupo C de riesgo (definido textualmente como: «no se dispone de datos en humanos y en estudios realizados en animales se ha observado riesgo o no se han realizado»), mientras que EULAR recomienda su retirada seis meses antes de la gestación (con un nivel de evidencia IV), lo que establece la necesidad de utilizar protocolos de seguridad en pacientes premenopáusicas, de manera similar a los que se utilizan con metotrexato y fármacos con un perfil similar de seguridad108.
MisceláneaSe han publicado reacciones cutáneas leves, como exantema o prurito, que ocurren con una frecuencia similar a la observada con los antibióticos y ceden sin secuelas con la retirada del fármaco. Sin embargo, son muy raros los casos de procesos graves como el síndrome de Stevens-Johnson109. Asimismo, se han publicado casos aislados de hepatotoxicidad leve110,111, que cede al suspender el fármaco y que se caracterizan por un ligero incremento de transaminasas al inicio del tratamiento y, en grandes bases de datos, se ha recogido una variada serie de efectos adversos que se producen de manera anecdótica, como astenia, cefalea, vértigo y disgeusia, cuya atribución a los BF es probablemente muy dudosa112,113.
ConclusionesEl perfil general de seguridad de los BF es aceptable y sus efectos adversos suelen ser leves. Sin embargo, en los últimos años y como producto de la farmacovigilancia y del análisis de las bases de datos estatales, se han comunicado una serie de complicaciones relacionadas con estos fármacos que pueden resultar graves y cuyo conocimiento por parte de los clínicos es imprescindible para tomar las decisiones oportunas en cada caso.
Los efectos adversos gastrointestinales son frecuentes aunque raramente constituyen una causa de suspensión del tratamiento. No obstante, en aquellos casos en los que, tras asegurar que se toman correctamente, persistan las molestias, se deberá evitar la prescripción de antisecretores de forma prolongada por su efecto negativo sobre la masa ósea y la incidencia de fracturas, planteándose el cambio de vía de administración o de clase terapéutica. La reacción de fase aguda, el efecto adverso más frecuente relacionado con los BF intravenosos, responde bien al paracetamol y tiende a desaparecer en las siguientes infusiones. También debe recordarse la necesidad de asegurar un buen aporte de calcio y vitamina D para evitar hipocalcemia postransfusional, sobre todo en los pacientes de riesgo. Otros efectos, como dolor osteomuscular, daño renal y hepatotoxicidad, son muy infrecuentes y rara vez ocasionarán la retirada del fármaco.
Los dos efectos adversos más controvertidos en la actualidad son la osteonecrosis de los maxilares y las fracturas atípicas de la diáfisis femoral. Aunque no se conoce la patogenia de estos procesos, es necesario tomar precauciones en ambos casos sobre todo en pacientes de alto riesgo. Asimismo, se deberá valorar cuidadosamente la indicación del BF, evitando su administración si el riesgo de fractura no es elevado y valorando su retirada o suspensión temporal tras 5 años de tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.