Evaluar la eficacia del tratamiento con tocilizumab (TCZ) en pacientes con artritis reumatoide (AR) en práctica clínica, las tasas de supervivencia del fármaco y variables clínicas predictoras de respuesta.
MétodosEs un estudio descriptivo, prospectivo, longitudinal y abierto en el que se incluyó a pacientes en condiciones de práctica clínica que recibieron TCZ (8mg/kg/cada 4 semanas). Las respuestas clínicas se midieron utilizando los criterios de respuesta de la European League Against Rheumatism (EULAR), las tasas de actividad baja y remisión según el Disease activity score-28 (DAS28-VSG) y Clinical Disease Activity Index (CDAI).
ResultadosLa tasa de respuesta EULAR fue del 86,63%, con una tasa de remisión DAS28 del 53,7% a los 6 meses de tratamiento. El 52,9% de los pacientes presentaron baja actividad de la enfermedad a los 24 meses según CDAI y 47,1% según DAS28. No hubo diferencias significativas en cuanto a respuesta EULAR, baja actividad y remisión DAS28 entre pacientes en tratamiento con TCZ en monoterapia y terapia combinada, ni entre pacientes positivos y negativos para factor reumatoide (FR) y/o anticuerpo antipéptido cíclico citrulinado (anti-PCC). Los pacientes que recibieron TCZ de primera línea presentaron mejores tasas de remisión y baja actividad a los 6 meses. La tasa de supervivencia fue del 61% a los 24 meses, siendo una de las causas de discontinuación más frecuente los efectos adversos.
ConclusiónEl TCZ es efectivo en pacientes con AR, tiene eficacia similar cuando se utiliza en monoterapia o en combinación con fármacos antirreumáticos modificadores de la enfermedad (FAME) sintéticos y presenta altas tasas de supervivencia.
To evaluate the efficacy of tocilizumab (TCZ) in patients with rheumatoid arthritis (RA) in clinical practice, retention rates of the drug and predictors of response.
MethodsWe performed a descriptive, prospective, longitudinal, open-label study in patients receiving TCZ (8mg/kg/4 weeks) in a clinical practice setting. The clinical responses were evaluated using the European League Against Rheumatism (EULAR) response criteria, and the low activity and remission rates according to the Disease Activity Score 28-erythrocyte sedimentation rate (DAS28-ESR) and the Clinical Disease Activity Index (CDAI).
ResultsThe EULAR response rate was 86.63% and the DAS28 remission rate was 53.7% after 6 months of treatment; rates of low disease activity were 52.9% on CDAI and 47.1% on DAS28 at month 24.
There were no statistically significant differences in EULAR response, rates of low activity and remission on DAS28 between patients receiving TCZ alone and those receiving TCZ in combination therapy, or between patients positive or negative for rheumatoid factor (RF) and/or anti-cyclic citrullinated peptide (anti-CCP) antibodies. The naïve biological therapy patients showed better remission and low activity rates after 6 months of treatment. The retention rate was 61% at month 24. Adverse events were among the most frequent causes of discontinuation.
ConclusionsTocilizumab is effective in RA, has a similar efficacy when used alone or in combination with synthetic disease-modifying antirheumatic drugs (DMARDs) and shows high retention rates.
La artritis reumatoide (AR) es una enfermedad inflamatoria crónica que afecta principalmente a articulaciones pequeñas y medianas. Es la forma más común de artritis inflamatoria, capaz de producir daño articular importante, así como deformidad e incapacidad funcional1.
Las recomendaciones actuales en el manejo de pacientes con AR centra como objetivo terapéutico la remisión completa de la enfermedad y en su defecto la baja actividad de la misma2.
El tratamiento inicial de elección una vez realizado el diagnostico de AR lo constituyen los fármacos antirreumáticos modificadores de la enfermedad (FAME). El metotrexato (MTX) constituye el tratamiento inicial recomendado, salvo contraindicación2.
En el caso de pacientes que responden insuficientemente a MTX u otro FAME, ya sea asociado o no a glucocorticoides, el siguiente escalón terapéutico consiste en la administración de terapia biológica en combinación con FAME o en monoterapia, encontrándose actualmente disponibles los inhibidores del TNF alfa, abatacept, tocilizumab (TCZ), anakinra y en determinadas situaciones rituximab2,3.
Una de las opciones terapéuticas disponibles es el TCZ, un anticuerpo monoclonal humanizado dirigido contra el receptor, tanto soluble como de membrana, de interleucina-64.
La eficacia y la seguridad de TCZ ha sido demostrada en pacientes con AR que han presentado una respuesta inadecuada a MTX/FAME o inhibidores del TNF alfa, en diversos ensayos clínicos5,6.
El propósito de nuestro estudio fue evaluar los resultados de nuestra experiencia en términos de eficacia, así como la tasa de supervivencia y análisis de las causas de discontinuación en pacientes de práctica clínica habitual.
MétodosPacientesEs un estudio descriptivo, prospectivo, longitudinal y abierto, en el que se incluyó a pacientes diagnosticados de AR, según criterios de clasificación de la American College of Rheumatology7 de 1987, que fueron tratados de forma rutinaria entre marzo del 2009 y julio del 2015 con tocilizumab, procedentes de consultas externas del Hospital Universitario Virgen de las Nieves de Granada (España). De estos pacientes, 17 habían formado parte de ensayos clínicos; 10 del ACT-SURE5 y 7 en el JUST-ACT.
Durante el período de estudio, se incluyó a 85 pacientes, adultos (mayores de 18 años de edad) diagnosticados de AR, con indicación de tratamiento con terapias biológicas según las recomendaciones de la EULAR2 y de la Sociedad Española de Reumatología8,9.
El TCZ se administró por vía intravenosa a una dosis de 8mg/kg cada 4 semanas. Se realizó ajuste de dosis de TCZ según ficha técnica. No se realizó optimización de tratamiento en ningún paciente. Todos los pacientes proporcionaron su consentimiento informado. El estudio se realizó de conformidad con los principios éticos de la Declaración de Helsinki y con los principios de buena práctica clínica.
VariablesLos datos basales de los pacientes (previos al inicio de tratamiento con TCZ) fueron los siguientes: edad, sexo, duración de la enfermedad, tratamiento concomitante con FAME, y el número de agentes biológicos utilizados previamente, la velocidad de sedimentación globular (VSG), proteína C reactiva (PCR), y los parámetros sanguíneos (hemoglobina, glóbulos blancos, neutrófilos y el recuento de plaquetas). El estado serológico basal para el factor reumatoide (FR) y los anticuerpos antipéptido cíclico citrulinado (anti-PCC) también fueron recogidos. A los 6, 12 y 24 meses se recogieron las siguientes variables: recuento de articulaciones dolorosas y tumefactas, escala visual analógica (EVA) del dolor y de su enfermedad por el paciente, EVA de la enfermedad por parte del médico, analítica sanguínea con determinación de VSG, FR, PCR y anti-PCC.
El objetivo primario del estudio fue valorar la eficacia de TCZ en nuestros pacientes. La eficacia del tratamiento con TCZ se evaluó mediante un análisis por intención de tratar, constituida por pacientes que habían recibido una dosis o más de TCZ. Los pacientes que discontinuaron de forma prematura el estudio se consideraron como no respondedores en el análisis de eficacia.
Se evaluó el porcentaje de pacientes que consiguieron una mejora clínicamente significativa según criterios de respuesta de la EULAR (reducción de ≥ 0,6 unidades en el índice DAS28 y DAS28 ≤ 5,1), baja actividad de la enfermedad (DAS28 ≤ 3,2) y remisión (DAS28 < 2,6) a los 6, 12 y 24 meses. Asimismo, se determinaron las tasas de baja actividad de la enfermedad o de remisión clínica según CDAI (CDAI ≤ 2,8 para remisión y baja actividad CDAI ≤ 10). Asimismo, para valorar si existía alguna variable clínica que condicionara una mejor respuesta al tratamiento, se comparó la eficacia del TCZ en 3 subgrupos de pacientes: pacientes positivos para FR y/o anti-PCC respecto a pacientes negativos para las 2 variables, pacientes en tratamiento con TCZ en monoterapia respecto a pacientes en tratamiento con un FAME concomitante (fundamentalmente MTX) y los pacientes que habían recibido algún tratamiento biológico frente a pacientes que no habían recibido terapia biológica previamente.
La seguridad se valoró mediante la recogida de acontecimientos adversos (AA) que motivaron la suspensión del fármaco en pacientes que habían recibido al menos una dosis de TCZ.
Se evaluó la supervivencia durante los 2 años de tratamiento y también si existía alguna diferencia en los subgrupos antes mencionados.
Análisis estadísticoSe presenta un análisis descriptivo calculando medidas de tendencia central y dispersión para las variables numéricas; frecuencias absolutas y relativas para las cualitativas. La normalidad de los datos se ha contrastado con el test de Shapiro-Wilks.
Se ha realizado un análisis bivariante para analizar la relación de la respuesta o actividad de la enfermedad con el uso de FAME concomitante, número de terapias biológicas previas, positividad para el FR y/o anti-PCC y resto de características medidas. Para las variables cuantitativas se ha utilizado el test t de Student para muestras independientes o Mann-Whitney en los casos de no normalidad. Para las cualitativas, el test de la chi al cuadrado de Pearson o Fisher.
Además se realizó un análisis de supervivencia por el método de Kaplan-Meier para estudiar el tiempo hasta finalización del tratamiento. Se calcularon probabilidades de supervivencia y su intervalo de confianza del 95%, medias y medianas de supervivencia. Además se utilizó el test de Log-Rank para comparar por grupos (FAME concomitante, terapias biológicas previas y positividad para FR y/o anti-PCC).
Para todos los análisis se considera significativo un valor p<0,05. Los datos se han analizado con el software IBM SPSS Statistics 19.
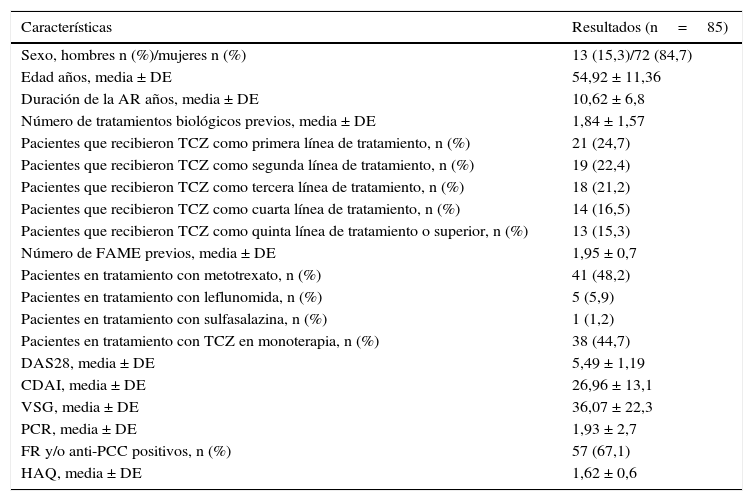
ResultadosPacientesLa población a estudio incluyó a 85 pacientes, de los cuales 72 eran mujeres (84,7%) y 13 varones (15,3%), con una edad media de 54,92±11,36 años, con un tiempo medio de evolución de la enfermedad de 10,62±6,81 años, y alta actividad de la enfermedad (media de DAS28 de 5,49±1,19 y de CDAI de 26,96 ± 13,12). De los 85 pacientes, 38 recibieron TCZ en monoterapia y 21 pacientes recibieron TCZ como primera línea de tratamiento. Los pacientes habían recibido una media de 1,83±1,57 terapias biológicas y de 1,95±0,7 FAME con anterioridad. El MTX fue el FAME asociado más frecuente 48,2% (n=41). El 68,7% de los pacientes eran positivos al FR y/o anti-PCC (tabla 1).
Características clínicas y demográficas basales
| Características | Resultados (n=85) |
|---|---|
| Sexo, hombres n (%)/mujeres n (%) | 13 (15,3)/72 (84,7) |
| Edad años, media ± DE | 54,92 ± 11,36 |
| Duración de la AR años, media ± DE | 10,62 ± 6,8 |
| Número de tratamientos biológicos previos, media ± DE | 1,84 ± 1,57 |
| Pacientes que recibieron TCZ como primera línea de tratamiento, n (%) | 21 (24,7) |
| Pacientes que recibieron TCZ como segunda línea de tratamiento, n (%) | 19 (22,4) |
| Pacientes que recibieron TCZ como tercera línea de tratamiento, n (%) | 18 (21,2) |
| Pacientes que recibieron TCZ como cuarta línea de tratamiento, n (%) | 14 (16,5) |
| Pacientes que recibieron TCZ como quinta línea de tratamiento o superior, n (%) | 13 (15,3) |
| Número de FAME previos, media ± DE | 1,95 ± 0,7 |
| Pacientes en tratamiento con metotrexato, n (%) | 41 (48,2) |
| Pacientes en tratamiento con leflunomida, n (%) | 5 (5,9) |
| Pacientes en tratamiento con sulfasalazina, n (%) | 1 (1,2) |
| Pacientes en tratamiento con TCZ en monoterapia, n (%) | 38 (44,7) |
| DAS28, media ± DE | 5,49 ± 1,19 |
| CDAI, media ± DE | 26,96 ± 13,1 |
| VSG, media ± DE | 36,07 ± 22,3 |
| PCR, media ± DE | 1,93 ± 2,7 |
| FR y/o anti-PCC positivos, n (%) | 57 (67,1) |
| HAQ, media ± DE | 1,62 ± 0,6 |
HAQ: Health Assessment Questionnaire; AR: artritis reumatoide; DE desviación estándar; FAME: fármacos antirreumáticos modificadores de la enfermedad; FR: factor reumatoide; CDAI: Clinical Disease Activity Index; DAS28: Disease Activity Score basado en 28 articulaciones; PCR: proteína C reactiva; anti-PCC: anticuerpo antipéptido cíclico citrulinado; TCZ: tocilizumab; VSG: velocidad de sedimentación globular.
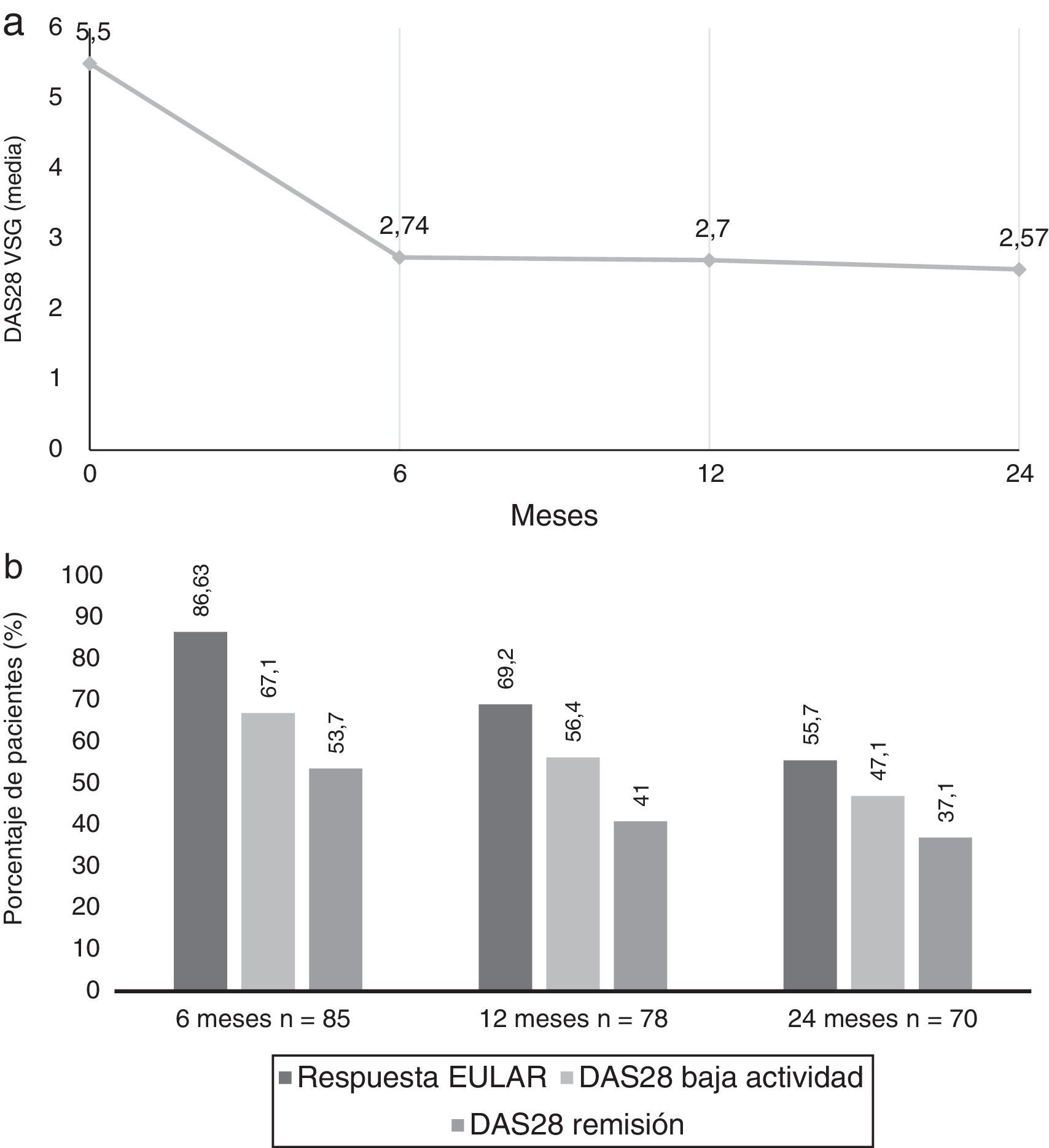
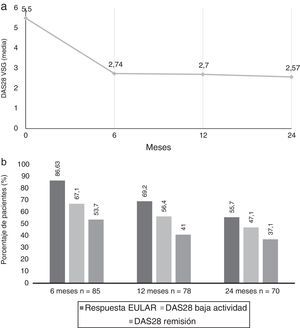
Se observaron mejorías en las puntuaciones DAS28-VSG desde el nivel basal hasta los 24 meses (fig. 1a). El cambio medio del DAS28 después de 6 meses (ΔDAS28) fue de –2,7±1,61, de –2,8 ± 1,57 a los 12 meses y de –3,0±1,66 a los 24 meses.
A) Valores de media de DAS28 VSG de la visita basal hasta los 2 años de evolución. B) Porcentaje de pacientes con DAS28 baja actividad (≤ 3,2), DAS28 remisión (≤ 2,6) y respuesta EULAR (descenso del DAS28 ≥ 0,6 y DAS28 ≤ 5,1) a los 6, 12 y 24 meses del inicio del tratamiento con tocilizumab.
Se alcanzaron tasas de respuesta EULAR en el 86,6% (n=71) de los pacientes a los 6 meses, 69,2% (n=54) a los 12 meses y en el 55,7% (n=39) a los 24 meses. A los 6 meses, el 67,1% de los pacientes presentaron baja actividad de la enfermedad, y el 53.7% estaban en remisión clínica según índice DAS28, siendo dichas tasas del 56,4/41% a los 12 meses, y del 47,1/37,1% a los 24 meses respectivamente (fig. 1b).
Según valores de CDAI, un 14,3% alcanzaron valores de remisión a los 6 meses, un 9,5% a los 12 meses y 11,4% a los 24 meses; sin embargo, se observó que un 58,4% presentan baja actividad según CDAI a los 6 meses, un 54,1% a los 12 meses y del 52,9% a los 24 meses.
Se produjo un descenso de las variables biológicas (PCR 0,52±1,15 y VSG 12,63 ± 12,99) a los 6 meses de tratamiento, manteniéndose en valores normales durante los 24 meses seguimiento.
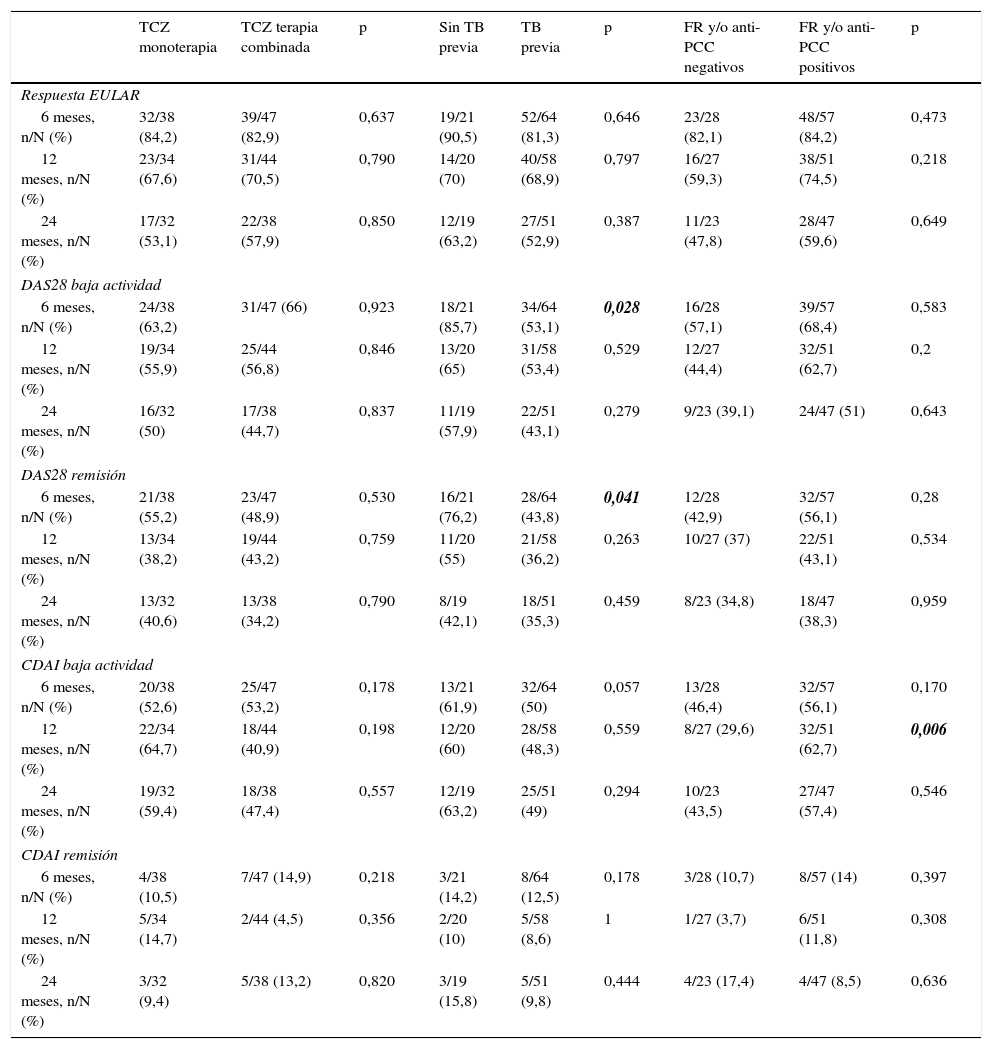
Análisis por subgruposLos resultados de eficacia en los diferentes subgrupos de pacientes se muestran en la tabla 2.
Datos de eficacia en los subgrupos de pacientes a los 6, 12 y 24 meses del inicio del tratamiento con tocilizumab
| TCZ monoterapia | TCZ terapia combinada | p | Sin TB previa | TB previa | p | FR y/o anti-PCC negativos | FR y/o anti-PCC positivos | p | |
|---|---|---|---|---|---|---|---|---|---|
| Respuesta EULAR | |||||||||
| 6 meses, n/N (%) | 32/38 (84,2) | 39/47 (82,9) | 0,637 | 19/21 (90,5) | 52/64 (81,3) | 0,646 | 23/28 (82,1) | 48/57 (84,2) | 0,473 |
| 12 meses, n/N (%) | 23/34 (67,6) | 31/44 (70,5) | 0,790 | 14/20 (70) | 40/58 (68,9) | 0,797 | 16/27 (59,3) | 38/51 (74,5) | 0,218 |
| 24 meses, n/N (%) | 17/32 (53,1) | 22/38 (57,9) | 0,850 | 12/19 (63,2) | 27/51 (52,9) | 0,387 | 11/23 (47,8) | 28/47 (59,6) | 0,649 |
| DAS28 baja actividad | |||||||||
| 6 meses, n/N (%) | 24/38 (63,2) | 31/47 (66) | 0,923 | 18/21 (85,7) | 34/64 (53,1) | 0,028 | 16/28 (57,1) | 39/57 (68,4) | 0,583 |
| 12 meses, n/N (%) | 19/34 (55,9) | 25/44 (56,8) | 0,846 | 13/20 (65) | 31/58 (53,4) | 0,529 | 12/27 (44,4) | 32/51 (62,7) | 0,2 |
| 24 meses, n/N (%) | 16/32 (50) | 17/38 (44,7) | 0,837 | 11/19 (57,9) | 22/51 (43,1) | 0,279 | 9/23 (39,1) | 24/47 (51) | 0,643 |
| DAS28 remisión | |||||||||
| 6 meses, n/N (%) | 21/38 (55,2) | 23/47 (48,9) | 0,530 | 16/21 (76,2) | 28/64 (43,8) | 0,041 | 12/28 (42,9) | 32/57 (56,1) | 0,28 |
| 12 meses, n/N (%) | 13/34 (38,2) | 19/44 (43,2) | 0,759 | 11/20 (55) | 21/58 (36,2) | 0,263 | 10/27 (37) | 22/51 (43,1) | 0,534 |
| 24 meses, n/N (%) | 13/32 (40,6) | 13/38 (34,2) | 0,790 | 8/19 (42,1) | 18/51 (35,3) | 0,459 | 8/23 (34,8) | 18/47 (38,3) | 0,959 |
| CDAI baja actividad | |||||||||
| 6 meses, n/N (%) | 20/38 (52,6) | 25/47 (53,2) | 0,178 | 13/21 (61,9) | 32/64 (50) | 0,057 | 13/28 (46,4) | 32/57 (56,1) | 0,170 |
| 12 meses, n/N (%) | 22/34 (64,7) | 18/44 (40,9) | 0,198 | 12/20 (60) | 28/58 (48,3) | 0,559 | 8/27 (29,6) | 32/51 (62,7) | 0,006 |
| 24 meses, n/N (%) | 19/32 (59,4) | 18/38 (47,4) | 0,557 | 12/19 (63,2) | 25/51 (49) | 0,294 | 10/23 (43,5) | 27/47 (57,4) | 0,546 |
| CDAI remisión | |||||||||
| 6 meses, n/N (%) | 4/38 (10,5) | 7/47 (14,9) | 0,218 | 3/21 (14,2) | 8/64 (12,5) | 0,178 | 3/28 (10,7) | 8/57 (14) | 0,397 |
| 12 meses, n/N (%) | 5/34 (14,7) | 2/44 (4,5) | 0,356 | 2/20 (10) | 5/58 (8,6) | 1 | 1/27 (3,7) | 6/51 (11,8) | 0,308 |
| 24 meses, n/N (%) | 3/32 (9,4) | 5/38 (13,2) | 0,820 | 3/19 (15,8) | 5/51 (9,8) | 0,444 | 4/23 (17,4) | 4/47 (8,5) | 0,636 |
anti-PCC: anticuerpo antipéptido cíclico citrulinado; CDAI: Clinical Disease Activity Index; DAS28: Disease Activity Score basado en 28 articulaciones; Respuesta EULAR (descenso del DAS28 ≥ 0,6 y DAS28 ≤ 5,1); DAS28 baja actividad (DAS28 ≤ 3,2); DAS28 remisión (DAS28<2,6); CDAI baja actividad: CDAI ≤ 10; CDAI remisión: CDAI ≤ 2,8; FR: factor reumatoide; TB: terapia biológica; TCZ: tocilizumab.
p significativas en negrita.
Cuando se comparó a los pacientes en tratamiento con TCZ en monoterapia respecto a los que estaban en tratamiento con terapia combinada, se observó que de los 38 pacientes en tratamiento con TCZ en monoterapia, 32 (84,2%) presentaron criterios de respuesta EULAR a los 6 meses, 67,6% a los 12 meses y 53,1% a los 24 meses, frente al 82,9% de los pacientes que estaban en tratamiento con FAME concomitante a los 6 meses, 70,5% a los 12 meses y 57,9% a los 24 meses, siendo estas diferencias no estadísticamente significativas.
Asimismo, el 63,2% (24/38) de los pacientes en tratamiento en monoterapia con TCZ cumplieron criterios de baja actividad según DAS28 a los 6 meses, un 55,9% (19/34) a los 12 meses y el 50% (16/32) a los 24 meses; entre los pacientes en tratamiento con terapia combinada, las tasas fueron del 66, el 56,8%, el 44,7% a los 6, 12 y 24 meses, respectivamente.
Tampoco hubo diferencias estadísticamente significativas en cuanto a las tasas de remisión DAS28 entre los pacientes que recibieron TCZ en monoterapia (el 55,2, el 38,2, el 40,6 a los 6, 12 y 24 meses, respectivamente) y los pacientes en tratamiento con terapia combinada (el 48,9, 43,2 y el 34,2% a los 6, 12 y 24 meses).
Solo un 10,5% de pacientes en monoterapia con TCZ alcanzaron remisión según CDAI a los 6 meses, un 14,7% a los 12 meses y un 9,4% a los 24 meses, en comparación con el 14,9% de pacientes en terapia combinada a los 6 meses, el 4,5% a los 12 meses y el 13,2% a los 24 meses.
No se encontraron diferencias significativas en las tasas de baja actividad según CDAI entre estos grupos (el 52,6, el 64,7% y el 59,3% en pacientes en monoterapia y el 53,2, el 40,9 y el 47,4% en los pacientes en tratamiento con terapia combinada, a los 6, 12 y 24 meses).
Sin terapia biológica previaDe los pacientes que no habían recibido tratamiento biológico previamente, el 90,5% a los 6 meses, el 70% a los 12 meses y el 63,2% a los 24 meses alcanzaron criterios de respuesta EULAR y en los pacientes que habían recibido al menos un fármaco biológico previamente dichas tasas fueron del 81,3, el 68,9 y el 52,9% a los 6, 12 y 24 meses, respectivamente, no alcanzando dichas diferencias significación estadística.
Un 85,7% de los pacientes que no habían recibido tratamiento biológico previamente presentaron tasas de baja actividad según DAS28 a los 6 meses, un 65% a los 12 meses y un 57,9% a los 24 meses. Las tasas de remisión según DAS28 fueron del 43,8% a los 6 meses de tratamiento en pacientes que habían recibido al menos un FAME biológico previamente, del 36,2% a los 12 meses y del 35,2% a los 24 meses. Realizando una comparación entre estos grupos se vio que las diferencias fueron estadísticamente significativas para las tasas tanto de baja actividad como de remisión a los 6 meses de tratamiento (p = 0,028, p = 0,041).
En cuanto a tasas de baja actividad y de remisión según CDAI, los pacientes que no habían recibido previamente FAME biológico presentaron mayores tasas a lo largo del estudio, aunque las diferencias no fueron estadísticamente significativas.
Factor reumatoide y/o anticuerpos antipéptido cíclico citrulinadoNo hubo diferencias entre los pacientes que fueron positivos para FR y/o anti-PCC respecto a los pacientes FR y anti-PCC negativos en cuanto a respuesta EULAR, baja actividad ni remisión clínica, excepto en las tasas de actividad baja según CDAI a los 12 meses, en que el 62,7% de los pacientes positivos para FR y/o anti-PCC presentaban baja actividad según CDAI a los 12 meses (p = 0,006).
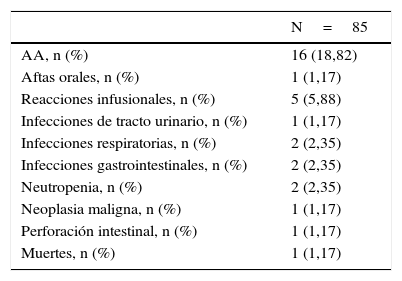
SeguridadLos resultados de seguridad que motivaron la suspensión del tratamiento se presentan en la tabla 3.
Resultados de seguridad. Acontecimientos adversos que motivaron la suspensión de tocilizumab
| N=85 | |
|---|---|
| AA, n (%) | 16 (18,82) |
| Aftas orales, n (%) | 1 (1,17) |
| Reacciones infusionales, n (%) | 5 (5,88) |
| Infecciones de tracto urinario, n (%) | 1 (1,17) |
| Infecciones respiratorias, n (%) | 2 (2,35) |
| Infecciones gastrointestinales, n (%) | 2 (2,35) |
| Neutropenia, n (%) | 2 (2,35) |
| Neoplasia maligna, n (%) | 1 (1,17) |
| Perforación intestinal, n (%) | 1 (1,17) |
| Muertes, n (%) | 1 (1,17) |
AA: acontecimientos adversos.
En total, se suspendió TCZ en 16 pacientes por AA. Las infecciones fueron uno de los AA más frecuentes (n=5), así como la presencia de reacciones infusionales en 5 pacientes. Dos pacientes desarrollaron neutropenia, en ningún caso el recuento de neutrófilos fue inferior de 500/mm3 y un paciente presentó una perforación intestinal. Una paciente desarrolló adenocarcinoma de ovario y se registró un caso de muerte (accidente cerebrovascular) durante el estudio, no relacionado con el tratamiento.
En relación con la elevación de niveles de enzimas hepáticas y colesterol total, no se requirió la suspensión de la administración de TCZ, debido a que la misma fue controlada ya sea mediante ajuste de dosis de TCZ y con tratamiento específico.
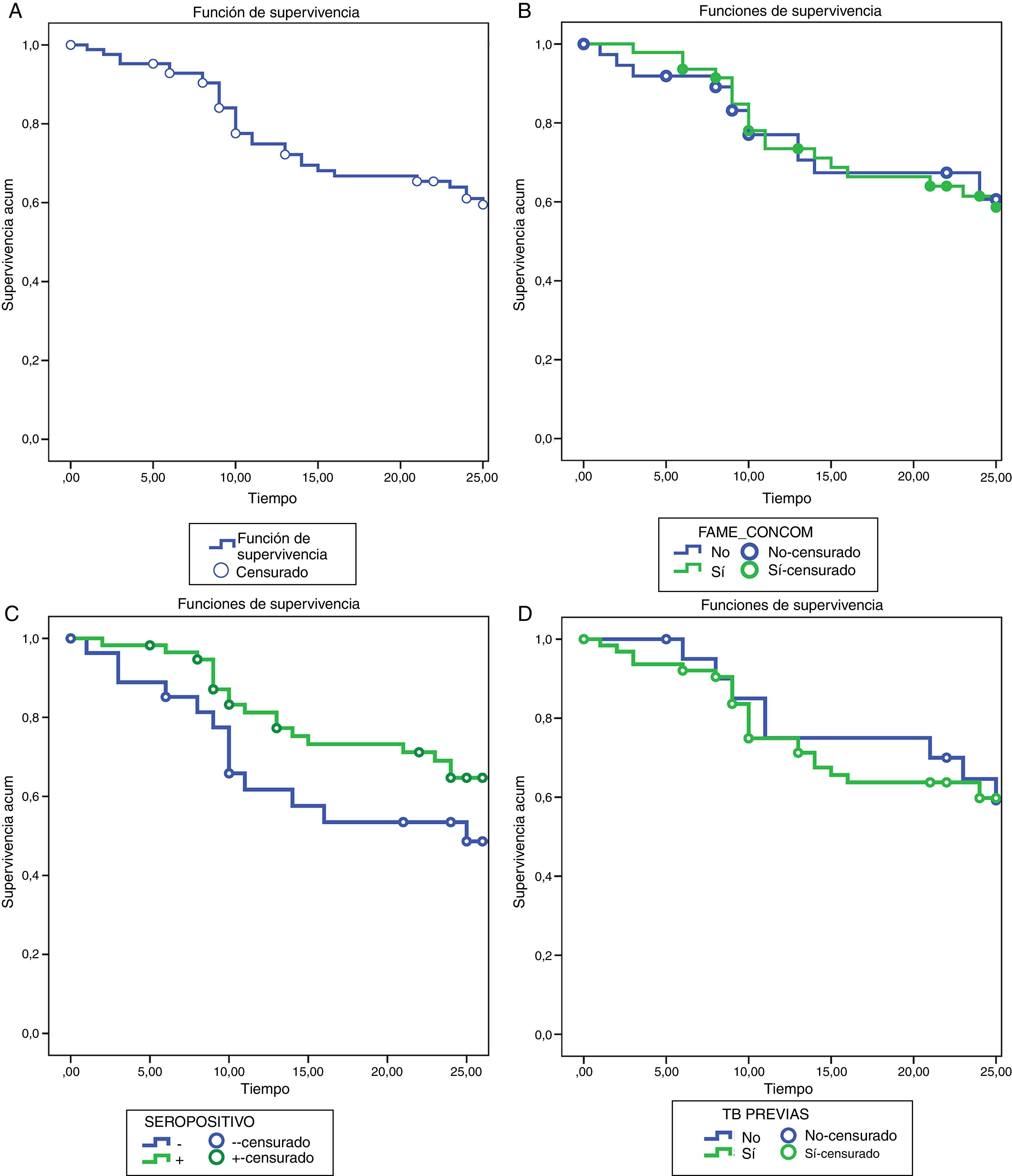
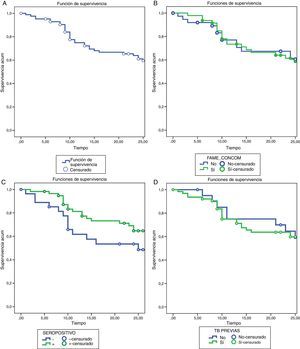
Retención de tocilizumabLas tasas de supervivencia de TCZ a los 12 meses fueron del 72,2 y el 61% a los 24 meses. Las razones de discontinuación fueron: la falta de eficacia (16 pacientes, 48,5%), AA (16 pacientes, 48,5%) y otras causas entre los que no se incluyen pacientes en remisión (un paciente, 3%).
No se encontraron diferencias estadísticamente significativas al analizar las tasas de supervivencia ni los motivos de discontinuación del tratamiento entre los distintos subgrupos de pacientes (fig. 2).
Análisis de supervivencia por el método de Kaplan-Meier. A) Supervivencia de TCZ durante 24 meses de tratamiento. B) Supervivencia de TCZ en monoterapia vs. terapia combinada. C) Supervivencia de TCZ en pacientes FR y/o anti-PCC positivos vs. FR y/o anti-PCC negativos. D) Supervivencia de TCZ TB naïve vs. TB previa.
FAME: fármacos antirreumáticos modificadores de la enfermedad; TB: terapia biológica; TCZ: tocilizumab.
El TCZ ha demostrado en varios ensayos clínicos ser eficaz en disminuir la actividad de la enfermedad e inhibir la progresión radiológica en pacientes con AR10-14.
La mejoría de los parámetros de actividad de la enfermedad y la remisión según DAS28 alcanzada en un 53,7% de los pacientes a los 6 meses son parecidos a los presentados en el estudio TAMARA, en donde la tasa de remisión a las 24 semanas fue del 47,6%15.
El mayor porcentaje de pacientes en remisión según el índice DAS28 en comparación con la aplicación del índice CDAI, podría estar en relación con el efecto del TCZ en los reactantes de fase aguda y la influencia de la VSG en la fórmula del DAS2816. Sin embargo, el hecho de que las tasas de baja actividad sean similares tanto para CDAI como para DAS28 explicaría que la eficacia de TCZ no está solo en relación con su efecto sobre los reactantes de fase aguda.
Considerando la remisión clínica según CDAI, un 14,3% alcanzó valores de remisión a los 6 meses, llegando a solo un 11,4% a los 24 meses. Esto podría estar relacionado con la discrepancia en la percepción de actividad de la enfermedad por parte de los pacientes y los médicos; debido a que los pacientes necesitan percibir una mayor mejoría y menos deterioro para considerarse satisfechos con los mismos17.
Los resultados obtenidos no han indicado diferencias significativas en la efectividad clínica entre TCZ en monoterapia en comparación con terapia combinada con FAME sintéticos. Estos hallazgos son similares a los de otros ensayos clínicos18-22.
En los pacientes que no habían recibido previamente un tratamiento biológico, alcanzaron la remisión, según el DAS28 el 80% a los 6 meses. Estos resultados apoyan más los datos del estudio ACT-SURE, en el cual se objetivó que los pacientes que no habían recibido terapia anti-TNF previa presentaban mejores tasas de respuesta con TCZ que los pacientes que habían recibido un anti-TNF previamente23.
La bibliografía disponible demuestra el hecho de que los pacientes que no han recibido tratamiento biológico con anterioridad presentan mejores tasas de respuesta24,25. En nuestro estudio, comparando la eficacia entre estos pacientes con los que habían sido tratados con algún FAME biológico previamente, las diferencias observadas fueron estadísticamente significativas, solo a los 6 meses de tratamiento, no así a largo plazo. Estos datos estarían en concordancia con los de Kaneko et al.26, en el que comparan la eficacia según DAS28 y CDAI entre ambos grupos, obteniendo diferencias significativas solo al inicio del tratamiento.
En relación con los datos de seguridad, la tasa de pacientes que suspendieron el tratamiento con TCZ debido a AA fue del 18,8% en nuestro estudio, cifra ligeramente superior al 10,1% observado en un estudio reciente de Iking-Konert et al., que podría estar en relación con el método de recogida de datos en dicho estudio el cual no se realizó de forma directa27.
Las tasas de retención en nuestro estudio fueron del 72,2% a los 12 meses, siendo similares a los del estudio REACTION, en donde la tasa de supervivencia a la semana 52 fue del 71,1%28, y esta no difiere entre pacientes que han recibido TCZ en monoterapia o en combinación con algún FAME sintético. Estos resultados contrastan con lo observado por Gabay et al.29, en quienes objetivaron que la tasa de retención de TCZ era mayor cuando este se prescribía en combinación con MTX, alcanzando significación estadística a partir de los 1,5 años de tratamiento, siendo la causa de discontinuación principal la pérdida de eficacia. En nuestro estudio, la tasa de supervivencia a los 2 años era ligeramente superior en los pacientes en monoterapia, aunque sin diferencias significativas entre los grupos. Las diferencias observadas entre nuestro estudio y otros estudios basados en registros de pacientes, en cuanto a las tasas de retención de TCZ, cuando se utiliza en monoterapia o en terapia combinada, podría ser el reflejo de diferencias en cuanto a disponibilidad del fármaco, recomendaciones locales, situaciones económicas o disponibilidad de otras opciones de tratamientos e incluso de preferencias de prescripción de tratamiento por parte del médico.
Dentro de las limitaciones de este estudio, se encuentran las propias de un estudio observacional, que no ha tenido grupo control y que al ser un solo centro, el número de pacientes es reducido. A pesar de que en este estudio se valoró la eficacia de TCZ en nuestra práctica clínica habitual, hemos incluido a 17 pacientes que procedían de 2 ensayos clínicos, que tras analizar las variables demográficas basales de estos pacientes y compararlas con la de nuestros pacientes de práctica clínica, se concluyó que eran similares, y por este motivo fueron incluidos en este estudio (no se muestran datos).
En conclusión, nuestro estudio demuestra que el tratamiento con TCZ, tanto en combinación como en monoterapia, es efectivo en pacientes con AR evolucionada, produce un descenso sostenido de los parámetros biológicos y presenta unas altas tasas de supervivencia. Se necesitarían realizar más estudios de práctica clínica, que incluyeran más pacientes y así poder demostrar nuestros resultados.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.