Estudio clínico aleatorizado para determinar la eficacia y seguridad de leflunomida (LFN) 100mg/semana en artritis reumatoide (AR), comparado con dosis bajas de metotrexate (MTX) 10mg/semana a 52 semanas.
Pacientes y métodosSe incluyeron pacientes con criterios de AR activa (ACR1987). Fueron realizados estudios de laboratorio, radiografías de manos y determinaciones clinimétricas para establecer criterios de respuesta clínica de ACR y EULAR. El análisis estadístico se obtuvo a través de mejoría ACR20. La eficacia se estableció por análisis de ANOVA de muestras independientes entre ambos grupos (p≤0,05). La seguridad fue analizada con porcentaje de eventos adversos.
ResultadosDe 90 pacientes evaluados, 5 fueron eliminados; 85 aleatorizados e incluidos en 2 grupos: 43 (LFN) y 42 (MTX). Completaron el estudio con LFN el 72% y con MTX el 74,4%. El criterio de mejoría de ACR20 al final del estudio fue alcanzado para LFN en 90,3% y para MTX 78,1%, p=0,14. El valor DAS28 al final para LFN fue de 3,45, y para MTX de 3,67, no existiendo diferencias significativas (p=0,43). Los pacientes excluidos para LFN fueron 11, y 10 para MTX. La falla terapéutica se definió en 5,2% para LFN, y 12,1 en el caso de MTX. No se reportaron eventos adversos graves que pusieran en riesgo la vida de los pacientes.
ConclusionesLos resultados confirman que LFN usada en dosis semanales de 100mg, ofrece una adecuada y sostenida mejoría de las manifestaciones clínicas de AR, al compararlo con una dosis baja de MTX. Pudiendo ser una opción terapéutica en algunos pacientes como monoterapia o en combinación con otros antirreumáticos.
To determine the clinical efficacy and safety of Leflunomide (LFN) 100mg/week compared to low dose Methotrexate (MTX) 10mg/week in a double-blind, randomized, controlled trial with 52 weeks of follow up in Rheumatoid Arthritis (RA) patients.
Patients and methodsPatients who met ARC1987 criteria for RA were included. All patients had medical records, including laboratory tests and hand X-rays. Clinical evaluations for improvement and ACR and EULAR response criteria were performed. Statistical analysis for independent's samples between both groups defined a P value of ≤.05. Safety was evaluated by comparing the proportion of adverse events (AE) registered.
ResultsOf 90 patients screened; five were withdrawn; the remaining 85 patients were randomised: 43 LFN and 42 MTX. Sixty-three patients completed the study; 72% in the LFN group and 74.4% in the MTX group. ACR20 improvement criteria were achieved by LFN group in 90.3%, and in MTX 78.1% (P=.14) at week 52. EULAR improvement criteria applied at the end point showed a DAS28 score for the LFN group of 3.45, and for the MTX group was 3.67(P=.43). Total withdrawals, including loss during follow up, AE and lack of efficacy for each group was 12 patients in the LFN group, and 10 patients in the MTX group. Regarding safety, no serious AE of a life threatening nature were reported.
ConclusionsThese outcomes confirm that LFN 100mg/week offers an adequate and sustained improvement effect on the clinical manifestations of RA, similar to low dose treatment with MTX 10mg/every week after 52 weeks of follow up; it may be a good therapeutic option alone or in combination with others anti-rheumatic drugs.
La leflunomida (LFN) es un fármaco antirreumático no-biológico, modificador de la enfermedad (FARME), inhibidor de la síntesis de purinas el cual está indicado en el tratamiento de la artritis reumatoide (AR). Existen varios estudios clínicos publicados que han demostrado su beneficio y seguridad equivalentes al tratamiento con sulfazalacina (SFA) o metotrexate (MTX)1–3.
Un problema que prevalece en el tratamiento de la AR es lograr mantener el apego (respetar las dosis de prescripción) y la adherencia al tratamiento (mantener el tratamiento por largo periodo de tiempo) de los FARME, situación difícil de cumplir debido a múltiples factores como son la polifarmacia, los eventos adversos farmacológicos y el alto costo del tratamiento que se requiere; sobre todo en aquellos pacientes que carecen de cobertura de seguridad social; todo ello dificulta obtener buenos resultados clínicos a largo plazo en la práctica clínica diaria.
Buscando alternativas de tratamiento que beneficien el apego y adherencia de los tratamientos, así como mantener la efectividad del tratamiento antirreumático, nosotros desarrollamos un estudio descriptivo abierto con el uso de LFN a dosis semanales de 100mg en pacientes con AR activa con seguimiento a 6 meses, donde se logró obtener mejoría clínica de acuerdo a criterios del Colegio Americano de Reumatología (ACR), sin evidenciar eventos adversos serios4.
En el presente estudio, nosotros describimos los resultados de eficacia y seguridad de pacientes tratados en forma aleatorizada, comparativa, y doble ciego de LFN a dosis semanales de 100mg, comparado con una dosis baja fija de MTX de 10mg/semana a 52 semanas de seguimiento.
Pacientes y métodosPoblación de pacientesLos pacientes incluidos en el estudio fueron población adulta que cumplieron los criterios de clasificación diagnóstica de AR activa, acorde a los criterios ACR 19875. Los pacientes fueron enrolados de junio del 2004 a diciembre del 2007 en la clínica de consulta externa de AR. La AR activa fue definida para aquellos pacientes que tuviesen al menos 6 o más articulaciones inflamadas (AI) y dolorosas (AD), rigidez matinal mayor a 30 min, velocidad de sedimentación globular (VSG) de 20mm/h o mayor. Tratamientos previos con FARME debieran haber sido suspendidos al menos un mes previo al enrolamiento, y más de 3 meses en el caso de haber consumido LFN o MTX. Pacientes recién diagnosticados sin tratamiento de FARME también fueron incluidos.
El uso de prednisona o equivalentes fue permitido con una dosis regular no mayor a 10mg diarios durante el menor periodo de tiempo posible. Pacientes fueron excluidos en caso de contar con historia de elevado consumo de alcohol, y para el caso mujeres con riesgo o duda de embarazo. Los estudios de laboratorio basales que fueron solicitados para inclusión fueron los siguientes: cuenta normal de células hemáticas blancas, concentración de hemoglobina mayor de 12gr/dl, niveles de albúmina ≥3,5g/d, pruebas de función hepática normales y en el caso del género femenino, prueba inmunológica de embarazo negativa.
Protocolo de estudioEs un estudio clínico controlado y aleatorizado a 52 semanas de seguimiento iniciado en el 2004 después de su aprobación en el Comité local de Investigación y Ética con registro número 209B 11331-1200-UEeI-322-2003 del Instituto de Seguridad Social del Estado de México y Municipios (ISSEMyM), el cual fue conducido bajo los lineamientos de la declaración internacional de Helsinki. El proceso de consentimiento informado fue requerido para todos los pacientes y además de aquellos del género femenino y que se encontraban en edad reproductiva, se requirió confirmación de no estar en estado de gestación y el uso de un método anticonceptivo seguro durante el desarrollo del protocolo y hasta que su médico lo indicase.
A todos los pacientes se les realizó historia clínica completa, exploración física, estudios de laboratorio y radiografías simples de manos y pies; estas últimas con fines de clasificación diagnóstica. Determinaciones clinimétricas fueron registradas, las cuales incluyeron: conteo de 28 articulaciones (dolorosas e inflamadas), evaluación global del paciente (EGP) y del médico (EGM) sobre una escala visual análoga (EVA 0-100mm), escala de evaluación del dolor por el paciente (EVA 0-100mm), cuestionario validado de limitación física funcional para pacientes de habla hispana (HAQ-Di en español)6, los estudios de laboratorio basales requeridos fueron velocidad de sedimentación globular (VSG) por técnica de Westergren, proteína C-reactiva, biometría hemática y pruebas de función hepática. Los estudios clínicos y de laboratorio fueron realizados al inicio del enrolamiento de pacientes y mensualmente por 3 meses, y posteriormente con visitas cada 2 meses hasta completar las 52 semanas de seguimiento. Los estudios de rayos-X de manos y pies solo se efectuaron al inicio del protocolo. Todos los estudios de laboratorio y de imagen fueron realizados en el Centro Médico ISSEMyM Toluca, realizados bajo técnicas estandarizadas validadas en forma internacional de acuerdo al protocolo de buenas prácticas de laboratorio clínico.
El objetivo primario del estudio fue evaluar la mejoría clínica de la enfermedad según criterios de mejoría de ACR, con una mejoría del 20% en articulaciones inflamadas y dolorosas y al menos cualquiera de los siguientes 3 de 5 determinaciones del constructo para determinar mejoría ACR: dolor, evaluación global de la enfermedad por el paciente y el médico, HAQ-Di y reactantes de fase aguda. También fueron incluidos los resultados adicionales de la evolución de respuesta ACR 50 y 707, DAS 28, criterios de actividad y mejoría de enfermedad por la European League Against Rheumatism (EULAR) en cada visita y al final, incluyendo al término de este, criterios de remisión por EULAR8 y el registro de descontinuación de tratamientos por eventos adversos.
Los criterios de descontinuación de pacientes en el estudio se aplicaron para todos aquellos que no alcanzaron la mejoría ACR 20 a la semana 16, o si el paciente presentaba eventos adversos serios (EAS), lo que requeriría la apertura del código de seguridad del fármaco. Respecto a los pacientes que presentaron elevación de transaminasas en forma recurrente, fueron descontinuados del estudio con el siguiente criterio: cifras mayores de 2,5 veces el valor normal de transaminasas (TGO y TGP) durante 2 meses consecutivos.
Asignación de grupos de tratamientoLos pacientes fueron asignados en forma aleatoria en 2 bloques usando una tabla de números aleatorios, sin intervención del grupo de investigadores (1:1): el grupo blanco para LFN y un grupo control de MTX. Para el grupo blanco de LFN, una dosis de impregnación de 100mg/día por 3 días consecutivos fue administrado, y con base en el promedio de vida media del fármaco, se administró una dosis semanal de 100mg. Para el grupo de MTX, una dosis baja y fija de 10mg semanal fue administrada; para ambos grupos, en forma numérica fueron administrados los placebos en forma equivalente para lograr los ciegos de pacientes y de los médicos investigadores.
Análisis estadísticoEl objetivo primario del estudio es comparar la eficacia y seguridad de una dosis semanal de LFN de 100mg comparado al efecto alcanzado con MTX a dosis bajas de 10mg semanales. La eficacia medida a través del criterio de mejoría ACR 20 como punto final del estudio a las 52 semanas de tratamiento. También fueron incluidas las variables de mejoría ACR 50 y 70, criterios de mejoría EULAR, y evaluación independiente de las variables de VSG y HAQ-Di.
La eficacia se estableció por un ANOVA de muestras independientes entre ambos grupos a las 8, 24 y 52 semanas. Y se consideró estadísticamente significativo si p≤0,05. La seguridad fue analizada en función del porcentaje de eventos adversos reportados en cada grupo.
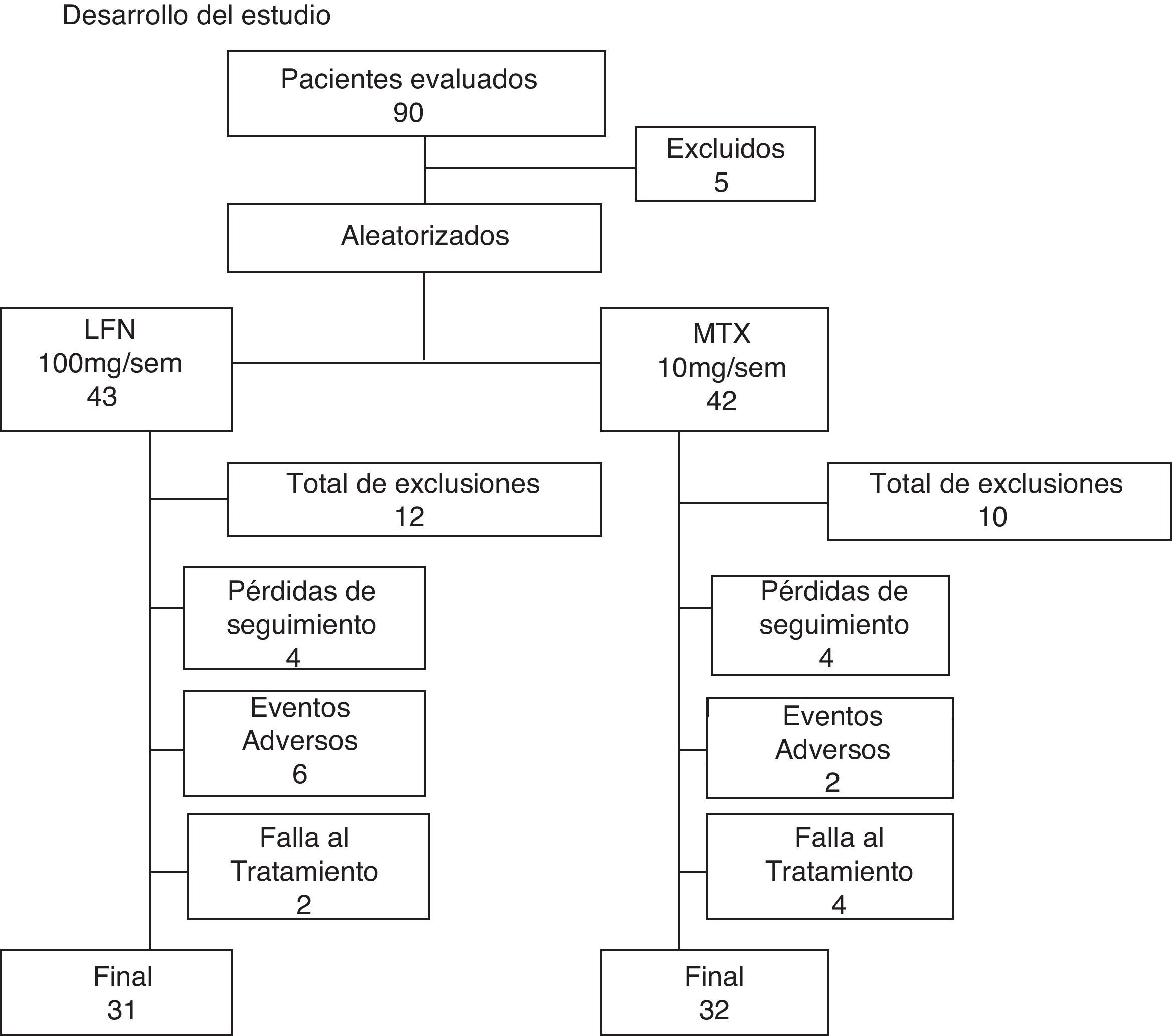
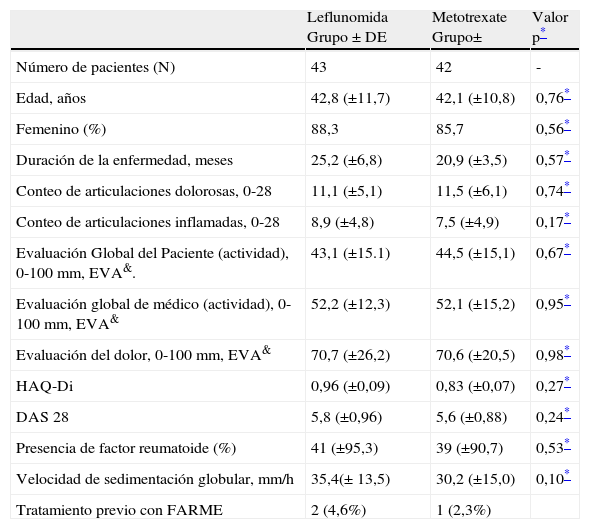
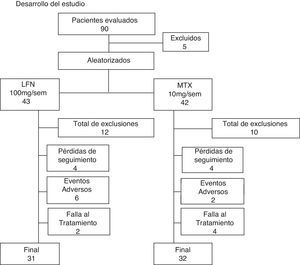
ResultadosDe 90 pacientes evaluados para entrar al estudio, 5 fueron excluidos; de los 85 que permanecieron fueron aleatorizados en 2 grupos como sigue: al grupo de LFN se asignaron 43 pacientes y 42 al de MTX (fig. 1). Para ambos grupos los pacientes se evaluaron cuando al menos tuvieran una visita de seguimiento de la basal. Los datos demográficos y las características de la enfermedad para ambos grupos fueron similares (tabla 1). Tres pacientes recibieron tratamiento con FARME previo al enrolamiento; 2 para el grupo blanco de LFN. Uno de ellos recibió LFN 20mg/día e hidroxicloroquina por 2 meses, suspendió tratamiento durante 7 meses, antes de ser aleatorizada al grupo de LFN. Un segundo paciente, con inicio de tratamiento irregular en su hospital de adscripción, tomó MTX por un mes, siendo aleatorizada 3 meses después al grupo de LFN. Finalmente un paciente en tratamiento convencional de LFN, desarrolla alopecia difusa y después de 2 meses y medio suspende tratamiento; es enviada a nuestro hospital e incluida previa aleatorización después de no tener tratamiento por 3 meses al grupo de MTX. Sesenta y tres pacientes completaron las 52 semanas de tratamiento, siendo 31 del grupo de LFN (72%) y 32 para el de MTX (74,4%). La descontinuación temprana de pacientes ocurrió a la semana 16 con mayor frecuencia en el grupo de LFN que en el de MTX (19,4 vs. 5%) respectivamente. Al final de estudio, el total de pacientes que salieron del estudio fueron 21, ya sea por pérdida del seguimiento o por eventos adversos. Doce casos ocurrieron (27,9%) en el grupo de LFN y para el de MTX correspondió a 10 pacientes (23,8%). La descontinuación por falta de eficacia se encontró en 2 pacientes en el grupo de LFN (5,2%) y 4 casos en el de MTX (12,1%) (fig. 1).
Este flujograma muestra la evolución de los pacientes evaluados e incluidos para el estudio. Los pacientes que fueron excluidos e ellos no cumplieron con criterios de inclusión, 2 se perdieron en el seguimiento y uno retiro el consentimiento informado antes de la aleatorización. Doce pacientes salieron del grupo de LFN y 10 del de MTX. El motivo de exclusiones es explicado en detalle en el texto. Se logró finalizar el estudio con un 74% de permanencia para ambos grupos, con 31 pacientes en el de LFN y 32 en el de MTX.
Características de la enfermedad y datos demográficos
| Leflunomida Grupo±DE | Metotrexate Grupo± | Valor p* | |
| Número de pacientes (N) | 43 | 42 | - |
| Edad, años | 42,8 (±11,7) | 42,1 (±10,8) | 0,76* |
| Femenino (%) | 88,3 | 85,7 | 0,56* |
| Duración de la enfermedad, meses | 25,2 (±6,8) | 20,9 (±3,5) | 0,57* |
| Conteo de articulaciones dolorosas, 0-28 | 11,1 (±5,1) | 11,5 (±6,1) | 0,74* |
| Conteo de articulaciones inflamadas, 0-28 | 8,9 (±4,8) | 7,5 (±4,9) | 0,17* |
| Evaluación Global del Paciente (actividad), 0-100mm, EVA&. | 43,1 (±15.1) | 44,5 (±15,1) | 0,67* |
| Evaluación global de médico (actividad), 0-100mm, EVA& | 52,2 (±12,3) | 52,1 (±15,2) | 0,95* |
| Evaluación del dolor, 0-100mm, EVA& | 70,7 (±26,2) | 70,6 (±20,5) | 0,98* |
| HAQ-Di | 0,96 (±0,09) | 0,83 (±0,07) | 0,27* |
| DAS 28 | 5,8 (±0,96) | 5,6 (±0,88) | 0,24* |
| Presencia de factor reumatoide (%) | 41 (±95,3) | 39 (±90,7) | 0,53* |
| Velocidad de sedimentación globular, mm/h | 35,4(±13,5) | 30,2 (±15,0) | 0,10* |
| Tratamiento previo con FARME | 2 (4,6%) | 1 (2,3%) |
DE: desviación estándar; EVA: escala visual análoga; FARME: fármacos antirreumáticos, modificadores de enfermedad.
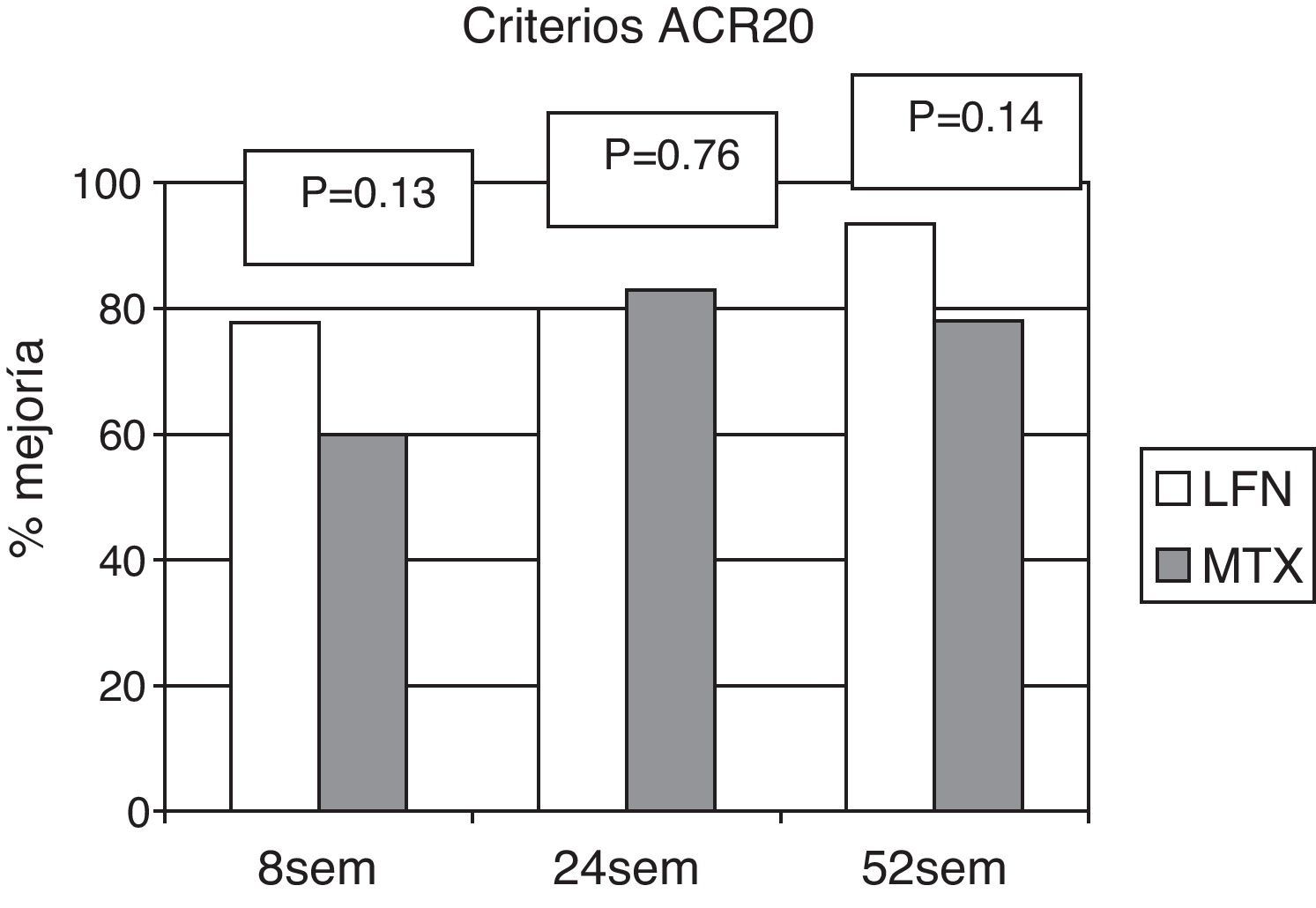
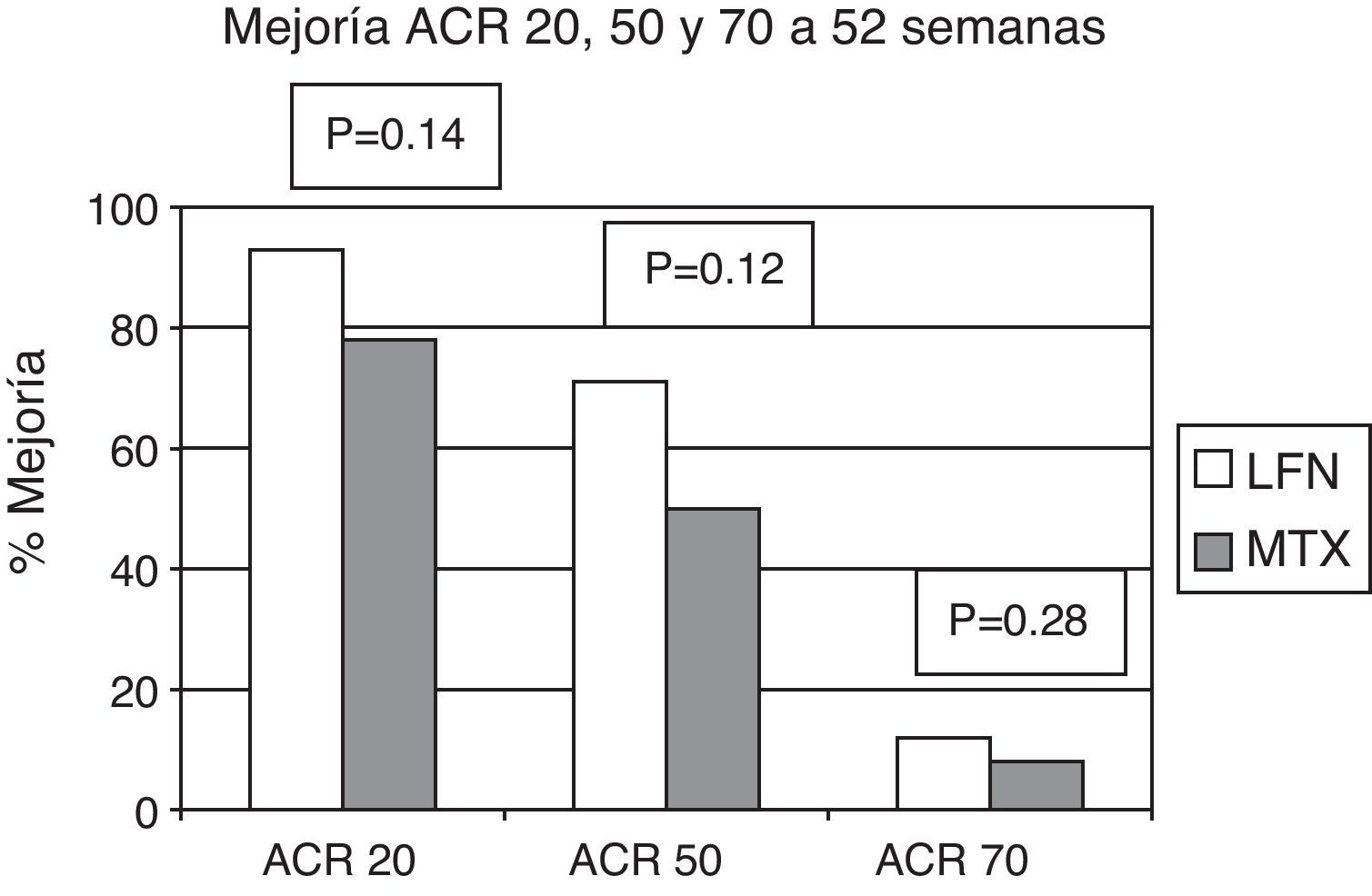
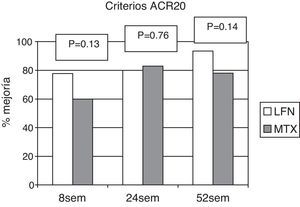
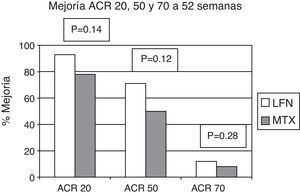
El criterio de mejoría ACR fue evaluado en las semanas 8, 24 y 52. En los pacientes asignados al grupo de LFN, 28 (80%) alcanzaron la respuesta ACR 20 a la semana 24 y en 29 casos (93,5%) a la semana 52. Para el grupo de MTX los resultados mostraron que 30 pacientes (83%) alcanzaron ACR 20 a la semana 24 y otros 25 (78,1%) a la semana 52; comparando ambos grupos para dichos puntos de evaluación, no existió diferencia estadísticamente significativa (fig. 2). Evaluando los resultados al punto final del estudio para ACR 50 y ACR 70, tampoco se establecieron diferencias significativas al comparar los grupos para estas variables (fig. 3).
Las variables independientes fueron evaluadas, y los resultados del HAQ-Di al inicio del estudio del grupo de LFN tuvieron una calificación de 0,96 y para el de MTX 0,83 (p=0,27). En la evaluación final del estudio los datos mostraron para el grupo de LFN una calificación de 0,23 y para MTX 0,39, con una reducción de la calificación de 0,7 y 0.43 respectivamente para cada grupo de estudio, encontrando una diferencia marginal al evaluar estos datos (p=0,05) a favor del grupo de LFN.
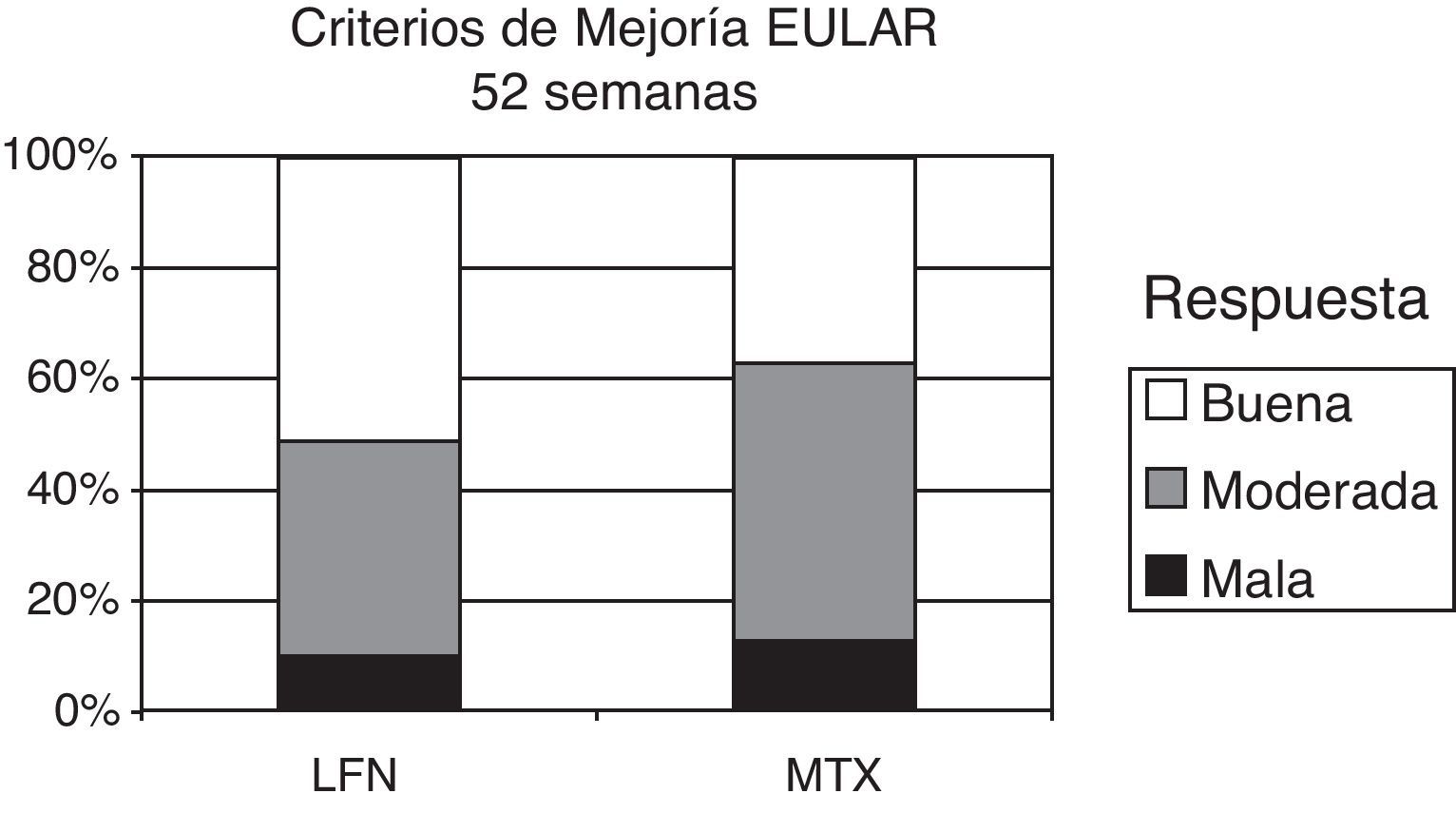
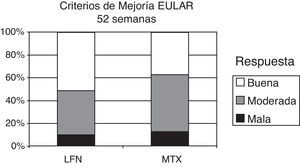
Los criterios de mejoría y remisión de EULAR fueron evaluados a la semana 52 del estudio. Los resultados de DAS 28 inicial en el grupo de LFN mostraron una calificación de 5,83 y a la semana 52, una calificación de 3,45 (reducción de 2,38 puntos). En el caso del grupo de MTX se observó una calificación basal de 5,60, siendo al final del estudio de 3,67, con una reducción neta de 1,93 puntos. Tampoco se encontraron diferencias significativas estadísticamente al comparar los resultados entre ambos grupos (p=0,43). Los puntos de corte estándar para definir mejoría de EULAR con DAS 28, fueron los siguientes: <3,2 puntos=buena respuesta, de 3,2 a 5,1 se consideró respuesta moderada y>5,1 puntos sin respuesta (fig. 4). Aplicando los criterios de remisión de EULAR (<2,6 puntos), 11 pacientes de ambos grupos alcanzaron este criterio.
En este gráfico se muestran los resultados e respuesta final de ambos grupos a la semana 52 del estudio. Corresponde al grupo de LFN una buena respuesta del 51,5% en comparación del de MTX con un 37,5%. Aplicando los criterios de remisión de EULAR (<2,6 puntos) mostraron que alcanzaron remisión 7 del grupo de LFN y 6 del de MTX.
Eventos adversos serios fueron considerados por los investigadores en 9 casos, 2 de ellos con reacciones dermatológicas que correspondieron a pacientes del grupo de LFN; uno de ellos desarrollo urticaria severa, un segundo presentó eritema polimorfo diseminado sobre el tronco. Seis pacientes presentaron elevación de enzimas hepáticas por arriba de 2,5 veces el rango normal; cuatro de ellos recibían LFN y 2 pertenecieron al grupo de MTX, todos ellos fueron retirados del estudio (fig. 1).
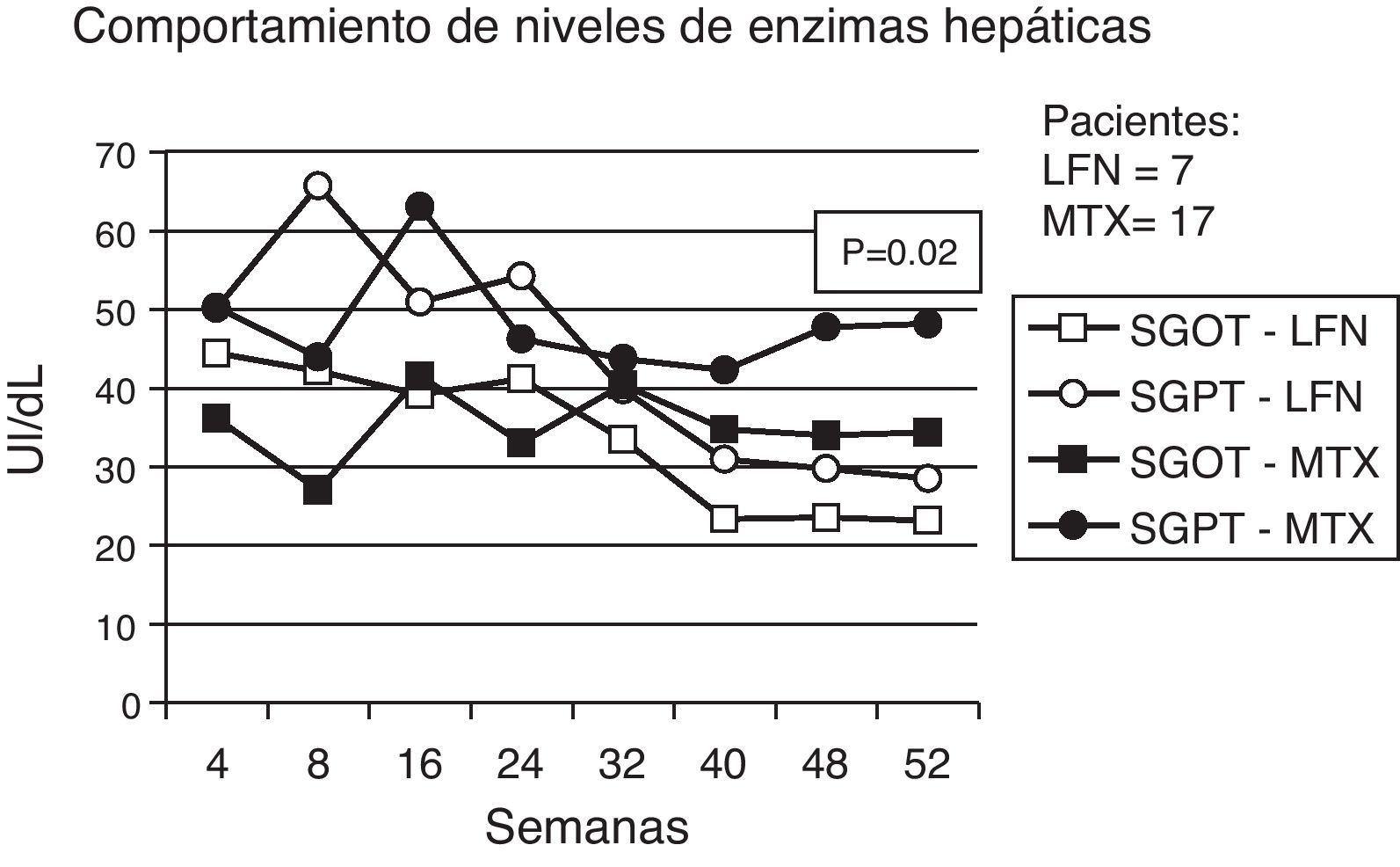
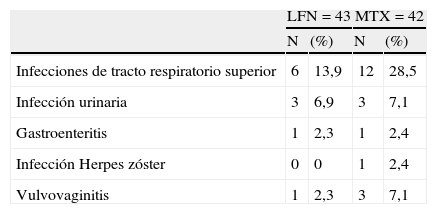
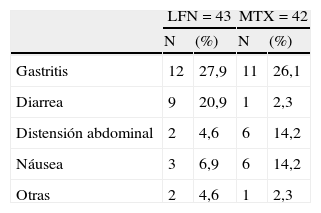
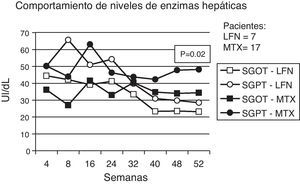
Eventos menos importantes fueron registrados para ambos grupos en que se incluyeron vasculitis, prurito, alopecia y cefalea. Presencia de infecciones fueron observadas en ambos grupos, teniendo un discreto porcentaje mayor en pacientes con tratamiento de MTX (tabla 2). Los eventos adversos gastrointestinales (GI), son descritos en la tabla 3, en donde incidió con mayor frecuencia los episodios de diarrea para el grupo de LNF. Los datos registrados por la alteración de las pruebas de función hepáticas fueron las siguientes: 7 y 17 casos observaron elevación de enzimas hepáticas para los grupos de LFN y MTX respectivamente por arriba de las cifras normales. Cuatro (9,3%) en el grupo de LFN persistieron elevados >2,5 veces el rango normal, por lo que los pacientes fueron retirados del estudio. En otros 3 pacientes, a pesar de haber elevado en cifras antes referidas, volvieron a cifras normales durante el estudio. Para el grupo de MTX, 2 pacientes presentaron elevación a esos mismos rangos por lo que fueron eliminados, otros 7 retornaron a cifras basales normales sin recidivas al final del estudio, no hubo diferencias estadísticamente significativas al comparar ambos grupos (p=0,02) (fig. 5). Tres casos de hipertensión arterial fueron detectados, 2 en el grupo de LFN y uno en el de MTX, para ambos grupos se clasificó como evento menor. Finalmente las alteraciones hematológicas documentadas en el grupo de LFN consistieron en leucopenia en 4 pacientes, 2 con anemia y uno con trombocitopenia; para el caso de MTX se registraron 2 casos de leucopenia, 2 con anemia y uno con trombocitopenia leve.
Enfermedades infecciosas registradas
| LFN=43 | MTX=42 | |||
| N | (%) | N | (%) | |
| Infecciones de tracto respiratorio superior | 6 | 13,9 | 12 | 28,5 |
| Infección urinaria | 3 | 6,9 | 3 | 7,1 |
| Gastroenteritis | 1 | 2,3 | 1 | 2,4 |
| Infección Herpes zóster | 0 | 0 | 1 | 2,4 |
| Vulvovaginitis | 1 | 2,3 | 3 | 7,1 |
En las enfermedades infecciosas que fueron registradas se muestra mayor prevalencia en las del tracto respiratorio en el grupo de MTX que en el de LFN.
Eventos gastrointestinales, no hepáticos
| LFN=43 | MTX=42 | |||
| N | (%) | N | (%) | |
| Gastritis | 12 | 27,9 | 11 | 26,1 |
| Diarrea | 9 | 20,9 | 1 | 2,3 |
| Distensión abdominal | 2 | 4,6 | 6 | 14,2 |
| Náusea | 3 | 6,9 | 6 | 14,2 |
| Otras | 2 | 4,6 | 1 | 2,3 |
Se reporta mayor frecuencia de eventos gastrointestinales como gastritis y diarrea en el grupo de LFN que en el de MTX como es observado en la literatura, sin embargo la distención abdominal fue más observada en el grupo de MTX.
No se registró ningún evento adverso que pusiera en riesgo la vida de los pacientes en ninguno de los 2 grupos.
DiscusiónEn la práctica diaria, los reumatólogos requieren de esquemas terapéuticos para la AR que sean eficaces y seguros, además que tengan flexibilidad en su forma de prescripción, con el objetivo de mantener la adherencia y apego al tratamiento y por tanto lograr los objetivos y metas de mejoría clínica o remisión de enfermedad9.
La LFN es un FARME no-biológico que pertenece a la clase de los isoxazoles; después de su administración es convertido rápidamente a su metabolito activo A77 1726, este metabolito induce su efecto terapéutico al inhibir la enzima dihidrorotato deshidrogenasa. Esta enzima es una llave importante en la producción de pirimidinas de novo en los linfocitos T. Esta molécula tiene una larga vida plasmática de aproximadamente 2 semanas (14-18 días)10.
Como referencia debemos comentar que estudios publicados indican que la respuesta de criterios de mejoría ACR 20 de pacientes con AR tratados con MTX como monoterapia oscila en rangos del 40 al 60% a los 6 y 12 meses de seguimiento11. Por otro lado, es bien conocido que el tratamiento de pacientes con AR tratados con LFN a dosis de 20mg/díaha demostrado beneficio en la respuesta clínica similar al MTX y otros FARME como la SFA11–13. Antecedentes del uso de LFN en dosis semanales han sido previamente documentados; Jakez-Ocampo et al. publicaron un estudio piloto, abierto con tratamiento de LFN a 100mg semanales en pacientes con AR refractaria14. En este estudio se incluyeron 16 pacientes, 8 de ellos en tratamiento con LFN 100mg/semanal y otros 8 con la dosis regular de 20mg diarios seguidos por un periodo de un año. El tratamiento base de los pacientes no fue modificado, incluyendo al menos la combinación de 2 o 3 FARME en asociación a diferentes dosis de esteroides. Los resultados mostraron beneficios en el tratamiento inicial al grupo de LFN 20mg/día, sin embargo, al final del estudio, no existieron diferencias estadísticamente significativas entre los 2 grupos, incluyendo la evolución de mejoría ACR 20. Eventos menores fueron reportados más frecuentemente en el grupo de LFN 20mg/día. Un segundo estudio fue realizado por los mismos autores15, que en esta ocasión compararon 3 grupos con AR de diagnóstico temprano (menor a un año). Treinta pacientes fueron distribuidos en 3 grupos; el primer grupo con 10 pacientes en tratamiento con LFN 100mg/semana, el segundo grupo de 10 pacientes en tratamiento con LFN 20mg/día y un tercer grupo en tratamiento con MTX a dosis de 7,5-15mg/semana, con un seguimiento a un año. A la octava semana del estudio se observó respuesta en los 3 grupos, observando nuevamente una respuesta más rápida en el grupo de LFN 20mg/día en comparación a LFN 100/semana y MTX/semana con una p=0,001 y p=0,03 respectivamente. Las diferentes variables evaluadas al final del estudio no mostraron diferencias significativas en ninguno de los 3 grupos. En relación a la presencia de eventos adversos, estos fueron más frecuentes en los grupos de LFN 20mg/día y MTX/semanal en comparación al grupo de LFN 100mg/semana.
Por otro lado nuestro grupo previamente llevó al cabo un estudio clínico abierto a 6 meses con la dosis semanal de LFN 100mg en pacientes con AR activa4. Cincuenta pacientes fueron enrolados en el estudio, iniciando el tratamiento con una dosis de impregnación de 100mg/día por 3 días, seguidos de una dosis semanal de LFN de 100mg por un periodo de 6 meses. Después de la semana 12, el 75% de los pacientes habían logrado alcanzar respuesta de mejoría ACR 20 y el 58% alcanzó un ACR 50. Al final del estudio el 74% alcanzó mejoría ACR 20, el 64% de los pacientes alcanzaron ACR 50 y el 28% ACR 70.
Los eventos adversos reportados en el estudio oscilaron en rangos del 2 al 16%, los cuales incluyeron principalmente cefalea, urticaria, pérdida de cabello, elevación de enzimas hepáticas y diarrea. Se concluyó en ese reporte un beneficio clínico como respuesta al régimen semanal de 100mg de LFN, mostrando eventos adversos menores ya reportados con anterioridad.
Los resultados obtenidos en el presente estudio muestran que para ambos fármacos en dosis subóptimas a las recomendadas, permiten mantener la adherencia y el apego al tratamiento en un porcentaje bastante aceptable, enfatizando que la dosis baja de MTX de 10mg/semana solo se recomienda actualmente al inicio del tratamiento, incrementándose en caso de ser tolerado por el paciente en forma rápida y escalonada16. Nosotros pudimos observar que a la semana 52, la permanencia de pacientes fue de 31 pacientes (72%) y 32 casos (76%) para los grupos de LFN y MTX respectivamente, con un global del 74% de permanencia, situación que difiere de reportes por otras autores, que alcanzan más de un 50% de pérdidas en los estudios para LFN con la dosis estándar17; cifra similar reportada en pacientes con seguimiento a largo plazo en tratamiento con MTX18.
Los resultados de mejoría ACR, HAQ-Di y VSG no mostraron diferencias significativas entre ambos grupos, subrayando que la dosis de MTX es considerada actualmente como subóptima y no comparable para valorar la eficacia de MTX en este estudio, ya que las recomendaciones actuales de EULAR, es el incremento rápido hasta alcanzar 20 o 25mg/semana para lograr reducir la actividad clínica. Los pacientes que finalizaron el estudio en el grupo de LFN, 28 alcanzaron la respuesta ACR 20 del 90,3% a la semana 52 (fig. 2), sin embargo, aplicando el cálculo de muestra de pacientes intencionados a tratar (ITT), la respuesta ACR 20 fue del 67,4%. Dos pacientes fueron eliminados del grupo de LFN por no alcanzar mejoría ACR 20, a comparación del de MTX que fueron 4 casos.
Con relación a los eventos adversos, el grupo de LFN fueron similares a los reportados en la literatura, afectando a la piel con lesiones urticarianas y eritematosas, alopecia y episodios de diarrea. La toxicidad hepática fue aparentemente menor en el grupo de LFN, y solo un paciente permaneció con elevación de enzimas persistente; en este caso se realizaron estudios complementarios que permitieron descartar hepatitis viral, y solo se logró evidenciar por ultrasonido convencional hígado graso. Los pocos y no serios eventos adversos identificados, probablemente estén en relación a la baja dosificación de LFN utilizada11.
Podemos concluir en este estudio clínico que la dosis semanal de 100mg de LFN ofrece una adecuada y sostenida respuesta en los pacientes que responden a este fármaco, permitiendo una adherencia y apego mayor a los reportados en la literatura para el tratamiento convencional; además de mostrar aparentemente un menor número de eventos adversos reportados comparados que con la dosis estándar recomendada. Actualmente la dosis de impregnación en la práctica común ya no se lleva al cabo, por ello, desafortunadamente en algunos países han retirado del mercado la presentación de tabletas de LFN 100mg. Este esquema también permite abrir la posibilidad de su uso como monoterapia o en combinación con otros FARME, incluido al MTX como un esquema atractivo de dosificación evitando la polifarmacia19. Por otro lado, la dosis semanal de LFN 100mg/semanal representa un ahorro económico para los pacientes al usar una menor dosis del fármaco y manteniendo su eficacia; esta situación es aplicable solo en los países en donde no existe un sistema de salud que permita una cobertura total de su población.
Finalmente, queremos subrayar que la falta de eficacia observada en los pacientes del grupo de MTX, pudiese ser un reflejo de la dosis baja utilizada para fines de este estudio, pero de ninguna manera sería una recomendación por los autores para su uso en la práctica clínica diaria.
Estudios con poblaciones mayores y a largo plazo, permitirán ratificar los resultados que hemos obtenido en esta investigación.
FinanciaciónEn este trabajo no existió ninguna relación financiera con ninguna de las empresas farmacéuticas de los fármacos utilizados para el estudio y los investigadores. Los fármacos fueron obtenidos a través del mismo instituto (ISSEMyM) donde se desarrolló la investigación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. Eduardo Brea Andrés, por la revisión de la metodología y análisis de resultados; asimismo, al Dr. Rodrigo Suárez Otero por la revisión y sugerencias al trabajo.