Los resultados de estudios previos muestran una amplia variabilidad en los medios diagnósticos y terapéuticos en artritis reumatoide (AR) en España. La calidad asistencial se beneficiaría al aplicar estándares de práctica apropiados; se presenta un estudio sobre variabilidad en el manejo de la AR en España.
MétodosEstudio descriptivo de revisión de historias clínicas (HC) de pacientes con AR de edad mayor de 16 años, seleccionados por muestreo estratificado por comunidades autónomas y bietápico por centro hospitalario y paciente. Se recogió datos sociodemográficos, evolución, seguimiento, recuento articular, reactantes, función, vida laboral, escalas visuales analógicas (EVA) y otros.
ResultadosSe obtuvo información válida de 1.272 pacientes con AR. Se empleó mayoritariamente la VSG, PCR y factor reumatoide (FR). Los porcentajes de ausencia de datos en los recuentos de articulaciones dolorosas (NAD) y tumefactas (NAT) son el 8,2 y el 9,6%; se utilizaron poco las EVA.
ConclusionesA pesar de tener una guía de práctica clínica sobre la AR, existe variabilidad en su manejo.
There is a wide variability in the diagnostic and therapeutic methods in rheumatoid arthritis (AR) in Spain, according to prior studies. The quality of care could benefit from the application of appropriate clinical practice standards; we present a study on the variability of clinical practice.
MethodsDescriptive review of clinical records (CR) of patients aged 16 or older diagnosed with RA, selected by stratified sampling of the Autonomous Communities in two stages per Hospital Center and patient. Collected analysis of sociodemographic data, evolution, follow-up, joint count, reactants, function, job history, Visual Analogue Scales (VAS) and other.
ResultsWe obtained valid information of 1,272 RA patients. The ESR, CRP and rheumatoid factor (RF) were regularly used parameters. The percentages of missing data in tender (TJN) and swollen (SJN) joint counts were 8.2% and 9.6% respectively; regarding the VAS we found 53.6% (patient), 59.1% (pain), and 72% in the physician VAS.
ConclusionsDespite having clinical practice guidelines on RA, there still exists a significant variability in RA management in our country.
Las variaciones en la práctica clínica (VPC) se definen como las diferencias en el proceso asistencial y/o en el resultado de la atención de un problema clínico concreto, entre diversos proveedores o uno mismo, una vez controlados los factores demográficos, socioculturales y de estado de salud1. El estudio del problema de la variabilidad en la práctica médica tiene su origen con los trabajos de Wennberg y Gittelshon2,3. Se reconoce que la VPC es influida por diversos factores, como la inexactitud de los datos o de su tratamiento4, los relacionados con la demanda de cuidados5, las características de los profesionales sanitarios6 y los dependientes del sistema sanitario7. Además, se sabe que tanto la comorbilidad, como las características de la enfermedad y del propio paciente influyen en la expresión clínica, aunque es preciso saber si estos efectos obedecen a factores modificables8. Todos estos datos justifican la realización de estudios de evaluación de las VPC de una determinada enfermedad8–10. En este sentido, los resultados del primer estudio sobre variabilidad en el manejo de la AR en España (emAR I), realizado hace 10 años, mostraron amplias diferencias en el uso de distintos recursos sanitarios, procedimientos diagnósticos y terapéuticos y formas de seguimiento de los pacientes con AR que, en muchos casos, era independiente de las características del paciente o de la gravedad de la enfermedad11,12. Por otra parte, y debido a posibles factores genéticos o ambientales, se han descrito variaciones en la prevalencia de la AR, así como en su expresión clínica en distintas poblaciones y con igual origen geográfico8. Para explicar esta VPC existen 3 teorías según confieran más importancia a la demanda de atención (la prevalencia del proceso en un área determinada, la edad de la población, el nivel socioeconómico)13, o bien incidan en la importancia de la oferta, tanto por la incertidumbre del profesional sanitario14 (falta de evidencia científica existente sobre los procedimientos) como por la prevalencia de médicos partidarios de un procedimiento15. La VPC es frecuente en medicina y origina una utilización incorrecta de los procedimientos, con repercusión negativa en el consumo de recursos y posibles efectos perjudiciales para los pacientes. El objetivo de este trabajo es describir las características clínicas, de actividad, incapacidad laboral y comorbilidad de los pacientes con AR en España. Los datos proceden del emAR II, un estudio sobre variabilidad en el manejo de la AR y las espondiloartritis (EsA), medida según distintos indicadores, y diversos factores dependientes del individuo, de la enfermedad y del sistema sanitario.
MétodosEl emAR II es un estudio transversal de asociación cruzada entre la variabilidad en el manejo de la AR y las EsA y diversos factores16.
Selección de la población de estudioLa muestra estuvo formada por HC de pacientes con AR o EsA atendidos en servicios de Reumatología de hospitales españoles que tenían al menos una visita al reumatólogo en los 2 años anteriores a la fecha de inicio del estudio. Se realizó un muestreo estratificado por comunidades autónomas (CC. AA.) y bietápico por centro hospitalario (unidad de primera etapa [UPE]) y paciente (unidad de segunda etapa [USE]). Para evitar la falta de representatividad asociada a la homogeneidad de UPE, en la primera etapa se efectuó un muestreo con probabilidad proporcional a su tamaño y en la segunda se llevó a cabo una selección aleatoria, equiprobabilística, de los pacientes de cada centro. El tamaño muestral se calculó según la hipótesis de que la proporción de pacientes que han necesitado cirugía ha pasado del 26% en el emAR I al 18% en el emAR II. Bajo esta premisa y asumiendo un error alfa de 5%, una potencia del 80%, un 15% de historias no localizadas o incompletas con un efecto de diseño de 2,5, se obtuvo un tamaño muestral de 1.410 pacientes para cada uno de los brazos del estudio. En este trabajo solo se considera el brazo de estudio de AR. Se obtuvo información sobre datos generales de la HC: fecha de nacimiento, sexo, fecha de inicio de los primeros síntomas, de la primera visita a un reumatólogo y de diagnóstico, cumplimiento de los criterios del ACR, clase funcional del ACR, positividad del factor reumatoide (FR) y de péptidos cíclicos citrulinados (PCC), progresión radiológica, manifestaciones extraarticulares. La evolución específica se valoró mediante diversos parámetros: reactantes de fase aguda (valores máximos y mínimos de VSG, PCR), escalas visuales analógicas (EVA) con la mejor y peor valoración subjetiva del médico y el paciente sobre la actividad de la enfermedad (ninguna cuando el EVA de actividad era <10mm o remisión completa a criterio médico ó algún criterio objetivo habitual; leve cuando el EVA era ≥10 y<40 o paciente con actividad leve que no requiere modificación de tratamiento; moderada cuando el EVA era ≥40 y<60 o paciente que ha requerido modificación menor del tratamiento, como incremento transitorio de dosis de AINE o corticoides; grave cuando el EVA era ≥60 o actividad grave con modificación mayor del tratamiento, como incremento de dosis, adición o cambio de FAME), valores mínimos y máximos de las EVA de dolor y actividad, así como del número de articulaciones dolorosas (NAD) y tumefactas (NAT), duración mínima y máxima de la rigidez matutina, valores mínimos y máximos del Disease Activity Score (DAS-28) y Health Assessement Questionnaire (HAQ). Además, se recogió información sobre la frecuencia de utilización de diferentes procedimientos de seguimiento clínico (con las opciones de nunca si no se utilizó en ninguna visita, ocasionalmente si fue en menos del 25%, habitualmente si fue entre el 25 y 75%, y siempre si fue en más del 75% de las visitas), recuentos articulares (de 28 articulaciones u otros), evaluación del dolor por el médico y el paciente (por EVA u otros procedimientos), reactantes de fase aguda (VSG, PCR u otros), índices de actividad compuestos (DAS, SDAI u otros), capacidad funcional (clase funcional de la ACR17, HAQ), comorbilidad, vida laboral activa en más del 50% en los 2 últimos años, características del paciente (nivel de estudios, profesión, residencia) y del médico responsable. Aunque no se utilizaron para este trabajo, en las hojas de recogida de datos (HRD) también se recogió amplia información sobre consumo de recursos, tratamiento con AINE, analgésicos, corticoides, fármacos antirreumáticos de acción lenta (ARAL), infiltraciones y otras medicaciones, fármacos biológicos, profilaxis gástrica y de osteoporosis.
Análisis estadísticoSe realizó un estudio descriptivo mediante medidas de tendencia central (media o mediana) y de dispersión (desviación estándar y percentil 25 y 75) para las variables continuas, según se ajustaran o no a una distribución normal, y porcentajes para las variables cualitativas. Se clasificó el DAS-28 en 3 niveles de actividad: baja (DAS≤3,2), moderada (DAS 3,2-5,1), y alta (DAS>5,1). El programa estadístico que se utilizó Stata 9.0 (StataCorp, Collage Station, EE.UU.).
ResultadosCaracterísticas sociodemográficasDe la muestra teórica a extraer (N=1.410) se obtuvo información válida de 1.272 pacientes con AR, lo que supone un 90,2% de la muestra teórica. En la tabla 1 se presentan las características sociodemográficas.
Características sociodemográficas de los pacientes de AR
| Característica | Mediana (p25-p75) o N (%) | No consta en historia clínica, N (%) |
| Edad actual (años) | 63,3 (51,6-73,3) | |
| Edad al inicio de la enfermedad | 49,8 (23,2-39,8) | |
| Tiempo evolución (meses) | 94,8 (46,2-167,9) | |
| Sexo (n=1.267) | ||
| Hombre | 339 (26,8) | |
| Mujeres | 928 (73,2) | |
| Estado civil (n=1.263) | 733 (58,0) | |
| Soltero | 49 (3,9) | |
| Casado | 397 (31,4) | |
| Viudo | 67 (5,3) | |
| Separado | 17 (1,3) | |
| Nivel de estudios (n=1.257) | 903 (71,8) | |
| Ninguno | 30 (2,4) | |
| Primarios | 217 (17,3) | |
| Secundarios | 58 (4,6) | |
| Superiores | 49 (3,9) | |
| Profesión (n=1.251) | 657 (52,5) | |
| Dirección empresas y administración | 5 (0,4) | |
| Técnicos, profesionales, intelectuales | 24 (1,9) | |
| Técnicos y profesionales de apoyo | 22 (1,7) | |
| Trabajadores de servicios | 44 (3,5) | |
| Trabajadores agricultura y pesca | 41 (3,3) | |
| Trabajadores de industrias | 13 (1,0) | |
| Operadores y montadores | 42 (3,3) | |
| Trabajadores no cualificados | 20 (1,6) | |
| Fuerzas armadas | 101 (8,1) | |
| Ama de casa | 14 (1,1) | |
| Estudiante | 262 (20,9) | |
| Residencia (N=1.266) | 56 (4,4) | |
| Misma localidad | 666 (52,6) | |
| Distinta localidad | 544 (43,0) | |
| Distancia al hospital (N=542) | ||
| Menor de 20km | 188 (34,7) | |
| Entre 20-50km | 204 (37,6) | |
| Mayor de 50km | 130 (24,0) | |
| No sabe | 20 (3,7) | |
| Vida laboral activa>50% (N=1.161) | 632 (54,4) | |
| Sí | 401 (34,5) | |
| No | 128 (11,0) | |
| Períodos de ILT* (N=460) | 393 (85,4) | |
| Si | 33 (7,2) | |
| No | 34 (7,3) | |
| Número de episodios de ILT* | 2 (1-2) | |
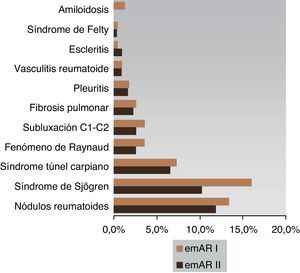
El 93,4% de los pacientes cumplían suficientes criterios ACR de 1987 para su clasificación. La mayoría de los pacientes se encontraba en una clase funcional I (36%), mientras que unas proporciones sensiblemente menores se situaban en las clases funcionales II (16,3%) y III (11,3%). La limitación para cualquier tipo de actividad solo ocurría en el 6,4% de los pacientes y no constaban datos de la clase funcional en el 29,9% de las HC. El FR presentó una determinación positiva en el 73,9% de los casos, mientras que solo el 41,3% tuvo PCC positivos a lo largo del seguimiento. Estas diferencias se mantuvieron también ante la falta de constancia de estos datos en la HC (1,3% en el FR frente al 40,6% para los PCC). La utilización del FR tuvo una mediana (p25-p75) de 3 (1-5), mientras los valores en los PCC fueron de 0 (0-1). Una proporción muy importante de casos presentó enfermedad erosiva (58,7%), no habiéndose realizado estudio radiológico en el 4,8%. Se encontró una manifestación extraarticular en 306 (24,1%) pacientes, 2 en 71 (5,6%), 3 en 16 (1,3%) y 4 en 4 (0,3%) pacientes, y el 31,3% presentaba alguna manifestación extraarticular (fig. 1).
Evaluación de la actividad y la capacidad funcionalLos reactantes de fase aguda empleados de forma metódica fueron la VSG (77,8%) y la PCR (75,1%), oscilando los valores mediana (P25-P75) mínimo y máximo entre 11 (5-20) y 33 (18-51) en el caso de la VSG, y entre 0,3 (0,2-0,9) y 1,5 (0,2-0,9) en el de la PCR. La valoración, mediante EVA del dolor y la actividad por parte del paciente, mostró valores similares entre ambas escalas, con valores mínimos según el paciente de 20 (6-30) para el dolor y de 17 (5-30) para la actividad, y máximos de 50 (25-70) y 50 (27-70) para el dolor y la actividad. Cuando la evaluación de la actividad era realizada por un médico, el mínimo y el máximo eran de 10 (5-20) y de 40 (14-60), respectivamente. Las mejores y peores evaluaciones de la actividad por parte del paciente mostraron unos patrones de distribución similares a las efectuadas por sus respectivos médicos. La rigidez matutina mostró mínimos de 0 (0-10) y máximos de 20 (0-60) min. Los porcentajes de HC, con ausencia de datos en las evaluaciones mencionadas anteriormente, fueron el 59,1% para la EVA de actividad según el paciente; el 72% para la EVA de actividad según el médico y el 50,5% para la rigidez matutina.
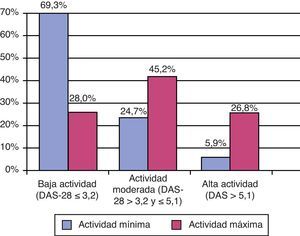
Los valores mínimos y máximo del DAS-28 mostraron una actividad baja con mediana (p25-p75) de 2,5 (1,9-3,5) y moderada 4,1 (p25-p75) (3,0-5,2); la distribución por categorías confirmó estos resultados (fig. 2). De forma paralela, la capacidad funcional según el HAQ estaba bastante conservada, con valores mínimo y máximo de 0,4 (0-1,0) y 1,0 (0,4-1,6). No existían datos de HAQ en el 86,6% de las HC revisadas. El dato del DAS no se encontró en la HC del 55% de la muestra estudiada, en el caso de pacientes tratados con biológicos no existía constancia de un DAS previo al inicio de este tratamiento en el 47,3% (222 casos de los 469 que iniciaron tratamiento biológico) de los que lo recibieron. A pesar del elevado número de valores faltantes en ambas determinaciones, solo se registró en la HRD la ausencia simultánea de ambos datos en la HC en 207 casos, lo que representa el 44,1% de los pacientes que recibieron biológicos.
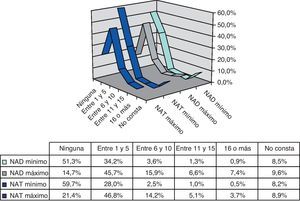
Recuentos articularesLa mayoría de los pacientes presentaron un recuento mínimo de NAD de 0 (51,3%) o entre 1 y 5 (34,2%) y un numero máximo de 1 a 5 (45,7%) o entre 6 y 10 (15,9%). La distribución del recuento mínimo del NAT era simétrica a la del NAD, presentando la mayoría de los pacientes ninguna o entre 1 y 5 articulaciones afectadas. Del mismo modo, se observó simetría entre el recuento máximo de NAD respecto al NAT, situándose la mayoría de los pacientes en la categoría de entre 1 y 5 articulaciones, y con los valores mínimos en los grupos entre 11 y 15, ó más de 16 (fig. 3).
Seguimiento clínicoRespecto de los diversos procedimientos de seguimiento clínico utilizados, los resultados mostraron que la evaluación mayoritaria se efectuó por el recuento de 28 articulaciones (siempre en el 41,4%) y nunca por otros recuentos (57,2%). Por el contrario, hay que destacar que en general no se utilizaron EVA para evaluar el dolor, ni por parte del médico ni del paciente, según se muestra en la tabla 2, aunque sí en mayor medida los reactantes de fase aguda VSG y PCR. Asimismo, el grado de respuesta según la mejor evaluación subjetiva de la actividad de la enfermedad por el médico y la peor evaluación subjetiva de la actividad se muestra en la tabla 3.
Grado de utilización de los instrumentos de seguimiento clínico (frecuencia: n, [%])
| Procedimientos, otros procedimientos, evaluaciones y reactantes | Nunca | Ocasionalmente | Habitualmente | Siempre |
| Recuento de 28 articulaciones (N=1.231) | 172 (14,0) | 231 (18,8) | 318 (25,8) | 510 (41,4) |
| Recuento articular: otro (N=787) | 450 (57,2) | 102 (13,0) | 116 (14,7) | 119 (15,1) |
| Evaluación dolor (medico): EVA (N=1.217) | 718 (59,0) | 217 (17,8) | 248 (12,2) | 134 (11,0) |
| Evaluación dolor (medico): Otro (N=821) | 518 (63,1) | 95 (11,6) | 133 (16,2) | 75 (9,1) |
| Evaluación dolor (paciente): EVA (N=1.225) | 540 (44,1) | 257 (21,0) | 219 (17,9) | 209 (17,1) |
| Evaluación dolor paciente: Otro (N=808) | 487 (60,3) | 79 (9,8) | 134 (16,6) | 108 (13,4) |
| Reactantes fase aguda: VSG (N=1.259) | 17 (1,3) | 62 (4,9) | 201 (16,0) | 979 (77,8) |
| Reactantes fase aguda: PCR (N=1.219) | 38 (3,1) | 97 (8,0) | 169 (13,9) | 915 (75,1) |
| Reactantes fase aguda: otro (N=676) | 410 (60,6) | 108 (16,0) | 47 (6,9) | 111 (16,4) |
| Índices compuestos: DAS-28 (N=1.226) | 592 (48,3) | 226 (18,4) | 226 (18,4) | 182 (14,8) |
| Índices compuestos: SDAI (N=1.053) | 1.013 (96,2) | 14 (1,3) | 18 (1,7) | 8 (0,8) |
| Índices compuestos: otro (N=833) | 763 (91,6) | 26 (3,1) | 35 (4,2) | 9 (1,1) |
| Capacidad funcional: HAQ (N=1.218) | 747 (61,3) | 222 (18,2) | 150 (12,3) | 99 (8,1) |
| Capacidad funcional: otro (N=888) | 704 (79,3) | 52 (5,9) | 83 (9,3) | 49 (5,5) |
Comparación de utilización de los instrumentos de seguimiento clínico entre estudios sobre la variabilidad en el manejo de la AR. n, (%)
| Estudio | Valoración actividad paciente* (n, %) | Valoración actividad médico* (n, %) | HAQ† (%) | NAD (%) | NAT (%) | Recuento de 28 articulaciones (%)† | Rigidez matutina (%) |
| emAR II | 328-65 (26 - 5,1) | 350-75 (27,9-5,9) | 61,3 | (figura 3) | (figura 3) | 14,0 | N. C |
| 421-238 (33,3-18,9) | 413-251 (33-19,9) | 18,2 | 18,8 | 50,5% | |||
| 164-335 (13-26,6) | 121-341 (9,6-27,1) | 12,3 | 25,8 | ||||
| 27-289 (2,1-22,9) | 14-222 (1,1-17,6) | 8,1 | N. C. | N. C. | 41,4 | ||
| 321-333 (25,4-26,4) | 355-371 (28,3-29,4) | 9,0 | 8,0 | ||||
| Bellamy et al19 (%) | |||||||
| nunca | 29 | 21 | 16 | 5 | 3 | 10 | 2 |
| ocasional | 20 | 13 | 13 | 13 | 15 | 5 | |
| habitual | 26 | 34 | 40 | 38 | 37 | 31 | |
| siempre | 25 | 32 | 42 | 46 | 38 | 62 | |
| emAR I24 | |||||||
| nunca | 707 (51,3) | 536 (38,8) | 76,9 | 4,0 | 2,4 | 85,5 | 15,9 |
| ocasional | 246 (17,8) | 248 (17,9) | 12,7 | 8,4 | 8,5 | 7,3 | 17,6 |
| habitual | 227 (16,4) | 357 (25,9) | 8,6 | 36,2 | 37,9 | 5,8 | 30,5 |
| siempre | 199 (14,3) | 238 (17,1) | 1,5 | 51,2 | 51,0 | 1,1 | 35,8 |
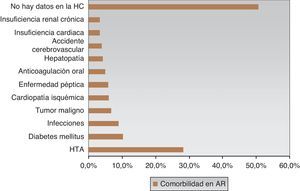
Las comorbilidades más frecuentes fueron HTA (28,2%) y diabetes (10,2%). Sin embargo, no hubo constancia en la HC de comorbilidades en el 50,6% de AR (fig. 4), lo que no significa que los pacientes pudieran presentar otras situaciones mórbidas no contempladas en la HRD. En el emAR I el 37% de los pacientes tenía alguna comorbilidad18, siendo la HTA la más frecuente (20%), seguida de la enfermedad péptica (14%), la diabetes (7%) y, con menor frecuencia, la insuficiencia renal, hepatopatía y terapia anticoagulante (3%).
Repercusión laboralEl 34,5% de los pacientes con AR tuvieron una vida laboral activa durante más del 50% del periodo de estudio, con unos datos sobre los periodos de incapacidad laboral transitoria que se muestran en la tabla 1.
DiscusionEn cuanto a lascaracterísticas clínicas de la AR, en una comparación entre los resultados obtenidos en el estudio emAR II con los del emAR I, no se aprecia gran variación en algunos parámetros, como la edad (media±DE) con valores de 62,0±14,5 años vs. 61,3±13,5 años; porcentaje de mujeres 73,2 vs. 73,5% y positividad del FR 74,0 vs. 75,9% y tiempo medio de evolución en meses 122,8±107,3 vs. 127,6±97,6, respectivamente18. Sin embargo, se encuentran diferencias estadísticamente significativas respecto de la situación funcional medida por la clase funcional ACR, puesto que los pacientes del emAR II en relación con el emAR I presentan una situación funcional significativamente mejor, con una frecuencia mayor en la clase I (36% vs. 27%) y menor proporción en las clases II (16,3% vs. 40%) y III (11,3% vs. 26%), aunque en la clase funcional IV los resultados son similares (6,4% vs. 6,5%)18. Además, se subraya como una constante la ausencia de esta información en la HC de una importante proporción de pacientes, en ambos estudios (31,2% vs. 29,9%). La escasez de datos en las HC revisadas es similar a la que se encuentra al comparar con el estudio de Bellamy et al., pues la clase funcional ACR se utiliza solo en el 49% de la muestra, seguido en el 16% por el HAQ19. La ausencia de datos en el DAS se podría valorar como parte de una variabilidad justificada por las características de la enfermedad, ya que en pacientes más leves podría no ser obligada la recogida de este dato debido a la falta de indicación del tratamiento con biológicos. Sin embargo, en los casos que inician tratamiento con biológicos la ausencia de DAS antes de la instauración de este tratamiento, situación que se produjo en el 53% de los pacientes que iniciaron este tratamiento, puede entenderse como una variabilidad no justificada.
En relación con las pruebas de laboratorio, el estudio de Donald et al. encuentra en la AR que alguno de estos parámetros son utilizados por el 86% de los profesionales, especialmente la VSG (65,9%) y ambos parámetros con mucha menor frecuencia (18,7%)20. En nuestro estudio, los porcentajes de utilización fueron más elevados, 77,8% para la VSG y 75,1% para la PCR. Según el citado estudio de Donald et al., los factores que influyen en la decisión de pedir una prueba de laboratorio, en orden de mayor a menor grado de importancia son: la experiencia clínica, la evidencia de la literatura, el aprendizaje como interno residente, la experiencia de otros especialistas y la repercusión económica; asimismo, expone que la mayoría de los participantes en la encuesta creen que utilizan los tests de laboratorio de la misma manera que otros reumatólogos, lo cual se podría considerar como una de las propuestas básicas de la hipótesis de la incertidumbre, que se refiere a la escasa variabilidad cuando existe acuerdo entre los clínicos sobre el valor de un procedimiento21. Además, estos autores analizan si la petición de pruebas de laboratorio se asocia con diversas variables (región geográfica, número medio de pacientes al mes, aseguramiento de los pacientes y la existencia de un laboratorio), sin encontrar diferencias entre los que utilizan y no utilizan las pruebas de laboratorio; aunque, en el grupo de AR, se obtuvieron diferencias estadísticamente significativas entre los que utilizan y no utilizan las pruebas de laboratorio en más del 50% de las visitas, pues encuentran que estos últimos profesionales tienen mayor probabilidad de haber realizado prácticas en un hospital universitario mientras que la distribución de otros lugares de trabajo es similar entre ambos grupos20. En este sentido, la función docente de los hospitales es un factor de variabilidad en la utilización de los parámetros de laboratorio, pues de hecho se han observado variaciones significativas en el empleo de factor reumatoide, otras pruebas de laboratorio y radiografías periféricas o axiales, entre residentes de reumatología y reumatólogos de hospitales no docentes, con un leve aumento de utilización por parte de los primeros12. Sin embargo, Henke et al. consideran que las diferencias en el estilo de la practica individual (tendencia de los proveedores para utilizar procedimientos más o menos frecuentemente que el promedio) es la causa más importante de variación en la utilización de estas pruebas por encima de las características de los pacientes o los incentivos asociados a la práctica22. En adición, la revisión de Marovic et al. exponen otros factores contribuyentes a la heterogeneidad que se encuentra entre los estudios, como la variabilidad consecuencia de un inadecuado acceso a cuidados sanitarios y/o seguros sanitarios o una educación medica continuada inadecuada23.
En relación con la valoración del dolor y la evaluación de la actividad, el emAR II muestra que la cumplimentación mediante EVA no es un procedimiento de seguimiento clínico muy utilizado, sino que lo más habitual es el recuento de 28 articulaciones, como se muestra en la tabla 3 al comparar los valores entre los estudios19, aunque Bellamy et al. exponen que se encuentran unos porcentajes mayores de utilización cuando se monitoriza el tratamiento con AINE (68%), terapia de segunda línea con DMARD (76%) y glucocorticoides (66%), lo cual según refieren se podría explicar porque la utilización de las escalas en el seguimiento clínico tiene una variación según se realicen en estudios basados en la práctica habitual o en ensayos clínicos19. En este sentido, Pincus et al. exponen que en una convención de especialistas se pregunta sobre la frecuencia de la realización de recuentos de articulaciones dolorosas e inflamadas en relación al número de visitas en la rutina de pacientes con AR (en ninguna visita, entre 1 a 24, de 25 a 49, entre 50 a 74, más del 75% de las visitas y siempre) y encuentran los siguientes porcentajes de respuesta afirmativa según el número de visitas: el 13, el 32, el 11, el 14, el 16 y el 14%, respectivamente; al igual que Bellamy et al. comunican que las discrepancias se pueden explicar por el tipo de estudio, pues se realiza en una convención internacional en lugar de observaciones reales o una revisión de historias clínicas25. También la discrepancia entre la importancia teórica atribuida a la utilización de las mediciones cuantitativas respecto de la práctica habitual, se expresa en un estudio de Singh et al., sobre las actitudes del clínico en la mielopatía cervical espondilótica, y sugieren que estas escalas son infrautilizadas o inadecuadas para la práctica clínica, por lo cual concluyen que podrían requerir una nueva escala de fácil uso y que reflejara mejor sus requerimientos clínicos26. Así, para el 80% de los reumatólogos participantes en el estudio de Bellamy et al., las características relevantes en los procedimientos de medición utilizados en la práctica clínica habitual son: simplicidad, realización rápida, puntuación fácil, fiabilidad, validez y sensibilidad19.
Las manifestaciones extraarticulares del emAR II se pueden enmarcar con las de un estudio realizado en 15 países, que muestra una variación en la prevalencia extraarticular del 15% (Holanda, Italia) al 30% (Alemania, Dinamarca, Polonia, Gran Bretaña), con un 22,9% para España27.
En relación con la incapacidad laboral, al comparar con una cohorte donde el período de observación era de 9 (4-16) años, se registra un 37% de pacientes con discapacidad laboral28. La constancia de datos en el emAR II (54,4%) es parecida al emAR I (49,1%)18. La incidencia de IT en el emAR I en pacientes laboralmente activos con AR fue de 14,4 personas por 100 pacientes en 2 años, mientras que en el emAR II este resultado fue de 7,2%, aunque hay que tener en cuenta que la vida laboral solo se recoge en un total de 460 HC, por lo que estos resultados deben interpretarse con cierta cautela, ya que la eficiencia en la recogida de los datos no ha sido del todo correcta. En primer lugar, es bastante frecuente que las HC no recojan este tipo de información, pero además, la incapacidad laboral recogida no se ha limitado, exclusivamente, a la derivada de la patología en estudio, sino que se han incluido otros procesos más o menos incapacitantes (tabla 1). A la hora de interpretar los resultados del presente estudio, es preciso tener en cuenta sus limitaciones. La duración de la recogida de datos fue solo de 2 años y, por lo tanto, la interpretación de los resultados obtenidos debe realizarse con precaución. Además, hay que tener en cuenta que los datos pueden no ser fácilmente extraíbles de la HC y no localizables en el documento escrito lo cual influye en la validez de los resultados4. Hay que añadir también las diferencias ya enumeradas anteriormente, que se encuentran en la utilización de las escalas en el seguimiento clínico o del recuento articular según el tipo de estudio, pues se tiene una variación según se realicen en estudios basados en la práctica habitual o en ensayos clínicos19,24, como ya se expone en otros estudios los índices cuantitativos son infrecuentemente utilizados en la practica clínica habitual29. A modo de conclusión, se puede resumir que, a pesar de la existencia de una guía de práctica clínica sobre AR (GUIPCAR)30, los resultados del emAR II muestran una importante variabilidad en algunos apartados de la HC, con utilización muy frecuente de los parámetros de evaluación clínica y los recuentos articulares, aunque menos común de la evaluación del dolor, actividad de la enfermedad, capacidad funcional y los índices compuestos como el DAS-28. Este tipo de estudios puede detectar el grado de cumplimiento recomendado por las guías de práctica clínica y disminuir la VPC.
FinanciaciónEl estudio emAR II ha sido promovido por la Sociedad Española de Reumatología y financiado por laboratorios Abbott.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Grupo de Estudio emAR II (Sociedad Española de Reumatología): J. Alegre, J.L. Alonso, M. Alvarez, B. Alvárez, A. Aragón, F.X. Arasa, M.J. Arias, J. Beltrán, J. Babío, C. Bohorquez, D. Boquet, S. Bustabad, A. Casado, J. Calvet, S. Castro, M.R. Colazo, E. Collantes, E. Cuende, N. Chozas, E. Delgado, D. de la Fuente, A. de Juanes, E. del Rincón, E. Enríquez, C. Escudero, L. Espadaler, P. Espino, A. Fernández, J. Fernández, L. Fernández, J. Fiter, P. Font, J. Galvez, A. Gallego, J. García, J. García, M.E. García, F. Gamero, E. Giménez, S. Gómez, B. González Álvarez, S. González, M. Granados, G. Iglesias, V. Irigoyen, F. Jimenez, E. Júdez, C. López, M. López, R. López, F.J. López-Longo, J. Maese, F.J. Manero-Ruiz, S. Manrique, I. Maries, C. Martínez, A. Martínez-Cristóbal, I. Mateo, J. Marzo, F. Medina, J. Medina, M. Medrano, P. Mesa, R. Miguélez, I. Monteagudo, C. Montilla, I. Moreno, M.L. Muñoz, A. Naranjo, R. Negueroles, M. Nolla, S. Ojeda, C. Ordás, S. Ordóñez, A.M. Ortíz, E. Pagán, A. Pecondón, S. Pérez Esteban, E. Pérez-Pampín, J.M. Pina, J.A. Piqueras, M.J. Pozuelo, V. Rios, N. Rivera, C. Rodríguez, J.M. Rodríguez, R. Roselló, M.J. Rubira, D. Ruiz, E. Saiz, M. Sánchez, T. Tinturé, C. Tornero, J. Tornero, E. Úcar, I. Ureña, C. Vázquez, R. Veroz, E. Vicente y J. Zubieta.
Los nombres de los componentes del Grupo de Estudio emAR II están relacionados en el Anexo 1.