Revisar la eficacia y seguridad del rituximab en neuropatía vasculítica (NV).
MétodosSe realizó una búsqueda en la literatura de Medline y Embase hasta 2017. Los términos incluidos guardaron relación con «vasculitis», «neuropatía vasculítica» y «rituximab». Dicha búsqueda fue realizada por 2 revisores. El resultado principal fue la eficacia del rituximab.
ResultadosTras seleccionar inicialmente 702 artículos, 5 de ellos permanecieron con un nivel de evidencia de entre 1+ y 3, y un grado de recomendación variable. En el único ensayo clínico incluido, el rituximab fue superior a la terapia convencional para vasculitis crioglobulinémica, mostrando NV un incremento en la tasa de retención farmacológica (64,3 vs. 3,5%; p<0,001) y una menor tasa de efectos adversos graves (0,12 vs. 0,48). Los estudios de cohortes de pacientes con vasculitis crioglobulinémica incluyeron una mejora probada y una remisión completa/parcial de NV. En una serie de 5 casos de EGPA refractaria con NV, el 60% y el 20% de los pacientes lograron una remisión completa y parcial, respectivamente.
ConclusionesRituximab parece ser un tratamiento eficaz y seguro para NV, en el contexto de vasculitis crioglobulinémica. Se carece de evidencia sobre la eficacia específica de NV en el contexto de otras vasculitis.
To review the efficacy and safety of rituximab in vasculitic neuropathy (VN)
MethodsA literature search was performed on Medline and Embase up until 2017. It included terms related to “vasculitis”,“vasculitic neuropathy” and “Rituximab”. Research was carried out by two reviewers. The main outcome was rituximab efficacy.
ResultsOf an initial selection of 702 articles, 5 remained with a level of evidence between 1+ and 3 and variable recommendation degree. In the only clinical trial included, rituximab was superior to conventional therapy for cryoglobulinemic vasculitis with VN showing an increase in drug retention rate (64.3% vs. 3.5%; P<.001)and with a lower rate of serious adverse effects (.12 vs. .48). Cohort studies of patients with cryoglobulinemic vasculitis showed improvement and complete/partial remission of VN. In a series of 5 cases of refractory EGPA suffering from VN, 60% and 20% of patients achieved complete and partial remission respectively.
ConclusionsRituximab seems an effective and safe treatment for VN in the context of cryoglobulinemic vasculitis. Evidence for specific efficacy in VN in the context of other types of vasculitis is lacking
El término vasculitis comprende un grupo heterogéneo de enfermedades caracterizado por inflamación y destrucción de la pared de los vasos sanguíneos, que causa daño en diferentes órganos y tejidos1,2.
La afectación del sistema nervioso periférico debido a vasculitis, i.e. neuropatía vasculítica, es resultado del daño isquémico por la oclusión del vaso. Las fibras gruesas sensitivas y motoras son las típicamente afectadas, por ser más propensas al daño isquémico, y el compromiso es predominantemente axonal3.
La presentación clásica de la afectación del sistema nervioso periférico por vasculitis es una mononeuropatía múltiple («mononeuritis multiplex») dolorosa, aunque también puede presentarse como polineuropatía rápidamente progresiva. Menos frecuente es la presentación como una polineuropatía dependiente de longitud crónica4.
La neuropatía vasculítica generalmente es una manifestación más de una afección sistémica que puede afectar a la piel, los pulmones, los riñones y otros órganos. En una revisión de 106 pacientes con neuropatía vasculítica seguidos durante un periodo de 28 años5, las principales enfermedades que cursaron con neuropatía vasculítica fueron vasculitis sistémicas (granulomatosis eosinofílica con poliangitis, poliarteritis nudosa, granulomatosis con poliangitis, poliangitis microscópica, crioglobulinemia) y enfermedades reumáticas como la artritis reumatoide o el lupus eritematoso sistémico. La frecuencia de neuropatía vasculítica para algunas de estas enfermedades según varios estudios6–9 sería del 80% en granulomatosis con poliangitis y granulomatosis eosinofílica con poliangitis, del 70% en poliangitis microscópica, del 50 al 70% en poliarteritis nudosa y del 70% en crioglobulinemia mixta. En una minoría de pacientes con neuropatía vasculítica, sin embargo, la vasculitis del sistema nervioso periférico se produce de forma aislada como una neuropatía vasculítica no sistémica5,10–12.
A pesar de que la neuropatía vasculítica es relativamente poco común, su identificación y tratamiento es importante debido a la morbilidad y discapacidad que conlleva para los pacientes13. Incluso en ausencia de afectación sistémica, la neuropatía vasculítica puede conducir a discapacidades funcionales graves de las cuales algunos pacientes nunca se recuperan por completo.
No hay un tratamiento específico para la neuropatía vasculítica y este ha dependido del contexto en el que se produzca, p. ej., se utilizan los inmunosupresores y los glucocorticoides en vasculitis primarias o asociadas a enfermedades reumáticas sistémicas y los antivirales en los casos de crioglobulinemia asociado a hepatitis C14,15.
El rituximab (RTX) es un anticuerpo monoclonal quimérico anti-CD20 con efectos deplecionadores de linfocitos B que está aprobado por la Agencia Europea de Medicamento (EMA) para tratamiento de artritis reumatoide, granulomatosis con poliangitis y poliangitis microscópica, además de linfomas no-Hodgkin y leucemia linfoide crónica16. También ha sido utilizado fuera de ficha técnica para eritematoso sistémico, esclerosis sistémica y otras vasculitis como crioglobulinemia mixta. Por ello nuestro objetivo fue revisar la evidencia sobre la eficacia del RTX en neuropatía vasculítica de forma específica, así como estudiar sus posibles efectos adversos en estos pacientes.
MétodosSe realizó una revisión sistemática de aquellos estudios que podrían responder a la pregunta de investigación.
Identificación y selección de estudiosSe realizó una búsqueda bibliográfica exhaustiva en Medline y Embase desde 1961 hasta octubre de 2017, restringiendo la búsqueda de artículos en inglés, francés y español realizados en humanos. La estrategia de búsqueda incluyó los términos MeSH y el texto libre y términos relacionados de «vasculitis», «neuropatía vasculítica» y «Rituximab». Las estrategias de búsqueda fueron realizadas por 2 autores que independientemente revisaron los títulos, resúmenes de artículos y los criterios de selección.
Se incluyeron según el tipo de estudios: metaanálisis, revisiones sistemáticas, ensayos clínicos y estudios observacionales (transversales, cohortes y estudio caso-control). Según el tipo de participante, se incluyeron los estudios con pacientes adultos diagnosticados de neuropatía vasculítica, utilizando cualquier método validado para el diagnóstico de vasculitis y la neuropatía podría haber sido diagnosticada clínicamente, mediante exploraciones complementarias o por ambas; se excluyeron los pacientes con neuropatía de cualquier otro origen que no fuera vasculítica. Según el tipo de intervención, la selección fue de los estudios que evaluaban la eficacia del tratamiento con RTX y se consideró el uso de RTX, solo o en combinación, después de un intervalo mínimo de seguimiento de al menos 6 meses.
Las principales medidas de resultado estudiadas fueron eficacia con RTX, i.e., deterioro sensorial al final del periodo de seguimiento (al menos 6 meses después del inicio del tratamiento), utilizando para su evaluación cualquier escala de neuropatía validada o pruebas sensoriales cuantitativas. Como desenlaces secundarios se incluyeron: tiempo de retención del tratamiento con RTX, número de participantes con mejoría o resolución de los síntomas de neuropatía determinado por la impresión global del investigador o escala de valoración del paciente, número de eventos adversos leves y graves durante el periodo de seguimiento.
Extracción de datos y evaluación de sesgosLos artículos cuyos títulos o resúmenes coincidían con los criterios de inclusión fueron leídos en su totalidad. El fallo de alguno de los criterios de elegibilidad fue suficiente para excluir un estudio. Cualquier desacuerdo en la inclusión de un estudio fue resuelto por consenso entre los 2 revisores y con la ayuda de un tercer revisor. Dos revisores extrajeron los datos de los documentos de forma independiente en forma de informe.
La calidad de la evidencia fue analizada a través de una lectura del texto completo siguiendo las directrices de la Red escocesa de Directrices Intercolegiales (SIGN).
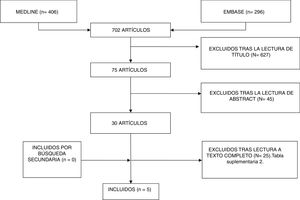
ResultadosDescripción de los estudiosDespués de la selección de 296 artículos publicado entre 1999 y 2017, se eliminaron 42 duplicados, 224 tras la lectura del título y el resumen, y 25 tras la lectura completa del artículo. Quedaron finalmente solo 5 artículos que cumplieron los criterios de selección establecidos y que constituyeron el foco de esta revisión sistemática (fig. 1). Los estudios incluidos fueron: un ensayo clínico, 3 estudios de cohortes y una serie de casos (tabla 1). La mayoría de los estudios fueron de cohortes con un nivel de evidencia entre 1+ y 3 y un grado de recomendación SIGN B.
Estudios incluidos
| Referencia | Estudio | Población | Variable | Nivel de evidencia |
|---|---|---|---|---|
| De Vita et al. | Ensayo clínico aleatorizado doble ciego, fase iii | Grupo experimental (n=28): pacientes con vasculitis crioglobulinémica grave y activa con RTX Grupo control (n=29): pacientes con vasculitis crioglobulinémica grave y activa con tratamiento convencional | Supervivencia del tratamiento a los 12 meses 64,3% con RTX vs. 3,5% tratamiento convencional (p<0,001). Independiente de presencia de neuropatía Tasa de efectos adversos RTX vs. tratamiento convencional: 0,12 vs. 0,48 | Nivel evidencia 1++ Grado A |
| Quartuccio et al. | Estudio de cohorte retrospectivo | Eficacia y seguridad a largo plazo de RTX en n=30 pacientes que participaron en el EC previo | Media de supervivencia de RTX para la neuropatía: media 6,7 (±DE 0,4) años Nueve efectos adversos (infecciones, hipogammaglobulinemia crónica, cardiovascular) y 6 muertes | Nivel evidencia 2+ Grado B |
| Ferri et al. | Estudio multicéntrico retrospectivo | n=87 pacientes con vasculitis crioglobulinémica mixta activa (85% refractaria a tratamiento convencional); n=69 con neuropatía vasculítica | Remisión completa de la neuropatía del 44%; remisión parcial del 26%. Mejoría de parestesias (p<0,0001) Efectos adversos: 18 leves, 3 graves: neumonía, gangrena y enfermedad del suero | Nivel evidencia 2+ Grado B |
| Cavallo et al. | Estudio de cohorte prospectivo | n=13 pacientes con vasculitis crioglobulinémica tipo ii (11 pacientes refractarios al tratamiento convencional) | Mejoría en la escala «Puntaje de discapacidad de neuropatía clínica» (p<0,0001), electromiograma (p<0,0001) y parestesias (p<0,0001) No hay efectos adversos | Nivel evidencia 2+ Grado B |
| Novikov et al. | Serie de casos | n=6 pacientes con granulomatosis eosinofílica con poliangitis activa (refractarios al tratamiento convencional previo) | El 60% remisión completa de neuropatía vasculítica; el 20% remisión parcial Tres efectos adversos no graves: una reacción a la infusión; 2 bronquitis | Nivel evidencia 3 Grado B |
DE: desviación estándar; EC: ensayo clínico; RTX: rituximab.
Los estudios excluidos y las razones de exclusión son mencionados en la tabla suplementaria. El número total de pacientes con neuropatía vasculítica tratados con RTX e incluidos en esta revisión fue 123, oscilando entre 5 y 69 pacientes de un artículo a otro. En relación con la duración del seguimiento observada en los estudios, esta fue variable entre 6 meses a 6 años.
Tratamiento previoEn la mayoría de los estudios analizados se describe el inicio de tratamiento con RTX tras fracaso a tratamiento convencional. En el estudio de Cavallo et al17 11 de 13 pacientes fueron refractarios a tratamiento previo (todos a corticoides y ciclofosfamida, micofenolato, plasmaféresis e interferón). En el estudio de Novikov et al.18 en 6 pacientes con granulomatosis con poliangitis eosinofílica tratados con RTX fueron todos refractarios a tratamiento convencional (todos a corticoides y ciclofosfamida; otros también con azatioprina, metotrexato y micofenolato en combinación). En el estudio de Ferri et al.19 solo el 15% de los pacientes recibieron RTX como primera línea de tratamiento siendo el resto refractario a tratamiento convencional.
En el ensayo clínico de De Vita et al.20 y el estudio retrospectivo posterior realizado sobre los mismos pacientes a largo plazo, Quartuccio et al.21 no reflejan si hubo tratamiento previo a la aleatorización para vasculitis crioglobulinémica. Solamente reflejan que los pacientes con serología del virus de la hepatitis C positiva no fueron tratados con antivirales o estos fueron ineficaces.
Esquema de tratamiento con rituximabEn todos los estudios el RTX fue utilizado en monoterapia (sin contar corticoides a dosis bajas), excepto en el estudio de Novikov et al.18 donde se asoció el tratamiento con RTX al tratamiento de base en un solo paciente (azatioprina).
En la mayoría de los estudios la dosis total de RTX (2g) fue administrada en infusiones semanales o bisemanales durante un mes; y en todos los estudios, las siguientes dosis a partir de 6 meses a demanda según situación clínica. Diez de 87 pacientes del estudio de Ferri et al.19 y todos los pacientes del estudio de Cavallo et al.17 recibieron un ciclo de 6 infusiones a razón de 375mg/m2/por semana durante el primer mes más 2 infusiones la primera semana de los siguientes 2 meses consecutivos.
Eficacia y seguridad de rituximabEn el ensayo clínico aleatorizado doble ciego en fase iii20, se observó en el desenlace primario que la supervivencia del tratamiento del grupo tratado con RTX (n=28) a los 12 meses fue superior al tratamiento convencional (n=29): glucocorticoides, azatioprina o ciclofosfamida o plasmaféresis, en pacientes con vasculitis crioglobulinémica severa y activa (con úlceras cutáneas, glomerulonefritis activa, o neuropatía periférica refractaria o con empeoramiento de la misma) (64,3% vs 3,5%; p<0,001). Uno de los desenlaces secundarios del estudio trató de analizar la eficacia del tratamiento con RTX por cada afectación única. La presencia o no de neuropatía en pacientes con vasculitis crioglobulinémica no influyó en la tasa de retención del fármaco (hazard ratio IC 95%=4,05 [0,91-18,03], p=0,066). Tampoco la presencia o no de las otras manifestaciones orgánicas tenidas en cuenta para la selección de los pacientes influyeron en la tasa de retención del tratamiento con RTX: úlcera cutánea y glomerulonefritis. No se encontraron diferencias significativas para cualquier grado de mejoría de la neuropatía al mes y a los 2 meses de tratamiento en el grupo de neuropatía tratado con RTX (n=16) en comparación con el grupo con tratamiento convencional (n=17) (p=0,156 y p=0,375). La neuropatía respondió a RTX a los 2 meses en 12 de los pacientes, a los 6 meses en 11 pacientes, a los 12 meses en 7 pacientes y a los 24 meses en 8 pacientes, concluyendo una posible falta de respuesta de RTX después de los 6 meses. Además, se observó una tasa de efectos adversos graves (neumonía, eventos cardiovasculares y fallo hepático) inferior en el grupo tratado con RTX frente a tratamiento convencional (0,12 vs. 0,48). En el grupo de RTX se describieron 2 muertes y una en el grupo de tratamiento convencional. No hubo diferencias significativas en infecciones graves entre ambos grupos, pero hay que señalar que 3 de los 4 pacientes que las sufrieron habían recibido dosis altas de glucocorticoides.
En el estudio de cohorte retrospectiva de Quartuccio et al.21 con una media de observación de 72,6 (20,4) meses se valoró la eficacia y seguridad a largo plazo de los pacientes que fueron tratados con RTX desde el inicio o cambio a RTX durante el ensayo clínico de De vita et al. y que en el caso de necesitar retratamiento con RTX solo fuera por empeoramiento (n=30); no fueron incluidos en el estudios 3 pacientes en terapia de mantenimiento con RTX, 5 fallecidos, 2 con reacciones de infusión al fármaco y 11 sin seguimiento tras finalización del ensayo clínico. En este estudio un 43,3% de los pacientes no necesitaron retratamiento, con una media de seguimiento de 62,4 meses. De los 17 pacientes que requirieron retratamiento, el 58,8% necesitaron solo un ciclo y el 41,2% más de un ciclo de tratamiento. La media de tiempo hasta el retratamiento tras a la dosis inicial fue de 22,3 (12,1) meses. En el 85% de los pacientes que requirieron retratamiento antes de los 24 meses fue debido a empeoramiento de la neuropatía, siendo esta misma causa por la cual se pautó de inicio RTX. En un 20% de los pacientes que requirieron retratamiento tras 24 meses fue por neuropatía. Se observó una media (±DE) de retención de RTX para neuropatía de 6,7 (0,4) años, algo menor que para nefritis (7,9 [0,4]). Durante el tiempo de seguimiento posterior al ensayo clínico de De Vita et al. hubo 9 efectos adversos con RTX (infecciones recidivantes, hipogammaglobulinemia crónica, cardiovasculares) y 6 muertes.
En un estudio multicéntrico retrospectivo de 6 meses de seguimiento19, se estudió a 87 pacientes con vasculitis crioglobulinémica mixta activa (el 92% asociada a hepatitis C, el 6% esencial y el 2% síndrome Sjogren), de los cuales 69 presentaban neuropatía periférica. En 20 de los 87 pacientes la indicación principal de RTX fue la afectación neuropática. Se alcanzó una remisión completa de neuropatía del 44% de los pacientes y remisión parcial del 26% a los 6 meses de tratamiento; y una mejoría estadísticamente significativa de parestesias (p<0,0001). En los 87 pacientes tratados hubo 18 efectos adversos; solo 3 pacientes de ellos presentaron efectos adversos graves: neumonía, gangrena y reacción tipo enfermedad del suero.
Asimismo en un estudio de cohorte prospectiva de 13 pacientes con vasculitis crioglobulinémica tipo ii refractarios a tratamiento convencional (12 de ellos asociado a hepatitis C habiendo siendo tratados con interferón 4 de ellos), se llevó a cabo un periodo de seguimiento de 12 meses tras el inicio de tratamiento con RTX. Se observó una mejoría significativa de la escala «clinical neuropathy disability score (CNDS)» (p<0,001), electromiograma (p<0,002) y parestesias (p<0,0001). No describen efectos adversos durante el periodo de seguimiento.
En una serie de 6 casos con granulomatosis eosinofílica con poliangitis activa en forma de afectación pulmonar severa y/o neuropatía periférica progresiva18, 5 de ellos (4 con anticuerpos anticitoplasma de neutrófilos positivo y uno negativo) fueron tratados con RTX por reactivación de la neuropatía o para inducir remisión de la misma. Presentaron una media de seguimiento de 10 meses con evaluación a los 3 y 6 meses. Alcanzaron remisión completa con RTX el 40% a los 3 meses y el 60% a los 6 meses, y la remisión parcial el 20% a los 6 meses. Tres pacientes presentaron efectos adversos durante el seguimiento: reacción infusional con broncoespasmo, y 2 pacientes tuvieron bronquitis purulenta resueltas con antibiótico.
DiscusiónA pesar de la eficacia que ha demostrado el RTX de manera general en vasculitis y enfermedades autoinmunes sistémicas, destaca la escasa información sobre la eficacia de este tratamiento concretamente en neuropatía vasculítica.
Aunque existen ensayos clínicos en los cuales se demuestra la eficacia del RTX para las vasculitis sistémicas ANCA, no existen ensayos clínicos en los que se aborde específicamente la neuropatía. En este sentido el RTX está aprobado para inducción de remisión en granulomatosis con poliangitis y poliangitis microscópica como se observó en los ensayos RITUXVAS y RAVE donde fue al menos tan efectivo como ciclofosfamida22,23. También la eficacia del RTX para el mantenimiento de remisión en granulomatosis con poliangitis y poliangitis microscópica se confirmó recientemente en el ensayo prospectivo, aleatorizado y controlado MAINRITSAN24. Sin embargo, en nuestra revisión solo hemos encontrado una serie de casos de vasculitis ANCA (granulomatosis eosinofílica con poliangitis) que aborden específicamente la eficacia del RTX en neuropatía vasculítica, donde el 80% de los pacientes alcanzaron la remisión a los 6 meses18.
Los restantes estudios que fueron finalmente seleccionados para esta revisión tratan sobre neuropatía vasculítica en contexto de vasculitis crioglobulinémica. Los hallazgos del ensayo clínico aleatorizado doble ciego en fase ii de De Vita et al.20 demuestran la superioridad del RTX en monoterapia en comparación con la terapia convencional con glucocorticoides, azatioprina, ciclofosfamida o plasmaféresis para el tratamiento de crioglobulinemia grave en forma de mayor supervivencia del tratamiento. En el análisis multivariante la presencia o no neuropatía no modificaba dicha superioridad. Sin embargo, no hubo diferencias significativas para cualquier grado de mejoría de la neuropatía al mes y a los 2 meses del tratamiento entre el grupo de RTX (n=16) y el grupo con tratamiento convencional (n=17) (p=0,156 y p=0,375) por lo que deben interpretarse con cautela las conclusiones sobre eficacia específica en neuropatía vasculítica que pudieran extraerse de este estudio. No obstante, no se dispone de los datos de dicha comparación a los 12 meses de seguimiento, que fue el tiempo fijado para el desenlace primario, lo que podría justificar la ausencia de diferencias significativas en este aspecto. En el estudio de seguimiento a largo plazo del ensayo clínico anterior21 se observó que la eficacia del RTX era mantenida en el tiempo de manera considerable y con una media de supervivencia del RTX para neuropatía de 6,7 (0,4) años incluyendo pacientes que requirieron retratamiento para la misma. Asimismo, en los otros 2 estudios también seleccionados se demostró la eficacia del RTX en forma de remisión completa o parcial en la mayoría de los pacientes con neuropatía y mejoría en parestesias, en escalas y en datos objetivos como parámetros electromiográficos17,19. Hay que tener en cuenta que salvo en el ensayo clínico, el resto de los datos no son comparativos con otro grupo de tratamiento por lo que no puede establecerse la superioridad del RTX para neuropatía vasculítica en el contexto de crioglobulinemia, pero sí su eficacia, aunque debe tenerse en cuenta que RTX fue eficaz en pacientes refractarios a otras terapias convencionales incluida ciclofosfamida.
La mayoría de los pacientes con crioglobulinemia mixta padecen infección por virus de la hepatitis C y así fue también en los pacientes incluidos en los estudios que hemos seleccionado. La crioglobulinemia también puede ser inducida por el virus de la hepatitis B o asociada con trastornos autoinmunes o linfoproliferativos y, en raras ocasiones, puede ser esencial25,26. El abordaje actual es que en pacientes con enfermedad progresiva o grave, además de tratar la infección por el virus (salvo contraindicación), debe instaurarse terapia inmunosupresora: glucocorticoides con RTX o ciclofosfamida y en algunos pacientes plasmaféresis15,27,28. En algunos casos por hepatitis B podría utilizarse también RTX, pero siempre concomitante con terapia antiviral. Las manifestaciones graves asociadas a la crioglobulinemia donde se recomienda tratamiento inmunosupresor incluirían neuropatía rápidamente progresiva.
El perfil de seguridad del RTX ha sido evaluado en todos los estudios revisados. Se describen efectos adversos en todos ellos, siendo algunos graves. Sin embargo, solo disponemos de escasos datos comparativos con terapia convencional. Estos mostraron que el RTX presentó mejor perfil de seguridad en forma de una menor tasa de efectos adversos graves, lo que está en concordancia con otros estudios en la literatura. Hubo además varias muertes en los estudios revisados, aunque no pueden ser directamente atribuidas al RTX. En un estudio observacional en 120 pacientes con granulomatosis con poliangitis y poliangitis microscópica, los pacientes tratados simultáneamente con RTX y ciclofosfamida tuvieron tasas de remisión similares a aquellos que recibieron RTX en monoterapia pero con una mayor mortalidad29. Entre los efectos adversos destacan: infecciones, hipogammaglobulinemia, reacción infusional, y cardiopatía isquémica. También hay que destacar que en uno de los estudios se encontró la neuropatía como efecto secundario al tratamiento con RTX.
En la mayoría de los estudios analizados se describe el inicio de tratamiento con RTX tras fracaso a tratamiento convencional, sin embargo, también se ha mostrado en el estudio de Ferri et al. que un 15% de los pacientes recibieron RTX como primera línea de tratamiento y en un paciente con granulomatosis eosinofílica con poliangitis, se logró la remisión completa a los 6 meses
Como limitaciones de esta revisión, en primer lugar, nombrar el escaso número de estudios que cumplían los criterios de inclusión de nuestra revisión. En segundo lugar, la mayoría de estos estudios son observacionales, contando solo con un ensayo clínico. En tercer lugar, la mayoría de la evidencia está relacionada solamente con una enfermedad (crioglobulinemia mixta esencial).
Como conclusión podemos decir que existe escasa evidencia de la eficacia del RTX para neuropatía vasculítica. Además, probablemente sea eficaz para la neuropatía vasculítica en el contexto de crioglobulinemia mixta y que posiblemente sea superior al tratamiento convencional con un mejor perfil de seguridad. No hemos encontrado datos para poder extraer conclusiones de su eficacia tanto en neuropatía vasculítica aislada como asociada a vasculitis sistémica y conectivopatías. Pensamos que al haber demostrado eficacia para artritis reumatoide y vasculitis ANCA del RTX deben realizarse estudios que aborden específicamente su eficacia en neuropatía para facilitar la mejor opción terapéutica en los casos en los cuales la neuropatía vasculítica sea la manifestación predominante de un cuadro sistémico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Sociedad Española de Reumatología (SER).