Analizar una cohorte de pacientes embarazadas con lupus eritematoso sistémico y comparar los desenlaces tanto de la enfermedad como del embarazo con los resultados de estudios previos realizados en la misma área geográfica.
Pacientes y métodosEstudio de cohortes retrospectivo de 37 mujeres con lupus eritematoso sistémico (64 embarazos) seguidas en una consulta multidisciplinar. Estudio comparativo con los estudios españoles similares identificados tras revisión bibliográfica.
ResultadosNuestra cohorte se caracterizó por una edad más elevada y por la presencia de pacientes de origen no caucásico. Aunque no encontramos diferencias clínicas relevantes, serológicamente nuestra cohorte presentó una mayor frecuencia de anticuerpos antifosfolípido. Las pacientes incluidas en este estudio fueron tratadas más frecuentemente con antipalúdicos y aspirina. La frecuencia de brotes fue muy similar entre los distintos estudios, y no identificamos predictores claros para los mismos. Aunque la tasa de nacidos vivos fue similar, el desenlace obstétrico de nuestra serie fue mejor, con una baja tasa de preeclampsia, parto pretérmino y recién nacido de bajo peso. El único predictor de acontecimiento obstétrico adverso fue la edad.
ConclusionesSi bien los cambios en la actitud terapéutica y la planificación del embarazo no han tenido un impacto directo sobre la tasa de reactivación del lupus eritematoso sistémico durante el embarazo, sí que han supuesto una mejoría en los resultados obstétricos. La introducción de nuevas variables independientes de la enfermedad como la edad en la concepción, la procedencia sociocultural, o la disponibilidad de unidades multidisciplinares deberán ser consideradas en los resultados de próximos estudios.
To analyse a cohort of pregnant patients with systemic lupus erythematosus and compare the outcomes of both the disease and pregnancy with the results of previous studies conducted in the same geographical area.
Patients and methodsRetrospective cohort study of 37 women with systemic lupus erythematosus (64 pregnancies) followed in a multidisciplinary unit. Comparative study with similar Spanish studies identified after literature search.
ResultsOur cohort was characterized by an older age and by the presence of non-Caucasian patients. Although we found no clinical differences, from the serological point of view our cohort presented a higher frequency of antiphospholipid antibodies. Patients included in this study were treated more frequently with antimalarials and low-dose aspirin. Systemic lupus erythematosus flare frequency was very similar between the different studies, and we did not identify clear predictors for them. Although the rate of live births was similar among studies, the obstetric outcome of our series was better with a very low rate of preeclampsia, preterm birth and low birth weight newborn. The only predictor of adverse obstetric event was age.
ConclusionsAlthough changes in the therapeutic attitude and planning of pregnancy in recent years have not had a direct impact on the rate of systemic lupus erythematosus flares during pregnancy, they have meant an improvement in the obstetric results. The introduction of new variables independent of the disease such as age at conception, socio-cultural origin, or the availability of multidisciplinary units should be considered in the results of future studies.
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune que afecta de forma predominante a mujeres en edad reproductiva1. El embarazo en las mujeres con LES se acompaña de un aumento significativo del riesgo materno y fetal2,3. Dentro de las complicaciones obstétricas, en pacientes con LES es especialmente frecuente el desarrollo de preeclampsia4. Una complicación, que además de poner en riesgo vital a la madre, también se acompaña de un riesgo fetal incrementado en forma de parto prematuro, bajo peso al nacer y muerte fetal5. Por otra parte, el embarazo en pacientes con LES se puede acompañar de un aumento en el riesgo de desarrollar nuevos brotes de la enfermedad tanto durante el embarazo como durante el posparto, que aunque en general suelen ser leves, en determinados casos pueden comprometer de forma significativa el pronóstico obstétrico6. Entre los principales predictores de brote de la enfermedad y de peor resultado obstétrico destacan la edad, la actividad de la enfermedad, el perfil serológico y los antecedentes de nefritis lúpica (NL)6,7.
La información al respecto es escasa en el ámbito nacional, con escasez de estudios y publicaciones poco recientes8,9. Por otra parte, en los últimos años, el cuidado de las pacientes con LES durante el embarazo ha cambiado de forma sustancial10–12 lo que hace pensar que el pronóstico de estas pacientes también haya podido mejorar de forma paralela. Así pues, puede resultar de interés conocer si el pronóstico del embarazo en las pacientes con LES se ha modificado en los últimos años en nuestro país.
Los objetivos fundamentales del presente estudio fueron: a) estudiar la influencia que ejerce el embarazo, en el curso del LES, especialmente en la frecuencia de reactivación, y sus posibles predictores; b) estudiar la influencia del LES en el devenir del embarazo, prestando especial interés a la incidencia de complicaciones obstétricas; y c) comparar los datos de nuestra cohorte con los publicados previamente en España.
Pacientes y métodosPacientesEstudio de cohortes retrospectivo que incluye a 37 mujeres seguidas en la Unidad de Patología Gravídica Autoinmune (unidad multidisciplinar atendida de forma conjunta por un especialista en Obstetricia y un especialista en Reumatología) de un hospital de tercer nivel. Las pacientes fueron atendidas durante el periodo 1/2005-4/2019. Todas las pacientes cumplían al menos 4 criterios de clasificación del American College of Rheumatology de 199713 y/o los criterios del Systemic Lupus International Collaborating Clinics de 201214. El síndrome antifosfolípido (SAF) fue diagnosticado de acuerdo a los criterios modificados de Sidney15. El presente trabajo fue aprobado por el Comité de Ética e Investigación de Cantabria.
Recogida de datosLas pacientes se han estudiado en distintos momentos: consulta preconcepcional (en su defecto, visita previa al embarazo), durante el embarazo (meses 0, 3, 6 y 9), y en el posparto (6 meses). Para la valoración de la actividad y el daño estructural de la enfermedad, previo a cada embarazo y en la visita posparto, se han empleado la escala SLEDAI16 y el índice de cronicidad del Systemic Lupus International Collaborating Clinics/ACR Damage Index17. Durante el embarazo se ha empleado la escala SLEDAI-P18. De forma rutinaria, en las visitas programadas se realizó a las pacientes hemograma, función renal, elemental y sedimento de orina, así como anti-dsDNA, C3, C4. Se ha considerado que hay un brote de LES cuando hay un aumento del nivel de la actividad (según la escala SLEDAI/SLEDAI-P)>4 puntos, o cuando se ha considerado necesario un aumento de la medicación para control de la enfermedad.
Para evaluar la influencia del LES sobre el embarazo se estudiaron las siguientes manifestaciones obstétricas: aborto espontáneo (pérdida de la gestación antes de la semana 22 o cuando el producto de la concepción es menor de 500g de peso), interrupción voluntaria del embarazo, muerte fetal, preeclampsia, retraso del crecimiento intrauterino (CIR), prematuridad (parto<37 semanas de gestación), cesárea, y parámetros del recién nacido (RN) (edad gestacional, peso, RN de bajo peso [<2500g], APGAR y pH). Como resultado obstétrico adverso (adverse pregnancy outcome, APO) se entiende la existencia de cualquiera de las siguientes patologías: aborto espontáneo, muerte fetal, preeclampsia, CIR, parto prematuro y RN de bajo peso. La preeclampsia y el CIR se definieron de acuerdo a criterios ampliamente aceptados19,20.
Análisis estadísticoEl análisis estadístico se llevó a cabo utilizando el paquete estadístico SPSS 25.0 SPSS 25.0 (IBM Corp. Released 2017. IBM SPSS Statistics for Windows, Version 25.0. Armonk, NY: IBM Corp.). En el análisis descriptivo se utilizaron frecuencias, porcentajes, medias, y, como medida de dispersión, la desviación estándar. En cuanto al análisis inferencial, en el análisis univariante se aplicó el test de Chi cuadrado para comparar 2 variables cualitativas, la prueba de t de Student o U de Mann Whitney para comparar variables cuantitativas. Se consideró como estadísticamente significativo todo valor de p<0,05. Se efectuó un análisis multivariante de regresión logística según los métodos «enter» y «hacia atrás condicional»; siguiendo el criterio de selección de variables propuesto por Hosmer y Lemeshow21, se incluyeron inicialmente aquellas que alcanzaron un nivel de significación (p<0,25) en el análisis univariante.
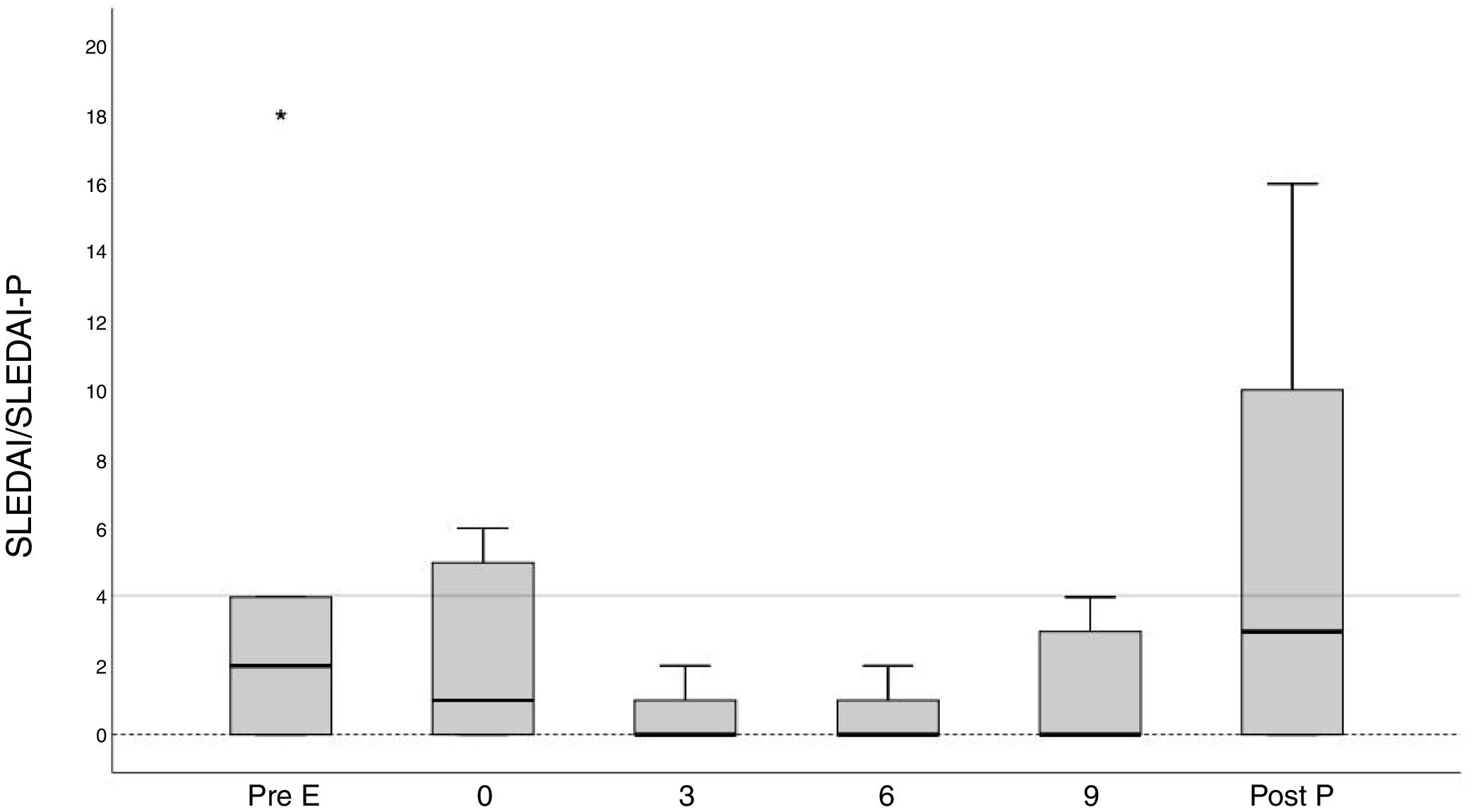
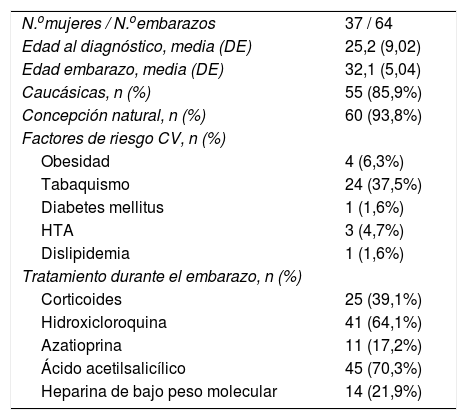
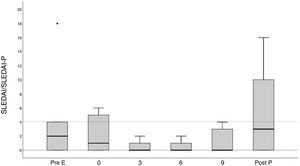
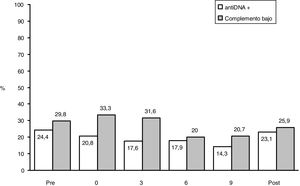
ResultadosDescripción general de la cohorteLa cohorte está constituida por 37 mujeres con LES que han tenido un total de 64 embarazos. Las características generales de la cohorte así como los tratamientos recibidos se recogen en la tabla 1. La edad media de las mujeres a la concepción fue de 32,1±5,04 años. Cincuenta y cinco embarazos ocurrieron en mujeres caucásicas y 9 en no caucásicas (una de origen asiático y el resto hispano). En 34 de los 64 embarazos, este se produjo de forma no planificada. Las pacientes con embarazo no planificado eran más jóvenes (p=0,002) y presentaban una mayor frecuencia de NL (p=0,027). Las pacientes presentaron una tasa elevada de factores de riesgo cardiovascular, especialmente el tabaquismo (37,5%). El 17,2% de las mujeres habían padecido una NL. De forma similar al resto del país22, en nuestra cohorte el índice de cronicidad era bajo: 40 (74,1%) embarazos con 0 puntos. En 31 (48,4%) embarazos existía serología SAF positiva, y en 15 (23,4%) los anticuerpos anti-Ro/anti-La fueron positivos. Ocho mujeres cumplían criterios clínicos de SAF15, siendo el resto portadoras de autoanticuerpos. El grupo con serología SAF positiva presentó más factores de riesgo cardiovascular, especialmente, obesidad (16,7% vs. 0%, p=0,008) y tabaquismo (62,5% vs. 22,5%, p=0,001). Los embarazos con serología SAF positiva recibieron con más frecuencia ácido acetilsalicílico (95,2% vs. 67,6%, p=0,01) y HBPM (40,9% vs. 13,5%, p=0,02.). Aunque no encontramos diferencias significativas, los embarazos con serología SAF positiva presentaron una menor tasa de RN vivos (56,5% vs. 73%, p=0,19). Globalmente, nuestra cohorte presentó un grado bajo de actividad (SLEDAI/SLEDAI-P≤4) tanto al momento de la visita previa al embarazo como durante el mismo, con un discreto aumento en el posparto (fig. 1.A). De la misma forma, se correlacionó con una baja actividad serológica (niveles de C3 y C4 normales y anticuerpos anti-DNAn negativos) (fig. 1.B). Dado que solo 3 de los embarazos presentaron niveles elevados de actividad al inicio del embarazo, no se pudo analizar el impacto de la enfermedad activa.
Características generales de la población a estudio
| N.omujeres / N.oembarazos | 37 / 64 |
| Edad al diagnóstico, media (DE) | 25,2 (9,02) |
| Edad embarazo, media (DE) | 32,1 (5,04) |
| Caucásicas, n (%) | 55 (85,9%) |
| Concepción natural, n (%) | 60 (93,8%) |
| Factores de riesgo CV, n (%) | |
| Obesidad | 4 (6,3%) |
| Tabaquismo | 24 (37,5%) |
| Diabetes mellitus | 1 (1,6%) |
| HTA | 3 (4,7%) |
| Dislipidemia | 1 (1,6%) |
| Tratamiento durante el embarazo, n (%) | |
| Corticoides | 25 (39,1%) |
| Hidroxicloroquina | 41 (64,1%) |
| Azatioprina | 11 (17,2%) |
| Ácido acetilsalicílico | 45 (70,3%) |
| Heparina de bajo peso molecular | 14 (21,9%) |
CV: cardiovascular; DE: desviación estándar; HTA: hipertensión arterial; N.o: número; %: porcentaje.
Evolución clínica y serológica del LES en pacientes embarazadas y durante el posparto.
A) se muestra la evolución de los valores medios de SLEDAI/SLEPDAI desde la visita previa al embarazo hasta el posparto; B) se muestra el porcentaje de pacientes con serología (anti-DNA+ y complemento disminuido) alterada durante el mismo periodo.
Post P: visita posparto; Pre E: visita preconcepcional o visita previa al embarazo.
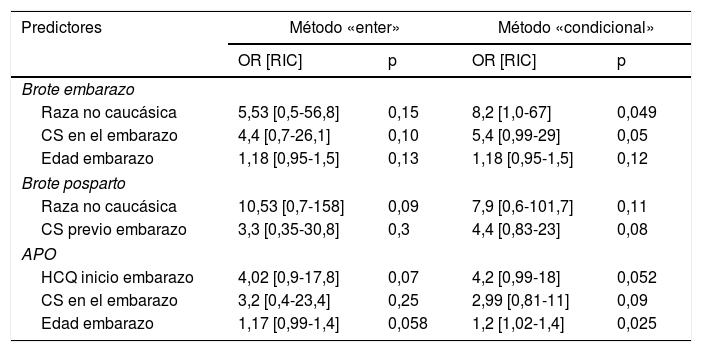
En la cohorte global se registraron 12 brotes durante el embarazo (18,8% de los embarazos) y 12 en el posparto (30,8%). En las tablas suplementarias 1 y 2 del material adicional se muestran con detalle los brotes de la enfermedad. En ningún caso, los brotes de la enfermedad obligaron a la interrupción del embarazo. No identificamos ningún predictor claro de brote en el embarazo, aunque la raza no caucásica (8,2 [1-67], p=0,049) y el uso de corticoides durante el embarazo (5,4 [0,99-29], p=0,05) fueron las variables más asociadas a la aparición de brote (tabla 2).
Predictores (análisis multivariante) de resultado adverso del embarazo (APO) y brotes de LES en el embarazo y posparto
| Predictores | Método «enter» | Método «condicional» | ||
|---|---|---|---|---|
| OR [RIC] | p | OR [RIC] | p | |
| Brote embarazo | ||||
| Raza no caucásica | 5,53 [0,5-56,8] | 0,15 | 8,2 [1,0-67] | 0,049 |
| CS en el embarazo | 4,4 [0,7-26,1] | 0,10 | 5,4 [0,99-29] | 0,05 |
| Edad embarazo | 1,18 [0,95-1,5] | 0,13 | 1,18 [0,95-1,5] | 0,12 |
| Brote posparto | ||||
| Raza no caucásica | 10,53 [0,7-158] | 0,09 | 7,9 [0,6-101,7] | 0,11 |
| CS previo embarazo | 3,3 [0,35-30,8] | 0,3 | 4,4 [0,83-23] | 0,08 |
| APO | ||||
| HCQ inicio embarazo | 4,02 [0,9-17,8] | 0,07 | 4,2 [0,99-18] | 0,052 |
| CS en el embarazo | 3,2 [0,4-23,4] | 0,25 | 2,99 [0,81-11] | 0,09 |
| Edad embarazo | 1,17 [0,99-1,4] | 0,058 | 1,2 [1,02-1,4] | 0,025 |
APO: resultado adverso del embarazo; CS en el embarazo: corticosteroides en cualquier momento del embarazo; CS previo embarazo: corticosteroides antes del embarazo; HCQ: hidroxicloroquina; LES: lupus eritematoso sistémico; OR: odds ratio; RIC: rango intercuartílico.
El 62,5% de los embarazos han finalizado con RN vivo (tabla 3). Se han registrado de forma general, 26 APO (40,6%). Únicamente ha habido un caso de preeclampsia (1,6%). Menos de un 10% de las pacientes tuvieron un parto pretérmino. La edad media gestacional fue ligeramente superior a las 37 semanas, y menos de un 10% de los RN presentaron un bajo peso al nacer. En el análisis multivariante, la edad fue el único parámetro asociado a un mayor riesgo de sufrir un APO (1,2 [1,02-1,4], p=0,025) (tabla 2).
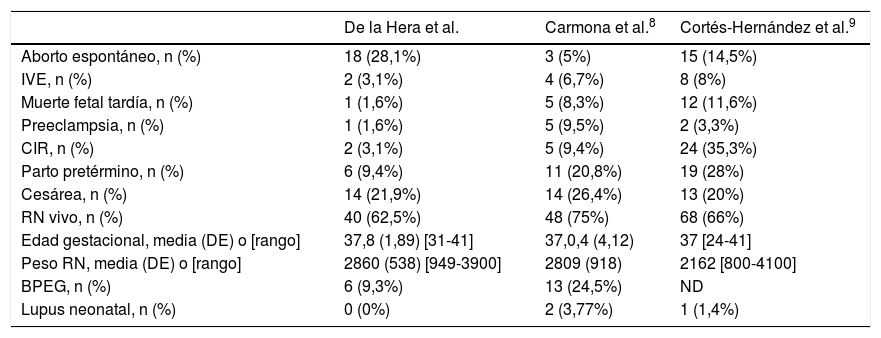
Principales resultados obstétricos en los estudios realizados en España sobre lupus eritematoso sistémico y embarazo
| De la Hera et al. | Carmona et al.8 | Cortés-Hernández et al.9 | |
|---|---|---|---|
| Aborto espontáneo, n (%) | 18 (28,1%) | 3 (5%) | 15 (14,5%) |
| IVE, n (%) | 2 (3,1%) | 4 (6,7%) | 8 (8%) |
| Muerte fetal tardía, n (%) | 1 (1,6%) | 5 (8,3%) | 12 (11,6%) |
| Preeclampsia, n (%) | 1 (1,6%) | 5 (9,5%) | 2 (3,3%) |
| CIR, n (%) | 2 (3,1%) | 5 (9,4%) | 24 (35,3%) |
| Parto pretérmino, n (%) | 6 (9,4%) | 11 (20,8%) | 19 (28%) |
| Cesárea, n (%) | 14 (21,9%) | 14 (26,4%) | 13 (20%) |
| RN vivo, n (%) | 40 (62,5%) | 48 (75%) | 68 (66%) |
| Edad gestacional, media (DE) o [rango] | 37,8 (1,89) [31-41] | 37,0,4 (4,12) | 37 [24-41] |
| Peso RN, media (DE) o [rango] | 2860 (538) [949-3900] | 2809 (918) | 2162 [800-4100] |
| BPEG, n (%) | 6 (9,3%) | 13 (24,5%) | ND |
| Lupus neonatal, n (%) | 0 (0%) | 2 (3,77%) | 1 (1,4%) |
BPEG: bajo peso edad gestacional; CIR: retraso del crecimiento intrauterino; DE: desviación estándar; IVE: interrupción voluntaria del embarazo; ND: no dato; RN: recién nacido.
Se realizó una búsqueda en Pubmed introduciendo los siguientes parámetros [Systemic lupus erythematosus] and [pregnancy] and [Spain], identificándose únicamente 2 estudios españoles que abordaban el impacto del LES en el embarazo8,9 (tabla 4): el estudio de Carmona et al.8 publicado en 1999, y el de Cortés-Hernández et al.9 en 2002, pero la cohorte seleccionada fue estudiada hasta 1999.
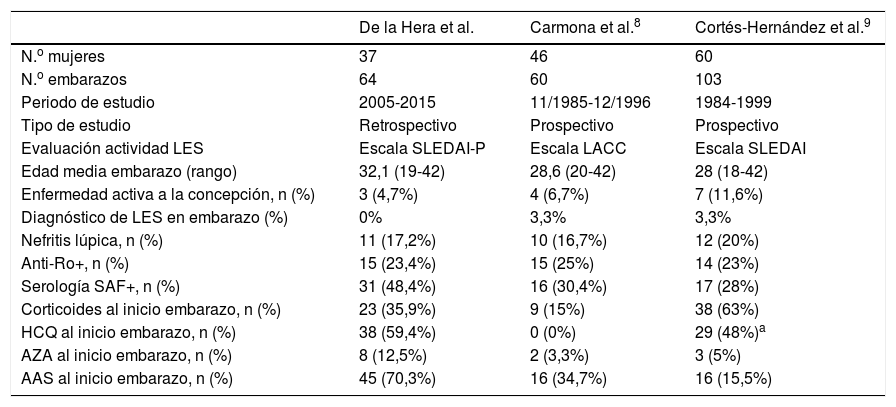
Características generales de los estudios realizados en España sobre lupus eritematoso sistémico y embarazo
| De la Hera et al. | Carmona et al.8 | Cortés-Hernández et al.9 | |
|---|---|---|---|
| N.o mujeres | 37 | 46 | 60 |
| N.o embarazos | 64 | 60 | 103 |
| Periodo de estudio | 2005-2015 | 11/1985-12/1996 | 1984-1999 |
| Tipo de estudio | Retrospectivo | Prospectivo | Prospectivo |
| Evaluación actividad LES | Escala SLEDAI-P | Escala LACC | Escala SLEDAI |
| Edad media embarazo (rango) | 32,1 (19-42) | 28,6 (20-42) | 28 (18-42) |
| Enfermedad activa a la concepción, n (%) | 3 (4,7%) | 4 (6,7%) | 7 (11,6%) |
| Diagnóstico de LES en embarazo (%) | 0% | 3,3% | 3,3% |
| Nefritis lúpica, n (%) | 11 (17,2%) | 10 (16,7%) | 12 (20%) |
| Anti-Ro+, n (%) | 15 (23,4%) | 15 (25%) | 14 (23%) |
| Serología SAF+, n (%) | 31 (48,4%) | 16 (30,4%) | 17 (28%) |
| Corticoides al inicio embarazo, n (%) | 23 (35,9%) | 9 (15%) | 38 (63%) |
| HCQ al inicio embarazo, n (%) | 38 (59,4%) | 0 (0%) | 29 (48%)a |
| AZA al inicio embarazo, n (%) | 8 (12,5%) | 2 (3,3%) | 3 (5%) |
| AAS al inicio embarazo, n (%) | 45 (70,3%) | 16 (34,7%) | 16 (15,5%) |
AAS: ácido acetilsalicílico; AZA: azatioprina; HCQ: hidroxicloroquina; HTA: hipertensión arterial; LES: lupus eritematoso sistémico; SAF: síndrome antifosfolípido.
Si atendemos a nuestra cohorte, la edad media es de 32,1 años, aproximadamente 4 años más que la edad media de los otros estudios8,9. Desde el punto de vista serológico, la prevalencia de los anticuerpos anti-Ro/La es muy similar entre las 3 cohortes estudiadas, aunque la frecuencia de serología de SAF es mayor en la nuestra. Lo mismo sucede con la frecuencia de NL, que es muy similar entre los 3 estudios. Desde el punto de vista terapéutico, casi el 60% de nuestra cohorte global ha recibido desde el inicio antipalúdicos, frente al 48% de los embarazos de Cortés-Hernández et al.9 y ninguno de los embarazos en el estudio de Carmona et al.8. Los embarazos de Cortés Hernández et al.9 recibieron casi un 30% más de corticoides. Desde el punto de vista de los resultados obstétricos (tabla 3), nuestros resultados, en general, mejoran en algunos aspectos los resultados de los otros estudios. De forma global, la tasa de RN vivos es muy similar entre las 3 series, aunque en la nuestra son más frecuentes los abortos precoces (posiblemente por las diferencias en el diseño de los estudios), la tasa de muerte fetal y de interrupción voluntaria del embarazo es inferior. Por otra parte, nuestra frecuencia de preeclampsia, de CIR y de parto pretérmino es claramente inferior, aunque la frecuencia de cesáreas es muy similar.
El estudio de Carmona et al.8 realiza una comparativa entre las mujeres con y sin NL. Como se muestra en la tabla suplementaria 3 del material adicional, los resultados son similares a los nuestros. El grupo de NL tiene más brotes en el embarazo, más HTA, más partos prematuros, una edad gestacional ligeramente menor y un menor peso del RN. Sin embargo, y a pesar de las similitudes en las tendencias de ambas cohortes por separado, cuando se compara el desenlace de su estudio con el nuestro, de forma global nuestra cohorte presenta menos HTA y menos parto prematuro, y la edad gestacional y peso del RN de nuestros pacientes con NL es superior8.
DiscusiónEl presente trabajo describe el resultado del embarazo en pacientes con LES en una cohorte española seguida en una unidad multidisciplinar en el siglo xxi. Si bien es cierto que el resultado obstétrico global es similar al de las cohortes previas, sí que se observan ciertos cambios en la actitud terapéutica que se acompañan de una mejoría en el desenlace obstétrico. Por otra parte, y aunque la tasa de brotes durante el embarazo y posparto sigue dentro de los parámetros promedio de otras series, la mayoría de los brotes son controlados con el tratamiento y no influyen de forma significativa en el pronóstico obstétrico.
Desde un punto de vista epidemiológico, existen 2 aspectos fundamentales a destacar al comparar las diferentes cohortes. Uno de los datos que pueden ser más determinantes es la edad a la concepción. Si atendemos a nuestra cohorte, la edad media es aproximadamente 4 años mayor que la edad media de los otros estudios8,9. El hecho de que nuestros embarazos se produzcan en mujeres de mayor edad, algo intrínseco a motivos sociales-laborales propios de este siglo, implica un mayor riesgo de APO, independientemente de otras variables como el nivel de actividad o el daño orgánico. A diferencia de lo presentado en los otros estudios españoles, en nuestra cohorte el 14% de los embarazos ocurrieron en mujeres no caucásicas. Cabe destacar que las mujeres no caucásicas tenían mayoritariamente embarazos no planificados. Estas mujeres se caracterizaban por tener una mayor frecuencia de NL y un mayor daño orgánico, consecuencia de una mayor prevalencia de HTA. Asimismo, las mujeres no caucásicas eran significativamente más jóvenes (p=0,004) que las caucásicas, un factor que se ha relacionado también en estudios recientes con un peor pronóstico del LES en el embarazo6,7. Debido a esta mayor gravedad, necesitaban más medicación, incluido el uso de corticoides e inmunosupresores. A pesar de todo esto, y probablemente debido al control exhaustivo de estas pacientes en una unidad multidisciplinar, los resultados obstétricos no han diferido de forma significativa de los de las mujeres caucásicas.
El porcentaje de mujeres con un brote durante el embarazo varía entre el 25-65% de unos estudios a otros6,23. Estas discrepancias se deben fundamentalmente a 3 aspectos: diferencias en la definición de brote, el uso de distintos parámetros para medir la actividad del LES24,25, y el diferente abordaje terapéutico de las pacientes durante el embarazo26. Lo que sí parecen concluir los estudios es que la mayoría de los brotes son leves a moderados en gravedad y que afectan, predominantemente, a nivel cutáneo, musculoesquelético, hematológico y renal. El presente trabajo demuestra una tasa de brote en los 3 estudios españoles muy similar, y en general por debajo de lo descrito en la literatura. Esta baja tasa puede estar relacionada con una baja proporción de pacientes con enfermedad activa en el momento de la concepción6, un número escaso de pacientes diagnosticadas de LES en el embarazo, y de forma relevante que los 3 estudios están realizados en unidades específicas dedicadas a la atención de estas pacientes.
Desde el punto de vista serológico, la prevalencia de autoanticuerpos específicos con potencial impacto sobre el embarazo es muy similar a la de los otros estudios excepto una mayor prevalencia de anticuerpos antifosfolípido. En los embarazos de pacientes portadoras de anticuerpos anti-Ro/La positivos no detectamos ningún caso de lupus neonatal. Este hecho es explicable por 2 motivos. En primer lugar, la frecuencia descrita de lupus neonatal en portadoras de estos anticuerpos es del 1-2%27. Solo por motivos de probabilidad estadística no es sorprendente que en nuestra cohorte no apareciese ningún caso de esta complicación. Por otra parte, se ha relacionado el uso de HCQ con un descenso en la probabilidad de desarrollar un lupus neonatal, y en este sentido, una proporción significativa de nuestros pacientes se encontraba en tratamiento con antipalúdicos antes del embarazo, lo que también ha podido contribuir a la ausencia de casos. Hay que destacar también que, aunque únicamente se ha detectado un aumento estadísticamente significativo de CIR en las portadoras de estos anticuerpos, hemos evidenciado una tendencia28 a presentar mayor número de complicaciones obstétricas que no pueden pasar desapercibidas. Parecen presentar más partos pretérmino, más necesidad de inducción del parto, más cesárea y más partos distócicos. A la vista de estos resultados parece razonable que, además del control del RN por la probabilidad de desarrollar lupus neonatal, los especialistas al cargo de estos pacientes sean conscientes del potencial riesgo de complicaciones obstétricas al final del embarazo y de la necesidad de una vigilancia más exhaustiva durante el último trimestre.
El mayor porcentaje de anticuerpos antifosfolípidos en nuestra serie puede ser explicado por una mayor sensibilidad de la técnica de ELISA, que en el siglo anterior no dependían de beta-2 glucoproteína I, ni medían los anticuerpos dirigidos frente a ella. De forma global, y aunque observamos una tasa de RN inferior en los pacientes con serología de SAF positiva, el resultado obstétrico de nuestros pacientes fue muy similar al de los pacientes que no presentaban estos anticuerpos. La principal manifestación fue la presencia de abortos tempranos, siendo muy poco frecuentes la preeclampsia y la muerte fetal tardía. Estos resultados son obviamente consecuencia del elevado porcentaje de pacientes que han recibido terapia antiagregante y/o anticoagulante durante el embarazo. Uno de los aspectos a destacar y que confirman estudios previos de nuestro grupo en pacientes portadores de anticuerpos antifosfolípido29 es la alta frecuencia de factores de riesgo cardiovascular presentes en las portadoras de serología de SAF, y más en concreto una elevada tasa de obesidad y tabaquismo. Sin duda, el control preconcepcional de estos factores en las pacientes con LES puede contribuir a un mejor desenlace.
Desde el punto de vista de los resultados obstétricos, los nuestros mejoran en algunos aspectos los resultados de los otros estudios. La tasa de RN vivos es muy similar entre las 3 series, y aunque en la nuestra son más frecuentes los abortos precoces, la tasa de muerte fetal y de interrupción voluntaria del embarazo es claramente inferior. Por otra parte, y aunque la frecuencia de cesáreas es muy similar, nuestra frecuencia de preeclampsia, CIR y parto pretérmino es inferior a las otras 2 cohortes. En este sentido, es posible que la menor frecuencia de preeclampsia se pueda relacionar con un mayor uso de ácido acetilsalicílico30. En nuestro estudio no pudimos evaluar el posible efecto protector de la hidroxicloroquina en el desarrollo de de preeclampsia5 debido a que solo se desarrolló en una paciente.
Con las limitaciones inherentes a un tamaño muestral reducido, en el presente estudio se muestra que si bien los cambios en la actitud terapéutica y la planificación del embarazo acontecidos en los últimos años no han tenido un impacto directo sobre la tasa de reactivación del LES durante el embarazo, sí que han supuesto una mejoría en los resultados obstétricos de nuestras pacientes. La introducción de nuevas variables independientes de la enfermedad como la edad en la concepción, la procedencia sociocultural, o la disponibilidad de unidades multidisciplinares para tratar a las pacientes con enfermedades autoinmunes durante el embarazo, deberán ser consideradas en los resultados de próximos estudios.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.