La fibrodisplasia osificante progresiva es la causa más grave de osificación ectópica en humanos. Se caracteriza por malformaciones esqueléticas congénitas y placas de hueso maduro (endocondral) en el músculo y en otras estructuras ricas en tejido conjuntivo. Se produce por una mutación espontánea en el gen del receptor de la activina A tipo i, similar a la activina-cinasa-2. A raíz de este hallazgo, se han producido importantes avances en el conocimiento de su base molecular y celular. Además de permitir una mejor comprensión de los mecanismos que gobiernan la osificación, evidencias recientes indican que la alteración primordial radica en mecanismos básicos de la diferenciación celular que son clave en varias vías fisiológicas y en la génesis de enfermedades de gran impacto. En el presente artículo, resumimos los últimos avances con implicaciones que trascienden los límites de esta devastadora enfermedad para postularse como un nuevo modelo dentro de la fisiopatología humana.
Fibrodysplasia ossificans progressiva is the most severe and disabling disorder of ectopic ossification in humans. It is characterized by congenital skeletal abnormalities in association with extraskeletal widespread endochondral osteogenesis. Virtually all patients show the same mutation in the “Activin A type-I/activin-like kinase-2” receptor encoding gene. As a result of this discovery there have been significant advances in the knowledge of the cellular and molecular basis of the disease. Besides allowing a better understanding of ossification process, recent evidence indicates that the primary disturbance lies within basic mechanisms of cell differentiation that are key in several physiological pathways and in the genesis of diseases with a major impact on health. In this article we summarize these breakthroughs, with implications that go beyond the limits of this devastating disease to insinuate a new model of human pathophysiology.
La fibrodisplasia osificante progresiva (FOP; MIM #135100) es una de las enfermedades constitucionales óseas más singulares y de mayor significado, hasta el punto de haber sido considerada «el monte Everest de los trastornos músculo-esqueléticos de origen genético»1 y un modelo aplicable a la investigación en medicina regenerativa y en el conocimiento de la metamorfosis de los tejidos2.
Principales rasgos epidemiológicosLa escasez de datos epidemiológicos es una carencia que la FOP comparte con el conjunto de las enfermedades raras y, de manera singular, con la mayoría de las demás enfermedades musculoesqueléticas de baja prevalencia3. La dispersión de casos inherente a estos procesos y su gran complejidad, con la dificultad diagnóstica añadida que ello supone, dificultan mucho llevar a cabo estudios de población sobre un censo fiable de casos con un diagnóstico de certeza4. Sin embargo, un dato que se acepta como válido con carácter universal, a pesar de ser una estimación obtenida por extrapolación a partir de los resultados obtenidos en un único estudio pionero, es la prevalencia global: en torno a un caso por cada 2 millones de habitantes5. Esta cifra parece consistente en todos los países y regiones geográficas donde se han realizado estudios comparables, por lo que se considera que no hay una clara predisposición étnica o de género6–8. Igualmente, en un trabajo realizado en España, los 17 pacientes identificados que sobrevivían a finales del 2011 (prevalencia puntual = 0,36×10−6) y los 24 incluidos en el total de la muestra son concordantes con la frecuencia estimada en otras áreas9. Por otra parte, como se verá en detalle más adelante, la inmensa mayoría de los casos aparecen de novo, como resultado de una mutación espontánea6,7. De este modo, la agregación familiar de la FOP es extraordinariamente infrecuente y solo se ha comunicado un número muy pequeño de familias con pocos casos en 2 generaciones6. En distintas ocasiones y en diferentes entornos geográficos se ha comunicado una mayor predisposición ligada a la edad paterna5,9,10 que podría estar en relación con el conocido efecto universal de una avanzada edad del padre como factor favorecedor de mutaciones. Adicionalmente, se ha comunicado una cierta exposición a agentes ambientales potencialmente inductores de mutaciones9. Sin embargo, las dificultades y las carencias metodológicas inherentes a estos estudios (en los que es muy difícil establecer controles apropiados y virtualmente imposible investigar la existencia de un efecto dosis-respuesta) obligan a interpretar estas inferencias con mucha cautela antes de darles valor causal.
Clínica, diagnóstico y alternativas terapéuticas actualesDesde el punto de vista clínico, la FOP se caracteriza por malformaciones congénitas y por el desarrollo de placas de hueso maduro (con un patrón de osificación endocondral) en el seno del músculo y en otras estructuras ricas en tejido conjuntivo11. La virulencia de estas alteraciones sitúa la FOP como la causa más grave de osificación ectópica en humanos12.
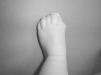
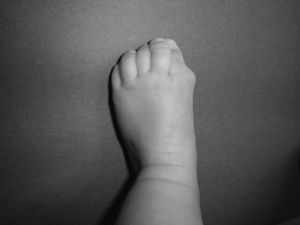
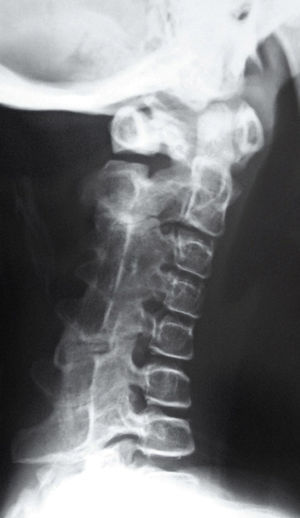
Los recién nacidos con FOP tienen un aspecto normal excepto por la presencia (en la práctica totalidad de ellos) de malformaciones en el dedo gordo del pie, siendo el hallux valgus congénito el sello más característico de la enfermedad (fig. 1)13,14. Aunque se suelen reconocer más tarde (e incluso pasan inadvertidas o son erróneamente interpretadas), el componente displásico de la FOP se puede manifestar por diversas anomalías esqueléticas congénitas que aparecen con una frecuencia variable pero casi siempre elevada. Entre estas malformaciones destacan: otras anomalías en los dedos de las manos y los pies distintas de las del dedo gordo del pie (acortamiento de falanges, metatarsianos y metacarpianos, sinostosis, clinodactilia)15; aumento de tamaño y fusión de la facetas posteriores con hipoplasia del cuerpo vertebral en la columna cervical (fig. 2), que puede acabar formando un bloque16–18; osteocondromas, sobre todo evidentes en la región medial de la tibia19, y cuello femoral corto y ancho20.
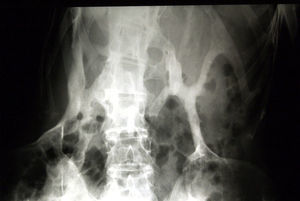
Por otra parte, con cierta variabilidad en cuanto a su aparición e intensidad, desde los primeros meses o años de vida, y a menudo desencadenados por un traumatismo, la mayoría de los pacientes presentan episodios agudos de formación de nódulos seudoinflamatorios2,7,12. Con el tiempo, estas lesiones presentes en el seno del músculo estriado, los tendones y los ligamentos se trasforman en placas de hueso maduro11 que progresan y se extienden de forma secuencial según un patrón anatómico específico: en dirección cefálica-caudal, proximal-distal y axial-apendicular21. Así, aunque el ritmo de progresión es variable, entre la segunda y la tercera décadas de la vida, las placas al ramificarse acaban formando «un segundo esqueleto»1,22 con puentes rígidos que disminuyen la movilidad de las estructuras sobre las que asientan (fig. 3)7,12. Como las placas se suelen localizar en regiones anatómicas de gran importancia funcional como el cuello, los hombros, las caderas y las rodillas, casi siempre acaban comprometiendo la movilidad y dificultan actividades básicas como la deambulación. Y más adelante pueden afectar a regiones vitales, como la zona submandibular —dando lugar a problemas para la masticación, la deglución y el habla— y la musculatura torácica, lo que dificulta la función respiratoria y origina graves complicaciones que pueden acarrear una muerte temprana12,23. Además, la FOP puede ocasionar otros trastornos que repercuten sobre funciones esenciales, como la pérdida de audición, presente en un elevado porcentaje de los enfermos24. Recientemente, en un estudio basado en un cuestionario postal enviado a una amplia muestra de pacientes, se ha comunicado una elevada frecuencia de síntomas neurológicos crónicos25. Dentro de esta misma línea de trabajo (cuyos hallazgos precisan confirmación), en 2 modelos animales y mediante técnicas de imagen se han observado lesiones desmielinizantes en el sistema nervioso central26, sugiriéndose que podrían estar relacionadas con la desregulación de la señal en la vía de las proteínas morfogenéticas óseas que, como se verá después, desempeñan un papel básico en la patogenia de la FOP.
Cada vez se está llamando más la atención sobre la heterogeneidad en la expresión clínica de la FOP27,28, la cual parece depender de la distinta influencia de factores genéticos y ambientales29,30. Así, en un estudio de 3 parejas de gemelos monocigóticos se comprobó que en cada par de hermanos la malformación del dedo gordo es idéntica y diferente de los de las otras parejas31. Basándose en estas evidencias y en observaciones acerca de la evolución clínica de la enfermedad, estos autores indican que los factores genéticos condicionarían las alteraciones ocasionadas durante el desarrollo fetal, mientras que los agentes ambientales asociados al estilo de vida (los traumatismos repetidos es el factor mejor conocido) determinarían en parte la intensidad y el ritmo de avance de la osificación.
En las fases iniciales, antes de la formación de placas de hueso heterotópico, los errores de diagnóstico son frecuentes, confundiéndose con procesos como la fibromatosis agresiva juvenil, el linfedema o el sarcoma de partes blandas12,32,33. Sin embargo, es muy importante tener en cuenta que, aunque los nódulos incipientes puedan prestarse a confusión, la presencia concomitante de la típica malformación congénita del dedo gordo del pie (fig. 1) permite realizar el diagnóstico de certeza. En todo caso, el test genético apropiado confirmaría la enfermedad, haciendo innecesarias otras pruebas y medidas terapéuticas que pueden ocasionar un daño irreversible34. A este respecto, hay que insistir en la inutilidad de la biopsia, la cual, al igual que los procedimientos quirúrgicos ortopédicos, deben evitarse, ya que de manera habitual conduce a un empeoramiento de la lesión33-35.
En la actualidad, no se dispone de un tratamiento efectivo para la FOP. En consecuencia, el esfuerzo se dirige a la prevención y el alivio sintomático de los brotes de nódulos (antes de la formación de placas óseas), medidas de soporte y recuperación funcional, ayudas, y consejo genético23,33. Es muy importante evitar o minimizar cualquier factor que pueda desencadenar o agravar el desarrollo de las placas, en particular los traumatismos, las inyecciones intramusculares y cualquier otra maniobra agresiva para la integridad de los tejidos conjuntivos. Así mismo se debe extremar el cuidado dental en evitación de caries, recomendándose que los trabajos sean realizados por especialistas familiarizados con situaciones complejas36. Así mismo, si hubiera necesidad de realizar una anestesia general (cualquier indicación quirúrgica debe estar muy justificada), el anestesista debe tener en cuenta el riesgo de que se produzca una luxación atlanto-axoidea y dominar técnicas de intubación especial a fin de minimizar esta complicación37,38. Para una descripción detallada de las pautas de tratamiento sintomático de los brotes de nódulos iniciales y el intento de prevenir su conversión en placas de hueso mediante tratamiento con corticoides, indicamos la lectura de las guías y recomendaciones publicadas por el «Consorcio clínico internacional de la FOP»33. Para los fines de esta revisión, podemos concluir aquí esta primera parte y pasar a analizar los hallazgos proporcionados por la investigación genética y bioquímica más reciente, que parecen abrir una puerta a la consecución de un tratamiento que modifique de manera eficaz la historia natural de esta devastadora enfermedad39,40.
La mutación FOP y la proteína morfogenética óseaLa práctica totalidad de los pacientes que muestran el fenotipo clásico de FOP que acabamos de describir tienen idéntica mutación−c.617 G>A –en el gen que codifica el receptor de la activina A tipo i similar a la activina-cinasa-2 (ACVR1/ALK2), una mutación heterocigota, recurrente y antisentido en el codón 206 (R206H), dentro del dominio GS del receptor41,42. El receptor ACVR1/ALK2 se expresa en tejidos como el músculo esquelético, los vasos sanguíneos (células endoteliales y pericitos) y el cartílago, entre otros, lo que explicaría las alteraciones del desarrollo esquelético y las osificaciones heterotópicas características del «fenotipo FOP»41,43,44.
El receptor transmembrana ACVR1/ALK2 pertenece a la familia de receptores de la proteína morfogenética ósea (BMP), los cuales se consideran miembros de la superfamilia de los factores de crecimiento transformante beta (TGF-β)45. Su conservación a lo largo de la evolución y su presencia en todos los organismos pluricelulares resaltan la importancia de estas citocinas que ejercen sus efectos en múltiples tejidos y sistemas. Los receptores de la superfamilia TGF-β/BMP muestran una estructura heterotetramérica muy compleja y de manera esquemática se pueden encuadrar en 2 categorías46:
- –
Tipo I: incluye 7 receptores (ALK1-7) con la característica común de ser cinasas del «receptor-activina». A este tipo pertenece el ACVR1/ALK2, cuya mutación está presente en la FOP.
- –
Tipo II: del cual se han descrito hasta 5 receptores distintos.
Una característica peculiar de todos los receptores TGF-β/BMP de tipo i es poseer una región rica en residuos de glicina y serina, yuxtapuesta a la membrana citoplásmica: el dominio GS. Múltiples hallazgos47–53 indican que esta zona es crítica en la señalización y que, tras la unión al ligando, desencadena al menos 2 cascadas de transmisión de la señal. En el caso del receptor ACVR1/ALK2, la interacción con los ligandos de BMP (principalmente BMP-2, 4, 6 y 7) conlleva la asociación del receptor de tipo i con el receptor de tipo ii, que es constitutivamente activo y que, a su vez, fosforila al receptor de tipo i en el residuo GS. Esta modificación provoca el desplazamiento de la proteína inhibidora FKBP1254 y la consecuente transducción de la señal a través de: a) una ruta canónica, que se caracteriza por la activación de las proteínas R-Smads1/5/8. La fosforilación de estos factores permite su acople con el Co-Smad (Smad4) y su translocación al núcleo, donde dirige la transcripción de genes específicos, muchos de ellos directamente involucrados en el establecimiento de un ambiente proosteogénico, y b) una ruta no canónica, caracterizada por una señalización a través de las «proteínas cinasa mitogénica activadas» (MAPK), que incluyen las enzimas p38, «cinasa regulada por señales extracelulares» (ERK) y «cinasa terminal de c-jun» (JNK). Al contrario que la ruta canónica, la regulación de estas cinasas por los ligandos BMP/TGF-β no ha sido estudiada en profundidad. No obstante, el hecho de que esta cascada de señalización «secundaria» no sea exclusiva de la ruta TGF-β/BMP indica que su control podría desempeñar un papel integrador con otras cascadas de transducción de señales (rutas inflamatorias55, ligandos de Wnt56 y Notch57), que también activan MAPK.
En síntesis, este conjunto de hechos permite afirmar que los ligandos de la «familia TGF-β» ocupan una posición central en la red de señales que rigen el crecimiento, la diferenciación y el destino final de las células progenitoras de una gran variedad de células y tejidos, tanto durante el desarrollo embrionario como después del nacimiento58-60. En particular, debido al papel clave de las BMP en la embriogénesis y en la homeostasis tisular del organismo adulto, sus alteraciones se han implicado en la etiopatogenia de varias enfermedades de naturaleza muy diversa61.
El metamorfogén de la FOP: desregulación de la señal «vía-BMP»Estudios con modelos celulares in vitro han permitido descubrir que la mutación canónica de la FOP induce una activación cuasi constitutiva del receptor ACVR1/ALK2 que causa una interacción amplificadora entre este y una de las enzimas clave en el proceso de transducción intracelular de la señal, la peptidil-prolil-cis-trans-isomerasa (FKBP1A/FKBP12), aumentando así la activación de varias proteínas de la ruta de las BMP43,62–64, sin necesidad de interacción ligando-receptor44. La simple sustitución de un aminoácido (arginina por histidina) que conlleva la mutación canónica de la FOP transforma el receptor morfogenético en un receptor metamorfogenético, proporcionando un sustrato que hace posible el desarrollo de las alteraciones ante y posnatales de la enfermedad58.
En consonancia con estas premisas, distintos modelos experimentales han mostrado que la activación constitutiva del receptor mutado: a) induce actividad de fosfatasa alcalina en células madre musculares (células satélite) del músculo murino (C2C12)63,65; b) regula al alza la BMP-4 y a la baja los antagonistas de la cascada de señal de la BMP a través de la vía Smad (véase después)44; c) expande elementos articulares, induce condrogénesis ectópica y estimula la fusión articular de forma similar a lo que ocurre en la FOP43,59,65, y d) regula la estabilidad del ARN mensajero de ACVR1/ALK2, actuando como un bucle de refuerzo positivo66.
Por otra parte, los resultados obtenidos en Drosophila melanogaster, en los que se estudió la regulación de la «ruta de Dpp» (genes homólogos de BMP) en los mutantes «decapentaplegic»67, al igual que el análisis fenotípico de los pacientes42, indican que la alteración patogénica afecta tanto al modelado embrionario como a la respuesta posnatal anómala a estímulos capaces de ocasionar una lesión tisular58. Algunos de los hallazgos más relevantes que apoyan esta teoría son un aumento en la expresión de BMP en células de lesiones activas62,68,69 y un incremento en la concentración de receptores de BMP tipo i en la superficie celular70. También se ha comunicado un aumento en la diferenciación osteogénica de células progenitoras del tejido conjuntivo obtenidas por exfoliación de dientes de leche: células «SHED» (por su sigla inglesa: «stem cells from human exfoliated decidous teeth»). En voluntarios sanos, estas células transmiten señales BMP tanto a través de las vía Smad como de la ruta MAPK (en particular, a través de la cinasa p38) y responden al tratamiento con BMP-4. En pacientes con FOP muestran una mayor respuesta basal y tras estimulación del ligando, y se diferencian con mayor rapidez que las de los controles hacia un fenotipo osteogénico71.
La dificultad y el riesgo inherentes a obtener tejidos primarios de pacientes con FOP35 han estimulado el desarrollo de modelos in vivo. Así, gracias a experimentos en un modelo de pez cebra que expresa el receptor mutado, se demostró que este gen inducía la condrogénesis de manera independiente de ligando43. Poco después, se confirmó que la expresión del receptor humano mutado en FOP ALK2 R206H en Drosophila melanogaster provocaba una sobreactivación de la ruta de señalización de las BMP. Curiosamente, estos experimentos demostraron que el receptor mutado ACVR1/ALK2 requiere un receptor de BMP tipo 2 funcional72. Recientemente, estos hallazgos se han confirmado en un modelo de FOP en ratón, que consiste en la expresión de un receptor ALK2 constitutivo con la mutación Q207D73, abriendo así las posibilidades de otra diana terapéutica para el desarrollo de fármacos. No obstante, estudios in vitro han demostrado diferencias funcionales entre el receptor ALK2 R206H y el receptor ALK2 Q207D64. En la actualidad, no es posible contar con un modelo de mamíferos (preferiblemente, ratones o ratas) que reproduzca en su totalidad el fenotipo humano de FOP, ya que dicha mutación resulta letal durante el desarrollo prenatal de estos animales. Quizás el avance de mayor relevancia en este sentido se produjo en 2012 con la publicación de un modelo de ratones quiméricos ALK2 R206H en los que la expresión del gen mutado se lleva a cabo en una etapa posterior del desarrollo prenatal, esquivando de esta manera la letalidad del gen74. Sin embargo, este modelo es laborioso y caro, lo que dificulta su empleo para investigar los mecanismos moleculares responsables de la enfermedad, así como el desarrollo de nuevos fármacos. En este sentido, recientemente se ha recurrido a la generación de células madre inducidas a partir de tejido primario de pacientes75,76. Gracias a esta estrategia se pretende contar con material ilimitado de pacientes sobre el cual identificar nuevos compuestos que interfieran con la progresión de la enfermedad.
Mecanismos clave: «transición endotelial-mesenquimal» e inflamaciónLa plasticidad epitelial y endotelial es clave para el desarrollo embrionario y la progresión de ciertas enfermedades77. La pérdida de los rasgos endoteliales y la adquisición de características mesenquimales —transición endotelial-mesenquimal (EndMT)— ocurre en varios procesos biológicos de gran importancia, todos ellos relacionados con alteraciones de las BMP. Así, se ha implicado en la progresión del cáncer77-79, en la fibrosis cardiaca80 y renal81-83, en la arteriosclerosis84,85, en la hipertensión pulmonar86,87 y en el proceso de cicatrización de las heridas88.
La observación de que los condrocitos y los osteoblastos presentes en la zona de reparación de las fracturas óseas se tiñen con anticuerpos específicos de marcadores endoteliales89 permitió plantear la hipótesis de que la EndMT, además de contribuir al mecanismo fisiológico de reparación, puede estar implicada en ciertos trastornos óseos. En ese sentido, tanto en pacientes con FOP como en modelos animales que remedan la enfermedad, se ha demostrado que la EndMT es un factor esencial en la patogenia. Así, en 2 modelos de ratón transgénico («Nse-BMP-4» y «MyoDiCre») diseñados de forma que permiten rastrear el origen de las células responsables de la esqueletogénesis, se ha observado que, en un microambiente inflamatorio y como respuesta a las señales de la vía BMP activadas por la mutación ACVR1/ALK2, las células endoteliales progenitoras se diferencian hacia una línea condrocitaria y contribuyen a todos y cada uno de los estadios de la osificación heterotópica, desde el esbozo mesenquimal hasta la formación de hueso endocondral90. Antes, con un método diferente, se había indicado que al menos una parte de las células mesenquimales involucradas en la metamorfosis esquelética que supone la FOP son de origen vascular91. Recientemente, tanto en muestras de pacientes obtenidas por biopsia, como en un modelo animal inducido por la transferencia de un gen ACVR1/ALK2 constitutivamente activado74, se ha demostrado mediante técnicas inmunohistoquímicas que los condrocitos y los osteoblastos presentes en las lesiones expresan marcadores del endotelio vascular como el Tie-2 y el factor de von Willebrand92. Adicionalmente, las células endoteliales que expresan el receptor mutado y el tratamiento con ligandos del receptor como el TGF-β-2 o el BMP-4 ocasionan EndMT y la adquisición de un fenotipo similar al de las células madre mesenquimales.
Además de estar influida por estímulos de otras rutas de señalización, la EndMT es dependiente de los ligandos de TGF-β y BMP, así como del receptor mutado en FOP ALK2 R206H. Por ello, los inhibidores químicos del TGF-β (SB-431542 y LY-36494779) y de las BMP (basados en dorsomorfina93-95, así como con una estructura distinta96) bloquean la EndMT. Es más, debido a la falta de especificidad de los compuestos desarrollados hasta el momento por la similitud estructural de los receptores ALK, se han ideado alternativas basadas en terapia génica para bloquear el receptor ALK2 sin afectar a otros receptores, evitando así posibles efectos secundarios97,98.
La condrogéneis requiere un microambiente hipóxico y antiangiogénico99. Por eso, al ser la hipoxia una de las consecuencias de la inflamación100, y dado que la activación de esta (en particular un aumento de las citocinas proinflamatorias prostaglandina E2 y factor de necrosis tumoral alfa101) se ha señalado como necesaria para iniciar la osificación heterotópica102, la interacción de ambos factores, entre sí y con otros mecanismos, puede ser determinante en la EndMT mediada por la mutación R206H90,94,102,103. Por otra parte, es bien conocido que las células troncomesenquimales, susceptibles de diferenciarse en adipocitos, osteocitos y condrocitos, pueden interactuar con células del sistema inmunitario innato y adaptativo, modulando diversas funciones104. Si bien ciertas células del sistema inmunitario derivadas de precursores hematopoyéticos han sido implicadas en la metamorfosis esquelética que caracteriza la FOP41, falta definir con precisión su posible papel patogénico.
En resumen, la predisposición a desarrollar el hueso heterotópico endocondral característico la FOP se debe a la mutación R206H del receptor ACVR1/ALK2, la cual provoca una regulación al alza de la cascada de señales de las BMP. Este hecho se vería favorecido por un microambiente de hipoxia asociado a la activación inflamatoria que se produce tras un traumatismo. Esta combinación de factores induciría una «transición endotelial-mesenquimal» de las células precursoras del endotelio vascular, dando lugar a células mesenquimales pluripotenciales con capacidad para diferenciarse en osteoblastos y condrocitos. De esta forma, las células endoteliales participarían en todas las etapas de la formación de hueso heterotópico (acumulación de células mesenquimales, formación de osteoblastos y condrocitos, y maduración ósea), focalizándose en las regiones anatómicas donde el receptor ACVR1/ALK2 se expresa en mayor medida (músculo esquelético, vasos sanguíneos y cartílago). Comprender en profundidad la mutación asociada a la FOP, la ruta de señalización de las BMP y el mecanismo de «transición endotelial-mesenquimal» no solo proporciona nuevas dianas terapéuticas para obtener fármacos eficaces frente a esta enfermedad, sino que supone un esperanzador avance en el conocimiento de una variedad de procesos básicos en la metamorfosis y la reparación de tejidos y órganos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.