Se ha realizado una evaluación económica retrospectiva de la restricción llevada a cabo en España en el uso de piroxicam, debido a un riesgo constatado de complicaciones gastrointestinales graves mayor que el de los otros antiinflamatorios no esteroideos, con el fin de poner en contexto la relevancia de las actividades de farmacovigilancia.
MétodosSe realizaron análisis de coste-efectividad y de impacto presupuestario retrospectivos. Se compararon costes y casos de complicaciones gastrointestinales graves en el escenario sin intervención (uso de piroxicam) y con intervención (uso de otros antiinflamatorios no esteroideos). Se ha obtenido el coste de complicaciones gastrointestinales graves mediante los Grupos Relacionados por el Diagnóstico del conjunto mínimo básico de datos y el de los antiinflamatorios no esteroideos con los datos de consumo en el Sistema Nacional de Salud. El riesgo de complicaciones gastrointestinales graves se estimó a partir de estudios epidemiológicos.
ResultadosLa intervención reguladora resultó la opción dominante, con un ahorro de 0,81 euros por paciente y 2,75 casos de complicaciones gastrointestinales graves evitados por 10.000 pacientes y un ahorro estimado en toda España de 578.608 euros en el primer año tras la intervención.
ConclusionesEs posible realizar evaluaciones económicas completas sobre actuaciones en farmacovigilancia. La intervención realizada por la Agencia Española de Medicamentos y Productos Sanitarios sobre piroxicam, además de cumplir con su objetivo de prevenir reacciones adversas, supuso un ahorro significativo, incluso bajo supuestos conservadores.
A retrospective economic evaluation was performed on the restriction of the use of piroxicam in Spain, a non-steroidal anti-inflammatory drug, with a proven higher risk of serious gastrointestinal complications compared to other non-steroidal anti-inflammatory drugs with the objective of putting the relevance of these activities into context.
MethodsA retrospective cost-effectiveness analysis and a budget impact analysis were performed. Costs and cases of serious gastrointestinal complications were compared in the non-intervention (use of piroxicam) and the intervention scenarios (use of other non-steroidal anti-inflammatory drugs). The cost of serious gastrointestinal complications was obtained from the Diagnosis Related Groups and the cost of non-steroidal anti-inflammatory drugs from usage data in the Spanish national health system. The risk of serious gastrointestinal complications was obtained from epidemiological studies.
ResultsThe regulatory intervention was the dominant option. In that sense, 0.81 euros per treated patient were saved, 2.75 cases of serious gastrointestinal complications were avoided per 10,000 patients and 578,608 euros were saved in total in Spain in the first year following the intervention.
ConclusionsIt is possible to perform complete economical evaluations on pharmacovigilance actions. The intervention performed by the Spanish Agency for Medicines and Medical Devices, AEMPS on piroxicam not only achieved the objective of preventing adverse drug reactions but also resulted in significant economical savings even under conservative assumptions.
En septiembre del 2006, se inició una revisión formal del balance beneficio-riesgo del antiinflamatorio no esteroideo (AINE) piroxicam por parte de la Agencia Europea de Medicamentos (EMA), a instancias de la Comisión Europea, ya que diferentes estudios epidemiológicos apuntaban de forma consistente a que piroxicam presentaba un mayor riesgo de complicaciones gastrointestinales que otros AINE. La conclusión del Comité del Medicamentos de uso humano de la EMA fue que la relación beneficio-riesgo de piroxicam solo es favorable en condiciones de uso muy restringidas1. Como consecuencia, en septiembre del 2007, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) restringió el uso de los medicamentos que contenían piroxicam por vía sistémica, incluyendo su paso a diagnóstico hospitalario, solamente para el tratamiento sintomático de la artrosis, de la artritis reumatoide y de la espondilitis anquilosante, pero nunca como primera línea de tratamiento2.
Numerosos estudios3,4 han analizado de modo global el impacto económico de las reacciones adversas a los medicamentos sobre la salud de la población. En particular, la relevancia sanitaria y económica de los efectos adversos gastrointestinales de los AINE5 queda de manifiesto por el importante número de estudios fármaco-económicos realizados en esta área, algunos de ellos en España6-10, diseñados para analizar la eficiencia de introducir el uso de AINE menos gastroerosivos (en concreto los llamados Coxib) y, más recientemente, para estudiar la eficiencia de determinadas estrategias terapéuticas en el uso de AINE11,12.
Podría asumirse que las intervenciones reguladoras en farmacovigilancia, cuyo objetivo es precisamente reducir la carga de enfermedad asociada a reacciones adversas a los medicamentos, producen una efectiva reducción de costes y de enfermedad para la población en la que se aplican. Sin embargo, no se encuentran en la literatura evaluaciones económicas completas de intervenciones concretas en farmacovigilancia. Estas decisiones se toman independientemente de sus consecuencias económicas y una evaluación fármaco-económica previa no se plantea como necesaria ni pertinente. Sin embargo, en el contexto de la necesaria evaluación de la efectividad de las medidas tomadas, una evaluación a posteriori, incluyendo su impacto económico sobre el sistema sanitario, puede servir para poner en contexto su relevancia como actividad de salud pública.
El objetivo del estudio es, por tanto, realizar una evaluación económica de la intervención en farmacovigilancia que tuvo lugar en el año 2007 sobre piroxicam en comparación con la situación que se hubiera producido de no haberse tomado la citada medida reguladora, con un horizonte temporal de un año. Para ello, se ha realizado un análisis de coste-efectividad y un análisis de impacto presupuestario.
Sujetos y métodosPoblación de referenciaPacientes candidatos a recibir piroxicam mediante prescripción en receta del Sistema Nacional de Salud (SNS) en España en los años 2006-2008. Se excluye a aquellos pacientes para los que piroxicam siguió estando indicado tras la decisión de restricción de uso decidida por la AEMPS2.
Para el caso base se considera una duración media del tratamiento con un AINE de 20 días, basándose en la duración más frecuente de un envase de un AINE y, por tanto, de una prescripción, considerando la dosis diaria definida (DDD) como dosis media diaria. Datos de base poblacional de utilización de estos medicamentos en España muestran que la mayor parte de los tratamientos con AINE recetados duran menos de 31 días13.
PerspectivaLa perspectiva es la del SNS, de modo que para el cálculo de los costes se tienen en cuenta exclusivamente los costes médicos directos para el sistema sanitario.
Intervención a evaluarIntervención reguladora que tuvo lugar en septiembre de 2007 por motivos de farmacovigilancia, consistente en la restricción de piroxicam a segunda línea de tratamiento y exclusivamente en patología articular crónica, debido a su riesgo incrementado de producir complicaciones gastrointestinales graves (CGIG) en comparación con otros AINE de similar eficacia antiinflamatoria y analgésica.
Valoración de los resultados en saludSe han valorado los resultados en salud en términos de efectividad clínica, en prevención de casos de CGIG asociados al uso de AINE. Se asume que la eficacia terapéutica de piroxicam y de los otros AINE alternativos es similar y que el resto del perfil de seguridad se puede considerar equiparable o, en todo caso, que piroxicam no demuestra ninguna ventaja respecto a los otros AINE.
Con este fin, se han escogido los 4 AINE con mayor uso en España en ese momento: ibuprofeno, diclofenaco, naproxeno y aceclofenaco, y que representan en conjunto más del 85% del consumo de AINE14. Las CGIG se definen como casos de perforación, obstrucción o hemorragia digestiva altas. Se ha obtenido el riesgo o probabilidad de presentar una CGIG con piroxicam y con los AINE alternativos mediante el cálculo de la incidencia acumulada de CGIC durante el tiempo de tratamiento (IAtrto) a partir de tasas de incidencia (TI) basales en personas-día y de los riesgos relativos (RR) para cada AINE mediante la fórmula: IAtrto=1−EXP(−TI×20)15. Se asume que el riesgo de CGIG es constante a lo largo del tratamiento.
Las TI de CGIC en la población general no expuesta a AINE se han obtenido de un metaanálisis de estudios epidemiológicos publicados16.
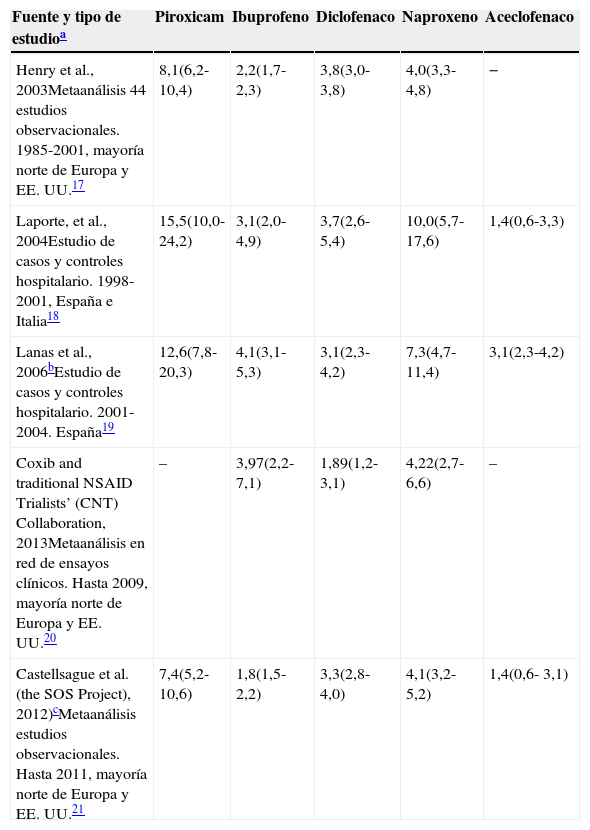
De entre los diferentes estudios17-21 que han estudiado el riesgo de CGIG asociado a los AINE de interés en el análisis (tabla 1) se han seleccionado los RR obtenidos en un metaanálisis de estudios observacionales publicado más recientemente21.
Complicaciones gastrointestinales graves asociadas a antiinflamatorios no esteroideos. Resultados de los estudios publicados, riesgo relativo (intervalo de confianza del 95%)
| Fuente y tipo de estudioa | Piroxicam | Ibuprofeno | Diclofenaco | Naproxeno | Aceclofenaco |
|---|---|---|---|---|---|
| Henry et al., 2003Metaanálisis 44 estudios observacionales. 1985-2001, mayoría norte de Europa y EE. UU.17 | 8,1(6,2-10,4) | 2,2(1,7-2,3) | 3,8(3,0-3,8) | 4,0(3,3-4,8) | − |
| Laporte, et al., 2004Estudio de casos y controles hospitalario. 1998-2001, España e Italia18 | 15,5(10,0-24,2) | 3,1(2,0-4,9) | 3,7(2,6-5,4) | 10,0(5,7-17,6) | 1,4(0,6-3,3) |
| Lanas et al., 2006bEstudio de casos y controles hospitalario. 2001-2004. España19 | 12,6(7,8-20,3) | 4,1(3,1-5,3) | 3,1(2,3-4,2) | 7,3(4,7-11,4) | 3,1(2,3-4,2) |
| Coxib and traditional NSAID Trialists’ (CNT) Collaboration, 2013Metaanálisis en red de ensayos clínicos. Hasta 2009, mayoría norte de Europa y EE. UU.20 | – | 3,97(2,2-7,1) | 1,89(1,2-3,1) | 4,22(2,7-6,6) | – |
| Castellsague et al. (the SOS Project), 2012)cMetaanálisis estudios observacionales. Hasta 2011, mayoría norte de Europa y EE. UU.21 | 7,4(5,2-10,6) | 1,8(1,5-2,2) | 3,3(2,8-4,0) | 4,1(3,2-5,2) | 1,4(0,6- 3,1) |
Estudios y metaanálisis publicados que se utilizaron como base para la decisión reguladora en Europa1, y los metaanálisis más recientes).
Se han valorado los costes en que se incurren para el diagnóstico y el tratamiento de las CGIG, que se asume siempre tienen lugar en el ámbito hospitalario. El resto de los costes en que se puede incurrir se pueden considerar costes comunes a las alternativas comparadas.
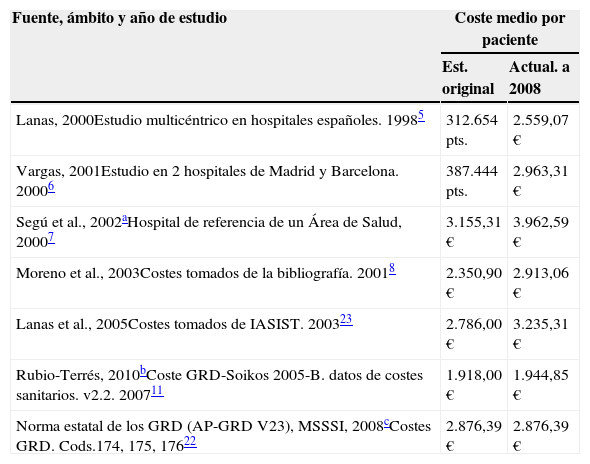
El coste medio hospitalario en el SNS en España en 2008 de una CGIC en el caso base se ha estimado en 2.876,39 euros. Se ha obtenido a partir de los costes de los Grupos Relacionados por el Diagnóstico (GRD) de los diagnósticos de alta hospitalarios del sistema del Conjunto Mínimo Básico de Datos (Norma estatal de los GRD [AP-GRD V23], año 2008). Los códigos GRD seleccionados correspondientes a las CGIG, utilizados ya previamente por otros autores11, junto con el coste GRD y el número de altas depuradas respectivas22, fueron los siguientes: 3.598,75 euros y 11.472 altas para hemorragia gastrointestinal con complicaciones (cód. GRD 174); 2.363,49 euros y 16.867 altas para hemorragia gastrointestinal sin complicaciones (cód. GRD 175) y 3.233,66 euros y 1.019 altas para úlcera péptica complicada (cód. GRD 176). Además, se han revisado estimaciones de valoración del coste de CGIG en España publicadas en la literatura5-8,11,23, que se han utilizado para el análisis de sensibilidad (tabla 2).
Fuentes de información para la valoración del coste medio de una complicación gastrointestinal grave asociada a antiinflamatorios no esteroideos
| Fuente, ámbito y año de estudio | Coste medio por paciente | |
|---|---|---|
| Est. original | Actual. a 2008 | |
| Lanas, 2000Estudio multicéntrico en hospitales españoles. 19985 | 312.654 pts. | 2.559,07 € |
| Vargas, 2001Estudio en 2 hospitales de Madrid y Barcelona. 20006 | 387.444 pts. | 2.963,31 € |
| Segú et al., 2002aHospital de referencia de un Área de Salud, 20007 | 3.155,31 € | 3.962,59 € |
| Moreno et al., 2003Costes tomados de la bibliografía. 20018 | 2.350,90 € | 2.913,06 € |
| Lanas et al., 2005Costes tomados de IASIST. 200323 | 2.786,00 € | 3.235,31 € |
| Rubio-Terrés, 2010bCoste GRD-Soikos 2005-B. datos de costes sanitarios. v2.2. 200711 | 1.918,00 € | 1.944,85 € |
| Norma estatal de los GRD (AP-GRD V23), MSSSI, 2008cCostes GRD. Cods.174, 175, 17622 | 2.876,39 € | 2.876,39 € |
GRD: Grupos Relacionados por el Diagnóstico; MSSSI: Ministerio de Sanidad, Servicios Sociales e Igualdad.
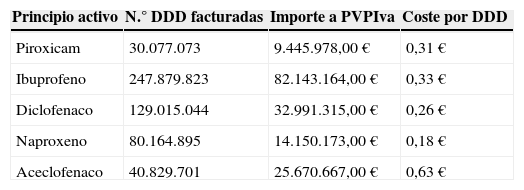
Para valorar y cuantificar los costes del tratamiento se han utilizado los datos de facturación en el SNS en el año 2006 de los AINE (grupo ATC M01A) compilados por el Ministerio de Sanidad, Servicios Sociales e Igualdad. Se ha asumido que el uso de otros medicamentos es similar en las alternativas comparadas. Para cada uno de los principios activos de AINE incluidos en el análisis se ha considerado el PVP-IVA de las DDD facturadas con las diferentes presentaciones de los medicamentos. Para ibuprofeno, se han excluido del análisis las presentaciones para uso pediátrico. Puesto que el consumo de piroxicam quedó fuertemente distorsionado por la medida reguladora, se ha seleccionado el año 2006, el anterior a la intervención, con el fin de obtener los datos de coste (tabla 3). Los costes de la DDD de los principios activos analizados fueron estables en el periodo 2006-2008, sin cambios en sus precios de referencia. El coste medio del tratamiento se ha obtenido multiplicando el coste medio de las respectivas DDD por los 20 días de tratamiento considerados.
Estimación del coste del tratamiento con antiinflamatorios no esteroideos
| Principio activo | N.° DDD facturadas | Importe a PVPIva | Coste por DDD |
|---|---|---|---|
| Piroxicam | 30.077.073 | 9.445.978,00 € | 0,31 € |
| Ibuprofeno | 247.879.823 | 82.143.164,00 € | 0,33 € |
| Diclofenaco | 129.015.044 | 32.991.315,00 € | 0,26 € |
| Naproxeno | 80.164.895 | 14.150.173,00 € | 0,18 € |
| Aceclofenaco | 40.829.701 | 25.670.667,00 € | 0,63 € |
DDD: dosis diaria definida.
Fuente: datos de facturación en recetas al Sistema Nacional de Salud en el año 2006.
Se ha utilizado un horizonte temporal de un año.
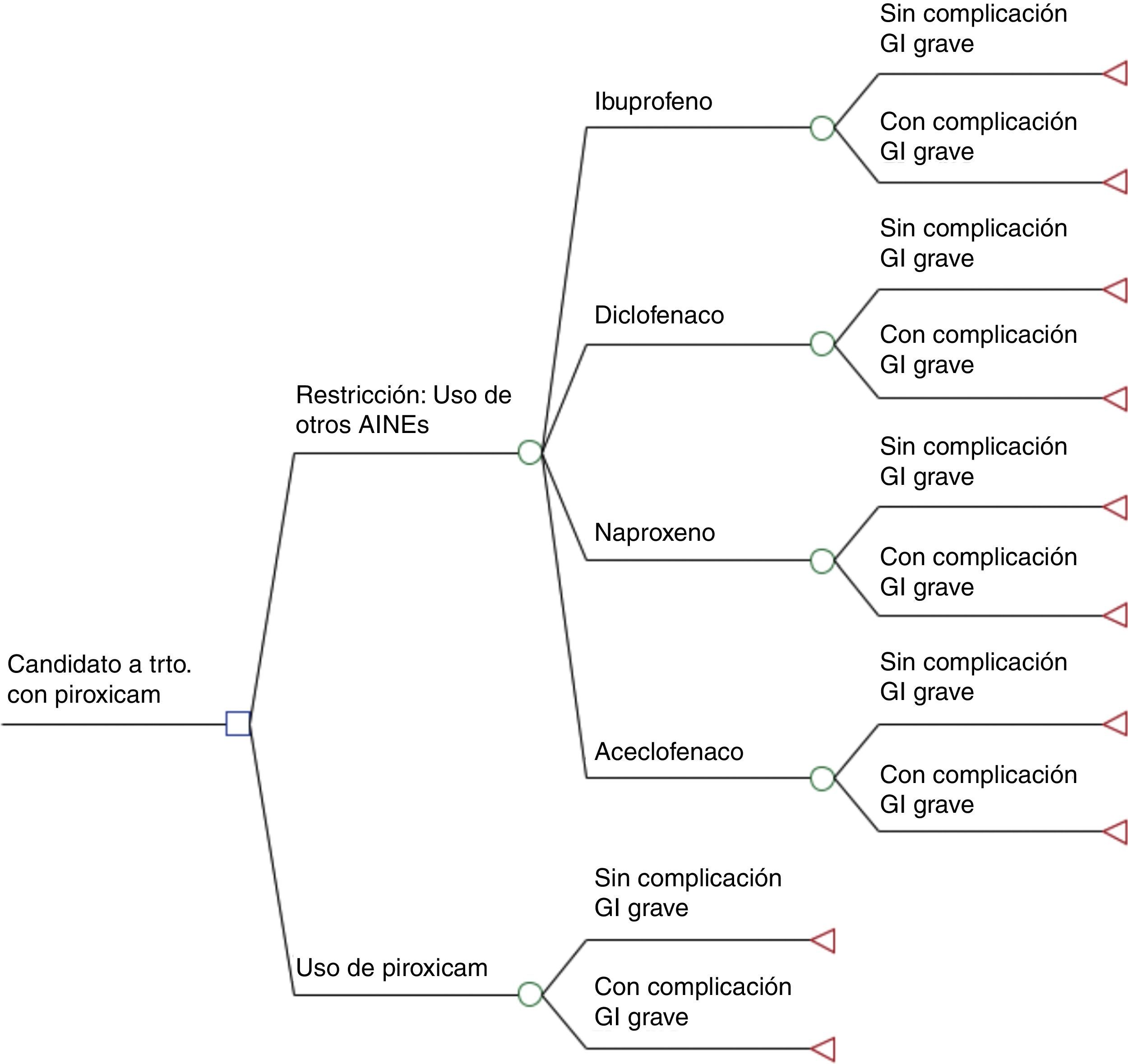
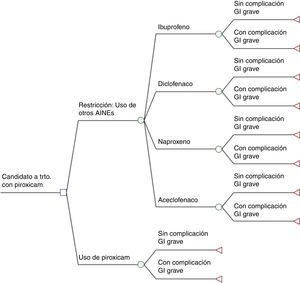
Modelo analítico de decisión y análisis coste-efectividadSe han valorado y comparado los costes (diagnóstico y tratamiento hospitalario de las CGIG y costes de los AINE) y la efectividad clínica (CGIG evitadas) entre las 2 alternativas: la intervención (real) que tuvo lugar en el año 2007 y que supuso una restricción del uso de piroxicam, y el supuesto bajo el cual no se hubiese tomado la referida medida y se hubiera seguido utilizando sin cambios piroxicam. Con este fin, se ha utilizado un modelo analítico de decisión (árbol de decisiones), utilizando el programa TreeAge Pro v11, que está representado en la figura 1.
Modelo analítico de decisión. Problema médico de partida: candidato a tratamiento con piroxicam mediante prescripción en el Sistema Nacional de Salud con dosis diarias iguales a una dosis diaria definida (DDD)×20 días, excluidos aquellos para los que aun sería posible la prescripción tras la intervención.
□ Nodo de decisión: el médico prescribe piroxicam (opción que solo es posible sin la intervención reguladora) o, en la situación alternativa con decisión reguladora, el médico ya no podrá prescribir piroxicam y decidirá entre prescribir ibuprofeno, diclofenaco, naproxeno, o aceclofenaco.
○ Nodo de probabilidad: para la primera opción, existe un nodo con las probabilidades de prescribir uno de los antiinflamatorios no esteroideos (AINE) según la proporción de uso en DDD de los 4 AINE obtenida de los datos de facturación en receta en el SNS en 2008.
○ Nodo de Probabilidad (para todas las decisiones anteriores): el paciente presenta/no presenta una complicación gastrointestinal grave (CGIG). Las probabilidades dependen del riesgo de CGIG estimado para cada AINE.
Se han realizado los análisis de sensibilidad univariante siguientes:
- 1.
Supuesto de una probabilidad más alta de que un paciente sufra una CGIG, acudiendo a estudios que han estimado incidencias basales y riesgos relativos mayores que en el caso base, y aplicando además el supuesto de una duración media mayor del tratamiento con AINE:
- –
Incidencia basal obtenida de los grupos placebo de ensayos clínicos12, que es mayor que el estimado para el caso base, el cual procede de estudios observacionales en población general).
- –
Riesgos relativos de CGIG para cada AINE: de entre los estudios que ofrecen estimaciones de RR para todos los AINE implicados (tabla 1), se ha escogido el estudio observacional multicéntrico en hospitales españoles19, que obtuvo riesgos relativos mayores que los resultantes de los metaanálisis de todos los estudios epidemiológicos.
- –
Una duración media del tratamiento con AINE de 60 días en lugar de 20 días.
- –
- 2.
Mayor proporción de uso de ibuprofeno, y aceclofenaco, de mayor coste que diclofenaco y naproxeno, en relación con el caso base: un 5% más de uso de cada uno de los 2 AINE con mayor coste por DDD (ibuprofeno y aceclofenaco) y descenso de un 5% de cada uno de los dos AINE (diclofenaco y naproxeno) con menor coste por DDD (tabla 3).
- 3.
Coste medio de una CGIG con un valor mínimo igual al del menor coste estimado en estudios publicados, y un valor máximo igual al del mayor coste estimado en estudios publicados. Se han considerado análisis publicados en los años 2000 que ofrecen estimaciones con cálculos reales del coste de CGIG en hospitales públicos en España, actualizando los costes con las tasas de inflación interanual correspondientes por cada año que estos datos recogidos se alejan del año 2008 (tabla 2).
Se ha realizado un análisis de impacto presupuestario bajo los mismos supuestos que el análisis coste-efectividad. La diferencia media de coste por cada paciente en tratamiento con piroxicam respecto a la intervención (uso de uno de los 4 AINE) obtenida en el análisis coste-efectividad se ha utilizado para calcular el impacto presupuestario en toda España que ha supuesto sustituir piroxicam por AINE menos gastrolesivos en el primer año postintervención (2008).
Para ello, utilizando los datos de consumo en recetas del SNS, se ha estimado la población expuesta a piroxicam durante el año inmediatamente anterior al de la intervención (año 2006) así como la población, restringida, que siguió utilizando piroxicam en el año 2008, primer año completo posterior al paso de piroxicam a diagnóstico hospitalario como escenario postintervención. Al igual que en el modelo para el análisis coste-efectividad, se asume como efecto de la intervención que la población de pacientes que hubiera utilizado piroxicam recibe en su lugar otro AINE (excluyendo aquellos en los que sigue indicado piroxicam), y que este será uno de los 4 AINE que suponen la gran mayoría del consumo de AINE en España.
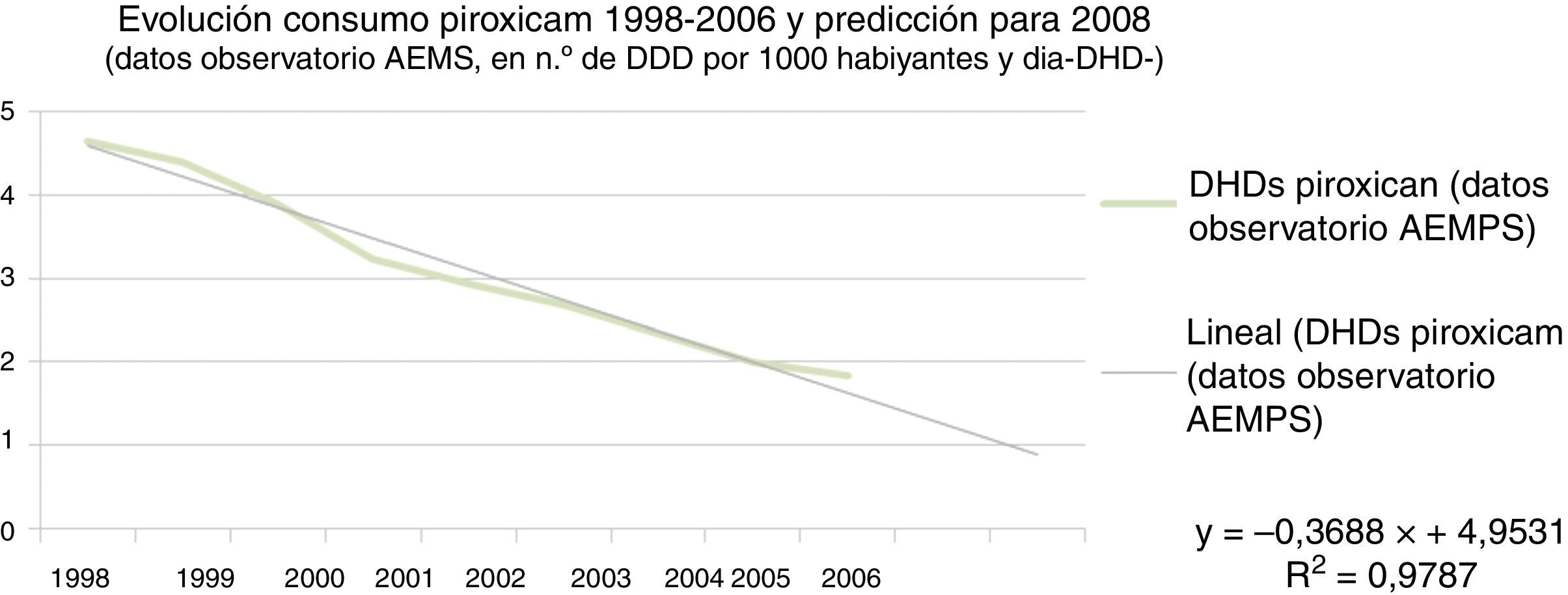
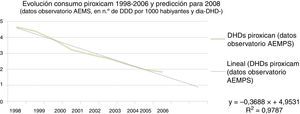
Para predecir el número de tratamientos con piroxicam en el año 2008 en el escenario de no haber ocurrido la intervención reguladora en 2007, se ha realizado una recta de regresión con los datos de consumo de piroxicam en DDD por 1.000 habitantes y día (DHD) desde el año 1998 hasta el 2006, con el fin de extrapolar los datos a 2008 (fig. 2). Así, el consumo de piroxicam que se ha estimado para 2008 en un escenario en que no hubiera habido intervención sería de 0,8963 DDD por 1.000 habitantes y día (DHD).
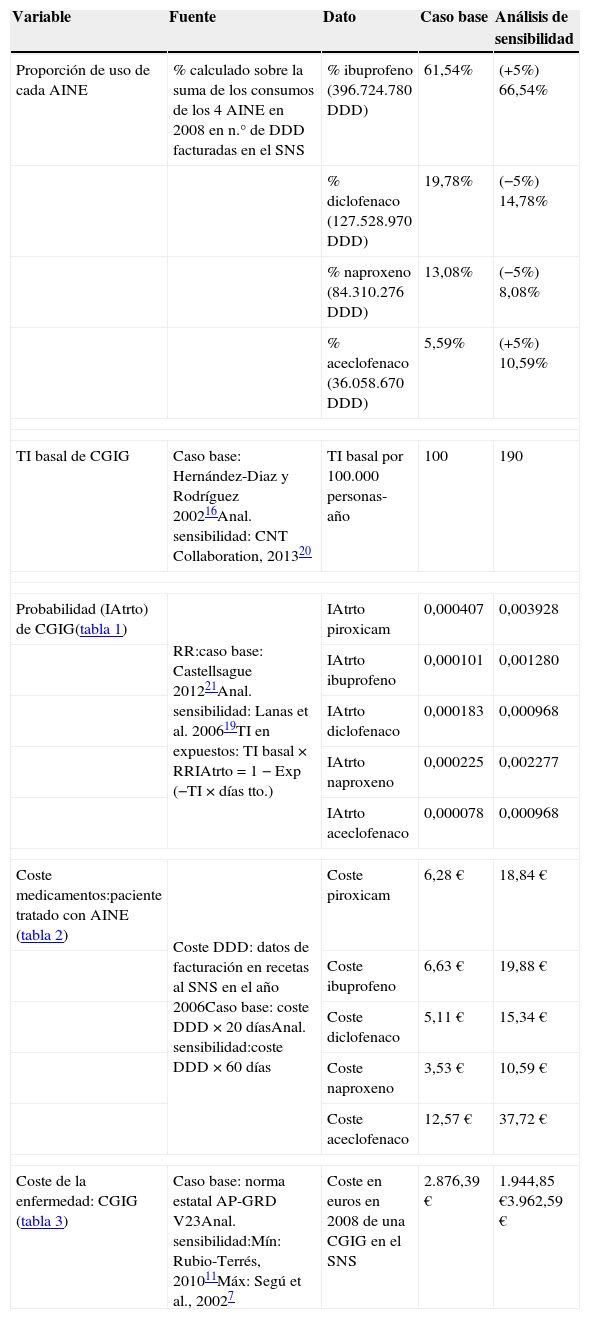
ResultadosEn la tabla 4 se resumen los datos que han servido de base para el cálculo de los resultados en salud y de los costes de las alternativas analizadas.
Resumen de los datos utilizados para el cálculo de los resultados en salud y de los costes sanitarios. Caso base y análisis de sensibilidad
| Variable | Fuente | Dato | Caso base | Análisis de sensibilidad |
|---|---|---|---|---|
| Proporción de uso de cada AINE | % calculado sobre la suma de los consumos de los 4 AINE en 2008 en n.° de DDD facturadas en el SNS | % ibuprofeno (396.724.780 DDD) | 61,54% | (+5%) 66,54% |
| % diclofenaco (127.528.970 DDD) | 19,78% | (−5%) 14,78% | ||
| % naproxeno (84.310.276 DDD) | 13,08% | (−5%) 8,08% | ||
| % aceclofenaco (36.058.670 DDD) | 5,59% | (+5%) 10,59% | ||
| TI basal de CGIG | Caso base: Hernández-Diaz y Rodríguez 200216Anal. sensibilidad: CNT Collaboration, 201320 | TI basal por 100.000 personas-año | 100 | 190 |
| Probabilidad (IAtrto) de CGIG(tabla 1) | RR:caso base: Castellsague 201221Anal. sensibilidad: Lanas et al. 200619TI en expuestos: TI basal×RRIAtrto=1 − Exp (−TI×días tto.) | IAtrto piroxicam | 0,000407 | 0,003928 |
| IAtrto ibuprofeno | 0,000101 | 0,001280 | ||
| IAtrto diclofenaco | 0,000183 | 0,000968 | ||
| IAtrto naproxeno | 0,000225 | 0,002277 | ||
| IAtrto aceclofenaco | 0,000078 | 0,000968 | ||
| Coste medicamentos:paciente tratado con AINE (tabla 2) | Coste DDD: datos de facturación en recetas al SNS en el año 2006Caso base: coste DDD×20 díasAnal. sensibilidad:coste DDD×60 días | Coste piroxicam | 6,28 € | 18,84 € |
| Coste ibuprofeno | 6,63 € | 19,88 € | ||
| Coste diclofenaco | 5,11 € | 15,34 € | ||
| Coste naproxeno | 3,53 € | 10,59 € | ||
| Coste aceclofenaco | 12,57 € | 37,72 € | ||
| Coste de la enfermedad: CGIG (tabla 3) | Caso base: norma estatal AP-GRD V23Anal. sensibilidad:Mín: Rubio-Terrés, 201011Máx: Segú et al., 20027 | Coste en euros en 2008 de una CGIG en el SNS | 2.876,39 € | 1.944,85 €3.962,59 € |
AINE: antiinflamatorio no esteroideo; DDD: dosis diaria definida; CGIC: complicaciones gastrointestinales graves; GRD: Grupos Relacionados por el Diagnóstico; IAtrto: incidencia acumulada asociada a un paciente en tratamiento con AINE; RR: riesgo relativo; SNS: Sistema Nacional de Salud; TI: tasa de incidencia en personas expuestas/no expuestas a AINE.
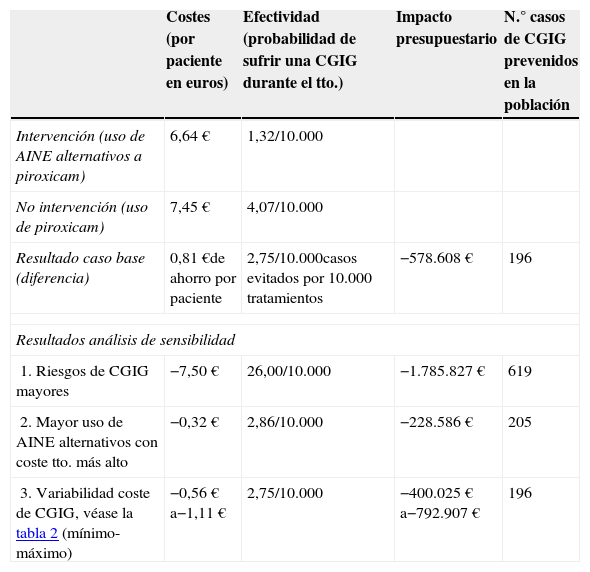
En el caso base el coste medio por paciente para la opción de la intervención (uso de AINE alternativos a piroxicam), es de 6,64 euros, frente a 7,45 euros por paciente si se hubiera continuado utilizando piroxicam. Esto implica un ahorro de 0,81 euros por paciente. En cuanto a la efectividad, el modelo prevé para el escenario en el que los pacientes son tratados con los AINE alternativos 1,32 casos de CGIG por cada de 10.000 pacientes tratados, y 4,07 casos para piroxicam (2,75 casos de CGIG evitados por cada 10.000 pacientes en tratamiento de 20 días). Por tanto, la intervención reguladora resulta ser la opción dominante (tabla 5).
Resultados del análisis coste-efectividad y de impacto de la restricción de uso de piroxicam en el primer año tras la intervención
| Costes (por paciente en euros) | Efectividad (probabilidad de sufrir una CGIG durante el tto.) | Impacto presupuestario | N.° casos de CGIG prevenidos en la población | |
|---|---|---|---|---|
| Intervención (uso de AINE alternativos a piroxicam) | 6,64 € | 1,32/10.000 | ||
| No intervención (uso de piroxicam) | 7,45 € | 4,07/10.000 | ||
| Resultado caso base (diferencia) | 0,81 €de ahorro por paciente | 2,75/10.000casos evitados por 10.000 tratamientos | −578.608 € | 196 |
| Resultados análisis de sensibilidad | ||||
| 1. Riesgos de CGIG mayores | −7,50 € | 26,00/10.000 | −1.785.827 € | 619 |
| 2. Mayor uso de AINE alternativos con coste tto. más alto | −0,32 € | 2,86/10.000 | −228.586 € | 205 |
| 3. Variabilidad coste de CGIG, véase la tabla 2 (mínimo-máximo) | −0,56 € a−1,11 € | 2,75/10.000 | −400.025 € a−792.907 € | 196 |
AINE: antiinflamatorio no esteroideo; CGIC: complicaciones gastrointestinales graves.
El análisis de sensibilidad univariante realizado ofrece para las 3 variables analizadas un resultado también dominante para la opción de la intervención reguladora. El caso base sigue siendo la opción más conservadora en cuanto a la efectividad, y con el escenario de unos riesgos de CGIG mayores el ahorro por paciente alcanza 7,50 euros y 26 casos de CGIG evitados por 10.000 pacientes en tratamiento.
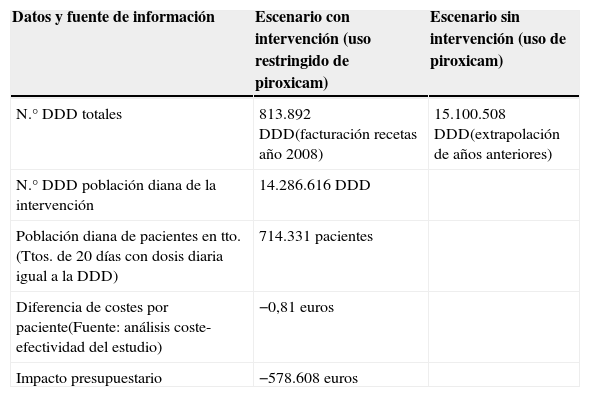
Impacto presupuestario y complicaciones gastrointestinales graves evitadasSe obtiene que en España, en el año 2008, asumiendo la sustitución de piroxicam por alguno de los 4 AINE de referencia, el ahorro en un año para el SNS se estima en −578.608 euros (tabla 6). Tras realizar un análisis de sensibilidad con las mismas variables que para el análisis coste-efectividad, el ahorro oscila entre los 228.586 euros en el caso de que en sustitución de piroxicam se usaran en mayor porcentaje (10% más) los AINE de mayor coste, y 1.785.827 euros que se estiman en el caso de que los riesgos de CGIG hubieran sido mayores que los utilizados en el caso base.
Fuentes de información en los cálculos para el análisis de impacto presupuestario
| Datos y fuente de información | Escenario con intervención (uso restringido de piroxicam) | Escenario sin intervención (uso de piroxicam) |
|---|---|---|
| N.° DDD totales | 813.892 DDD(facturación recetas año 2008) | 15.100.508 DDD(extrapolación de años anteriores) |
| N.° DDD población diana de la intervención | 14.286.616 DDD | |
| Población diana de pacientes en tto.(Ttos. de 20 días con dosis diaria igual a la DDD) | 714.331 pacientes | |
| Diferencia de costes por paciente(Fuente: análisis coste-efectividad del estudio) | −0,81 euros | |
| Impacto presupuestario | −578.608 euros |
DDD: dosis diaria definida.
El estudio realizado pone de manifiesto que las intervenciones en farmacovigilancia no solo resultan en beneficios para la salud pública, al limitar el riesgo de reacciones adversas a los medicamentos (unos 200 casos de CGIG prevenidos en un año), sino que además pueden tener un impacto económico favorable en el sistema sanitario (cerca de 600.000 euros ahorrados al SNS en 2008).
El estudio propone un planteamiento metodológico en ciertos aspectos novedoso. Por un lado, sigue una metodología similar a una evaluación económica completa que se realiza con motivo de la introducción de un nuevo medicamento o estrategia terapéutica. Es decir, se analizan los costes y las consecuencias de la intervención en comparación con la no intervención. Sin embargo, en este caso, la intervención consiste en restringir el uso de un medicamento, en lugar de introducirlo en el mercado, y las consecuencias son las derivadas de la prevención del problema de salud al sustituir el medicamento problema por alternativas más seguras. Además, las fuentes de información son todas retrospectivas, ya que la intervención ya tuvo lugar, con lo que son necesarias menos asunciones y modelizaciones que en análisis que deben anticipar un escenario futuro.
Otro aspecto a tener en cuenta es que el análisis realizado puede considerarse conservador en diferentes aspectos. Así, el horizonte temporal se ha limitado a un año. Más allá de ese tiempo resulta más incierto asumir que otras acciones diferentes de la propia medida reguladora pudieran haber influido sobre el uso de piroxicam. De hecho, se observa que el consumo de piroxicam en España estaba ya disminuyendo en los años anteriores a la medida reguladora (fig. 2), lo que se ha tenido en cuenta en el análisis. En este descenso, es indudable que influyó la mayor conciencia entre los prescriptores sobre los riesgos gastrointestinales de este fármaco, así como las recomendaciones, desde diversas instancias, favoreciendo el uso de AINE como ibuprofeno, diclofenaco o naproxeno, con menor riesgo gastrointestinal, tal como también muestran los datos presentados.
En cuanto a la fuente de información sobre los resultados en salud, es decir, el riesgo de CGIG con los diferentes AINE, se ha optado por utilizar datos de estudios observacionales. En este caso, la posible alternativa de usar datos procedentes de ensayos clínicos, por un lado no es factible, pues no hay datos fiables del riesgo de CGIG con piroxicam procedentes de ensayos clínicos. Y por otro, en este escenario, los datos de los estudios observacionales, obtenidos de una población con características demográficas, y con factores de riesgo más representativos de la población general, ofrecen datos más fiables y representativos, como ya han apuntado otros autores24. Además, por el interés de realizar un análisis conservador, en el caso base se han seleccionado fuentes de información del riesgo de CGIG que estiman los riesgos más bajos para piroxicam, en comparación, por ejemplo, con los del estudio utilizado en el análisis de sensibilidad19, que además es representativo de los ingresos hospitalarios por CGIG en España. Por otra parte, la duración media del tratamiento seleccionada en el caso base (20 días) es mucho más corta que el utilizado, por ejemplo, en los modelos de los estudios fármaco-económicos realizados con la entrada en el mercado de los Coxibs, en los que los escenarios de los modelos estaban basados en los ensayos clínicos en patología reumática crónica y duración del tratamiento de 6 meses o un año, aun mayor que los 60 días utilizados en el análisis de sensibilidad de este estudio.
Como limitación del estudio, se ha asumido que no existen diferencias entre los fármacos analizados en otros riesgos diferentes del de CGIG. Para los riesgos cardiovasculares no considerar estas posibles diferencias podría ser relevante. Los riesgos cardiovasculares de los AINE han sido analizados extensamente en una reciente revisión de ámbito europeo25. Sin embargo, no hay conclusiones robustas para AINE que como piroxicam, no han sido analizados en los grandes estudios realizados sobre este tema. En este sentido, el AINE de mayor uso, ibuprofeno, no tiene demostrada una diferencia ni a favor ni en contra con piroxicam, y datos de un estudio reciente en España26 indican que probablemente no presente ventajas respecto a ibuprofeno a este respecto. Por otra parte, hay que hacer notar que los datos actuales señalan que aceclofenaco y diclofenaco tendrían un mayor riesgo cardiovascular, mientras que naproxeno tendría un relativamente riesgo menor, comparado con las dosis habituales de ibuprofeno, y que estas diferencias entre los diferentes AINE sustitutos de piroxicam no se han considerado en el modelo. Respecto a otros posibles riesgos, se constata en algunos estudios epidemiológicos un mayor riesgo del grupo de los AINE tipo oxicam (al que pertenece piroxicam) de producir más reacciones cutáneas graves, aunque con una incidencia muy baja. En todo caso, esto daría una desventaja adicional al piroxicam. Del mismo modo no se han considerado efectos adversos gastrointestinales menos graves, como úlceras no complicadas o intolerancia digestiva en general, que podría argumentarse que son más comunes con piroxicam, pero con datos de incidencia, en comparación con otros AINE menos sólidos.
Otra limitación del estudio es la utilización de datos agregados de consumo de medicamentos en el SNS y de la DDD para estimar el perfil de uso de AINE en España. Por tanto, las estimaciones de población en tratamiento asumen una duración media y una dosis media de los tratamientos, mientras que en la realidad puede haber una variabilidad importante que no llega a tenerse en cuenta en los análisis realizados. Respecto a la DDD, aunque su uso permite comparaciones en la utilización de medicamentos en el tiempo y entre diferentes lugares, no tiene por qué representar la dosis real tomada por los pacientes. Respecto a los AINE, datos de prescripciones reales en España13 indican que la DDD de naproxeno (0,5g) puede ser inferior a la dosis media diaria real. Si esto ocurriera diferencialmente con naproxeno, la repercusión en los resultados del modelo sería en todo caso muy limitada. Se habría incurrido en una infravaloración del coste con este AINE pero también en una sobrevaloración de su prevalencia de uso, que también implicaría más casos de CGIC evitadas dado que el riesgo gastrointestinal de naproxeno es algo mayor que los otros AINE del modelo sustitutos de piroxicam (tabla 1).
En este sentido, la realización de futuros estudios con un planteamiento similar, pero que recurran a fuentes de información sobre el uso de medicamentos con datos individuales de los pacientes, como la base de datos BIFAP27, permitirían solventar estos problemas y posibilitar además la evaluación de las consecuencias de cambios cualitativos en los patrones de uso de los medicamentos. Es más, este tipo de bases de datos permitiría realizar simulaciones para ver la repercusión de las medidas reguladoras, incluyendo las repercusiones económicas.
Finalmente, el presente estudio demuestra que es posible realizar evaluaciones económicas completas sobre actuaciones en farmacovigilancia. La intervención realizada por la AEMPS en 2007 sobre piroxicam, además de cumplir con su objetivo de prevenir reacciones adversas, supuso un ahorro significativo, incluso bajo supuestos conservadores. En definitiva, la determinación del alcance de los beneficios económicos producidos por esta u otras decisiones en farmacovigilancia permite aportar nuevos argumentos para invertir en estas actividades de salud pública.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNinguna.
Conflicto de interesesNinguno.
AgradecimientosAl profesor Félix Lobo Aleu, director del Máster en Evaluación Sanitaria y Acceso al Mercado (Fármaco-Economía) de la Universidad Carlos III de Madrid, y bajo cuya dirección este estudio ha sido presentado como proyecto de fin de máster.