El dolor musculoesquelético (DME) asociado a estatinas es el efecto adverso más frecuente y responsable de su abandono. Diversos trabajos sugieren que el déficit de vitamina D incrementa el riesgo de padecer dolor asociado a estatinas.
ObjetivosEvaluar una posible asociación entre el nivel de vitamina D y la presencia de DME en pacientes en tratamiento con estatinas.
MétodosSe realizó una búsqueda bibliográfica en Medline, Cochrane Central y EMBASE para identificar estudios que: 1) incluyeran pacientes tratados con estatinas; 2) en los que valoraran niveles séricos de vitamina D, 3) en relación con DME.
ResultadosSe identificaron 127 estudios de los que se incluyeron y analizaron finalmente 3. La heterogeneidad de los estudios no permitió realizar metaanálisis. Una revisión sistemática y 2 estudios de cohorte no incluidos en la revisión previa mostraron una asociación significativa entre el déficit de vitamina D y el DME.
ConclusionesLa evidencia sugiere una asociación significativa entre niveles séricos de 25OHD<30ng/ml y la presencia de DME
Musculoskeletal pain associated to statin use, is the most common adverse event, leading to cessation of treatment. Several studies proposed Vitamin D deficiency to increase the risk of pain associated to statin intake.
ObjectivesTo evaluate whether vitamin D status is linked to musculoskeletal pain associated to statin use.
MethodsWe performed a systematic review based on electronic searches through MEDLINE, Cochrane Central and EMBASE to identify studies that 1) included patients on statin therapy 2) with vitamin D serum levels assessment, 3) in relation to musculoskeletal pain.
ResultsThe electronic search identified 127 potentially eligible studies, of which three were included and analysed in the present study. The heterogeneity of studies did not allow metanalysis. A systematic review and two cohort studies not included in the previous systematic review, revealed a statistically significant association of vitamin D deficit in patients with musculoskeletal pain on statin therapy.
ConclusionThe displayed evidence suggests a significant association between 25OHD serum levels<30ng/ml and the presence of musculoskeletal pain in patients on statin therapy.
Las estatinas han demostrado su efectividad tanto en la prevención como en la reducción global de la mortalidad por causa cardiovascular1. Como consecuencia, el número de pacientes en tratamiento con estatinas se ha extendido sustancialmente y continúa aumentando. Sin embargo, cerca de un 15-30% de ellos desarrollarán dolor musculoesquelético (DME) como principal efecto adverso, lo que conduce al frecuente abandono del tratamiento2 (su mecanismo de producción es desconocido, y como potenciales factores se incluyen la predisposición genética, una posible disfunción mitocondrial, de la síntesis de coenzima Q y/o del colesterol)3.
Estudios recientes han sugerido que el déficit de vitamina D se asociaría al DME inducido por estatinas, y que este podría ser reversible con la suplementación de vitamina D y la consecuente normalización de los niveles séricos de 25OHD4,5.
Realizamos la presente revisión sistemática de la literatura con el objetivo de determinar si los niveles séricos de 25OH vitamina D se asocian o no con mayor prevalencia de DME relacionado con ingesta de estatinas.
Material y métodosFuente de datos y estrategia de búsquedaSe realizó una búsqueda sistemática en 3 bases de datos: Medline, Cochrane Central Register of Controlled Trials (CENTRAL) y EMBASE (hasta octubre 2015), a través del servicio de documentación de la SER.
Además, se efectuó una búsqueda manual entre los resúmenes de los Congresos del American College of Rheumatology (ACR) y del EULAR de los últimos 3 años. Se incluyeron estudios en inglés y español.
Ver estrategia de búsqueda (Anexo A) (disponible en la web).
Criterios de inclusión- •
Por población: pacientes adultos (≥18años) con cualquier enfermedad de base en tratamiento con estatinas (de cualquier tipo y dosis).
- •
Por factor: que evalúen los niveles séricos de 25OHD.
- •
Por outcome: dolor musculoesquelético.
- •
Por tipo de estudios: revisiones sistemáticas (RS), estudios cohorte y/o longitudinales que se hayan publicado luego de la RS más actualizada. Diseños que evaluaran factores de riesgo (asociación).
- •
Por N de muestra: >20 por grupo.
De forma independiente, 2 revisoras (CAP/MBN) evaluaron los resúmenes identificados (criterios de inclusión y calidad de los estudios seleccionados), y ante las discrepancias de criterios se resolvía por consenso. Las citas se gestionaron con ENDNOTE X versión 7.2.
La calidad de los estudios se evaluó con la escala New Castle-Ottawa6 y el Checklist SIGN (RS). Los desacuerdos se resolvieron por consenso.
Análisis estadísticoNo se realizó metaanaálisis, pero se identificó una revisión sistemática2 que utilizó diferencias de medias ponderadas, y la heterogeneidad estadística con el Cochran Q test y el índice I2.
Los resultados se presentan de forma narrativa.
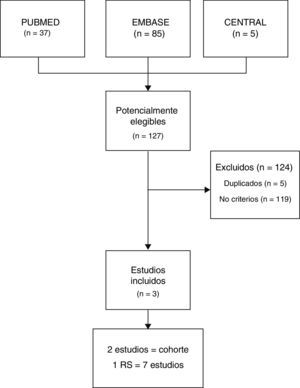
ResultadosLa búsqueda combinada identificó 127 estudios, de los cuales se excluyeron 119 por no cumplir criterios de inclusión y 5 por estar duplicados. Finalmente se incluyeron 3 estudios (fig. 1), de los cuales uno fue una revisión sistemática —Michalska-Kasiczak et al.2— que contenía 7 estudios1,7-12, y los otros 2 fueron estudios de cohorte que se publicaron posteriormente, Mergenhagen et al.13 y Morioka et al.14.
En cuanto a la calidad, la RS es aceptable (SIGN), al igual que los estudios cohorte (NOS 6-7) (tabla 1).
Características generales de los estudios
| Estudio País | Estudios (incluidos en RS) País | Diseño estudio Registro (años) | n total DME (%) | Población Sexo (M/F) Edad | Estatinas Dosis | DME 25OHD ng/ml Media (DE) | Asintomáticos 25OHD ng/ml Media (DE) |
|---|---|---|---|---|---|---|---|
| MichalsKa-Kasiczak et al. 2015 | Duell y Connor 2008 ND | Cross sectional ND | n=99 (38,4) | Sexo: ND 58-59,3 | Todos Dosis: ND | 20,5 (10) | 30,1 (12,5) |
| Ahmed et al. 2009 EE.UU. | Cross sectional 2007-08 | n=621 (20,6) | DME=128 (52/76) 58-60 | Todos Dosis: ND | 28,6 (13,2) | 34,2 (13,8) | |
| Linde et al. 2010 EE.UU. | Cohorte, retrospectivo | n=64 (60,9) | DME=39 (21/18) 59 | Todos Dosis: 5-80mg | 28,2 (11,6) | 24,3 (10,5) | |
| Backes et al. 2011 EE.UU. | Cohorte, retrospectivo | n=129 (44,2) | DME=57 (26/31) 58-62,4 | Todos Dosis: ND | 21,4 (9,7) | 21,8 (12,1) | |
| Riphagen et al. 2012 Holanda | Prospectivo, observacional 2009-10 | n=75 (29,3) | Sexo: ND 65 | Todos Dosis: ND | 18 | 15,2 | |
| Eisen et al. 2014 Israel | Cohorte, retrospectivo 2007-10 | n=272 (39) | DME=106 (52/54) 66-69 | Todos Dosis: ND | 19,1 (4,1) | 20,2 (6,0) | |
| Palamaner S Shanta et al. 2014 EE.UU. | Cohorte, retrospectivo 2005-12 | n=1.160 (27,8) | Sexo: ND 55,9 | Atorvastatina/ Simvastatina Dosis: ND | 22,3 (7,1) | 33,8 (4,5) | |
| Mergenhagen et al. 2014 EE.UU. | Cohorte, retrospectivo 2006-11 | n=450 (11,1) | DME=50 (45/5) 65-69 | Simvastatina Dosis: 80mg | 26,2 (12,9) | 36,3 (11,8) | |
| Morioka et al. 2015 EE.UU. | Cross sectional, Estudio Nacional de Salud Nutricional (NHNES) 2001-04 | n=1.057 (30,5) | M: 565/F: 492 62,8 | ND | 25(OH)D <15 OR: 1,90 (1,18-3,05) | 25(OH)D ≥15 OR: 0,91 (0,71-1,16) |
DE: desviación estándar; DME: dolor musculoesquelético; ND: no hay datos; OR: odds-ratio.
La población total de los estudios fue de 3.927 pacientes, de los cuales 1.038 (26,43%) presentaban DME, y el resto, 2.889 (73,53%), estaban asintomáticos. La edad media de los pacientes fue de 61,7años, con un rango entre 58-69años. Se identificaron 1.026 mujeres y 1.527 varones; no hubo datos poblacionales en 3 estudios1,7,12.
El fármaco más utilizado fue la simvastatina2,12,13; le siguieron en frecuencia la atorvastatina2,12, pravastatina2,8, y rosuvastatina1,2. Las dosis utilizadas y la duración del tratamiento fueron especificadas solo en un estudio cohorte13 que empleó simvastatina a 80mg/d.
En cuanto a cointervenciones, un solo estudio9 menciona la utilización de otros fármacos como niacina, fenofibrato, diltiazem y verapamilo.
En la revisión sistemática2 (n=2.420 pacientes, con 7 estudios incluidos), el 27,5% presentó DME probablemente relacionado con la ingesta de estatinas. Cuando compararon el nivel medio sérico de la 25OHD entre los pacientes con DME y los asintomáticos, se observó una media de 28,4ng/ml en el primer grupo vs. 34,8ng/ml en el grupo asintomático. La diferencia de medias ponderada fue de: –9,41ng/ml (–10,17 a –8,64), con un test de heterogeneidad elevado (I2=94%; p=0,00001).
En el estudio de Mergenhagen et al.13 (n=450), el 11,1% de los pacientes presentó DME. En la comparación del nivel medio sérico de la 25OHD entre los pacientes con DME y los asintomáticos, hubo una media de 26,2ng/ml en el grupo con dolor vs. 36,3ng/ml en el grupo asintomático, con una diferencia de medias de 10ng/ml (p=0,0003).
Finalmente, en el trabajo de Morioka et al.14 (n=5.907), de los 1.057 pacientes (18%) que recibían estatinas, un 30,5% de este grupo presentaban DME. De estos pacientes sintomáticos, un 43,8% (33,5-54,6%) presentaban 25OHD <15ng/ml vs. el 28% (23,4-33,2%) que tenían niveles >15ng/ml (p=0,01).
Estos autores calculan el OR de desarrollar DME en pacientes que toman estatinas: si el nivel de 25OHD es <15ng/ml, el OR=1.90 (1,18-3,05; p=0,01), y si el nivel de 25OHD es >15ng/ml, el OR=0,91 (0,71-1,16; p=0,43) (tabla 2).
Resultados de niveles de 25OHD en pacientes con y sin dolor musculoesquelético
| Autor/año | Estudios incluidos en RS | Población n | Dolor musculoesquelético n (%) | Nivel 25OHD ng/ml Media (DE) | p | ||
|---|---|---|---|---|---|---|---|
| Con DME | Sin DME | Con DME | Sin DME | ||||
| Michalska-Kasiczak et al. 2 0 1 5 | Duell y Connor 2008 | 99 | 38 (38,8) | 61 (61,6) | 20,5 (±10) | 30,1 (±12,5) | <0,05 |
| Ahmed et al. 2009 | 621 | 128 (20,6) | 493 (79,3) | 28,6 (±13,2) | 34,2 (±13,8) | 0,0001 | |
| Linde et al. 2010 | 64 | 39 (60,9) | 25 (39,0) | 28,2 (±11,6) | 24,3 (±10,5) | NS | |
| Backes et al. 2011 | 129 | 57 (44,1) | 72 (55,8) | 21,4 (±9,7) | 21,8 (±12,1) | NS | |
| Riphagen et al. 2012 | 75 | 22 (29,3) | 53 (70,6) | 18,0 | 15,2 | NS | |
| Palamaner S. Shanta et al. 2014 | 1.160 | 276 (24,2) | 864 (75,7) | 22,3 (±7,1) | 33,8 (±4,5) | 0,01 | |
| Eisen et al. 2014 | 272 | 106 (38,9) | 166 (61,0) | 19,1 (±4,1) | 20,2 (±6) | NS | |
| Mergenhagen et al. 2014 | 450 | 50 (11,1) | 400 (88,9) | 26,2 (±12,9) | 36 (±11,8) | 0,0003 | |
| Morioka et al. 2015 | 1.057 | 322,3 (30,4) | 734,7 (69,5) | 25 OH D (ng/ml) con DME | |||
| <15 (ng/ml) 43,8% (33,5-54,6) | >15 (ng/ml) 28% (23,4-33,2) | 0,01 | |||||
| n total | 3.927 (100%) | 1.038 (26,5%) | 2.889 (73,5%) | ||||
DE: desviación estándar; DME: dolor musculoesquelético; NS: no significativo.
La presente revisión sistemática sugiere la existencia de una asociación entre déficit de vitamina D y DME. Así, en torno a uno de cada 4 pacientes que recibían estatinas en el presente trabajo, manifestaron DME. En este sentido, la definición de DME relacionado con estatinas es aún algo confusa y poco precisa15, ya que no existe una clasificación estandarizada internacionalmente16. Su forma clínica engloba, desde simple mialgia, debilidad muscular, hasta rabdomiólisis. Así, el dolor muscular no asociado a elevación de creatinfosfokinasa es la forma de presentación más frecuente16,17. Del mismo modo, es bien conocido que niveles séricos disminuidos de vitamina D también son causa de DME generalizado18, y posiblemente la presencia del receptor de vitamina D (VDR) en las células musculares refuerce este principio19. La relación entre niveles séricos de 25OHD <30ng/ml y DME asociado a estatinas ya había sido descrita en algunas series no controladas8,20. Aunque de forma especulativa, se estima que el mecanismo de interacción entre el DME por estatinas y el déficit de vitamina D pudiera tener relación con la activación de citocromos CYP3A4, CYP2B6 y CYP2C9 en los hepatocitos3. Así, la vitamina D es un activador de estos citocromos, los que a su vez son responsables de la metabolización de diferentes estatinas, especialmente las de tipo lipofílicas (atorvastatina, simvastatina, lovastatina, fluvastatina y pravastatina)3,21. Su déficit, podría explicar una prolongación de la vida media de estos fármacos y posible toxicidad de los mismos, resultando en DME. Las fibras musculares afectadas serían las tipo II, que también están implicadas en las mialgias causadas por alcohol22. Además, se sugiere que bajos niveles de vitamina D pudieran disminuir el gen transcripcional ligado a VDR, mermando la síntesis de proteínas para reparar el sistema t-tubular y prevenir la rotura subsarcolemal de dichas fibras22. La combinación de 2 causales, déficit de vitamina D y estatinas, potenciaría la afectación sobre las fibras musculares tipo II, favoreciendo el desarrollo de dolor. Esta sintomatología parece extenderse incluso en pacientes que reciben estatinas a días alternos. Así, el estudio de Minissian et al.23 mostró que pacientes con DME por estatinas, que además recibían tratamiento a días alternos por intolerancia a estos fármacos, presentaban niveles séricos disminuidos de vitamina D en forma significativa comparados con aquellos pacientes que eran tolerantes a terapias diarias. Por el contrario, estudios como los de Eisen et al.11, Kurnik et al.24, y Backes et al.10, no encontraron vinculación entre niveles séricos de vitamina D y riesgo de DME en pacientes recibiendo estatinas. Posiblemente esta discordancia se correspondiera con diferencias en el tipo de población estudiada, etnias, tipo y dosis de estatinas empleadas o estado nutricional de los pacientes, etc. Una vez más, en ninguno de estos estudios se hizo mención a la estación/es del año y al/los métodos empleados para la valoración de los niveles séricos de 25OHD. En este sentido, es relevante mencionar que el déficit (<30ng/ml o 75nmol/l)25,26 de vitamina D es una condición prevalente en diferentes poblaciones y regiones del mundo27-29. Además, esta situación se ha ido extendiendo y profundizando en los últimos años30. Por este motivo es relevante mencionar, si bien no entra dentro de los objetivos de este estudio, que algunos trabajos no controlados han evaluado la respuesta de los pacientes con DME por estatinas a la suplementación con vitamina D, con resultados alentadores4,5,8.
Esta revisión presenta algunas limitaciones: limitaciones propias del tipo de diseño y los sesgos que conlleva de los estudios incluidos (diseños retrospectivos, duración de registro de datos imprecisos, etc.). Asimismo, no hay suficientes datos acerca de los tipos, dosis y tiempo de ingesta de estatinas por parte de los pacientes. Tampoco hay referencias suficientes sobre presencia de comorbilidades y/o cointervenciones. Una particularidad a tener en cuenta es la definición actual de DME causado por estatinas que, a nuestro juicio, es muy impreciso y puede conducir a confusión. Por último, entendemos que es muy importante definir la metodología de medición de la vitamina D, así como el período del año en que se produce la extracción, análisis de la muestra y valoración por grupos etarios.
Podemos concluir que la evidencia disponible (una revisión sistemática y 2 estudios cohorte) muestra una prevalencia de DME asociado a estatinas entre 11-30%, y además habría una asociación significativa entre niveles séricos disminuidos de 25OHD, y una mayor prevalencia de DME asociado a estatinas.
Se requieren estudios prospectivos, bien diseñados, y a largo plazo que confirmen estos resultados.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Las autoras agradecen a la Dra. Loreto Carmona su colaboración en la revisión de este artículo, y a la Sra. Mercedes Guerra, documentalista en la Unidad de Investigación de la SER, su ayuda en la estrategia de búsqueda bibliográfica y en la obtención de artículos.