Las enfermedades pulmonares intersticiales difusas asociadas a enfermedades autoinmunes sistémicas (EPID-EAS) pueden presentar una progresión fibrótica. El objetivo principal del estudio es describir una serie de casos de pacientes con EPID-EAS que cursan con fibrosis pulmonar progresiva e inician tratamiento con fármacos antifibróticos.
MétodosEstudio observacional retrospectivo unicéntrico de un hospital de tercer nivel sobre una serie de casos de pacientes con EPID-EAS con fibrosis pulmonar progresiva valorados en una consulta conjunta de neumología y reumatología, que iniciaron tratamiento con fármacos antifibróticos entre el 01/01/2019 y el 01/12/2021. Se analizaron las características epidemiológicas, clínicas, funcionales, radiológicas y terapéuticas al inicio del tratamiento, y la evolución funcional durante el tratamiento, así como los efectos adversos.
ResultadosSe incluyeron 18 pacientes. La edad media observada fue de 66,7±12,7 años, con mayor frecuencia de sexo femenino (66,7%), siendo la esclerosis sistémica la enfermedad autoinmune sistémica más frecuente (36,8%). La mayoría de los pacientes se encontraban en tratamiento con glucocorticoides sistémicos (88,9%), un 72,2% de pacientes con fármacos modificadores de la enfermedad, siendo el más frecuente el micofenolato mofetilo (38,9%), y un 22,2% con rituximab. Se observó una estabilidad funcional tras el inicio del tratamiento antifibrótico. Fallecieron 2 pacientes durante el seguimiento, uno de ellos como consecuencia de la progresión de la enfermedad intersticial pulmonar.
ConclusiónNuestro estudio sugiere un efecto beneficioso del tratamiento antifibrótico añadido al tratamiento inmunomodulador en pacientes con EPID-EAS fibrótica en vida real. En nuestra serie de casos, los pacientes con EPID-EAS con afectación fibrosante progresiva muestran una estabilidad funcional tras el inicio del tratamiento antifibrótico. La tolerancia al tratamiento fue relativamente buena, con un perfil de efectos secundarios similar al descrito en la literatura médica.
Interstitial lung diseases associated with systemic autoimmune diseases (ILD-SAD) can progress to a fibrotic form that can benefit from antifibrotic treatment. The aim of the study is to describe a cohort of patients with ILD-SAD who manifest progressive pulmonary fibrosis treated with antifibrotics.
MethodsSingle-centre retrospective observational study from a tertiary care hospital on a cohort of patients with ILD-SAD with progressive pulmonary fibrosis evaluated in a joint pulmonology and rheumatology clinic that initiated treatment with antifibrotic drugs between 01/01/2019 and 01/12/2021. Clinical characteristics were analysed. The evolution of pulmonary function test and adverse effects during treatment were described.
Results18 patients were included. The mean age was 66.7±12.7 years, with a higher frequency of females (66.7%). Systemic sclerosis (SS) was the most frequent systemic autoimmune disease (36.8%). The majority of patients were receiving systemic glucocorticoid treatment (88.9%), 72.2% of patients were receiving treatment with disease-modifying drugs, the most frequent being mycophenolate mofetil (38.9%), and 22.2% with rituximab. Functional stability was observed after the start of antifibrotic treatment. Two patients died during follow-up, one due to progression of ILD.
ConclusionOur study suggests a beneficial effect of antifibrotic treatment added to immunomodulatory treatment in patients with fibrotic ILD-SAD in real life. In our cohort, patients with ILD-SAD with progressive fibrosing involvement show functional stability after starting antifibrotic treatment. Treatment tolerance was relatively good with a side effect profile similar to that described in the medical literature.
La enfermedad pulmonar intersticial difusa asociada a enfermedad autoinmune sistémica (EPID-EAS) tiene una evolución y un pronóstico variable, siendo la primera causa de mortalidad en esclerosis sistémica (ES) y la segunda causa de mortalidad en artritis reumatoide (AR)1,2. Un porcentaje significativo de estos pacientes desarrolla una afectación de tipo fibrosante progresivo que conlleva un importante impacto en la evolución de la enfermedad3. En los últimos años, se han publicado dos ensayos clínicos que demuestran la eficacia y seguridad del tratamiento con nintedanib en pacientes con EPID fibrosante asociada a ES y EAS4,5. No obstante, faltan datos sobre pacientes en vida real, que aporten datos sobre el uso en práctica clínica, así como eficacia y tolerabilidad en un grupo más amplio de pacientes. El objetivo principal del estudio es describir una serie de casos de pacientes con EPID-EAS con fibrosis pulmonar progresiva en tratamiento con fármacos antifibróticos.
Material y métodosEstudio observacional retrospectivo unicéntrico de un hospital de tercer nivel.
Se incluyeron pacientes con EPID-EAS con afectación fibrosante progresiva valorados en una consulta conjunta de neumología y reumatología que iniciaron tratamiento con fármacos antifibróticos entre 01/01/2019 y 01/12/2021. Se incluyeron pacientes con EAS de acuerdo con el diagnóstico realizado por reumatología y de acuerdo con criterios de clasificación internacionales6. También se incluyeron aquellos pacientes que no cumplieron criterios de una EAS definida, pero que cumplían criterios de neumonía intersticial con características autoinmunes (IPAF) según criterios ATS/ERS7.
La EPID-EAS fue definida por la presencia de imágenes pulmonares sugestivas de EPID en tomografía computarizada de alta resolución (TCAR) de acuerdo con criterios clasificatorios internacionales. Se consideró enfermedad progresiva una reducción ≥10% de la capacidad vital forzada (CVF), una reducción ≥15% en la difusión de monóxido de carbono (DLCO) o una reducción entre el 5 y 10% de la CVF asociada a un empeoramiento de síntomas respiratorios y/o de la fibrosis en TC de tórax, todo ello en los 24 meses previos.
Se evaluaron las características epidemiológicas, clínicas, radiológicas y terapéuticas al inicio del tratamiento. Además, se evaluaron las pruebas funcionales respiratorias previas al inicio del tratamiento (12-24 meses previos), así como al inicio y a los 6 y 12 meses de seguimiento. Se analizó la evolución de acuerdo a la variación del porcentaje respecto del valor teórico en la CVF y la capacidad de difusión de monóxido de carbono (DLCO). Se describen los efectos secundarios ocurridos durante el tratamiento antifibrótico, así como las modificaciones en la dosificación y suspensión del fármaco.
Dichos datos se obtuvieron de forma retrospectiva mediante la revisión de la historia clínica electrónica.
Las variables cualitativas se expresan en números absolutos y porcentajes. Las variables cuantitativas se expresan mediante media±desviación estándar.
ResultadosSe incluyeron 18 pacientes. La edad media observada fue de 66,7±12,7 años, con una mayor frecuencia de sexo femenino (66,7%) y sin contacto con el tabaco (66,6%). Las características demográficas de la población estudiada se muestran en la tabla 1. La ES fue la enfermedad autoinmune sistémica más frecuente (38,9%). El 55,5% presentaban un patrón radiológico tipo neumonía intersticial usual (NIU) o probable NIU. En el momento de inicio del tratamiento antifibrótico, la mayoría de pacientes se encontraban en tratamiento con glucocorticoides sistémicos (88,9%). Un 72,2% de los pacientes estaban en tratamiento con fármacos modificadores de la enfermedad, siendo el más frecuente el micofenolato mofetilo (38,9%), y un 22,2% estaba en tratamiento con rituximab. Desde el inicio del tratamiento antifibrótico, 2 pacientes suspendieron el tratamiento con micofenolato (uno por efectos adversos y otro por progresión de la enfermedad), e iniciaron tratamiento con rituximab y con ciclofosfamida, respectivamente. Además, un paciente añadió tratamiento con tocilizumab para control de la enfermedad de base (AR) y por progresión inflamatoria de la enfermedad pulmonar intersticial.
Características basales
| Edad (años) | 66,7±12,7 |
| Sexo (mujeres) | 12 (66,6%) |
| Tabaquismo | |
| Nunca | 12 (66,6%) |
| Exfumadores | 6 (33,4%) |
| Hipertensión pulmonar | 1 (5,6%) |
| Patrón radiológico | |
| NIU/probable NIU | 10 (55,5%) |
| Otros | 8 (44,5%) |
| Enfermedad autoinmune | |
| Esclerosis sistémica | 7 (38,9%) |
| Artritis reumatoide | 4 (22,2%) |
| IPAF | 4 (22,2%) |
| Síndrome de Sjögren | 2 (11,1%) |
| Lupus eritematoso sistémico | 1 (5,6%) |
| Tratamiento inmunosupresor | |
| Glucocorticoides | 16 (88,9%) |
| Hidroxicloroquina | 2 (11,1%) |
| Leflunomida | 1 (5,6%) |
| Metotrexato | 1 (5,6%) |
| Azatioprina | 2 (11,1%) |
| Micofenolato mofetilo | 8 (44,4%) |
| Rituximab | 4 (22,2%) |
IPAF: neumonía intersticial con características autoinmunes; NIU: neumonía intersticial usual.
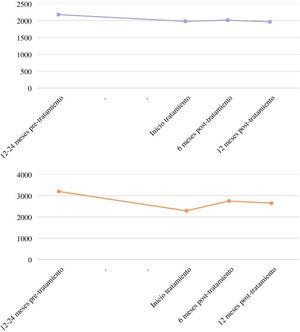
El antifibrótico empleado en todos los casos fue nintedanib (100%). El tiempo medio de seguimiento desde el inicio de nintedanib fue de 417,4±172,7 días. En el estudio de la función pulmonar se observó una CVF media previa al tratamiento, al inicio del mismo, a los 6 meses y a los 12 meses de 2.176±714mL, 1.978±375mL, 2.012±622mL y 1.964±530mL, respectivamente (fig. 1); y una DLCO media de 3.195±976mmol/kPa/min, 2.292±932mmol/kPa/min, 2.750±939mmol/kPa/min, 2.651±1.409mmol/kPa/min, respectivamente. Dos pacientes presentaron deterioro funcional durante los 12 meses posteriores al inicio del tratamiento antifibrótico (reducción ≥10% de la CVF y/o reducción ≥15% en la DLCO). Este fármaco precisó de reducción de dosis en 7 pacientes (38,9%) y fue suspendido en 3 pacientes por efectos secundarios gastrointestinales (15,8%), con una media de tiempo hasta la suspensión del fármaco de 177 días. No se registraron efectos secundarios a nivel de toxicidad hepática. Se produjeron 2 fallecimientos durante el seguimiento: uno de ellos en relación con la progresión de la enfermedad pulmonar intersticial, y el otro falleció en su domicilio en probable relación con un diagnóstico reciente de neoplasia pulmonar estadio IV.
DiscusiónLa fibrosis pulmonar idiopática (FPI) es la enfermedad intersticial progresiva más estudiada. Sin embargo, otras EPID distintas de la FPI también tienen riesgo de desarrollar una enfermedad fibrosante progresiva, entre las que se encuentran las EPID-EAS secundarias a patologías como la ES, la AR, las miopatías inflamatorias idiopáticas, el síndrome de Sjögren o las IPAF8. En el estudio INBUILD5, los pacientes con progresión fibrótica se definieron como aquellos con progresión en los 24 meses previos, definida como una disminución de la CVF de al menos el 10%, o bien una disminución de la CVF entre el 5 y el 10% con empeoramiento de síntomas respiratorios o aumento de fibrosis en el TCAR, o una combinación de empeoramiento de síntomas respiratorios y empeoramiento de fibrosis en el TCAR. Más recientes son las recomendaciones clínicas internacionales acerca del manejo de la fibrosis pulmonar progresiva diferente a FPI, entre las que se incluyen los pacientes con EPID-EAS con afectación fibrosante progresiva. En esta guía clínica se establece la definición de fibrosis pulmonar progresiva en aquellos pacientes con EPID de tipo no FPI siempre que se reúnan dos de los siguientes criterios: 1) empeoramiento sintomático; 2) empeoramiento funcional entendido como caída absoluta ≥5% de la CVF o ≥10 en la DLCO en un año de seguimiento; 3) evidencia de progresión radiológica. Del mismo modo, en estas nuevas recomendaciones, se sugiere emplear nintedanib como tratamiento antifibrótico en este perfil de paciente una vez optimizado el tratamiento farmacológico para la enfermedad de base9.
En el caso de la EPID-EAS, la evidencia de fármacos inmunosupresores para el tratamiento de la afectación pulmonar proviene de ensayos clínicos realizados en ES10,11, así como de estudios observacionales en el resto de EAS12,13. Además, en el estudio SENSCIS14 también se observó que los pacientes tratados con micofenolato y nintedanib tuvieron un beneficio adicional en la disminución del deterioro de la CVF en comparación con los pacientes que solo tomaban micofenolato, con un perfil de efectos adversos similar. No obstante, actualmente no existe ningún consenso establecido sobre cuál es el tratamiento inmunosupresor adecuado previo a iniciar tratamiento antifibrótico. Por lo tanto, se debe hacer una valoración individualizada de cada paciente, para lo cual es imprescindible un abordaje multidisciplinar.
En lo relativo a las limitaciones de nuestro estudio, se trata de un estudio observacional con escaso tamaño muestral y además los pacientes recibieron distintos tratamientos inmunosupresores, lo que dificulta la extrapolación de resultados. Dado el escaso número de pacientes, no se pudieron realizar análisis por subgrupos. No obstante, nuestro estudio tiene varias fortalezas. En nuestro conocimiento, se trata del primer estudio realizado en práctica clínica que incluye pacientes con EPID-EAS y enfermedad pulmonar fibrótica progresiva en tratamiento con nintedanib con los mismos efectos secundarios que los descritos en los ensayos clínicos. Además, los pacientes fueron valorados de manera estandarizada en una consulta conjunta de reumatología y neumología, con un tiempo de seguimiento relativamente largo tras el inicio del tratamiento antifibrótico (media de 15,7 meses).
ConclusiónEn nuestro estudio los pacientes con EPID-EAS y afectación intersticial fibrosante progresiva muestran una relativa estabilidad funcional tras el inicio del tratamiento con antifibróticos. Los efectos adversos fueron similares a lo descrito en los ensayos clínicos, siendo los efectos gastrointestinales los más frecuentes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.