En 2010 se conocieron las primeras experiencias con un grupo de medicamentos denominados inhibidores de los puntos de control inmunitario (IPCI) para el tratamiento del cáncer. Actualmente se utilizan en diferentes tumores y estadios, mejorando la sobrevida de los pacientes pero generando un nuevo perfil de toxicidad. Este nuevo espectro de toxicidades inmunomediadas (irAE) es generado por una exagerada respuesta inflamatoria de linfocitosT que puede desarrollar enfermedades autoinmunes o patologías similares. Entre ellas se hallan las toxicidades reumatológicas. Esta revisión se propone alertar a los internistas y reumatólogos a reconocer las irAE reumatológicas y conocer su manejo clínico.
The first experiences with a group of drugs called immune checkpoint inhibitors for the treatment of cancer were described in 2010. They are currently used in many tumours, with successful survival outcomes but a new profile of adverse events. This new spectrum of immune-mediated toxicities includes an exaggerated inflammatory response of Tlymphocyte and the development of autoimmune diseases or similar pathologies. Of these, of particular note are the rheumatological toxicities. This review aims to alert internists and rheumatologists to their recognition and clinical management.
En 2010 se conocieron las primeras experiencias con un grupo de drogas denominadas inhibidores de los puntos de control inmunitario (IPCI) para el tratamiento del cáncer. Los IPCI son anticuerpos monoclonales contra un grupo específico de proteínas que se encuentran sobre la membrana celular del linfocitoT, o sus ligandos: proteína4 del antígeno linfocitario citotóxico (CTLA4), proteína de muerte celular programada (PD1) y su ligando (PDL1); actúan bloqueando las señales inhibitorias del linfocitoT durante la respuesta inflamatoria, señales necesarias para ejercer la tolerancia inmune. De esta manera, generan persistencia de la actividad inflamatoria mediada por linfocitosT y en consecuencia potencian la respuesta inmune antitumoral, evitando la evasión del sistema inmune que las células tumorales utilizan para prevalecer1,2.
Los IPCI en uso actualmente son: ipilimumab (anti CTLA4), nivolumab, pembrolizumab y cemiplimab (anti PD1) y atezolizumab, avelumab y durvalumab (anti PDL1). Se hallan aprobados para un espectro creciente de enfermedades oncológicas (melanoma, cáncer de pulmón de células no pequeñas, carcinoma de células renales, linfoma de Hodgkin, mesotelioma, tumores uroteliales, de cabeza y cuello, cáncer de mama triple negativo y merkelomas)3.
Los IPCI han modificado el pronóstico de los pacientes con cáncer, pero generaron un nuevo perfil de toxicidades, que se han agrupado bajo el nombre de eventos adversos relacionados con el sistema inmunitario (immune-related Adverse Events [irAE]) y se deben a la activación inespecífica de las célulasT. Las manifestaciones clínicas de los irAE son diversas, así como su gravedad y su aparición en el tiempo desde la exposición. Este escenario genera una necesidad de integración de diferentes especialidades, entre ellos reumatólogos, ante la aparición de síntomas articulares y musculoesqueléticos muy similares a las enfermedades autoinmunes sistémicas4.
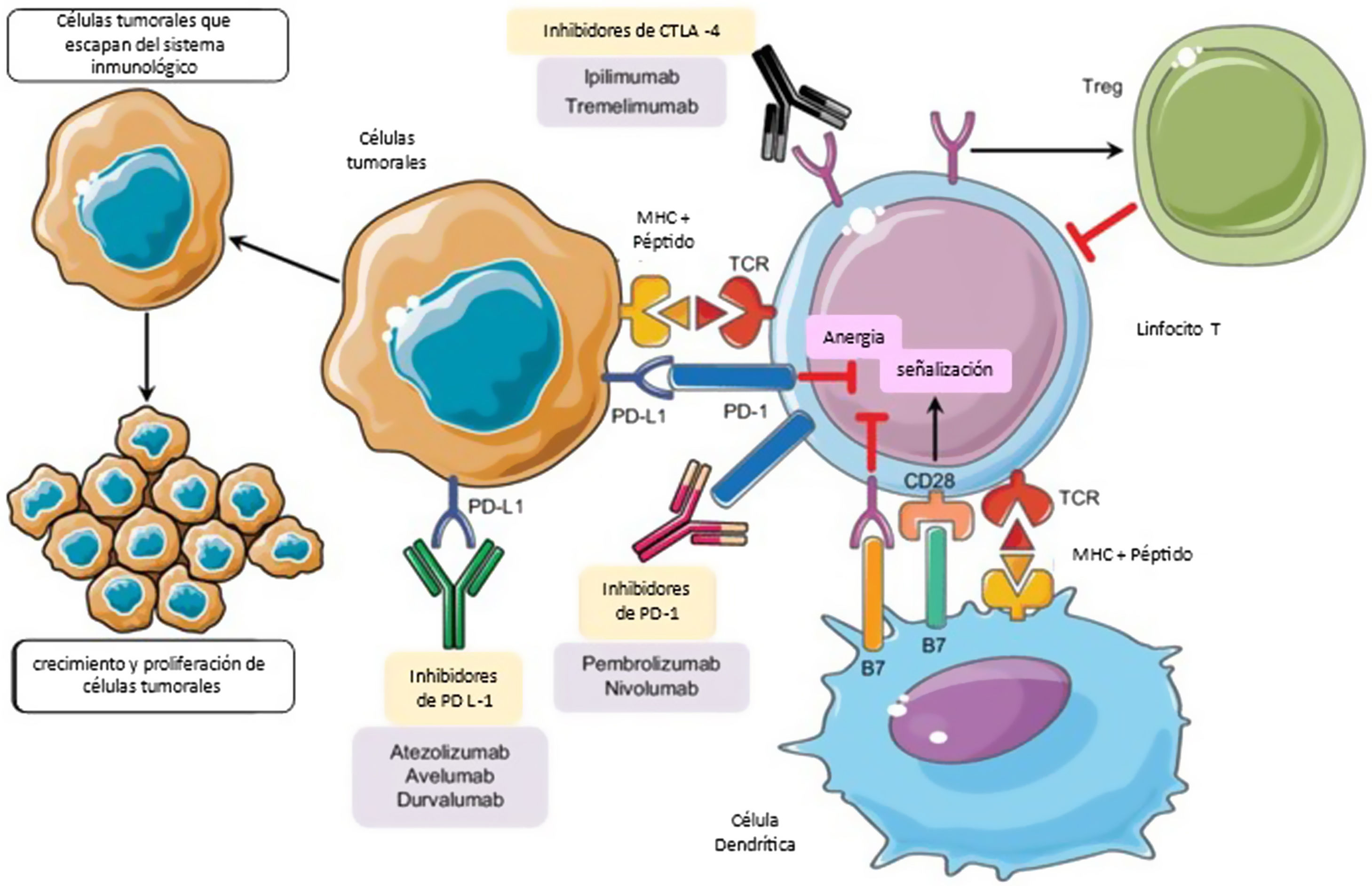
Fisiopatología de los irAEEn la respuesta inflamatoria fisiológica existen puntos de control inmunes celulares. Estos sistemas de regulación actúan limitando la activación de célulasT, evitando una hiperrespuesta inmune, la pérdida de la homeostasis y la tolerancia inmunológica. La activación de la célulaT requiere la unión de su receptor a un antígeno, y una segunda señal denominada co-estimuladora que proviene de la unión del CD28 (molécula accesoria al receptorT) con las moléculas CD80/CD86 presentes en la célula presentadora de antígenos, produciendo una señal positiva y activando una cascada de segundos mensajeros que culmina en el inicio de la respuesta inflamatoria. El CTLA4 es una molécula presente en el linfocitoT, de características inhibitorias, homóloga al CD28, con alta afinidad por CD80/CD86, que compite por la unión a esta molécula. Al hacerlo, impide la generación de la segunda señal, impidiendo la activación de la célulaT5,6. De manera similar, PD1 (proteína de muerte celular programada) es un regulador negativo de la actividad de linfocitosT, al unirse a sus ligandos PDL1 y PDL26.
El CTLA4 expresa su actividad tempranamente en los ganglios linfáticos y en el timo7, mientras que la inhibición de la célulaT por PDL1 se produce en etapas más tardías de la respuesta inmune8. PD1 y PDL1 juegan un rol clave en el mantenimiento de la tolerancia periférica, controlando a los linfocitosT autorreactivos que escaparon al mecanismo de tolerancia central en el timo2 y en situaciones donde la célulaT activada es incapaz de deshacerse del antígeno, como ocurre en infecciones crónicas o en el ambiente tumoral9 (fig. 1).
En la respuesta inflamatoria los ligandos B7 expresados en las APC se unen al receptor CD28 en CTL, lo que conduce a la amplificación de célulasT y la respuesta inmunitaria. Alternativamente, la unión de ligandos B7 a CTLA-4 expresados en célulasT suprime su actividad. CTLA-4 también mejora la actividad de Tregs que conduce a la actividad inmunosupresora. PD-1 se expresa en célulasT activadas. PD-1 se une a su PD-L1, lo que provoca la anergia de los CTL y promueve aún más las señales inhibidoras. La inhibición farmacológica de los puntos de control inmunitarios con anticuerpos monoclonales restaura la actividad inflamatoria, incluyendo la antitumoral9.
CTL: linfocitosT citotóxicos; CTLA-4: antígeno 4 de linfocitosT citotóxicos; DC: célula dendrítica; MHC: complejo mayor de histocompatibilidad; PD-1: muerte celular programada-1; PD-L1: ligando de muerte celular programada-1; TCR: receptor de célulasT; Tregs: célulasT reguladoras.
Adaptado de Taieb et al.9.
Al aumentar la actividad del sistema inmune los IPCI generan numerosos efectos adversos inmunomediados (irAE) hasta en el 80% de los pacientes tratados8. Los principales órganos afectados son la piel (rash maculopapular, eccema, prurito), el tracto gastrointestinal (colitis), las glándulas endocrinas (hipo o hipertiroidismo, hipofisitis, fallo suprarrenal) y el hígado (hepatitis autoinmune)10. En menor medida también se afectan el sistema nervioso central (Guillain-Barré, encefalitis y mielitis transversa), el aparato cardiovascular (miocarditis), los pulmones (neumonitis), el sistema hematológico, las articulaciones y el sistema musculoesquelético7,8,11. Sobre estos últimos se desarrollará la presente revisión.
Es controvertido aún si la aparición de un irAE predice una respuesta antitumoral favorable. Se ha sugerido que la aparición de vitíligo o lesiones granulomatosas cutáneas en pacientes con melanoma pueden ser marcadores de una mayor respuesta terapéutica12. En una serie australiana de 244 pacientes tratados con IPCI, 19 que desarrollaron irAE reumatológicos tuvieron buena respuesta antitumoral13. Sin embargo, se requieren estudios prospectivos para arribar a una conclusión7,8,14.
Generalidades de los irAE reumatológicosLa presentación clínica de los irAE reumatológicos suele ser similar a la enfermedad reumatológica no mediada por IPCI, pero se distinguen por su distribución etaria y de género. Habitualmente los autoanticuerpos son negativos y escasos pacientes cumplen los criterios de clasificación de las enfermedades autoinmunes.
El síntoma más común es la artralgia (10-15% de los pacientes), seguido de mialgias y síndrome seco. Una revisión sistemática halló que la frecuencia de artralgias era del 1 al 43% y de mialgias del 2 al 20% de los casos tratados con IPCI15. Esta heterogeneidad en el reporte se debe a que los pacientes no son derivados al reumatólogo por síntomas leves, o a la presencia de otro irAE concomitante tratado con inmunosupresores por otro especialista o por el oncólogo12,13,16.
Entre el 3,5 y el 6,6% de los pacientes bajo IPCI requieren la intervención de un reumatólogo por artritis inflamatoria, miositis, síndrome seco o vasculitis17,18.
Mecanismos de los irAE reumatológicosLos irAE se producen por distintos mecanismos: 1)aumento de la actividad de linfocitosT contra antígenos expresados tanto en el tumor como en tejido sano; 2)aumento del título de autoanticuerpos preexistentes por aumento de la actividad de linfocitosB; 3)aumento de citocinas proinflamatorias, inflamación mediada por complemento8.
Los irAE reumatológicos incluyen la artritis inflamatoria, la miositis, la polimialgia reumática, la artritis psoriásica y la artritis reactiva7,19,20. También se han comunicado vasculitis, síndrome seco, sinovitis simétrica seronegativa remitente con edema con fóvea (RS3PE), tenosinovitis, entesitis, reacciones esclerodermiformes y sarcoidosis21.
Muchos pacientes tienen más de un efecto adverso inmunológico simultáneo: la colitis es el irAE que más frecuentemente se presenta concomitante a la artritis, que también se asoció a neumonitis y a tiroiditis12.
Si bien no hay un biomarcador predictivo del desarrollo de irAE reumatológicos14, el desarrollo de cualquier otro irAE se considera un factor de riesgo para el desarrollo de síntomas reumatológicos22. Revisaremos en los siguientes párrafos los hallazgos reumatológicos más comúnmente asociados a IPCI.
Debemos recordar que los síntomas musculoesqueléticos generales (artralgias, mialgias, debilidad) también pueden asociarse a la enfermedad oncológica de base, a artritis preexistente, a infecciones o a efectos adversos de otros fármacos, que deben tenerse en cuenta en el diagnóstico diferencial. Además, los reactantes de fase aguda pueden estar aumentados por la misma enfermedad oncológica o por otros irAE7.
Manifestaciones clínicas de los irAE reumatológicosArtritisSus patrones de presentación pueden ser: artritis simétrica de pequeñas articulaciones a predominio de manos (símil artritis reumatoide [AR]), oligoartritis asimétrica de grandes articulaciones con predominio de afectación de rodillas (símil espondiloartritis) o compromiso de cintura escapular y pélvica similar a la polimialgia reumática (PMR)6. También se han descrito casos de artritis reactiva y artritis psoriásica7,14. Una gran diferencia con las enfermedades reumatológicas clásicas es que no existe predilección de género, siendo los casos similares en hombres y mujeres7,14. Además suelen ser negativas para factor reumatoide y antipéptido cíclico citrulinado (anti-PCC), cursan con mayor prevalencia de entesitis y tenosinovitis y requieren dosis más altas de corticoides que las habitualmente utilizadas para las artritis inflamatorias7. Solo el 20% de los pacientes cumplen criterios de clasificación de AR o PMR21.
El diagnóstico es clínico, apoyado por imágenes23,24. Puede observarse una velocidad de sedimentación globular (VSG) y una proteínaC reactiva (PCR) elevadas, aunque el ascenso de estos marcadores puede deberse a la neoplasia.
El tiempo desde la exposición al fármaco hasta la aparición de artritis inflamatoria es variable, siendo en promedio de 120días21. Se han diagnosticado casos posteriores a la suspensión de IPCI e incluso evolución a la cronicidad a pesar de la suspensión del tratamiento7,12,19,21,22. La discapacidad funcional, el haber recibido terapia combinada de IPCI, la positividad de FR y/o anti PCC, y el hallazgo de erosiones podrían justificar un enfoque terapéutico más agresivo25.
En una revisión sistemática de Ghosh et al.26 que incluyó 372 pacientes, el 49% se presentaron con poliartritis símil AR y el 17% con oligoartritis. Los autores sugieren que esta relación similar entre la frecuencia de AR y la espondiloartritis en la población general se debería a que los IPCI podrían inducir estas enfermedades en pacientes genéticamente predispuestos. De hecho, los pacientes con artritis asociada a IPCI presentan con mayor frecuencia la secuencia de epítopo compartido en HLA-DRB1 comparado con la población general, que, como sabemos, se asocia a la fisiopatogenia de la AR27. Un síndrome similar a PMR se presenta en el 2% de los pacientes que reciben IPCI. El 25% de ellos no cumplen con los criterios preliminares de PMR de la Liga Europea contra el Reumatismo/Colegio Americano de Reumatología (EULAR/ACR) de 2012. Se observaron algunas características atípicas, como la afectación articular (principalmente rodillas y manos), la ausencia de marcadores inflamatorios elevados y casos agresivos que no responden al tratamiento habitual. En estos casos se deben indagar síntomas que sugieran arteritis de células gigantes, que con frecuencia pueden coexistir22.
MiositisLa miositis es un efecto adverso infrecuente pero potencialmente mortal21. La diferenciación entre una miositis paraneoplásica o inducida por IPCI puede ser difícil, pero el interrogatorio minucioso puede detectar el momento de inicio de los síntomas y su relación con el inicio del tratamiento28. Los estudios prospectivos informan solo unos pocos casos de miositis inducida por IPCI, lo que indica una baja prevalencia29,30. Sin embargo, su frecuencia parece estar en aumento, probablemente debido a un mayor número de pacientes tratados con inmunoterapia. La miositis inducida por IPCI tiene características atípicas en comparación con las formas idiopáticas de la enfermedad y conlleva un alto riesgo de mortalidad.
Generalmente la miositis se presenta luego de la primera o segunda dosis del IPCI, con una media de aparición de 25días7,21. Los principales síntomas son debilidad proximal y mialgias, en ausencia del rash característico de la dermatomiositis; la ptosis palpebral y la diplopía deben hacer sospechar miastenia miastenia gravis concomitante, que se asocia a miositis hasta en un 12,5% y obliga a explorar síntomas bulbares y fallo respiratorio31. Generalmente cursa con aumento de CPK14,21. El diagnóstico se basa en el examen físico y los niveles elevados de enzimas musculares y eventualmente se requiere un electromiograma y una resonancia magnética muscular. Los anticuerpos para miopatías inflamatorias y los anticuerpos contra el receptor de acetilcolina (AChR) suelen ser negativos7,21. El papel de la biopsia muscular no está claro; existen escasos informes de hallazgos que revelan necrosis e inflamación y confirman el daño muscular.
La miocarditis pertenece al espectro clínico de la miositis22; la evaluación cardiaca debe incluir la búsqueda de signos clínicos como dolor precordial, disnea y trastornos en la conducción. Se debe dosar troponinas, solicitar ecocardiograma Doppler y electrocardiograma21. Se han informado signos de inflamación en resonancia magnética cardíaca en más del 60% de los pacientes con miositis por IPCI32.
Sarcoidosis y reacciones de tipo sarcoideEn la bibliografía se han descrito casos de sarcoidosis o reacciones de tipo sarcoide inducidas por IPCI, en su mayoría después de monoterapia con anti-CTLA4 o anti-PD133. Si bien el mecanismo patogénico de la sarcoidosis inducida por IPCI no es del todo conocido, en la sarcoidosis idiopática hay disminución en la expresión de CTLA4 en célulasT-regulatorias (T-reg) y Th17. Esto puede conducir a una función supresora T-reg defectuosa y, por otro lado, a una mayor activación de las células Th17, ambos eventos con implicaciones patogénicas25. Esto puede explicar, al menos parcialmente, la aparición de sarcoidosis después del bloqueo de CTLA4.
La sarcoidosis inducida por IPCI puede presentarse como sarcoidosis cutánea34 o sistémica, con linfadenopatía y compromiso pulmonar o afectación neurológica y ocular35. No hay hallazgos séricos específicos para la sarcoidosis inducida por IPCI. El tumor más frecuentemente asociado a la sarcoidosis por IPCI es el melanoma y su aparición es variable, llegando hasta los 200días luego del inicio del tratamiento36.
Esta presentación tiene importancia desde el punto de vista clínico y pronóstico, ya que las reacciones de tipo sarcoide pueden diagnosticarse erróneamente como progresión de la enfermedad. Las biopsias de ganglios linfáticos realizadas en estos casos para excluir la recurrencia o la progresión del cáncer demostraron en su mayoría inflamación granulomatosa no necrosante36.
Vasculitis sistémicasExiste vinculación entre la fisiopatología de la vasculitis sistémica idiopática y la falla en la expresión de moléculas que forman parte de los puntos de control inmunes fisiológicos, con menor expresión de la vía PD1/PDL1. Estimando que la inflamación vascular está estrechamente relacionada con los puntos de control inmunitarios disfuncionales, no sorprende que la inhibición de estos puntos de control en el contexto de la inmunoterapia pueda generar vasculitis37. Se han comunicado casos de vasculitis de pequeños, medianos y grandes vasos7. En una revisión sistemática de 53 casos sospechosos de vasculitis, 20 fueron confirmados. Las más frecuentes fueron: vasculitis de grandes vasos (arteritis de células gigantes y aortitis aislada) y vasculitis del sistema nervioso (central y periférico). El tiempo medio a la aparición de síntomas fue de 3meses luego de iniciada la inmunoterapia y en la mayoría de los casos bajo tratamiento con anti-PD138. Este hallazgo es concordante con estudios que sugieren una deficiencia en la vía PD1/PDL1 en la patogénesis de la vasculitis de grandes vasos38. También se han publicado casos de vasculitis con afectación retiniana o uterina y un caso de granulomatosis con poliangeítis con compromiso pulmonar y renal14. Un caso de arteritis de células gigantes luego de infusión de nivolumab se presentó con una gran úlcera del cuero cabelludo31. Conociendo que las vasculitis sistémicas pueden presentar manifestaciones clínicas graves con daño de órganos, ante la sospecha de vasculitis se deben suspender los IPCI e iniciar terapia con esteroides.
Síndrome secoLos desequilibrios en los puntos de control inmune pueden inducir activación y proliferación de células autorreactivas que conduzcan al síndrome seco39. Los polimorfismos de CTLA4 se han correlacionado con la susceptibilidad a la enfermedad y la producción de autoanticuerpos40.
El síndrome seco en los pacientes tratados con IPCI generalmente se presenta en forma aguda, sin parotiditis y en ausencia de anti-Ro y anti-La14. En una serie de 4casos, la presentación fue con boca seca de inicio abrupto y con signos de severa hipofunción glandular12. Una revisión reciente identificó 17 casos de síndrome seco después del tratamiento con IPCI41. Estos pacientes tenían una mediana de edad de 63años, con ligero predominio masculino (53%), la mayoría tenían melanoma (71%) y habían recibido terapia anti-PDL1 (88%). La mediana de tiempo hasta su aparición tras el inicio del tratamiento fue de 3,8meses, y no tenían autoanticuerpos típicos de la enfermedad.
Cuando se realizó biopsia de glándula salival, esta demostró una sialoadenitis distinta del Sjögren, con infiltración linfocítica difusa de célulasT y lesión acinar mediada por infiltración de célulasT CD4+ y CD8+25. En el Sjögren la sialoadenitis es focal, con agregados densos de 50 o más linfocitos perivasculares o periductales adyacentes a ácinos mucosos de apariencia normal42.
Lupus eritematoso sistémicoLa desregulación de los puntos de control inmunitarios está involucrada en la patogénesis del lupus eritematoso sistémico (LES). Los datos sugieren que polimorfismos en los genes PD1 y CTLA4 en humanos y modelos animales pueden provocar manifestaciones de lupus43. A pesar de que el LES es el prototipo de enfermedad autoinmune sistémica, el lupus inducido por IPCI es muy poco frecuente44. Según el sistema de notificación de eventos adversos de la Food and Drug Administration (FDA), hasta junio de 2018 se notificaron solo 18 casos de LES, 7 casos de lupus cutáneo, 2 de síndrome similar al lupus, un caso de nefritis lúpica y uno de lupus del sistema nervioso central asociados a IPCI45. Se presenta tardíamente, con una media mayor a 120días del comienzo del IPCI; el grupo etario (60años) es diferente al lupus clásico y con predominio del género masculino.
Síndromes esclerodermiformesSe han informado 2 casos de esclerodermia en pacientes bajo tratamiento con pembrolizumab por melanoma: uno de ellos con escleroderma localizada y otro con escleroderma difusa, ambos confirmados con biopsia de fibrosis y esclerosis cutánea33. Aunque se desconoce el mecanismo subyacente, se sugiere que la inflamación mediada por anti-PD1 podría conducir a la activación en la piel del factor de crecimiento transformanteβ (TGF-β), desencadenando una cascada profibrótica46.
En la bibliografía se hallan publicados 13 casos de fascitis eosinofílica, la mayoría de ellos en pacientes tratados por melanoma con terapia anti-PD147.
Artritis cristálicaSe ha descrito un caso de ataques recurrentes de pseudogota en la articulación de la rodilla en un paciente tratado con nivolumab por cáncer renal, 7 a 10días posteriores a cada infusión; estos eventos cedieron bajo profilaxis con colchicina. En el análisis de líquido sinovial de dicho paciente se observaron cristales de pirofosfato cálcico y un aumento de la IL-17 que correlacionó con el incremento de neutrófilos sinoviales. Los autores sugieren un potencial efecto de los Th17 en el reclutamiento de neutrófilos en los eventos de pseudogota inducidos por ICPI48.
Compromiso óseoSe ha alertado acerca de irAE con afectación del hueso. Se han comunicado 6 casos con dos fenotipos de afectación esquelética distinta: 3 pacientes con nuevas fracturas vertebrales no traumáticas (uno de ellos con fracturas múltiples, incluyendo costillas y pelvis) y 3 con resorción ósea localizada. Cinco eran hombres. Ninguno de los pacientes con fracturas tenía osteoporosis por densitometría y ninguno tenía factores de riesgo adicionales para osteoporosis49.
Síndrome antifosfolipídicoUn caso del Centro Hospitalario Universitario Ambroise Paré (Bélgica) relata un paciente con cáncer de pulmón tratado con pembrolizumab que desarrolló un accidente cerebrovascular en el territorio de la arteria cerebral media derecha, con anticuerpos anti-cardiolipinas IgG y anti-B2 glucoproteína1 IgG positivos. Los autores revisaron la literatura y hallaron 4 casos similares en pacientes con melanoma, incluyendo un caso de síndrome antifosfolipídico (SAF) catastrófico50.
Tratamiento de los irAE reumatológicosClásicamente se estratifica a los irAE según severidad en 5 categorías diferentes (desde1 para las toxicidades leves hasta5 para los casos fatales); cada categoría se trata de acuerdo con su impacto clínico y define la continuidad, la suspensión y/o la reexposición al tratamiento con IPCI. A su vez, de acuerdo con la categoría se recomiendan estudios diagnósticos y de derivación a reumatología. Se han publicado diferentes guías con recomendaciones para el manejo de las toxicidades: las más importantes son la de la Sociedad Europea de Oncología Médica (ESMO) de 201751, la de la Sociedad Americana de Oncología Clínica (ASCO) de 201952 y la de la Red Nacional Integral de Cáncer (NCCN), actualizada por última vez en febrero de 202253. Todas ellas tienen un perfil de recomendaciones similares.
En 2020 se publicaron las guías EULAR para el manejo y el diagnóstico de los irAE reumatológicos por IPCI21, donde se resalta la importancia de la incorporación del reumatólogo al equipo de trabajo para el manejo de estos pacientes. Las recomendaciones terapéuticas se resumen a continuación:
- •
En caso de ineficacia del tratamiento sintomático, utilizar corticoides locales o sistémicos. La dosis y la vía de administración dependen de la clínica y del grado de actividad. Cuando se consigue mejoría sintomática, se sugiere un descenso lento de corticoides sistémicos hasta la dosis mínima efectiva.
- •
Los drogas modificadoras de la enfermedad (DMARD, por sus siglas en inglés) clásicas deben considerarse cuando la respuesta a corticoides es insuficiente, o como ahorradores de corticoides.
- •
En pacientes con manifestaciones severas o con respuesta insuficiente a los DMARD clásicos deben considerarse los DMARD biológicos, siendo los anti-TNF o los inhibidores de IL-6 las opciones de preferencia para la artritis inflamatoria.
- •
La miositis es una condición severa. En presencia de síntomas que amenazan la vida, como síntomas bulbares (disfagia, disartria, disfonía), disnea o miocarditis, deben considerarse corticoides en altas dosis, inmunoglobulina humana y recambio plasmático. La inmunoterapia siempre debe suspenderse en estos casos.
- •
Antes del inicio de la inmunoterapia no está indicado realizar dosaje de autoanticuerpos en todos los pacientes. En caso de manifestaciones reumatológicas, musculoesqueléticas o síntomas sistémicos previos, se llevará a cabo una evaluación reumatológica completa.
No se conoce si el uso de esteroides pudiera modificar la respuesta antitumoral; estudios retrospectivos han demostrado que los desenlaces fueron similares en aquellos pacientes que recibieron inmunosupresores para los irAE8,54. Algunos autores sugieren que minimizar la exposición a los esteroides podría mejorar el control del tumor a largo plazo, así como limitar los eventos adversos metabólicos55. Por ello, se propone un cambio en el paradigma del tratamiento de los irAE reumatológicos, pasando del modelo convencional, donde los corticoides forman parte de la base de la pirámide, que progresa hacia DMARD clásicos y luego DMARD biológicos, hacia una pirámide invertida, donde se priorice el uso de tratamientos dirigidos anti-citocinas o de inhibición de la señalización intracelular, y reducir el uso de corticoides6.
La aparición de un irAE llevó a la suspensión definitiva del IPCI en el 38% de los pacientes y transitoriamente en el 11%, según una revisión sistemática26. Según las Guías de Práctica Clínica de la Sociedad para Inmunoterapia en Cáncer (SICT, por sus siglas en inglés), los pacientes que experimenten irAE grado2 pueden ser re-expuestos a la droga si los signos y síntomas se resolvieron o están controlados con menos de 10mg/día de prednisona o equivalentes. La decisión de re-exponer a los pacientes que desarrollaron irAE grado3 o4 debe ser individualizada según los riesgos y beneficios potenciales de la terapia. Los pacientes con miositis que experimentaron miocarditis deben interrumpir la terapia en forma permanente56.
Las redes inmunitarias son complejas y diversos anticuerpos monoclonales, inmunosupresores e inhibidores de la señalización inmunitaria pueden tener efectos variados sobre la eficiencia de la IPCI56,57. Por ello, cuando se inicie tratamiento inmunosupresor por un irAE, se debe insistir en el uso de la menor dosis posible que ofrezca efecto terapéutico.
Uso de inmunoterapia para el cáncer en pacientes con enfermedades autoinmunes previasLos pacientes con enfermedades autoinmunes fueron excluidos de los ensayos clínicos con inmunoterapia para el cáncer7,14; sin embargo, ya existen series de casos que avalan el uso de inmunoterapia en pacientes con enfermedades reumatológicas preexistentes.
En una revisión sistemática que incluyó 123 pacientes con enfermedades autoinmunes preexistentes, el 41% tuvieron exacerbación de su enfermedad de base, el 25% tuvieron irAE (siendo la colitis y la hipofisitis los más frecuentes) y el 9% presentaron ambas complicaciones58. No se observó una diferencia significativa de irAE entre quienes tenían enfermedad autoinmune activa o inactiva. Los pacientes que estaban recibiendo tratamiento inmunosupresor previo a la inmunoterapia tuvieron menos irAE (59%) que aquellos sin tratamiento (83%). El 62% de los pacientes requirieron corticoides a altas dosis para el tratamiento y el 16% requirieron DMARD u otros inmunosupresores. Los irAE mejoraron en el 90% de los pacientes. Cappelli y Bingham57 han comunicado que hasta el 40-50% de los pacientes con enfermedades autoinmunes que reciben IPCI pueden desarrollar exacerbación de su enfermedad de base, principalmente AR y artritis psoriásica; no hay datos confiables en vasculitis, esclerodermia y LES.
Se puede concluir que el uso de IPCI en pacientes con enfermedades autoinmunes e inflamatorias previas se basa en el equilibrio entre el riesgo y el beneficio para cada individuo. Es frecuente que el tratamiento provoque una exacerbación de la afección previa, pero, por otro lado, la aparición del irAE se asocia a una mejor respuesta terapéutica, según la observación reciente de un estudio del Memorial Sloan Kettering Cancer Center59.
ConclusionesEs innegable que la terapia con IPCI ha logrado instalarse como parte del tratamiento del cáncer, generando un perfil de toxicidades que nos obliga al trabajo interdisciplinario.
El espectro clínico de las toxicidades reumatológicas es múltiple y no tan raro. Ocurren más frecuentemente con terapia anti-PD1. Las artralgias suelen ser el síntoma de presentación, y la poliartritis simétrica y la polimialgia reumática son los síntomas inflamatorios más frecuentes. La severidad que conllevan las miopatías inflamatorias las coloca en un lugar de alarma extrema. Debemos tener en cuenta que la presentación clínica puede ser atípica, los autoanticuerpos suelen ser negativos y la prevalencia en hombres y mujeres es similar. Hasta el momento no hay contraindicación en el inicio de terapia inmunosupresora para su manejo.
La demora en el diagnóstico de un irAE reumatológico condiciona el pronóstico de estos pacientes; los síntomas reumatológicos pueden persistir aun después de suspender el tratamiento y los potenciales daños pueden generar una limitación permanente de la funcionalidad. La tabla 1 resume la relación entre el tumor, el tipo de fármaco y el irAE asociado.
Resumen de los IPCI, mecanismo de acción, indicaciones e irAE reumatológicos
| Mecanismo de acción | Fármaco | Indicaciones | Efecto adverso reumatológico |
|---|---|---|---|
| Anti CTLA4 | Ipilimumab | • Melanoma cutáneo y metastásico• Carcinoma renal avanzado• Cáncer colorrectal metastásico | Artritis no especificada11,16Síndrome seco16Nefritis lúpica32Vasculitis31Sarcoidosis37 |
| Tremelimumab | Uso conjunto con durvalumab en el tratamiento de carcinoma de pulmón no células pequeñas estadio IV | ||
| Anti PD1 | Nivolumab | • Melanoma, cáncer de pulmón no células pequeñas• Carcinoma renal• Carcinoma hepatocelular• Linfoma de Hodgkin• Carcinoma escamoso de cabeza y cuello• Carcinoma urotelial• Cáncer colorrectal con inestabilidad de microsatélite | Artritis no especificada13,16,25Monoartritis23Oligoartritis23Símil PMR13,14,20,23Símil AR11,14AIJ11Artritis psoriásica11Artritis por depósito de CPPD25Pseudogota29Miositis11Síndrome seco13,16,23Vasculitis25Sarcoidosis36Fractura vertebral41Resorción ósea41 |
| Pembrolizumab | • Melanoma• Cáncer de pulmón no células pequeñas• Linfoma de Hodgkin• Carcinoma escamoso de cabeza y cuello• Carcinoma urotelial• Cáncer gástrico• Tumores sólidos con gran inestabilidad de microsatélite | Artritis25Monoartritis23Oligoartritis23Símil PMR14,20Símil AR11,14Bursitis olecraneana25Miositis11,23,30Sarcoidosis35Fascitis eosinofílica34Vasculitis31SAF40Fractura vertebral41 | |
| Anti PDL1 | Atezolizumab | • Cáncer de pulmón no células pequeñas metastásico• Carcinoma urotelial | Símil PMR14,20Síndrome seco13 |
| Avelumab | • Carcinoma de células de Merckel metastásico• Carcinoma urotelial localmente avanzado o metastásico | ||
| Durvalumab | • Carcinoma urotelial localmente avanzado o metastásico• Cáncer de pulmón no células pequeñas irresecable estadio III | ||
| Terapia combinada | Ipilimumab +Nivolumab | Melanoma metastásico o irresecable | Artritis no especificada13,16Poliartritis23Oligoartritis23Símil PMR13,20,23Síndrome seco11,13,16Mialgias11Vasculitis31Sarcoidosis39Resorción ósea41 |
| Ipilimumab +Pembolizumab | Artritis no especificada13Monoartritis23 | ||
| Tremelimumab +Durvalumab | • Carcinoma de pulmón no células pequeñas estadio IV | Miositis13 |
Esta revisión intenta responder a algunos de los interrogantes planteados por Nóvoa Medina y Rodríguez Abreu, cuando en REUMATOLOGÍA CLÍNICA publicaron tres interrogantes respecto de los irAE reumatológicos: 1)la incidencia real de la patología reumática teniendo en cuenta la posible infraestimación por falta de estandarización en el diagnóstico; 2)el impacto del tratamiento del irAE en el tumor y en la nueva enfermedad reumatológica, y 3)el efecto concomitante de la inmunoterapia y la inmunosupresión en pacientes con historia de enfermedad reumatológica previa60.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.