El síndrome de anticuerpos antifosfolipídicos catastrófico (SAAFC) es una forma rara de presentación del síndrome de anticuerpos antifosfolipídicos, de mal pronóstico, por lo que son necesarios un diagnóstico y un tratamiento precoces. Presentamos un paciente que tuvo gangrena como manifestación inicial de un SAAFC.
Catastrophic antiphospholipid syndrome (CAPS) is an unusual form of presentation of antiphospholipid syndrome with a poor prognosis, so early diagnosis and treatment are necessary. We report a patient who had gangrene as the initial manifestation of CAPS.
El síndrome de anticuerpos antifosfolipídicos (SAAF) es un proceso autoinmunitario cuya variante catastrófica (SAAFC), que representa un 1% del total de casos, se define por múltiples eventos trombóticos que pueden conducir a un fallo multiorgánico.
El SAAFC puede ser primario o secundario, en ausencia o no, respectivamente, de una enfermedad autoinmunitaria. La enfermedad que se asocia con mayor frecuencia con el síndrome es el lupus eritematoso sistémico (LES).
Presentamos el caso de una mujer cuya manifestación inicial y causa de ingreso fue una gangrena del antepié. Su evolución posterior llevó al diagnóstico de SAAFC.
Caso clínicoMujer de 19 años de edad, que acudió al servicio de urgencias de nuestro hospital por necrosis distal en el pie derecho y una úlcera en el izquierdo. Como antecedentes personales, había sufrido un aborto en el tercer trimestre del embarazo 4 meses antes y había requerido, un mes más tarde, ser ingresada en la unidad de cuidados intensivos (UCI) de un hospital de su país de origen (Marruecos) por anemia grave, por lo que recibió varias transfusiones. Presentaba, en ese momento, lesiones en ambos pies (carecemos de informes clínicos de esos ingresos). Ante la ausencia de mejoría, la paciente decidió acudir a nuestro hospital para su valoración.
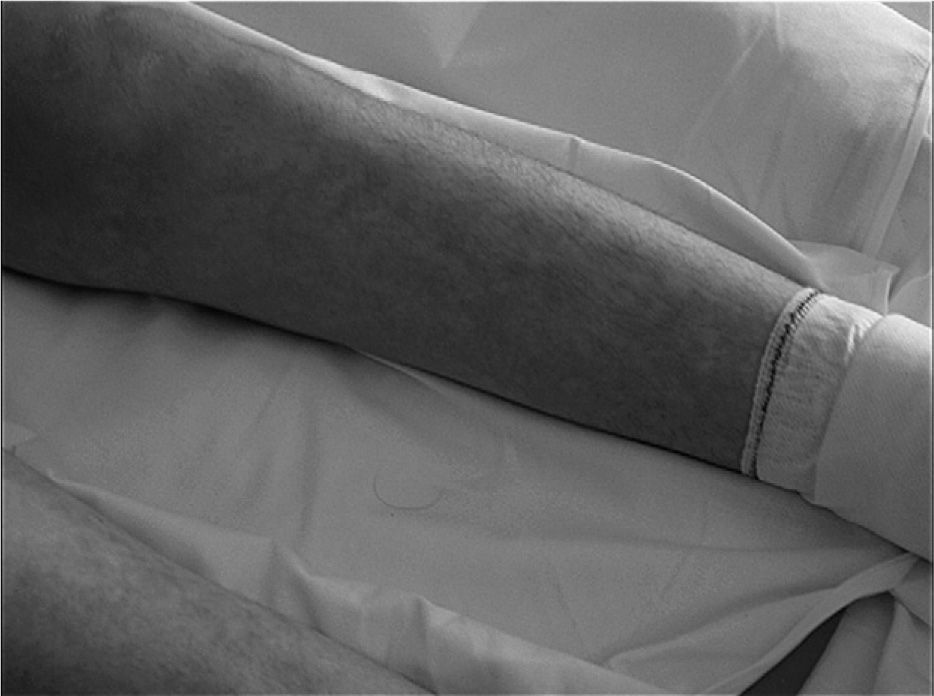
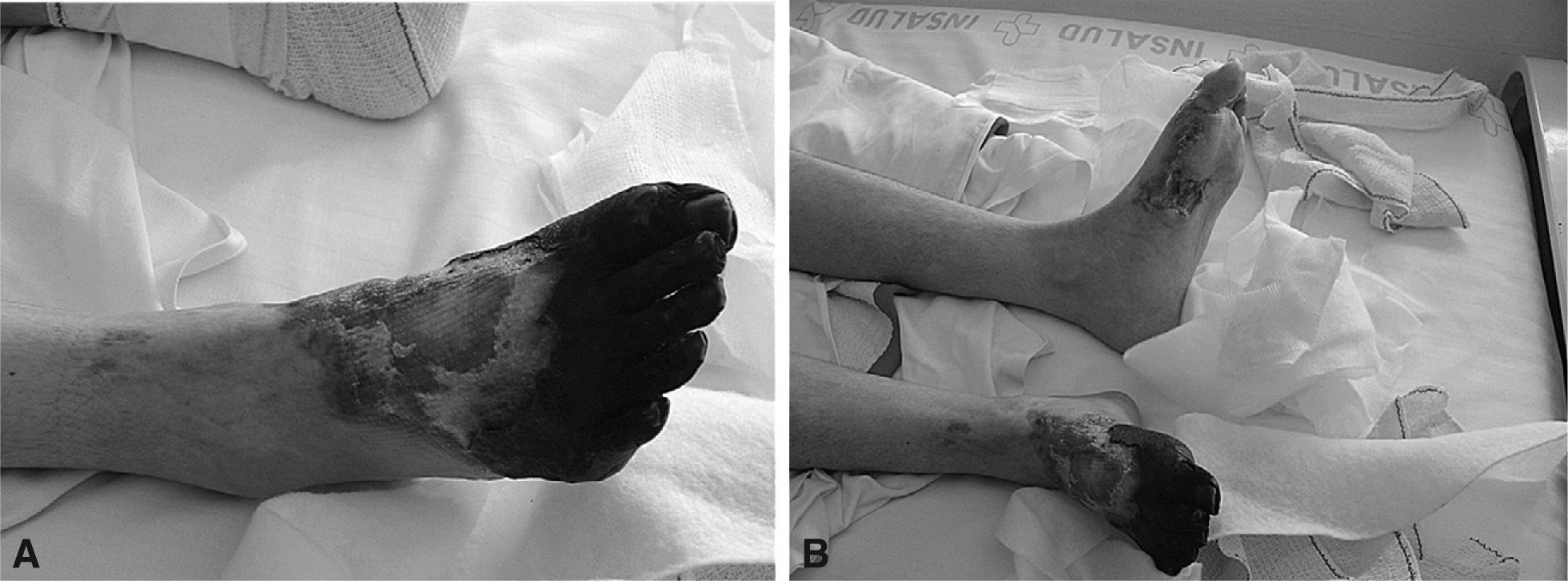
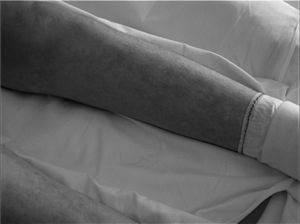
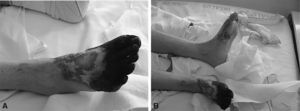
A su ingreso, la paciente estaba afebril y con estabilidad hemodinámica. A la exploración física llamaba la atención la presencia de livedo reticularis (fig. 1), necrosis de todos los dedos y antepié derechos y una lesión ulcerativa en la cara interna del pie izquierdo con lesiones isquémicas distales (fig. 2); los pulsos y la movilidad eran normales. El estudio analítico mostraba únicamente elevación de los reactantes de fase aguda; la radiografía de tórax, el electrocardiograma, el ecocardiograma y el eco-Doppler de los miembros inferiores eran normales. A lo largo de su evolución presentó fiebre persistente con hemocultivos negativos y cultivo de exudado positivo para Staphylococcus epidermidis, S. aureus y Citrobacter freundii sensibles a la antibioterapia administrada desde el ingreso (ceftriaxona, 2g/24h intravenoso [iv]; clindamicina, 600mg/6h iv). Posteriormente, presentó descenso progresivo de las cifras de hemoglobina, hasta llegar a 6,5g/dl; la prueba de Coombs directa fue positiva. Otros hallazgos fueron: haptoglobina de 74mg/dl, LDH de 13.056; se observaron esferocitos, poiquilocitos y hematíes fragmentados, con ausencia de esquistocitos, además de que se detectó panaglutinina. Todos estos datos indicaban una anemia hemolítica autoinmunitaria, sin poder descartarse la presencia de aloanticuerpos. Los anticuerpos anticardiolipínicos (aCL) (IgG, 17 GPL/ml; IgM, 100 U MPL/ml), el anticoagulante lúpico (AL) y los anticuerpos anti-beta-2 glucoproteína I (> 5) resultaron positivos. Se realizó el diagnóstico de probable síndrome de anticuerpos antifosfolipídicos, por lo que se instauró tratamiento con glucocorticoides (5 bolos de metilprednisolona, 1g iv cada 24 horas y posteriormente prednisona, 1mg/kg/día), heparina de bajo peso molecular a dosis terapéuticas (anteriormente a dosis profilácticas) y transfusión, a pesar de los riesgos.
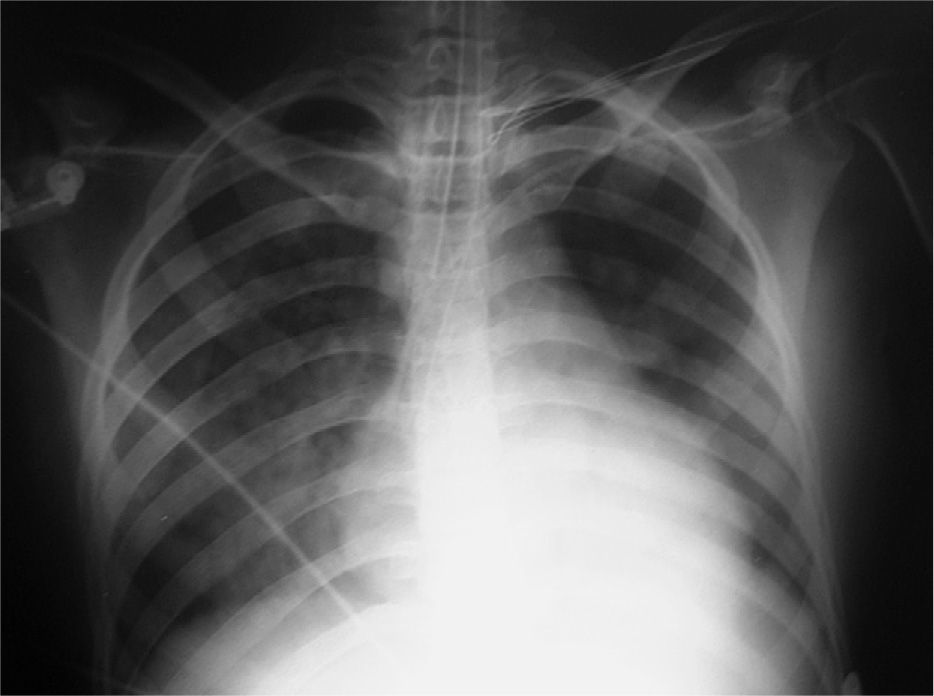
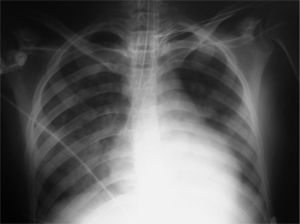
Cuarenta y ocho horas después de su ingreso, la paciente presentó deterioro del estado general y de la función renal, por lo que requirió de hemofiltración. Presentó, además, fallo hepático, con elevación de las enzimas de citólisis y colestasis, así como síndrome de distrés respiratorio (fig. 3), que requirió intubación orotraqueal e ingreso en la UCI. Ante la situación de fallo multiorgánico, se instauró tratamiento con heparina sódica iv, ciclofosfamida iv (pulso de 750mg/m2 de superficie corporal) y posteriormente vía oral (a dosis de 1mg/kg/ día), así como inmunoglobulinas iv, a dosis de 400mg/ kg/día durante 5 días, con lo que experimentó mejoría progresiva de las cifras de creatinina y de las enzimas hepáticas. No se realizó recambio plasmático por no disponer de esta técnica en nuestro hospital y por no ser posible su traslado.
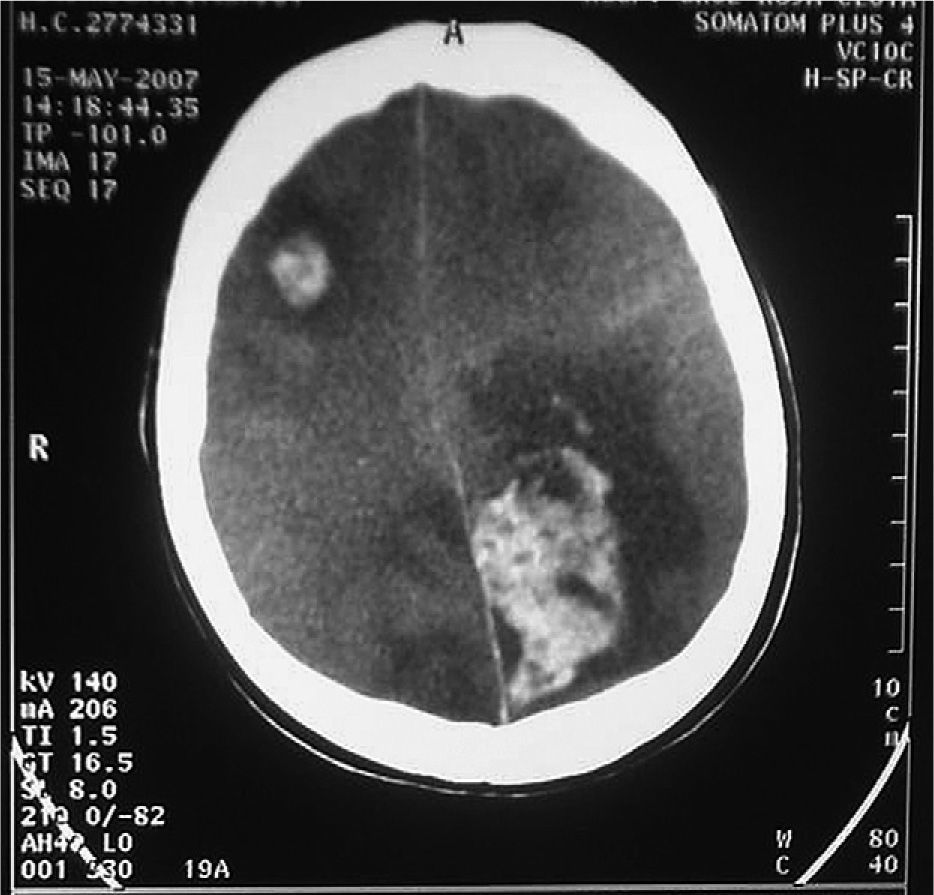
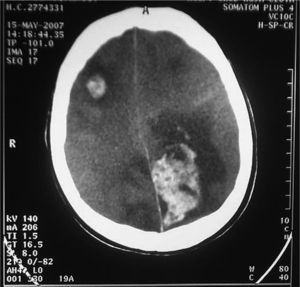
Tras 10 días de ingreso en la UCI, presentó un episodio de bradicardia, hipotensión, midriasis no reactiva y ausencia de reflejos osteotendinosos y del tronco. En la tomografía computarizada craneal (fig. 4) se observaron infartos occipitales izquierdos con transformación hemorrágica, uno frontal derecho, edema, obliteración de las cisternas y borramiento completo de los surcos y las cisuras. Dos días después se recibieron las determinaciones de los anticuerpos antinucleares (ANA) y los anti-ADN nativo, que resultaron positivos a títulos altos, por lo que se estableció el diagnóstico de síndrome de anticuerpos antifosfolipídicos catastrófico probablemente secundario. No se realizó necropsia por motivos religiosos.
DiscusiónEstamos ante un caso de SCAAFC probablemente secundario a lupus, que se inició con manifestaciones cutáneas (isquemia, úlcera y gangrena), a las que se añade, de forma aguda y simultánea, afección hepática, renal, pulmonar y cerebral. Esta afección multiorgánica, asociada a la positividad de los anticuerpos antifosfolipídicos (aPL), sin que fuera posible realizar una segunda determinación por la muerte de la paciente, nos lleva al diagnóstico de SAAFC probable. Los ANA y los anti-ADN nativo positivos, así como la anemia hemolítica, nos hacen pensar en un lupus asociado.
El SAAF se caracteriza por la aparición de trombosis de repetición (tanto venosas como arteriales o de pequeños vasos), morbilidad en los embarazos (fundamentalmente abortos, pérdidas fetales recurrentes y prematuridad) y alteraciones hematológicas (trombocitopenia y anemia hemolítica), asociados a la presencia de aPL (AL, aCL) y anticuerpos anti-beta-2-glucoproteína I1–3.
El SAAFC, también denominado síndrome de Asherson, es una variante del SAAF, que se caracteriza por múltiples trombosis de aparición aguda y curso extremadamente grave. En comparación con el SAAFC primario, el SAAFC asociado al LES es más frecuente en mujeres, se presenta en personas de menor edad, con mayor frecuencia afecta al cerebro y el páncreas, tiene una menor prevalencia de aCL isotipo IgG a títulos altos y se asocia con una mortalidad mayor ajustada por edad, sexo, órgano afectado y tratamiento4.
El SAAFC suele afectar a vasos de pequeño calibre simultáneamente, en un período corto y en múltiples localizaciones, mientras que en el SAAF no catastrófico los eventos trombóticos tienen lugar en vasos de mayor calibre, de forma esporádica y a menudo en una única localización5,6. Los criterios propuestos en 2002 para la clasificación del SAAFC (definitivo y probable) aparecen en la tabla 17.
Criterios de clasificación del síndrome catastrófico de anticuerpos antifosfolipídicos
| 1. Evidencia clínica de afección de 3 o más órganos, sistemas o tejidos. Generalmente, evidencia clínica de trombosis confirmada por técnicas de imagen. La afección renal se define por incremento del 50% de la creatinina, hipertensión arterial grave (> 180/100mmHg) y/o proteinuria > 500mg/24h |
| 2. Desarrollo de las manifestaciones simultáneamente o en menos de 1 semana |
| 3. Confirmación anatomopatológica de la oclusión de los vasos de pequeño calibre en al menos 1 órgano. Debe haber signos de trombosis, aunque en ocasiones puede coexistir una vasculitis |
| 4. Confirmación analítica de la presencia de aPL (AL o aCL). Si el paciente no ha sido diagnosticado previamente de síndrome de anticuerpos antifosfolipídicos, la confirmación analítica requiere que la presencia de aPL sea detectada en 2 o más ocasiones, con una separación de al menos 12 semanas entre una y otra (no necesariamente en el momento de la trombosis) |
| Síndrome de anticuerpos antifosfolipídicos catastrófico definitivo: los 4 criterios |
| Síndrome de anticuerpos antifosfolipídicos catastrófico probable: |
| Los 4 criterios, excepto la afección de sólo 2 órganos, sistemas o tejidos |
| Los 4, excepto la confirmación en una segunda determinación de aPL al menos 6 semanas después por muerte prematura |
| Criterios 1, 2 y 4 |
| Criterios 1, 3 y 4 y el desarrollo de la tercera trombosis después de la primera semana, pero antes de 1 mes, pese a la anticoagulación |
El SAAFC puede afectar potencialmente a cualquier órgano o sistema, incluida la piel. La lesión cutánea observada con mayor frecuencia es la livedo reticularis, pero también podemos encontrar ulceraciones, gangrena digital, hemorragias subungueales, trombosis venosa superficial, púrpura trombocitopénica, manifestaciones seudovasculíticas, necrosis cutánea extensa y anetoderma primario. Se ha descrito la necrosis superficial de la piel de predominio en miembros inferiores y nalgas, hasta en un 3% de los pacientes con SAAF8,9. Las lesiones cutáneas se observan con mayor frecuencia en el SAAFC, al caracterizarse éste por oclusiones microvasculares extensas que pueden afectar a múltiples órganos simultáneamente. Histológicamente, se trata de una trombosis de vasos pequeños con proliferación vascular y mínimos cambios inflamatorios3.
El SAAFC representa afortunadamente sólo el 1% de los casos de SAAF. Su mortalidad es de aproximadamente el 50%5,6,10. Son factores de mal pronóstico la edad mayor de 36 años, el diagnóstico de LES, la afección pulmonar, renal y adrenal, así como un número elevado de órganos afectados y la necesidad de hemodiálisis2. Las causas más frecuentes de muerte son la afección cerebral (27%), la afección cardíaca y las infecciones (20%). Se ha logrado un aumento de la supervivencia con el tratamiento combinado con anticoagulantes, glucocorticoides, recambio plasmático y/o inmunoglobulina iv11.
El tratamiento del SAAFC debe instaurarse tan pronto como se sospeche el diagnóstico, e incluye heparina no fraccionada intravenosa, con un bolo inicial de 5.000 U, seguido de perfusión continua a 1.500 U/h, con controles seriados del tiempo de tromboplastina parcial activada. Si el curso clínico es satisfactorio, se mantiene durante 7 a 10 días y posteriormente se sustituye por anticoagulantes orales, con la intención de mantener un INR entre 2,5 y 3,5. Desde el inicio se añade prednisona a dosis de 1 a 2mg/kg/día, precedida en casos graves de bolos intravenosos de 1g de metilprednisolona durante 3 días.
En caso de empeoramiento o situaciones de riesgo vital, se añade plasmaféresis durante 3 a 5 días por lo menos, inmunoglobulina intravenosa a dosis de 400mg/kg/día durante 5 días y en casos de ausencia de respuesta a lo anterior, ciclofosfamida6–8.