Existen varias guías de práctica clínica tanto nacionales como internacionales para el tratamiento del lupus eritematoso sistémico. No obstante, la mayoría de las guías disponibles no están diseñadas para población mexicana o solamente son para el manejo de manifestaciones específicas como nefritis lúpica o para algún estado fisiológico como el embarazo. El Colegio Mexicano de Reumatología se propuso elaborar unas guías de práctica clínica que conjuntaran la mayor parte de las manifestaciones de la enfermedad y que incluyeran adicionalmente pautas en situaciones controversiales como lo son la vacunación y el periodo perioperatorio. En el presente documento se presenta la «Guía de práctica clínica para el manejo del lupus eritematoso sistémico» propuesta por el Colegio Mexicano de Reumatología, que puede ser de utilidad principalmente a médicos no reumatólogos que se ven en la necesidad de tratar a pacientes con lupus eritematoso sistémico sin tener la formación de especialistas en reumatología. En esta guía se presentan recomendaciones sobre el manejo de manifestaciones generales, articulares, renales, cardiovasculares, pulmonares, neurológicas, hematológicas, gastrointestinales, respecto a la vacunación y al manejo perioperatorio.
There are national and international clinical practice guidelines for systemic lupus erythematosus treatment. Nonetheless, most of them are not designed for the Mexican population or are devoted only to the treatment of certain disease manifestations, like lupus nephritis, or are designed for some physiological state like pregnancy. The Mexican College of Rheumatology aimed to create clinical practice guidelines that included the majority of the manifestations of systemic lupus erythematosus, and also incorporated guidelines in controversial situations like vaccination and the perioperative period. The present document introduces the «Clinical Practice Guidelines for the Treatment of Systemic Lupus Erythematosus» proposed by the Mexican College of Rheumatology, which could be useful mostly for non-rheumatologist physicians who need to treat patients with systemic lupus erythematosus without having the appropriate training in the field of rheumatology. In these guidelines, the reader will find recommendations on the management of general, articular, kidney, cardiovascular, pulmonary, neurological, hematologic and gastrointestinal manifestations, and recommendations on vaccination and treatment management during the perioperative period.
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune de comportamiento clínico muy heterogéneo, caracterizada por remisiones y exacerbaciones. La incidencia y prevalencia ajustada por edad por 100.000 personas es de 5,5 (IC 95%: 5,0-6,1) y 72,8 (IC 95%: 70,8-74,8)1. No se tiene un registro nacional de casos en México, pero se sabe que existen diferencias sustanciales de la carga de la enfermedad en diferentes poblaciones y diferentes países2, por ejemplo, la población afroamericana tiene una incidencia y prevalencia de más de 2veces la de la población caucásica1. Aun entre poblaciones «hispánicas», que es como suele agruparse a los latinoamericanos en los estudios clínicos, existen importantes diferencias en la presentación de la enfermedad3.
Existen varias guías de práctica clínica (GPC) tanto nacionales como internacionales para el tratamiento del LES4-7, no obstante, la mayoría de las GPC disponibles no están diseñadas para población mexicana o solamente son para el manejo de manifestaciones específicas, como nefritis lúpica, o para algún estado fisiológico, como el embarazo. La existencia de guías nacionales facilita la incorporación de ciertas enfermedades a los planes nacionales de salud. Hasta el momento no existe en el país una propuesta de manejo para esta enfermedad que abarque a representantes de los principales sistemas de salud de forma global y estandarizada.
La enfermedad tiene características propias en los distintos grupos étnicos, tal como se ha informado en cohortes como LUMINA y GLADEL8,9. Los mestizos tienen formas graves, con mayor frecuencia de glomerulonefritis, mayor mortalidad y mayor daño acumulado. Asimismo, algunas manifestaciones, tales como las neuropatías desmielinizantes y la mielitis transversa, son más frecuentes en poblaciones latinoamericanas, si bien suelen responder mejor al tratamiento que las poblaciones caucásicas10,11. Se han publicado algunos estudios en pacientes mexicanos, en los que se evalúan variantes bioquímicas que pudieran estar relacionadas con la respuesta terapéutica12, así como terapias específicas de inducción por nefropatía lúpica13 o respuesta específica a fármacos biológicos14. Sin embargo, estos estudios tienen la debilidad de haber sido hechos en poblaciones cautivas, con un número reducido de participantes, por lo que no se pueden establecer peculiaridades generales de los pacientes mexicanos ni generalizar una recomendación con base en esa evidencia local.
Estos hechos justifican la elaboración de guías nacionales en un país en donde la mayoría de la población es mestiza y requiere acceso a sistemas públicos de salud para la obtención tanto de consulta médica como de tratamiento.
Con base en lo anterior, el Colegio Mexicano de Reumatología (CMR) se propuso elaborar una GPC que conjuntara la mayor parte de las manifestaciones de la enfermedad y que incluyera, adicionalmente, pautas en situaciones controversiales como lo son la vacunación y el periodo perioperatorio. Si bien las recomendaciones emitidas en esta GPC están basadas en evidencia científica, todas las guías tienen limitaciones para la toma de decisiones individuales, ya que cada paciente tiene características únicas y, por lo tanto, este documento, como su nombre lo dice, solo tiene la intención de ser una guía y de ninguna manera pretende sustituir o limitar el juicio clínico del médico. La publicación de esta GPC es el comienzo de un proceso de actualización continua que llevará a cabo el CMR cada 2 años o cuando sea pertinente a la luz de nueva evidencia. A manera de complemento de la presente guía se está preparando el informe de la evidencia que sustenta las recomendaciones, que será publicado más adelante.
Al desarrollar esta guía, nos propusimos enfocarnos en un rango amplio de pacientes. Para emitir las recomendaciones se tomaron en cuenta publicaciones de pacientes con LES y afección en todos los órganos y sistemas, con posibles comorbilidades. Los únicos 2casos que no se consideraron fueron la población pediátrica y el lupus en el embarazo porque el CMR ya cuenta con una guía al respecto5. Dado que la respuesta al tratamiento y la presentación de la enfermedad pueden diferir en distintos grupos étnicos, las recomendaciones fueron realizadas con población mexicana en mente. El contexto socioeconómico del país fue tomado en consideración en virtud de que el costo de algunos fármacos puede ser muy alto para pacientes no asegurados o derechohabientes o para las mismas instituciones de salud. Las recomendaciones que se presentan en esta guía, por lo tanto, son aplicables a pacientes mexicanos adultos no gestantes con LES.
Este documento fue realizado con el objetivo de proporcionar una guía lo más completa posible que sirviera de apoyo especialmente a médicos no reumatólogos que se ven en la necesidad de tratar a pacientes con LES sin tener la formación de especialistas en reumatología. Es común que médicos de atención primaria o de otras especialidades tengan que hacer frente al manejo de pacientes con LES debido al bajo número de reumatólogos en las instituciones de salud. Es importante resaltar que los pacientes con LES deben ser tratados por reumatólogos, pero, a falta de esta opción, esta guía puede proporcionar información útil basada en evidencia y servir de apoyo para la toma de decisiones en el tratamiento de estos pacientes. En esta guía se presentan recomendaciones sobre el manejo de manifestaciones generales, articulares, renales, cardiovasculares, pulmonares, neurológicas, hematológicas, gastrointestinales.
MetodologíaLos médicos reumatólogos que formaron el panel de expertos encargados de la realización de esta GPC fueron elegidos por la Junta Directiva del CMR con base en su expertise en el tratamiento del lupus. Se incluyó a reumatólogos senior de varios estados de la República Mexicana y se invitó a formar parte de los equipos a reumatólogos jóvenes que hubieran mostrado gran interés por participar en las actividades académicas del CMR.
Para la preparación de este documento se reunió por primera vez en la Ciudad de México en diciembre de 2016 al panel de expertos. En dicha reunión se definieron los grupos de trabajo y se planteó la metodología para la elaboración de este documento. Posteriormente a esta reunión se tuvieron 2reuniones presenciales en las que se revisó que se estuviera siguiendo la metodología propuesta y se presentaron los hallazgos encontrados en la literatura por parte de cada uno de los equipos. Adicionalmente, se tuvo comunicación vía electrónica constante. Los equipos, después de presentar sus resultados ante el resto de los panelistas, prepararon sus recomendaciones y las enviaron a la metodóloga que coordinó el trabajo, quien a su vez preparó un documento con todas las recomendaciones. Dicho documento fue sometido a consideración de todos los panelistas por vía electrónica y las recomendaciones finales se realizaron por consenso: no hubo desacuerdos entre los miembros de los equipos.
El autor responsable de la publicación sometió a consideración ante el Comité de Investigación los temas que debían ser abordados en la guía y en conjunto se tomó la decisición final de generar recomendaciones por tipo de manifestación e incluir recomendaciones de manejo general.
Búsqueda bibliográficaPara la realización de la búsqueda bibliográfica se generaron una serie de preguntas de investigación para el manejo general de la enfermedad y para cada una de las manifestaciones de la enfermedad. Cada pregunta de investigación derivó en una o más de una búsqueda, dependiendo de su complejidad. Se utilizó la metodología PICO, que conlleva la realización de búsquedas indentificando claramente la población (P), la intervención (I), el comparador (C) y el desenlace (O). En resumen, la población blanco fueron pacientes con LES, las intervenciones y comparadores fueron todos los tratamientos que se presentan en el presente documento y los desenlaces fueron múltiples, tomando en consideración no solo los desenlaces más relevantes clínicamente como prevención del daño renal o disminución de su progresión, remisión tras la inducción, prevención de recaídas, resolución, control o disminución de las manifestaciones de la enfermedad, sino también los relevantes para los pacientes, como fatiga y disminución del dolor. Las búsquedas se realizaron del año 2000 al año 2016, se limitó a adultos y, dada la escasez de literatura científica, no se limitó la búsqueda a publicaciones con poblaciones mexicanas, si bien los artículos con esta población tuvieron más peso en la generación de las recomendaciones. A falta de evidencia directa, muchas de las recomendaciones se realizaron con base en resultados de otras poblaciones.
Cada equipo recibió de parte de la responsable metodológica los mecanismos de búsqueda PICO correspondientes al tema que les fue asignado. Cada uno realizó la revisión de los artículos y, con base en la revisión de los artículos relacionados y la bibliografía citada en las publicaciones de interés, completaron la búsqueda. Los integrantes de los equipos verificaron que los artículos que serían utilizados para generar las recomendaciones contestaran las preguntas de investigación y cumplieran con los criterios de selección determinados con anterioridad por la Junta Directiva del CMR. Los desacuerdos en los equipos se resolvieron por medio de diálogo entre los miembros. Una vez revisada toda la literatura científica, se procedió a la redacción de las recomendaciones. A diferencia de la mayoría de las GPC mexicanas, que han utilizado los niveles de evidencia de Shekelle et al.15, para la redacción de las recomendaciones de esta GPC, de la calificación del grado de evidencia y de la fuerza de las recomendaciones, se utilizó el sistema GRADE16, que es el sistema que recomiendan en la actualidad los mismos autores que desarrollaron los niveles de evidencia con los que se había trabajado en los años previos en la nueva guía para el desarrollo de GPC17. El método de GRADE ha mostrado ser superior a los otros sistemas de evaluación de recomendaciones de GPC18 y ya ha sido adoptado por la colaboración Cochrane.
Calidad de la evidenciaLa calidad del cuerpo de la evidencia utilizado para generar las recomendaciones se clasificó como muy baja, baja, moderada y alta, según sus características. La opinión de expertos no se consideró evidencia, por lo que se clasificó como evidencia de muy baja calidad. La asignación de calidad alta de evidencia significa que es poco probable que estudios futuros cambien la confianza en el efecto estimado; calidad moderada implica que es probable que estudios futuros tengan un impacto importante en la confianza del efecto estimado y podrían cambiar el efecto estimado; calidad baja implica que es muy probable que investigaciones posteriores tengan un impacto importante en la confianza en el efecto estimado y es probable que cambie el efecto estimado y, por último, calidad muy baja implica que cualquier efecto estimado es muy incierto19.
Recomendación fuerte o débil o recomendación de buena prácticaUna vez realizada la evaluación de la calidad de la evidencia, se determinó si las recomendaciones eran fuertes o débiles. Se dice que cuando se emite una recomendación fuerte existe certeza de que las consecuencias deseables de la intervención sobrepasan sustancialmente las consecuencias indeseadas; por el contrario, en las recomendaciones débiles existe incertidumbre de que las consecuencias deseables de la intervención sobrepasen sustancialmente las consecuencias indeseadas o que sean similares19. Las recomendaciones que fueron consideradas importantes pero no pudieron ser calificadas en cuanto a calidad de evidencia ni fuerza de la recomendación fueron clasificadas como «de buenas prácticas»20.
Resultados y discusiónTratamiento del lupus eritematoso sistémicoNo hay un tratamiento general para el LES debido a lo heterogéneo de su comportamiento y el manejo debe individualizarse con base en las características del paciente y la actividad de la enfermedad e incluso con la posibilidad de acceso a algunos fármacos como las terapias biológicas. El tratamiento se basa en el uso de glucocorticoides (GC), antiinflamatorios no esteroideos (AINE), antimaláricos y diversos inmunosupresores. Con estos tratamientos se ha mejorado notablemente el pronóstico de los pacientes, aunque pueden ser frecuentes las recaídas, así como, en algunos casos, la falla terapéutica. Es necesario vigilar la toxicidad de dichos fármacos. El objetivo del tratamiento es alcanzar la remisión21 (ausencia de actividad clínica percibida) o, por lo menos, llevar al paciente a la actividad mínima posible22,23 que permita suspender los inmunosupresores y los GC o, por lo menos, mantenerlos en las dosis más bajas posibles para así evitar los efectos adversos asociados a ellos. Existen pacientes refractarios al tratamiento, que son aquellos que no responden al tratamiento estándar o que requieren una dosis inaceptable de GC para mantener la remisión24. Antes de considerar que un paciente es refractario, se debe revisar cómo es su apego terapéutico y la presencia de daño acumulado que no sea susceptible de mejorar con el tratamiento25,26.
Para efectos de estas recomendaciones, se entiende como lupus grave cuando los pacientes son tratados debido a manifestaciones potencialmente fatales como nefritis lúpica, afección neuropsiquiátrica, anemia hemolítica (Hb < 7g/dL), trombocitopenia (<30.000 plaquetas)27, vasculitis, hemorragia pulmonar, miocarditis, neumonitis lúpica, miositis graves, enteritis lúpica, pancreatitis lúpica, hepatitis lúpica, enteropatía perdedora de proteínas, queratitis grave, vasculitis retiniana, escleritis grave, neuritis óptica. Lupus no grave se entiende como afección a órgano menor (mucocutáneo, articular, serosas) y que no amerite tratamiento para manifestaciones de la enfermedad28.
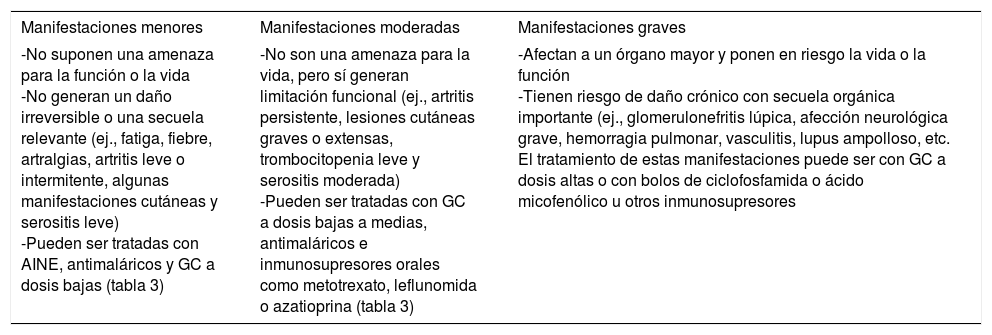
Como ya se mencionó, el tratamiento de LES debe ser individualizado y dependerá del tipo de manifestación, del o de los órganos o sistemas involucrados y de la gravedad de la enfermedad26. Las clasificaciones de las manifestaciones de acuerdo con su gravedad se encuentran en la tabla 1.
Clasificación de las manifestaciones clínicas en el LES con base en el impacto que tienen sobre el paciente25,26
| Manifestaciones menores | Manifestaciones moderadas | Manifestaciones graves |
|---|---|---|
| -No suponen una amenaza para la función o la vida -No generan un daño irreversible o una secuela relevante (ej., fatiga, fiebre, artralgias, artritis leve o intermitente, algunas manifestaciones cutáneas y serositis leve) -Pueden ser tratadas con AINE, antimaláricos y GC a dosis bajas (tabla 3) | -No son una amenaza para la vida, pero sí generan limitación funcional (ej., artritis persistente, lesiones cutáneas graves o extensas, trombocitopenia leve y serositis moderada) -Pueden ser tratadas con GC a dosis bajas a medias, antimaláricos e inmunosupresores orales como metotrexato, leflunomida o azatioprina (tabla 3) | -Afectan a un órgano mayor y ponen en riesgo la vida o la función -Tienen riesgo de daño crónico con secuela orgánica importante (ej., glomerulonefritis lúpica, afección neurológica grave, hemorragia pulmonar, vasculitis, lupus ampolloso, etc. El tratamiento de estas manifestaciones puede ser con GC a dosis altas o con bolos de ciclofosfamida o ácido micofenólico u otros inmunosupresores |
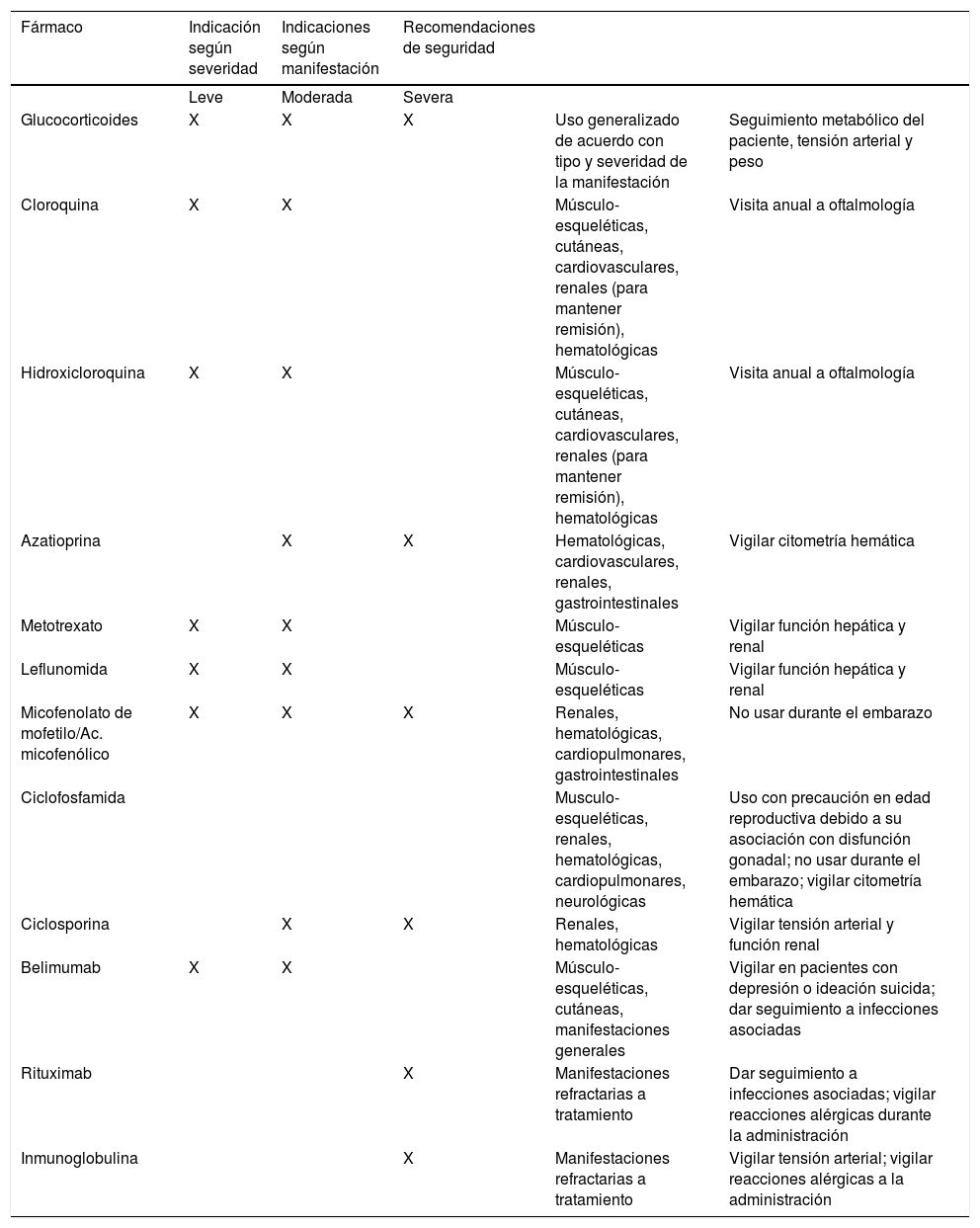
Las recomendaciones basadas en evidencia para cada tipo de manifestación que forman parte de la presente GPC para el manejo de LES se encuentran en los cuadros de recomendaciones de cada manifestación. Adicionalmente, en el siguiente apartado y en la tabla 2 se presentan algunas generalidades sobre los grupos de fármacos más utilizados en el tratamiento de LES.
Generalidades del uso de fármacos para el tratamiento de LES
| Fármaco | Indicación según severidad | Indicaciones según manifestación | Recomendaciones de seguridad | ||
|---|---|---|---|---|---|
| Leve | Moderada | Severa | |||
| Glucocorticoides | X | X | X | Uso generalizado de acuerdo con tipo y severidad de la manifestación | Seguimiento metabólico del paciente, tensión arterial y peso |
| Cloroquina | X | X | Músculo-esqueléticas, cutáneas, cardiovasculares, renales (para mantener remisión), hematológicas | Visita anual a oftalmología | |
| Hidroxicloroquina | X | X | Músculo-esqueléticas, cutáneas, cardiovasculares, renales (para mantener remisión), hematológicas | Visita anual a oftalmología | |
| Azatioprina | X | X | Hematológicas, cardiovasculares, renales, gastrointestinales | Vigilar citometría hemática | |
| Metotrexato | X | X | Músculo-esqueléticas | Vigilar función hepática y renal | |
| Leflunomida | X | X | Músculo-esqueléticas | Vigilar función hepática y renal | |
| Micofenolato de mofetilo/Ac. micofenólico | X | X | X | Renales, hematológicas, cardiopulmonares, gastrointestinales | No usar durante el embarazo |
| Ciclofosfamida | Musculo-esqueléticas, renales, hematológicas, cardiopulmonares, neurológicas | Uso con precaución en edad reproductiva debido a su asociación con disfunción gonadal; no usar durante el embarazo; vigilar citometría hemática | |||
| Ciclosporina | X | X | Renales, hematológicas | Vigilar tensión arterial y función renal | |
| Belimumab | X | X | Músculo-esqueléticas, cutáneas, manifestaciones generales | Vigilar en pacientes con depresión o ideación suicida; dar seguimiento a infecciones asociadas | |
| Rituximab | X | Manifestaciones refractarias a tratamiento | Dar seguimiento a infecciones asociadas; vigilar reacciones alérgicas durante la administración | ||
| Inmunoglobulina | X | Manifestaciones refractarias a tratamiento | Vigilar tensión arterial; vigilar reacciones alérgicas a la administración |
Los GC son la piedra angular del tratamiento en LES. Es frecuente que se administren bolos de GC que, para fines de este documento y a menos que sea especificado de otra manera, serán definidos como la administración de dosis elevadas de esteroide por vía intravenosa. Generalmente se administra 1g de succinato de metilprednisolona en un lapso de 2h, administrando en promedio 3 bolos, uno cada día, por 3 días consecutivos. Si bien no hay un consenso sobre recomendaciones estandarizadas, en pacientes tratados con GC se deben evaluar las comorbilidades y factores de riesgo para eventos adversos y tratarlos si está indicado. Durante el tratamiento el paciente debe ser monitorizado en cuanto a peso corporal, presión sanguínea, edema periférico, insuficiencia cardíaca, lípidos y glucosa séricos y evaluación oftalmológica. Si el paciente tiene una dosis > 7,5mg/día de prednisona y requiere tratamiento por más de 3 meses, se deberá iniciar tratamiento con suplemento de calcio y vitamina D. El uso de antirresortivos debe valorarse con base en factores de riesgo del paciente29. Las consideraciones sobre su uso en el esquema de inducción a la remisión y de mantenimiento se presentan en la tabla 3.
Consideraciones sobre el uso de glucocorticoides en el en el esquema de inducción a la remisión y de mantenimiento de LES
| Inducción a la remisión | Mantenimiento |
|---|---|
| La dosis inicial de GC (prednisona o equivalente) depende de la actividad del LES -Actividad baja: dosis bajas (<7,5 mg/día) -Actividad moderada: dosis intermedias (7,5-30 mg/día) -Actividad grave: dosis altas (30-100 mg/día o bolos con dosis >250 mg/día, habitualmente intravenosos de 1 a 5 días)45,46 | Una vez que se logre la reducción de la actividad o la remisión, iniciar esquema de disminución. Habitualmente se inicia después de 6 semanas de uso de dosis altasa -Disminuir 10-20% cada 7-15 días hasta llegar a 30 mg/día -Posteriormente, disminuir 10% cada 15 días hasta la suspensión o continuar con dosis de mantenimiento (<7,5 mg/día)29,46 |
Los antimaláricos se han usado en el tratamiento del LES desde el siglo XIX y, aunque hay pocos estudios dirigidos a demostrar su eficacia, la evidencia actual hace que se recomiende el uso de hidroxicloroquina (HCQ) (de 200 a 400mg al día) o cloroquina (de 150 a 300mg al día) (no hay evidencia de que las dosis más altas sean más efectivas que las bajas y se deja al juicio del clínico la dosis oportuna). Los antimaláricos tienen efectos fotoprotectores, hipolipidemiantes, antiangiogénicos, antitrombóticos y, además, inhiben la función del factor activador de células B y de la fosfolipasa A2, lo que permite que estén indicados en el tratamiento de lupus cutáneo, de LES con actividad leve a moderada, como tratamiento concomitante para prevenir recaídas y el daño a órganos mayores30. Siempre que no haya contraindicaciones para el uso de antimaláricos, se recomiendan en todos los pacientes con LES. El uso de HCQ se asocia con una sobrevida libre de daño mayor a la de los que no la usaron (45,1 vs. 26,5%; p < 0,001) y se correlaciona de forma negativa con el daño acumulado medido mediante SLICC (r = −0,22; p = 0,015)31, disminuyendo la probabilidad de daño renal acumulado (HR 0,68; IC 95%: 0,53-0,93)32 (OR 0,38; IC 95%: 0,25-0,58)33 en quienes los usan en comparación con los que no. También son útiles en la prevención de la morbilidad por ateroesclerosis y en el manejo del síndrome de anticuerpos antifosfolípidos asociado a LES34,35. Se ha reportado que la suspensión de HCQ aumenta el riesgo relativo de recaída 2,5 veces (IC 95%: 1,08-5,58) en un periodo de 6 meses36. Para el monitoreo de eventos adversos debe realizarse una evaluación oftalmológica basal y, posteriormente, anual.
Antiinflamatorios no esteroideosLos AINE se recomiendan para el tratamiento de dolor e inflamación en enfermedades reumáticas. En el consenso del uso de AINE de la Sociedad Española de Reumatología y el CMR se recomienda individualizar el uso con base en la variabilidad en la respuesta, los factores de riesgo de toxicidad gastrointestinal, cardiovascular, renal y hepática de cada paciente. No es posible considerar que un AINE sea mejor que otro (tanto tradicionales como COXIBS). Hay que evitar el uso simultáneo de más de un AINE, pues esto solo aumenta la toxicidad, pero no incrementa la eficacia (efecto de techo). En procesos agudos, se deben usar durante el menor tiempo posible a la dosis máxima recomendada y, en procesos crónicos, se deben usar a la dosis mínima necesaria para mantener la respuesta clínica deseada. Periódicamente se deben evaluar los factores de riesgo, efectos adversos y la indicación de su uso. El uso concomitante con GC aumenta la toxicidad gastrointestinal. Se deben evaluar las interacciones con otros fármacos como antihipertensivos, hipoglucemiantes, anticoagulantes orales, etc.37.
InmunosupresoresLa mayor parte de los reumatólogos está de acuerdo con el uso de inmunomoduladores para el LES moderado a grave durante un periodo de terapia inmonosupresora intensa conocida como terapia de inducción, seguido por un periodo más largo de terapia de mantenimiento. Los 3principales objetivos de la terapia de inducción son detener el daño, recuperar la función y controlar la actividad inmunológica. La terapia de mantenimiento se usa para consolidar la remisión y prevenir las recaídas con un programa de tratamiento que tenga un bajo riesgo de complicaciones y sea el más conveniente para el paciente, bajo el concepto actual de «tratamiento personalizado». Los fármacos tradicionalmente utilizados para estos objetivos son los siguientes:
- -
Ácido micofenólico (MMF): la dosis varía ampliamente dependiendo del órgano involucrado y de la gravedad de la manifestación; esta puede variar de 1 a 3g. Los eventos adversos que deben vigilarse son citopenias, alteración en PFH, diarrea y teratogenicidad38-41.
- -
Ciclofosfamida (CFM): la dosis puede variar de 500 a 1.000mg/m2 de superficie corporal. Los eventos adversos que deben vigilarse son citopenias, infertilidad teratogenicidad, trastornos mieloproliferativos, cistitis hemorrágica y cáncer de vejiga40.
- -
Azatioprina: la dosis varía entre 1 y 3mg/kg/día y los eventos adversos que deben vigilarse son mielosupresión, hepatotoxicidad, trastornos linfoproliferativos y teratogenicidad41,42.
- -
Metotrexato: puede utilizarse en dosis de 7,5 a 25mg por vía oral o parenteral y los eventos adversos que deben vigilarse son mielosupresión, hepatotoxicidad, neumonitis, alopecia, estomatitis y teratogenicidad39-42.
- -
Ciclosporina: se utiliza principalmente en nefropatía resistente y sus principales eventos adversos son hiperplasia gingival, hipertensión arterial, hirsutismo, insuficiencia renal y anemia43.
Otros fármacos que se utilizan en el LES son los biológicos belimumab y rituximab. Belimumab se emplea en manifestaciones leves a moderadas como artritis, serositis o si hay afectación cutánea (ADNdc+ o consumo de C3/C4). Los eventos adversos más comunes con este fármaco biológico es la depleción de linfocitos B. Rituximab también se utiliza cuando hay afección articular resistente a tratamiento convencional, hematológica, del sistema nervioso central o en nefritis resistente, y sus principales eventos adversos son alergia, enfermedad del suero y leucoencefalopatía multifocal progresiva44.
Recomendaciones basadas en la revisión de la evidencia científicaLos siguientes cuadros muestran las recomendaciones producto de la revisión de la literaura y el trabajo en consenso de los participantes del grupo de trabajo que suscribe la presente GPC. En la tabla 4 se presentan las recomendaciones para el manejo de las manifestaciones generales de LES y en las tablas 5-10 se presentan las recomendaciones para el tratamiento de manifestaciones renales, cardiovasculares, pulmonares, neurológicas, hematológicas y gastrointestinales.
Recomendaciones para el manejo de las manifestaciones generales de LES
| Fatiga, dolor y fiebre |
|---|
| –No se propone el uso de dehidroepiandrosterona ni aceite de pescado para el manejo de la fatiga47-49. (Calidad de la evidencia moderada, recomendación débil) –Se propone considerar el uso de colecalciferol 50.000 UI/semana para el manejo de la fatiga50. (Calidad de la evidencia moderada, recomendación débil) –Por su costo no debería considerarse el uso de abatacept, belimumab ni rituximab para el manejo de primera línea de fatiga51-56. (Calidad de la evidencia alta, recomendación fuerte) –No existe evidencia suficiente para recomendar el uso de acupuntura, fototerapia, abordaje psicológico ni dieta en el tratamiento de dolor y fatiga en pacientes con LES48,49,57. (Calidad de la evidencia baja, recomendación débil) –El ejercicio tanto aeróbico como isotónico por al menos 15 min y 3 veces por semana es útil para disminuir la fatiga (medida por FSS) en pacientes con LES sin actividad de la enfermedad48,58,59. (Calidad de la evidencia moderada, recomendación fuerte) |
| Diagnóstico diferencial de fiebre |
| –Es necesario primero descartar infección y efecto tóxico de medicamentos, respectivamente, antes de atribuir la manifestación a actividad de la enfermedad. Para determinar si la fiebre está asociada a actividad del LES se recomienda tomar en consideración que la fiebre por actividad suele cursar con niveles bajos de complemento, elevación de títulos de anti-ADN y elevación discreta de la PCR57. (Calidad de la evidencia moderada, recomendación fuerte). En pacientes sin datos iniciales de proceso infeccioso, se recomienda el uso de GC en dosis medias a altas (prednisona de 20 a 40mg al día con respuesta en 1 a 5 días); si en 72 h no hay respuesta considerar una etiología diferente59,60. (Calidad de la evidencia moderada, recomendación fuerte) |
| Biopsia |
| –Siempre que sea posible y no exista una contraindicación formal, deberá realizarse biopsia a los pacientes con datos sugestivos de nefritis lúpica para clasificar el tipo de glomerulonefritis y evaluar datos de actividad, cronicidad, cambios vasculares y tubulares7,61,62. (Calidad de la evidencia alta, recomendación fuerte) –En caso de recaída en la que se sospeche viraje de nefritis, o bien nefropatía cicatricial, debe plantearse la posibilidad de repetir la biopsia7,63,64. (Calidad de la evidencia moderada, recomendación débil) |
| Vacunación |
| –Se recomienda registrar cuáles vacunas ha recibido el paciente con diagnóstico de LES y, de ser posible, la fecha de aplicación al momento del primer contacto del paciente con el especialista en reumatología. (Buena práctica) –Se recomienda establecer el grado de actividad de la enfermedad utilizando el SLEDAI (Índice de Actividad de Lupus Eritematoso Sistémico), así como el tratamiento inmunosupresor vigente. (Buena práctica) –En pacientes con LES a quienes se les aplican vacunas, se recomienda la vigilancia de eventos temporalmente asociados a su aplicación, tales como hipertermia, eritema y dolor en el sitio de aplicación, que aparecen en las primeras 48 h65. (Calidad de la evidencia baja, recomendación fuerte) –Se recomienda la inmunización contra virus de influenza tanto estacional como epidémica: –En pacientes con LES en remisión (SLEDAI 0) o con actividad leve (SLEDAI 2 a 4) a moderada (SLEDAI 4 a 8)66-80. (Calidad de la evidencia alta, recomendación fuerte) –Cuando la dosis equivalente de prednisona sea menor a 20 mg/día69. (Calidad de la evidencia moderada, recomendación fuerte) –En pacientes con LES que reciben tratamiento con MMF, metotrexato, azatioprina o CFM, a pesar de que estos pacientes pueden presentar una menor respuesta69,72,73,76. (Calidad de la evidencia moderada, recomendación fuerte) –Se recomienda la aplicación de la vacuna 23-valente contra la bacteria de neumococo en pacientes con LES en remisión o con actividad leve a moderada78,81-84. (Calidad de la evidencia alta, recomendación fuerte) –Se propone aplicar la vacuna cuadrivalente contra virus de papiloma humano en pacientes con LES: –Que tienen menos de 25 años de edad, sin antecedentes de trombofilias y sin otros factores de riesgo para trombosis (inmovilidad, tabaquismo, uso de hormonales)85. (Calidad de la evidencia moderada, recomendación débil) –Con dosis de prednisona menores a 10 mg/día85,86. (Calidad de la evidencia moderada, recomendación débil) –Con inmunosupresores (MMF) a pesar de que estos pacientes pueden presentar una menor respuesta85. (Calidad de la evidencia moderada, recomendación débil) –Se recomienda la aplicación de la vacuna y refuerzo contra el virus de hepatitis B en pacientes con LES en remisión o con actividad leve (SLEDAI 2 a 4) a moderada (SLEDAI 4 a 8)87. (Calidad de la evidencia moderada, recomendación fuerte) –Se recomienda la aplicación de la vacuna contra tétanos y Haemophilus influenza B y sus refuerzos en pacientes con LES: –En remisión, actividad leve (SLEDAI 2 a 4) a grave (SLEDAI >8)77,78. (Calidad de la evidencia moderada, recomendación fuerte) –Que reciben tratamiento con metotrexato, azatioprina o CFM, a pesar de que estos pacientes pueden presentar una menor respuesta78. (Calidad de la evidencia moderada, recomendación débil) –No se recomienda la aplicación de vacunas de virus vivos atenuados como la vacuna contra herpes zóster en pacientes con LES con actividad de la enfermedad88,89. (Calidad de la evidencia baja, recomendación débil) |
| Recomendaciones perioperatorias |
| - En pacientes programados para cirugía ortopédica u otros tipos de cirugía con riesgos similares como laparoscopias (funduplicatura, apendicectomía, colecistectomía) se recomienda90-92 (calidad de la evidencia moderada, recomendación fuerte): Previo a la cirugía la calificación de la escala de SLEDAI se encuentre entre 0 y 3 para poder realizar la cirugía Los pacientes con riesgo quirúrgico ASA IV o V no sean operados hasta que sus condiciones generales mejoren Los pacientes con LES antes de ser operados tengan cultivos de orina y de orofaringe negativos sin ningún síntoma ni signo de infección activa - Se propone suspender los AINE al menos 3 a 4 veces su vida media o bien 2a 3días antes de la cirugía ortopédica (sobre todo la que involucra tendones y tejidos blandos) y reiniciar solo cuando la cicatrización ha ocurrido (6 semanas al menos)93. (Calidad de la evidencia baja, recomendación débil) - En pacientes que reciben tratamiento con GC que serán intervenidos quirúrgicamente, se propone administrar de la siguiente manera de acuerdo con el tipo de cirugía94. (Calidad de la evidencia baja, recomendación débil): 25mg de hidrocortisona (o la dosis equivalente de GC), dosis única el día de la cirugía en cirugía menor (por ejemplo, plastia de pared abdominal, colonoscopia) De 50 a 75mg de hidrocortisona (o la dosis equivalente de GC) el día de la cirugía y a las 24 h regresar a la dosis usual en cirugía moderada (colecistectomía, hemicolectomia) De 100 a 150mg de hidrocortisona (o la dosis equivalente de GC) el día de la cirugía y a las 24 h regresar a la dosis usual en cirugía mayor (cirugía cardiotorácica mayor, Whipple) - Se recomienda realizar el manejo de los fármacos que alteran la hemostasia de la siguiente manera95-97 (calidad de la evidencia moderada, recomendación débil): Ácido acetilsalicílico y clopidogrel: suspender 7 días antes de la cirugía y reiniciar de 24 a 48 h posteriores al evento Dipiridamol: suspender de 7 a 14 días antes de la cirugía Anticoagulantes directos DOAC (rivaroxaban, dabigatran y apixaban): suspender de 24 a 48 h antes de la cirugía Heparina no fraccionada: suspender de 4 a 6 h previas a la cirugía Heparina de bajo peso molecular: suspender al menos de 12 a 18 h previas al evento quirúrgico y reiniciar 48 a 72 h posteriores al evento Warfarina: suspender 5 días antes de la cirugía. Para cirugía electiva, se propone que los pacientes que utilicen warfarina tengan un international normalized ratio menor a 1,5 international normalized ratio INR de más de 1,8 se recomienda aplicar 1mg de vitamina K intravenosa95-97. (Calidad de la evidencia moderada, recomendación débil) - En caso de cirugía de urgencia se recomienda aplicar 5mg de vitamina K intravenosa o plasma fresco congelado, aplicar de inicio 2 unidades de Protombinex-HT95-97. (Calidad de la evidencia moderada, recomendación débil) - Con relación a los pacientes que no usan anticoagulante y que van a requerir cirugía mayor, se propone la tromboprofilaxis con heparina de bajo peso molecular 12 h antes de la cirugía y extender hasta 35 días después95-97. (Calidad de la evidencia moderada, recomendación débil) - En pacientes con lupus grave que sean intervenidos con cirugía ortopédica (como cadera y rodilla) se recomienda continuar la dosis actual de MMF, azatioprina, ciclosporina y tacrolimus98. (Calidad de la evidencia baja, recomendación débil) - En pacientes con lupus no grave que sean operados mediante cirugía ortopédica (como cadera y rodilla), se recomienda suspender el MMF, azatioprina, ciclosporina y tacrolimus una semana antes de la cirugía y reiniciar 5 días después, en ausencia de infección o complicaciones en la cicatrización98,99. (Calidad de la evidencia baja, recomendación débil) - Se recomienda continuar la dosis actual de metotrexato, HCQ, antimaláricos, sulfasalazina durante el perioperatorio98,99. (Calidad de la evidencia baja, recomendación débil) - En cirugía de cadera, se recomienda administrar antibióticos de amplio espectro a dosis convencional un día antes de la cirugía y continuar 5 a 7 días después de la cirugía92. (Calidad de la evidencia baja, recomendación débil) - En pacientes que utilicen rituximab, se recomienda programar la cirugía en el mes 7 posterior a su aplicación99. (Calidad de la evidencia baja, recomendación débil) - En pacientes que utilicen belimumab, se recomienda programar la cirugía en la semana 5 posterior a su aplicación99. (Calidad de la evidencia baja, recomendación débil) |
Recomendaciones para manifestaciones renales
| Nefritis en pacientes mexicanos (latinos, mesoamericanos) |
|---|
| –En esta población se recomienda tratamiento de inducción a la remisión con MMF (2 a 3 g/día) o CFM (1 g/m2 de superficie corporal por mes)100,101. (Calidad de la evidencia moderada, recomendación fuerte) |
| Nefritis I y II |
| –Se recomienda el tratamiento con inmunosupresor en el caso de nefritis I y II que curse con deterioro de la función renal, sedimento activo o proteinuria ≥1 g/día102-104. (Calidad de la evidencia baja, recomendación débil) –Para el tratamiento de la nefritis I o II, valorando toxicidad/beneficio, se podría usar azatioprina (de 1 a 2 mg/kg/día), MMF (de 1 a 2 g/día) o CFM (de0,750 a 1 g/m2 de superficie corporal por mes), aunado a GC, en dosis medias (0,5 g/kg prednisona) con reducción gradual, por un periodo mínimo de 6 meses103. (Calidad de la evidencia baja, recomendación débil) |
| Tratamiento de inducción para nefritis III/IV y V con componente proliferativo |
| –Los pacientes con nefritis III/IV y V con componente proliferativo requieren un esquema de tratamiento de inducción a la remisión que puede consistir en MMF (2 a 3 g/día) o CFM (bolos mensuales de 1 g/m2 superficie corporal o dosis reducida de acuerdo con Eurolupus), aunado a esteroides en reducción gradual, por un periodo mínimo de 6 meses105-108. (Calidad de la evidencia alta, recomendación fuerte) –En caso de no respuesta a estos esquemas, se recomienda optar por el uso de rituximab, tacrolimus, azatioprina o terapia combinada con diferentes blancos terapéuticos107,109-113. (Calidad de la evidencia moderada, recomendación fuerte) –Los GC deben usarse en bolos (1g metilprednisolona por 3 días) o por vía oral (de 0,5 a 1 g/kg de prednisona) como tratamiento inicial concomitante, con reducción gradual7. (Calidad de la evidencia moderada, recomendación fuerte) |
| Nefritis tipo V sin componente proliferativo |
| –Se debe considerar el uso de MMF (de 2 a 3 g/día) o azatioprina (de 1 a 3 mg/kg)100,112,115. (Calidad de la evidencia alta, recomendación fuerte) –Se puede considerar el uso de tacrolimus, ciclosporina A, ciclofosfamida o rituximab en pacientes refractarios a tratamiento110,116,117. (Calidad de la evidencia moderada, recomendación débil) |
| Terapia de mantenimiento para nefritis III/IV y V con componente proliferativo |
| –Se debe considerar el uso de MMF (de 2 a 3 g/día) o azatioprina (de 1 a 3 mg/kg/día) a largo plazo (18 meses como mínimo de seguimiento)114,118,119. (Calidad de la evidencia alta, recomendación fuerte) –En pacientes con intolerancia a MMF o azatioprina se puede considerar el uso de CFM trimestral, tacrolimus, ciclosporina A o rituximab110. (Calidad de la evidencia moderada, recomendación débil) |
| Nefritis rápidamente progresiva/con medias lunas celulares |
| –Se recomienda manejo de inducción con CFM 750 a 1 g/m2 de superficie corporal mensual, o bien, MMF (de 2 a 3 g/día por 6 meses). Ambas opciones con administración de bolos de metilprednisona 1 g/día por 3 días o prednisona en dosis altas (1 g/kg/día con reducción gradual según evolución)120,121. (Calidad de la evidencia moderada, recomendación fuerte) –Se recomienda tacrolimus en dosis de 0,1 a 0,15 mg/kg/día vía oral en 2dosis divididas, titulado para mantener los niveles mínimos de 6 a 8 ng/ml por 12 h, debiendo ser considerado como tratamiento de inducción alternativo a CF IV o MMF121. (Calidad de la evidencia moderada, recomendación fuerte) –Puede considerarse el uso de rituximab122,123 o terapia dirigida a diferentes blancos terapéuticos124 en el manejo de casos refractarios, valorando riesgo sobre beneficio. (Calidad de la evidencia baja, recomendación débil) –El tratamiento de mantenimiento puede ser con MMF (de 2 a 3 g/día), azatioprina (de 2 a 3 mg/kg/día) y prednisona en dosis de reducción114. (Calidad de la evidencia baja, recomendación fuerte) |
| Manejo adyuvante |
| –Se recomienda control de peso en pacientes obesos debido a los beneficios para evitar la progresión de la enfermedad renal y control de la presión arterial125. (Calidad de la evidencia alta, recomendación fuerte) –Se recomienda el uso de IECA y ARAII como antiproteinúricos125,126. (Calidad de la evidencia alta, recomendación fuerte) –Se recomienda el control estricto de la presión arterial con metas por debajo de 130/80mmHg y control de otros factores de riesgo cardiovascular como tabaquismo125,127. (Calidad de la evidencia alta, recomendación fuerte) –Se recomienda el control de la dislipidemia, con metas de colesterol LDL < 100 mg/dl y triglicéridos < 150 mg/dl125. (Calidad de la evidencia moderada, recomendación fuerte) –Se recomienda HCQ 5mg/kg/día de forma permanente para disminuir la probabilidad de recaída renal128-130 y por sus beneficios sobre la dislipidemia131. (Calidad de la evidencia alta, recomendación fuerte) |
| Vigilancia periódica de la respuesta |
| –El monitoreo de la respuesta al tratamiento de la nefritis lúpica debe individualizarse y se acepta que las herramientas más útiles para ello son el análisis del sedimento urinario, proteinuria en 24 h o el cociente Pr/Cr, creatinina sérica, complemento y anticuerpos anti-–ADN doble cadena103,125. (Calidad de la evidencia alta, recomendación fuerte) –Se recomienda vigilancia mensual durante el periodo de inducción a remisión y trimestral para el mantenimiento103,132. (Calidad de la evidencia alta, recomendación fuerte) |
| Tratamiento de las recaídas |
| Se recomienda repetir tratamiento de inducción a la remisión previamente eficaz125. (Calidad de la evidencia moderada, recomendación fuerte) |
| Manejo con terapia sustitutiva y trasplante renal |
| –En pacientes con insuficiencia renal crónica por nefritis lúpica, se recomienda el trasplante renal como la mejor opción de tratamiento a largo plazo133. (Calidad de la evidencia alta, recomendación fuerte) –Se recomienda la hemodiálisis como primera opción de terapia sustitutiva en pacientes con insuficiencia renal crónica por nefritis lúpica, ya que la diálisis peritoneal se ha asociado a mayor número de complicaciones y mortalidad por los inmunosupresores134. (Calidad de la evidencia moderada, recomendación fuerte) |
| Nefritis lúpica en pacientes deseando embarazo |
| –Se recomienda que cualquier mujer que desee un embarazo se encuentre en remisión de la enfermedad por lo menos 6 meses antes de concebir135. (Calidad de la evidencia alta, recomendación fuerte) –No se recomienda el embarazo si la creatinina está por arriba de 2,8 mg/dl o existe evidencia clara de actividad136. (Calidad de la evidencia alta, recomendación fuerte) –En pacientes con nefritis lúpica recomendamos el cambio de medicamentos inmunosupresores y antihipertensivos a aquellos permitidos en el embarazo para el mantenimiento de la remisión y para evitar recaídas5,137. (Calidad de la evidencia alta, recomendación fuerte) |
Recomendaciones para manifestaciones cardiovasculares
| Pericarditis |
|---|
| –AINE: En los casos de pericarditis leve, aguda o crónica, con o sin derrame, se recomienda el uso de aspirina (500mg vía oral cada 12h) o indometacina (50mg cada 12h vía oral) o ibuprofeno (600mg cada 8h vía oral) hasta la mejoría de los síntomas clínicos26,138. (Calidad de la evidencia baja, recomendación débil) –Glucocorticoides: En el caso de las pericarditis agudas o crónicas con derrame pericárdico, se recomienda el uso de prednisona (0,5 mg/kg/día) en pacientes cuya manifestación inicial sea pericarditis de leve a moderada. En el caso de pericarditis grave o constrictiva se recomiendan bolos de metilprednisolona (1 g/día por 3 días)139-143. (Calidad de la evidencia moderada, recomendación fuerte) –Colchicina: En pacientes con pericarditis recurrente o de reciente inicio se recomienda el uso de 1mg de colchicina en combinación con tratamiento convencional de esteroides e inmunosupresores hasta alcanzar la remisión. Para evitar recaída de pericarditis se recomienda la adición de colchicina (1mg por día durante al menos un mes)140,144,145. (Calidad de la evidencia moderada, recomendación débil) –Cirugía: Se recomienda cirugía de pericarditis en caso de pericarditis resistente a tratamiento o tamponade que no responde a tratamiento farmacológico. (Buena práctica) |
| Miocarditis |
| –Esteroides: Se recomienda uso de GC en bolos, metilprednisolona (1 g/día por 3 días) en casos de miocarditis graves con arritmias, fracción de eyección ventricular de <55% y la administración de prednisona (de 0,5 a 1 mg/kg/día) después de la administración de bolos146. (Calidad de la evidencia baja, recomendación fuerte) –Antimaláricos: Se recomienda el uso de HCQ a dosis de 200 a 400mg/día, o cloroquina (de 150 a 300 mg/día) para la etapa de mantenimiento146. (Calidad de la evidencia baja, recomendación débil) –Ciclofosfamida: En el caso de manifestación grave con arritmias o fracción de eyección ventricular de menos del 40%, se recomienda el uso de CFM intravenoso a dosis de 0,5 a 1 g/m2 de superficie corporal por 3 a 10 meses como primera línea de tratamiento en forma conjunta con esteroides147. Con base en la experiencia del panel de expertos, se recomienda administrar por lo menos 3 meses esperando respuesta; en caso de no haberla, suspender para evitar riesgo de toxicidad y, en caso de responder, se recomienda un mínimo de 6 meses de tratamiento. (Calidad de la evidencia moderada, recomendación fuerte) Ácido micofenólico: Se recomienda el uso de MMF a dosis de 2 g/día en dosis divididas, como terapia de mantenimiento después de CFM intravenoso, para reducir las recaídas146. (Calidad de la evidencia moderada, recomendación débil) –Azatioprina: Se recomienda el uso de azatioprina (de 2 a 3 mg/kg/día) como terapia de mantenimiento después de CFM en aquellos pacientes con intolerancia a MMF146 y vigilar citopenias (BH). (Calidad de la evidencia baja, recomendación débil) –Gamaglobulina: En el caso de las miocarditis complicadas, se recomienda el uso de gamaglobulina a dosis de 400 mg/kg/día por 5 días en aquellos pacientes que han fallado a la terapia de inducción estándar con esteroides orales o intravenosos y CFM146. La aparición de hipertensión durante la infusión, así como reacciones anafilácticas, deberán ser consideradas. (Calidad de la evidencia baja, recomendación débil) |
| Hipertensión pulmonar |
| –Esteroides: Se recomienda uso de GC a dosis de 0,5 a 1 mg/kg/día por 4 semanas con reducción gradual a dosis mínimas de 5mg diarios para mantenimiento o hasta su suspensión148,149. (Calidad de la evidencia moderada, recomendación fuerte). El uso de bolos de metilprednisolona a dosis de 1 g/día por 3 días se ha propuesto en casos graves cuando coinciden con afección a otros órganos y recaídas150,151. (Calidad de la evidencia baja, recomendación fuerte) –Ciclofosfamida: Se recomienda el uso de CFM a dosis de 600 mg/m2 de superficie corporal por 3 a 6 meses como tratamiento inmunosupresor asociado a GC, vasodilatadores, diuréticos y otras medidas de soporte150,152. Otros esquemas propuestos son de 500 a 1.000mg/m2 de superficie corporal de forma mensual por 3 a 6 meses149. (Calidad de la evidencia moderada, recomendación fuerte) –Ácido micofenólico: Se recomienda MMF (de 2 a 3 g/día) como mantenimiento posterior a CFA o en caso de intolerancia o contraindicación a CFA IV151. (Calidad de la evidencia baja, recomendación débil) –Inhibidores de canales de calcio: No puede recomendarse el uso de inhibidores de canales de calcio debido a que no hay suficiente evidencia sobre su eficacia y seguridad en hipertensión pulmonar asociada a LES153,154. (Calidad de la evidencia baja, recomendación débil) –Prostanoides: En pacientes con clase funcional III y IV según la clasificación de NYHA, se recomienda el uso de epoprostenol administrado vía intravenosa por catéter venoso central con bomba de infusión continua a dosis de 2 a 40 ng/kg/min por 3 a 6 meses, iniciando con 2 a 4 ng/kg min e incrementando la dosis paulatinamente153-156. (Calidad de la evidencia alta, recomendación fuerte). Se recomienda el uso de teprostinil a dosis de 1,25 a 2,5 ng/kg/min vía intravenosa por bomba de infusión continua con incremento de 1,25 a 2,5mg cada 1 a 2 semanas, a dosis máxima de 22,5 ng/kg/min por 12 semanas en pacientes con LES y con clases III y IV según la NYHA153,154,157. (Calidad de la evidencia moderada, recomendación débil). –Antagonistas de receptores de endotelina: Se recomienda el uso de bosentan a dosis de 62,5 mg 2 veces al día por 4 semanas con seguimiento 125mg 2 veces al día por 3 a 12 meses en forma conjunta con GC e inmunosupresores como manejo de primera línea en pacientes con clase funcional II y III según la NYHA153,158,159. (Calidad de la evidencia alta, recomendación fuerte). No se recomienda el uso de sitaxentan y ambrisentan ya que no cuentan con evidencia de eficacia y seguridad en el manejo de HAP en LES153. (Calidad de la evidencia alta, recomendación fuerte). –Inhibidores de fosfodiesterasa (PDE-5)a: Se recomienda el uso de sildenafil a dosis inicial de 20mg 3veces al día; se puede incrementar gradualmente a 80mg 3veces al día de acuerdo con la tolerancia del paciente para mejores resultados a largo plazo o como manejo de primera línea en pacientes con HAP y clase funcional II y III según la NYHA158,159. (Calidad de la evidencia alta, recomendación fuerte). Se recomienda considerar su uso en pacientes con clase funcional iv158-161. (Calidad de la evidencia baja, recomendación débil). –En pacientes con hipertensión pulmonar con clase funcional III y IV según la NYHA, se recomienda utilizar a dosis de 20 mg/día con incremento gradual hasta 40 mg/día de acuerdo con tolerancia en el paciente, como terapia de segunda línea y en combinación con terapia inmunosupresora149,153,158,159. (Calidad de la evidencia moderada, recomendación débil). No se recomienda el uso de vardenafil por falta de evidencia para el tratamiento de la hipertensión pulmonar159. (Calidad de la evidencia moderada, recomendación débil) –Terapia combinada: No se recomienda la terapia combinada con vasodilatadores, inhibidores de PDE-5 y antagonistas de receptores de endotelina-1 en pacientes con LES por falta de evidencia153,154. (Calidad de la evidencia moderada, recomendación débil) |
Recomendaciones para manifestaciones pulmonares
| Pleuritis con o sin derrame pleural |
|---|
| –AINE: Se recomienda el uso de AINE como grupo de tratamiento, preferentemente naproxeno en dosis de 250 a 500mg cada 12 h por 1 a 2 semanas, aunque cualquier AINE es aceptable. Se recomienda evaluar contraindicaciones a los AINE (gastrointestinales, insuficiencia renal, hipertensión arterial sistémica en descontrol, insuficiencia cardiaca)162,163. (Calidad de la evidencia moderada, recomendación fuerte) –Glucocorticoides: Están indicados cuando no existe respuesta terapéutica con AINE por un lapso de 1 a 2 semanas. Recomendamos el uso de prednisona en dosis de 20mg al día y reducción en un lapso de 2 a 3 semanas162,163. (Calidad de la evidencia moderada, recomendación fuerte) –Otros inmunosupresores: No se recomienda su uso debido a la falta de evidencia ya que rara vez se requieren en este contexto. (Recomendación de buena práctica) |
| Neumonitis lúpica aguda |
| –Glucocorticoides: Se recomienda el uso de prednisona en dosis de 1 mg/kg/día por 3 días y evaluar respuesta clínica; si no existe, entonces considerar bolos de metiprednisolona en dosis de 1 g/día por 3 días164. (Calidad de la evidencia moderada, recomendación fuerte) –Ciclofosfamida: En casos refractarios al uso de GC, se puede considerar la utilización de CFM en bolos mensuales (de 0,5 a 1 g/m2 de superficie corporal; de 3 a 6 bolos mensuales) vigilando efectos tóxicos (cistitis hemorrágica, mielotoxicidad, infecciones). Premedicar con hidratación, antiemético y MESNA164. (Calidad de la evidencia baja, recomendación débil) –Inmunoglobulina intravenosa: Se recomienda considerar para casos refractarios o con contraindicación para tratamiento con inmunosupresores a una dosis de 2 g/kg durante 5 días (400 mg/kg/día)163-165. (Calidad de la evidencia baja, recomendación débil) |
| Neumopatía intersticial crónica en lupus eritematoso sistémico |
| –Medidas generales: Se debe suspender el tabaquismo, considerar oxígeno suplementario por razón necesaria y esquema de vacunación para influenza y neumococo165. (Calidad de la evidencia moderada, recomendación fuerte) –Glucocorticoides: Se recomienda el uso de prednisona en dosis de 0,5 a 1 mg/kg/día, monitorizar sintomatología respiratoria y capacidad de difusión de monóxido de carbono para definir respuesta y vigilar la presencia de efectos adversos (infecciones, osteoporosis, hipertensión arterial sistémica, diabetes mellitus secundaria)166. (Calidad de la evidencia moderada, recomendación fuerte) –Inmunosupresores: Se recomienda utilizar, como ahorradores de esteroides, CFM en bolos mensuales, azatioprina, MMF167. La azatioprina y el MMF se utilizan a las dosis habituales en los casos leves a moderados. La CFM en bolos mensuales de 0,5 a 1 g/m2 de superficie corporal (de 6 a 12 meses) se reserva para los casos graves165,166. (Calidad de la evidencia moderada, recomendación fuerte) –Rituximab: Se recomienda utilizar rituximab en casos refractarios a las dosis habituales de 375 mg/m2 de superficie corporal en 4 dosis semanales o 1g dosis total por aplicación en 2 aplicaciones separadas por 15 días una de la otra165,166. (Calidad de la evidencia baja, recomendación débil) |
| Hemorragia pulmonar por lupus eritematoso sistémico165 |
| –Glucocorticoides: Se recomienda el uso de bolos de metilprednisolona a dosis de 1g por día durante 3 a 5 días168,169. (Calidad de la evidencia moderada, recomendación fuerte) –Inmunosupresores: Se recomienda el uso de bolos de CFM a dosis de 0,5 a 1 g/m2 de superficie corporal (de 6 a 12 bolos mensuales)169,170. (Calidad de la evidencia baja, recomendación fuerte). Se recomienda el uso de MMF (de 2 a 3 g/día) y de azatioprina (de 2 a 3 mg/kg/día)168,170. (Calidad de la evidencia baja, recomendación fuerte). Se recomienda el uso de rituximab con o sin bolos de CFM para casos refractarios o con intolerancia a los bolos de CFM171. (Calidad de la evidencia baja, recomendación fuerte) –Inmunoglobulina intravenosa: Se recomienda el uso de inmunoglobulina intravenosa en casos refractarios al tratamiento habitual en dosis 2 g/kg en infusión para 5 días (400 mg/kg/día)170. (Calidad de la evidencia baja, recomendación fuerte) –Factor VIIa recombinante activado: Considerar el uso de factor VIIa recombinante en casos refractarios172. (Calidad de la evidencia baja, recomendación débil) –Antibióticos: En caso de hemorragia pulmonar asociada a procesos infecciosos pulmonares, se recomienda la realización de cultivos de secreción bronquial y la cobertura antibiótica en los casos necesarios170. (Calidad de la evidencia moderada, recomendación fuerte) |
Recomendaciones para manifestaciones neurológicas
| Recomendaciones generales165 |
|---|
| –El paciente con LES y alguna manifestación neurológica o psiquiátrica debe ser estudiado de la misma forma que un paciente sin lupus26. (Calidad de la evidencia moderada, recomendación fuerte) –Según la manifestación neurológica o psiquiátrica que presente el paciente, debe realizarse electroencefalograma, velocidades de conducción nerviosa, electromiografía, punción lumbar, pruebas neuropsicológicas, potenciales evocados somatosensoriales y resonancia magnética nuclear de encéfalo o espinal incluyendo secuencias convencionales T1/T2 y FLAIR, así como secuencias con gadolinio en T1173. (Calidad de la evidencia moderada, recomendación fuerte) |
| Disfunción cognitiva165 |
| –Se recomienda el manejo de factores asociados como la ansiedad, la depresión y el control de factores de riesgo cardiovascular, así como el apoyo psicológico, debido a que pueden prevenir un mayor deterioro cognitivo174. (Calidad de la evidencia baja, recomendación débil) |
| Convulsiones165 |
| –Antiepilépticos: Los antiepilépticos se recomiendan cuando existen convulsiones recurrentes o cuando se presentan por lo menos 2 episodios dentro de las primeras 24 h o hay actividad epileptógena en el electroencefalograma175. (Calidad de la evidencia moderada, recomendación fuerte) –Metilprednisolona: Para las convulsiones refractarias asociada a actividad del LES, se recomienda metilprednisolona intravenosa (1 g/día por 3 días), seguida de prednisona (1 mg/kg/día por no más de 3 meses) y disminución de acuerdo con la actividad de la enfermedad176. (Calidad de la evidencia moderada, recomendación fuerte) –Ciclofosfamida: De manera concomitante se recomienda la CFM intravenosa 0,75 g/m2 de superficie corporal cada mes durante 12 meses176. (Calidad de la evidencia moderada, recomendación fuerte) |
| Neuropatía periférica, mielopatía y neuritis óptica165 |
| –Metilprednisolona: Se recomienda utilizar metilprednisolona intravenosa a 1 g/día por 3 días, seguida de prednisona (1 mg/kg/día por no más de 3 meses) y disminución de acuerdo con la actividad de la enfermedad176-179. (Calidad de la evidencia moderada, recomendación fuerte) –Ciclofosfamida: De manera concomitante se recomienda la CFM intravenosa 0,75 g/m2 de superficie corporal cada mes durante 12 meses176-178. (Calidad de la evidencia moderada, recomendación fuerte) Inmunoglobulina: Puede utilizarse inmunoglobulina intravenosa a dosis de 2 g/kg dividida en 5 días177,178,180-182. (Calidad de la evidencia moderada, recomendación débil) |
| Trastornos del movimiento (corea)165 |
| –Antiplaquetarios: Se recomienda el uso de aspirina en la corea asociada a anticuerpos antifosfolípido y la anticoagulación en la corea asociada al síndrome de anticuerpos antifosfolípido183-186. (Calidad de la evidencia baja, recomendación débil) –Antagonistas de dopamina: Se recomienda la terapia sintomática con antagonistas de dopamina175. (Calidad de la evidencia moderada, recomendación fuerte) –Otros: Hay reportes de casos que recomiendan que la metilprednisolona, la CFM, la azatioprina, y el rituximab pueden ser una opción terapéutica en pacientes refractarios183,187. (Calidad de la evidencia baja, recomendación débil) |
| Psicosis165 |
| –Prednisona: Se recomienda la prednisona a 1 mg/kg por día durante 8 semanas con disminución gradual hasta 5mg al día188. (Calidad de la evidencia moderada, recomendación fuerte) –Ciclofosfamida: Se recomienda el uso concomitante de CFM intravenosa a dosis de 0,75 g/m2 de superficie corporal cada mes durante 6 meses188,189. (Calidad de la evidencia moderada, recomendación fuerte) |
Recomendaciones para manifestaciones hematológicas
| Trombocitopenia |
|---|
| –Glucocorticoides: En casos de trombocitopenia se recomienda 1 mg/kg/día de prednisona (o su equivalente) hasta obtener cifras plaquetarias por arriba de 100.000 cel/mcl sin datos de sangrado e ir disminuyendo la dosis de GC hasta suspenderse y añadir algún otro inmunosupresor para disminuir el riesgo de recaída190-192. (Calidad de la evidencia moderada, recomendación fuerte). En casos de trombocitopenia grave (menos de 15×109/cel/mcl) o con datos de sangrado que pongan en riesgo la vida, se recomienda el uso de bolos de metilprednisolona (1g/24h, intravenoso, por 3 a 5 días, según la gravedad del cuadro) para obtener respuestas más rápidas, asegurándose de continuar a dosis de entre 0,5 y 1 mg/kg/día de prednisona o su equivalente para evitar el riesgo de recaídas. Se recomienda continuar con estas dosis hasta obtener cifras mayores de 50.000 cel/mcl y considerar algún otro inmunosupresor añadido190-192. (Calidad de la evidencia moderada, recomendación fuerte) –Inmunoglobulina intravenosa: Se recomienda como terapia de rescate únicamente en pacientes con pobre respuesta a GC (es decir, que hayan recibido bolos de metilprednisolona por 3 a 5 días o prednisona o su equivalente, a 1 mg/kg/día por más de 4 semanas y las cifras plaquetarias no sobrepasen 50.000 cel/mcl o datos de sangrado activo que pongan en peligro la vida). Se recomienda en dosis de 1 g/kg de peso en el día 1 y el día 2. La respuesta suele ser transitoria (promedio 10 días)193-196. (Calidad de la evidencia moderada, recomendación fuerte) –Danazol: Se recomienda su uso como terapia conjunta al tratamiento con GC orales, a una dosis de 200 a 800 mg/día según la gravedad de la trombocitopenia197,198. (Calidad de la evidencia moderada, recomendación fuerte) –Antimaláricos: Se recomienda su uso como terapia adjunta a los GC orales a dosis entre 200 y 400 mg/día según la gravedad de la trombocitopenia199. (Calidad de la evidencia baja, recomendación débil) –Biológicos (rituximab): Se recomienda su uso principalmente ante la falla al tratamiento con otros inmunosupresores. Se puede utilizar el esquema de 375 mg/m2 superficie corporal intravenoso cada semana por 4 semanas o el esquema de 1g intravenoso en día cero y día 15. La mejor respuesta se observa al asociarse con GC orales 1 mg/kg/día de prednisona o su equivalente y con dosis de descenso en 3 meses o menos200,201. (Calidad de la evidencia alta, recomendación fuerte). También se recomienda considerar el esquema con dosis bajas que consiste en 100mg intravenosos en los días 0, 7, 14 y 21 (es decir 4dosis, una por semana)200,201. (Calidad de la evidencia moderada, recomendación débil) –Esplenectomía: Se recomienda su uso principalmente en el escenario en en el que la trombocitopenia ha sido refractaria a diversos tratamientos inmunosupresores (es decir, última línea)202-205. (Calidad de la evidencia baja, recomendación débil) –Ciclofosfamida: Se recomienda su uso, principalmente, en pacientes que no han respondido al tratamiento previo; incluso se puede utilizar como rescate posterior a esplenectomía. Se recomiendan dosis de 500mg a 1,2 g/mes intravenoso por 3 a 6 meses, según la gravedad de la trombocitopenia y la respuesta clínica. En pacientes muy dependientes de GC, se puede considerar como agente ahorrador de este grupo de medicamentos206-208. (Calidad de la evidencia baja, recomendación débil) –Micofenolato de mofetilo: Se recomienda su uso ante pacientes refractarios al resto de las líneas de tratamiento. La dosis habitual es entre 1 y 2,5 g/día, según tolerancia y respuesta clínica38,209. (Calidad de la evidencia baja, recomendación débil) –Azatioprina: Se recomienda su uso en pacientes refractarios al resto de las líneas de tratamiento. La dosis recomendada va de 0,5 a 2 mg/kg/día, según tolerancia y respuesta190,210,211. (Calidad de la evidencia baja, recomendación débil) –Eltrombopag: No se recomienda su uso de manera rutinaria por falta de evidencia212,213. (Calidad de la evidencia baja, recomendación fuerte) Transfusión de concentrados plaquetarios: Se recomienda su uso en pacientes con recuentos plaquetarios por debajo de 10.000 cel/mcl sin importar si hay o no datos de sangrado o cifras por debajo de 50.000 cel/mcl con sangrado activo. Por arriba de 50.000 cel/mcl, se recomienda solo en caso de sangrado activo que ponga en riesgo la función o la vida. Idealmente cualquier paciente que vaya a ser tratado con un procedimiento invasivo menor (poer ejemplo, colocación de catéteres centrales, toracocentesis, etc.) se requieren al menos 50.000 cel/mcl. Con procedimientos como intervenciones quirúrgicas o procedimientos con mayor riesgo de sangrado (biopsia renal, por ejemplo), mantener de preferencia cifras por arriba de 100.000 cel/mcl214. (Calidad de la evidencia moderada, recomendación fuerte) |
| Anemia hemolítica autoinmune |
| –Biológicos (rituximab): Se recomienda su uso principalmente ante la falla al tratamiento con otros inmunosupresores. Se puede utilizar el esquema de 375 mg/m2 de superficie corporal (intravenoso) cada semana por 4 semanas o esquema de 1g intravenoso en día cero y día 15215,216. (Calidad de la evidencia buena, recomendación fuerte). Puede considerarse el esquema a dosis bajas que consiste en 100mg intravenosos en los días 0, 7, 14 y 21 (4 dosis, una por semana). La mejor respuesta de este esquema se observa al asociarse con GC orales 1 mg/kg/día de prednisona o su equivalente, con dosis de descenso en 3 meses o menos215-219. (Calidad de la evidencia baja, recomendación débil) –Glucocorticoides: Para tratar de obtener respuestas rápidas (en aprox 48 a 72 h) en situaciones en donde la anemia ponga en riesgo la vida, se recomienda el uso de bolos de metilprednisolona intravenosa (1g al día, de 3 a 5 días, según la gravedad de la anemia). Se recomienda que al pasar el GC a vía oral (1 mg/kg/día prednisona o su equivalente), se mantenga esta dosis por 4 semanas al menos y posteriormente el descenso sea lento y paulatino para evitar recaídas, hasta tener algún otro inmunosupresor y la cifra de hemoglobina sea estable y mayor de 7 g/dL43,220-223. (Calidad de la evidencia buena, recomendación fuerte) –Azatioprina: Se recomienda su uso como agente ahorrador de GC y en los casos en los que existan recaídas al retiro o descenso de los mismos en dosis de 0,5 a 2 mg/kg día, según tolerancia y respuesta clínica211,224. (Calidad de la evidencia moderada, recomendación fuerte) –Danazol: Se recomienda en pacientes refractarios en dosis de 200 a 800 mg/día, pero en coadyuvancia con otro inmunosupresor197,225-227. (Calidad de la evidencia moderada, recomendación fuerte) Inmunoglobulina intravenosa: No se recomienda su uso por falta de evidencia suficiente para emitir una recomendación228. (Calidad de la evidencia baja, recomendación débil) Micofenolato de mofetilo: Se recomienda su uso en pacientes refractarios al resto de las líneas de tratamiento. Dosis de 1 a 2,5 g/día, según tolerancia y respuesta clínica. Puede también funcionar como ahorrador de GC229-231. (Calidad de la evidencia baja, recomendación débil) –Ciclofosfamida: Se recomienda su uso, principalmente, en pacientes que no han respondido a los tratamientos de primera o segunda línea; se recomiendan dosis entre 500 y 1,2 g/mes (intravenoso) por 3 a 6 meses, según gravedad de la anemia y respuesta clínica43,232. (Calidad de la evidencia baja, recomendación débil) –Esplenectomía: No se recomienda mientras no se tenga información disponible sobre su eficacia y seguridad como tratamiento de rutina, excepto en pacientes refractarios en los que se considere que el posible beneficio supera los riesgos43,233. (Calidad de la evidencia baja, recomendación débil) –Transfusión sanguínea: No se recomienda su uso excepto en los casos en los que se encuentre en riesgo la vida o con condiciones como bajo gasto cardiaco, cardiopatía isquémica, alteraciones neurológicas graves, etc., siempre y en conjunto con supervisión de médicos hematólogos previamente al uso de paquetes globulares234. (Calidad de la evidencia moderada, recomendación fuerte) |
| Neutropenia |
| –Infección vs. manisfestación de la enfermedad: Es necesario primero descartar infección y efecto tóxico de medicamentos, respectivamente, antes de atribuir la manifestación a actividad de la enfermedad. (Recomendación de buena práctica) –Factor estimulante de colonias de granulocitos: En neutropenia <1.000/μl, asociada a fiebre o infección se recomienda iniciar con 300μg/día y continuar con la dosis mínima efectiva para alcanzar cifra de neutrófilos mayores a 1.000/μl235-240. (Calidad de la evidencia baja, recomendación fuerte) –Glucocorticoides: Se recomiendan dosis entre 0,5 y 1 mg/kg/día de prednisona o su equivalente235,236,241. (Calidad de la evidencia, recomendación débil) –Azatioprina: Se recomiendan dosis hasta 2,5 mg/kg/día, según respuesta y tolerancia241. (Calidad de la evidencia muy baja, recomendación débil) –Micofenolato de mofetilo: No se recomienda su uso debido a la falta de evidencia sobre dosis óptima235,241. (Calidad de la evidencia muy baja, recomendación débil) –Ciclosporina: No se recomienda su uso debido a la falta de evidencia sobre dosis óptima235,241. (Calidad de la evidencia muy baja, recomendación débil) –Rituximab: Se recomienda en enfermedad refractaria a dosis de 375 mg/m2 de superficie corporal semanal por 4 semanas o dosis de 1g día cero y día 14235,241. (Calidad de la evidencia muy baja, recomendación débil) |
| Púrpura trombocitopénica trombótica |
| –Plasmaféresis: Se recomienda iniciar la plasmaféresis tan pronto como se sospeche el diagnóstico (en las primeras 4-8 h). El reemplazo debe ser con plasma fresco congelado242-245. (Calidad de la evidencia baja, recomendación fuerte) –Glucocorticoides: Se recomienda su uso en combinación con plasmaféresis. Bolos de metilprednisolona (1g diario por 5 días) o prednisona (o equivalente) a dosis de 1 mg/kg/día242-245. (Calidad de la evidencia baja, recomendación fuerte) –Ciclofosfamida: Se recomienda su uso, aun cuando no existe consenso sobre las dosis242-244. (Calidad de la evidencia muy baja, recomendación débil) –Micofenolato de mofetilo: Se recomienda su uso ante contraindicación o efecto máximo de CFM, sin consenso de dosis244. (Calidad de la evidencia muy baja, recomendación débil) –Rituximab: Se recomienda su uso en casos refractarios, aumentando el porcentaje de respuesta. La dosis recomendada es 375 mg/m2 de superficie corporal semanal por 4 semanas. Se recomienda retrasar la plasmaféresis por lo menos 4 h después de la infusión de rituximab242,244,245. (Calidad de la evidencia muy baja, recomendación débil) –Vincristina: Podría utilizarse en casos refractarios (como opción después de rituximab) en dosis única de 1,4 mg/m2 de superficie corporal, con un máximo de 2mg como dosis total242,243,245,246. (Calidad de la evidencia muy baja, recomendación débil). |
| Síndrome hemofagocítico |
| –Medidas generales: Proporcionar tratamiento de soporte (reanimación con líquidos, antibióticos, cubrir requerimientos transfusionales). Buscar y tratar focos infecciosos. (Buena práctica) –Glucocorticoides: Se recomiendan bolos de metilprednisolona o prednisona (o equivalente), sin que exista una dosis consensuada245,247. (Calidad de la evidencia baja, recomendación fuerte) –Ciclofosfamida: Se recomiendan bolos de 500mg a 1g mensuales por 6meses247. (Calidad de la evidencia baja, recomendación débil) –Ciclosporina: Se recomiendan dosis de 2 a 5 mg/kg/día247. (Calidad de la evidencia baja, recomendación débil) –Inmunoglobulina intravenosa: No se recomienda su uso247. (Calidad de la evidencia baja, recomendación fuerte) |
Recomendaciones para manifestaciones gastrointestinales
| Pseudoobstrucción intestinal |
|---|
| –Glucocorticoides: Se debe considerar el uso de GC a dosis altas (metilprednisolona 1g intravenoso cada 24 h por 3 a 5 días seguido del equivalente a prednisona 1 mg/kg/día) en pacientes con pseudoobstrucción intestinal248,249. (Calidad de la evidencia baja, recomendación fuerte) –Inmunosupresores: Se debe considerar el uso concomitante de GC con inmunosupresores como CFM, ciclosporina A, metotrexato, azatioprina o tacrolimus249,250. (Calidad de la evidencia baja, recomendación fuerte) –Inmunoglobulina intravenosa: Se debe considerar su uso en pacientes refractarios a la terapia con dosis de masivas de GC249,250. (Calidad de la evidencia baja, recomendación fuerte) |
| Pancreatitis autoinmune |
| –Glucocorticoides: Se debe considerar el uso de GC a dosis altas (equivalentes a prednisona 1 mg/kg/día) en pacientes con pancreatitis aguda. En los pacientes que no responden a la dosis inicial de prednisona a 1mg por kg de peso se pueden utilizar bolos de metilprednisolona 1g intravenoso cada 24 h por 3dosis251,252. (Calidad de la evidencia baja, recomendación fuerte). –Inmunosupresores: Se recomienda considerar el uso concomitante de GC e inmunosupresores como CFM, metotrexato o azatioprina251,252. (Calidad de la evidencia baja, recomendación débil) –Plasmaféresis: Se debe considerar el uso de plasmaféresis en pacientes refractarios a terapia con GC253. (Calidad de la evidencia moderada, recomendación fuerte) |
| Enteropatía perdedora de proteínas |
| –Glucocorticoides: Se recomienda el uso de GC a dosis altas (equivalente a prednisona 1 mg/kg/día) en pacientes con enteropatía perdedora de proteínas. Los bolos de metilprednisolona deben considerarse si el paciente presenta otras complicaciones graves de la enfermedad como hipoalbuminemia grave que genere fuga capilar y secundariamente derrame pleural o pericárdico graves o en afección hepática grave254-256. (Calidad de la evidencia moderada, recomendación fuerte) –Inmunosupresores: Se debe considerar el uso concomitante de GC e inmunosupresores como CFM, ciclosporina A, metotrexato, azatioprina o MMF254-256. (Calidad de la evidencia baja, recomendación fuerte) |
| Vasculitis intestinal |
| –Glucocorticoides: Se debe considerar el uso de GC a dosis altas (metilprednisolona: 1g intravenoso cada 24 h por 3 a 5 días seguido del equivalente a prednisona 1 mg/kg/día) en pacientes con vasculitis intestinal257-259. (Calidad de la evidencia baja, recomendación fuerte) –Inmunosupresores: Se debe considerar el uso concomitante de GC y CFM intravenoso en pacientes con vasculitis intestinal asociada a otras manifestaciones graves de la enfermedad (LES) o en pacientes con recurrencia de la vasculitis258. (Calidad de la evidencia baja, recomendación fuerte) –Cirugía: Considerar laparotomía abdominal si no existe una mejoría del dolor en las primeras 24 a 48 h del inicio de la terapia con GC en bolos. (Buena práctica) |
El LES, al ser una enfermedad poco frecuente, es motivo de investigación con menor frecuencia que otras enfermedades, por lo tanto, existe una necesidad importante de evidencia sobre tratamientos efectivos que a la vez condicionen la menor tasa de eventos adversos. El panel de trabajo identificó una serie de brechas en el conocimiento para recomendar a los clínicos, investigadores y a la industria farmaceútica que dirijan sus esfuerzos a estas necesidades de investigación y así ofrecer cada vez mejores tratamientos a los pacientes que presentan esta enfermedad.
- 1)
De forma general, es necesario diseñar:
- a)
Estudios con cohortes prospectivas multicéntricas a nivel nacional.
- b)
Estudios comparativos con poblaciones de otros países.
- c)
Ensayos clínicos controlados en lo que respecta al tratamiento de las manifestaciones neuropsiquiátricas del lupus.
- a)
- 2)
Existe necesidad de ensayos clínicos para el tratamiento de las manifestaciones articulares en LES.
- 3)
Se requiere más evidencia de la eficacia y seguridad de tacrolimus en LES grave, antagonistas de calcio y medicamentos inmunosupresores (MMF y CFM) en pacientes con hipertensión pulmonar, CFM, azatioprina, micofenolato de mofetilo, danazol, antimaláricos en el tratamiento de pacientes con LES y trombocitopenia o anemia hemolítica, de CFM para síndrome hemofagocítico y púrpura trombocitopénica trombótica, aplicación de múltiples vacunas en la misma visita y la aplicación de vacuna contra el tétanos, cuadrivalente recombinante contra el virus del papiloma humano, virus de la hepatitis B y el herpes zóster en pacientes con actividad moderada y severa de la enfermedad.
- 4)
La evidencia terapéutica del uso de la esplenectomía requerirá más evidencia de estudios retrospectivos, ya que es poco factible la realización de un ensayo clínico controlado.
- 5)
Es necesario contar con estudios sobre la duración óptima de los tratamientos y esquemas de disminución de dosis una vez alcanzada la remisión de la sintomatología.
- 6)
Hacen falta estudios con mayor poder estadístico en afección gastrointestinal en lupus, ya que los actuales son series de casos.
- 7)
Se requieren estudios para determinar la dosis requerida de CFM para síndrome hemofagocítico y púrpura trombocitopénica trombótica.
Daniel Xibille-Friedman ha recibido honorarios de GlaxoSmithKline por actividades de capacitación y en ensayos clínicos. Sandra Carrillo-Vázquez ha recibido honorarios de Abbvie, Bristol Myers Squibb, Eli Lilly, Novartis, Pfizer, Roche, Takeda y Janssen. Lilia Andrade-Ortega ha recibido honorarios de Bristol Myers Squibb, Novartis, Pfizer, Roche, Janssen. Miguel Ángel Saavedra ha recibido honorarios de UCB y Pfizer. Leonardo Limón-Camacho ha recibido honorarios de Bristol Myers Squibb, UCB, Pfizer, Janssen, Roche, Lilly y Amgen. Leonor Barile Fabris ha recibido honorarios de Abbvie, Jansen, Roche, Bristol Myers Squibb, UCB, Novartis, Pfizer y GlaxoSmithKline.
Marcela Pérez-Rodríguez, Everardo Álvarez-Hernández, Francisco Javier Aceves, Mario C. Ocampo-Torres, Conrado García-García, José Luis García-Figueroa, Javier Merayo-Chalico, Ana Barrera-Vargas, Margarita Portela-Hernández, Sandra Sicsik, Víctor Manuel Rosales-Don Pablo, Aline Martínez, Pilar Prieto-Seyffert, Mario Pérez-Cristóbal, Zully Castro-Colín, Azucena Ramos, Gabriela Huerta-Sil, María Fernanda Hernández-Cabrera, Luis Javier Jara y Lizbet Tinajero-Nieto declaran no tener conflictos de interés.
Agradecemos a la M. en C. Guadalupe Olvera Soto por su invaluable apoyo en la búsqueda de los artículos utilizados en la revisión de la literatura; también agradecemos el apoyo educacional irrestricto de GlaxoSmithKline.