El embarazo en mujeres con enfermedades reumáticas autoinmunes se asocia a diversas complicaciones materno-fetales. El desarrollo de guías de práctica clínica con la mejor evidencia científica disponible puede ayudar a homogeneizar la atención en estas pacientes.
ObjetivosProporcionar recomendaciones respecto al control prenatal, el tratamiento y el seguimiento más efectivo de la mujer embarazada con lupus eritematoso sistémico, artritis reumatoide (AR) y síndrome por anticuerpos antifosfolípidos (SAF).
MetodologíaPara la elaboración de las recomendaciones se conformaron grupos nominales de expertos y se realizaron consensos formales, búsqueda sistematizada de la información, elaboración de preguntas clínicas, elaboración y calificación de las recomendaciones, fase de validación interna por pares y validación externa del documento final teniendo en cuenta los criterios de calidad del instrumento AGREE II.
ResultadosLos grupos de trabajo contestaron las 37 preguntas relacionadas con la atención materno-fetal en lupus eritematoso sistémico, AR y SAF, así como de fármacos antirreumáticos durante el embarazo y lactancia. Las recomendaciones fueron discutidas e integradas en un manuscrito final y se elaboraron los algoritmos correspondientes. En esta segunda parte se presentan las recomendaciones para mujeres embarazas con AR, SAF y el uso de fármacos antirreumáticos durante el embarazo y lactancia.
ConclusionesLa guía mexicana de práctica clínica para la atención del embarazo en mujeres con AR y SAF integra la mejor evidencia disponible para el tratamiento y el seguimiento de estas pacientes.
Pregnancy in women with autoimmune rheumatic diseases is associated with several maternal and fetal complications. The development of clinical practice guidelines with the best available scientific evidence may help standardize the care of these patients.
ObjectivesTo provide recommendations regarding prenatal care, treatment, and a more effective monitoring of pregnancy in women with lupus erythematosus, rheumatoid arthritis (RA) and antiphospholipid syndrome (APS).
MethodologyNominal panels were formed for consensus, systematic search of information, development of clinical questions, processing and staging of recommendations, internal validation by peers and external validation of the final document. The quality criteria of the AGREE II instrument were followed.
ResultsThe panels answered 37 questions related to maternal and fetal care in lupus erythematosus, RA and APS, as well as for use of antirheumatic drugs during pregnancy and lactation. The recommendations were discussed and integrated into a final manuscript. Finally, the corresponding algorithms were developed. In this second part, the recommendations for pregnant women with RA, APS and the use of antirheumatic drugs during pregnancy and lactation are presented.
ConclusionsWe believe that the Mexican clinical practice guidelines for the management of pregnancy in women with RA and APS integrate the best available evidence for the treatment and follow-up of patients with these conditions.
A continuación se presenta la segunda parte de las Guías de práctica clínica para la atención del embarazo en mujeres con enfermedades reumáticas autoinmunes del Colegio Mexicano de Reumatología, que fueron divididas en dos partes. Para el desarrollo y metodología de las mismas debe consultarse la primera parte.
Artritis reumatoideLa artritis reumatoide (AR) es una enfermedad inflamatoria sistémica caracterizada fudamentalmente por inflamación y proliferación destructiva de la membrana sinovial de origen autoinmune. La frecuencia de la AR se incrementa con la edad, pero tiende a afectar a mujeres desde su etapa reproductiva.
En la mujer con AR, ¿cuál es el efecto de la enfermedad y su tratamiento sobre la fertilidad y la fecundidad?En mujeres con AR no se ha evidenciado efecto en la tasa de fertilidad. En México se identificó una tasa de infertilidad secundaria en mujeres con AR, igual a la reportada en población general (20%)1,2. [NE III] En un estudio de casos y controles no se encontró diferencia en la incidencia anual de embarazos en mujeres con AR en comparación con la paridad de mujeres sin AR1. [NE III] En la evaluación integral de las mujeres con AR se debe considerar la historia gineco-obstétrica1. [GR C]
- •
En las pacientes con AR es importante identificar los antecedentes gineco-obstétricos y evaluar en particular la paridad. [PBP]
El uso de un método de barrera debe acompañarse de un espermicida para disminuir el riesgo de embarazo. El dispositivo intrauterino (DIU) es un método eficaz en un 95% de los casos. La píldora del día siguiente es eficaz en el 99% de los casos3. [NE III] Los anticonceptivos con estrógenos y los anticonceptivos con progestágenos solos son eficaces en el 95% de mujeres con AR. Los primeros disminuyen los efectos secundarios de la progesterona. Cuando se utilizan con diafragma y tapón cervical su eficacia alcanza el 98%3. [NE III] Los métodos anticonceptivos a base de progestágenos solos, disponibles para administración oral, inyectable o en forma de implantes subcutáneos no parecen estar asociados a recaídas de la enfermedad, ni a exceso en el riesgo de trombosis en pacientes con AR3. [NE III] Los tres principales tipos de anticoncepción recomendados en las mujeres con AR son los métodos de barrera, los anticonceptivos orales con progestágenos solos y el dispositivo intrauterino3. [GR C] El implante de tres años, es una opción eficaz para las mujeres con AR. El dispositivo intrauterino es otra opción para uso a largo plazo hasta por cinco años. La píldora del día siguiente puede ser utilizada en pacientes con AR3. [GR C]
- •
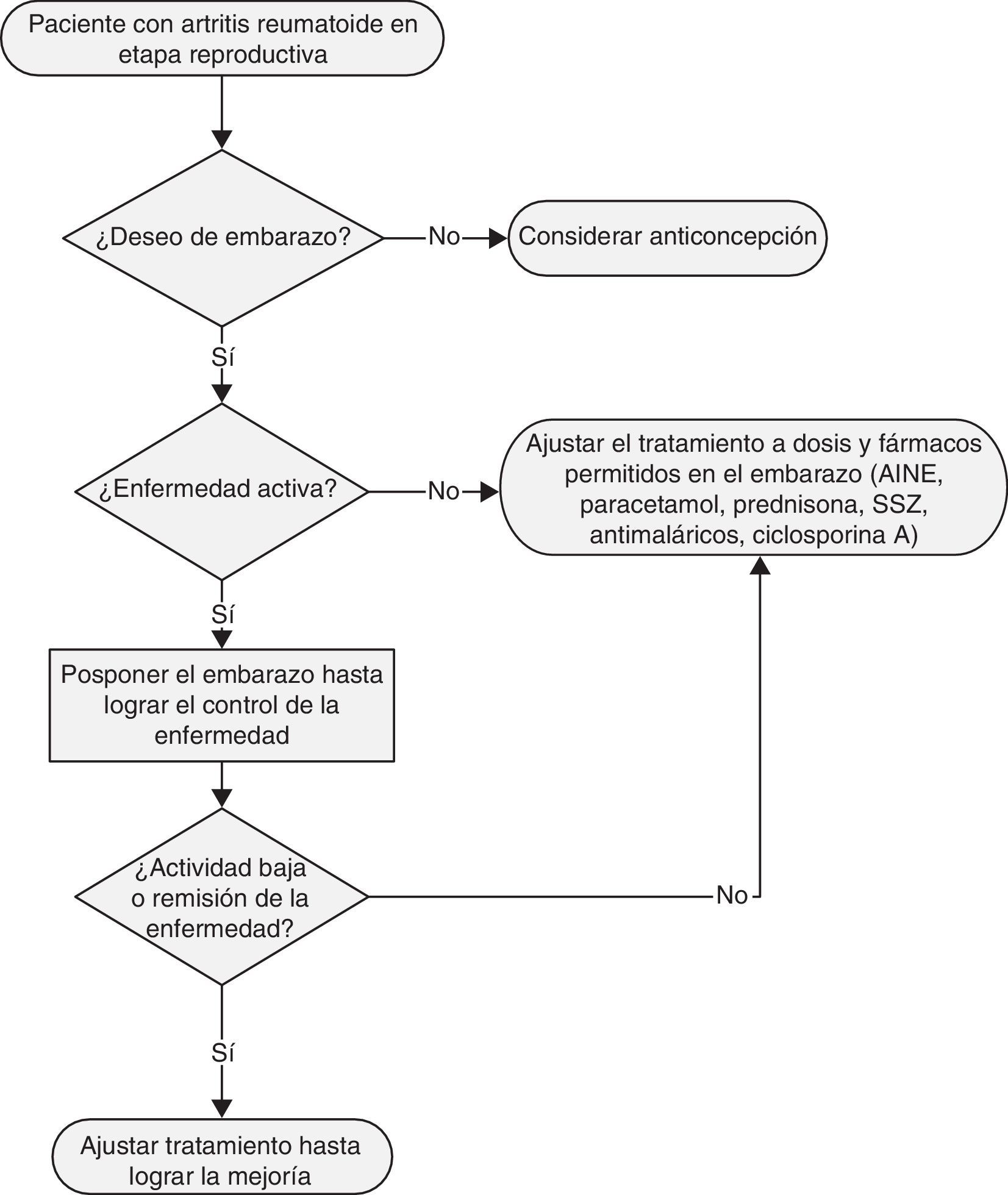
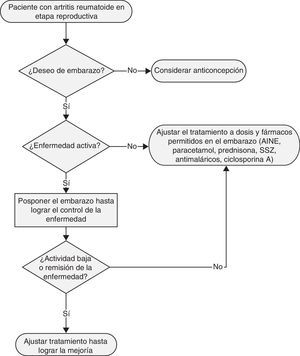
De acuerdo al contexto clínico y terapéutico, debe ofrecerse orientación sobre anticoncepción, y de acuerdo al caso y preferencias, indicar el mejor método anticonceptivo en todas las pacientes con AR en edad reproductiva (fig. 1). [PBP]
El uso de los diferentes métodos anticonceptivos, incluidos los métodos de barrera, DIU, implante subcutáneo, los orales a base de progestagénos solos y los que contienen estrógenos no se asocia a un incremento en la tasa de complicaciones, ni del riesgo de recaídas de la enfermedad3,4. [NE III] La tasa de expulsión de DIU después de los primeros 20 días de su aplicación es de 5%. La tasa de permanencia en el método después de un año es del 80%3,4. [NE III] Los diferentes métodos anticonceptivos pueden ser usados por las mujeres con AR, ya que su perfil de seguridad es similar al de las mujeres sin la enfermedad3,4. [GR C]
- •
El método de anticoncepción debe ser elegido por consenso entre la paciente con AR y su médico tratante, de acuerdo a preferencias, deseos y perfil de seguridad del caso específico. [PBP]
Un estudio prospectivo de 84 mujeres embarazadas con AR mostró una mejoría de la actividad de la enfermedad (evaluada por DAS28) durante el embarazo, con un incremento de la intensidad de la actividad en el posparto (p=0,035)5. [NE IIb] La remisión completa de la enfermedad se alcanza principalmente en el tercer trimestre del embarazo, sin embargo, del 57 al 80% de las pacientes presentan mejoría desde el primer trimestre6. [NE IV] En el periodo posparto existe un incremento transitorio en el riesgo de desarrollar AR, o de exacerbación de la misma, principalmente en los primeros 3 a 12 meses7. [NE IIb] Algunos estudios han reportado mejoría de la actividad de la enfermedad en pacientes con AR durante el embarazo (entre el 54 y 83%)8,9. [NE III] El embarazo en mujeres con AR no está contraindicado, la probabilidad de mejoría clínica de la enfermedad es alta en un porcentaje considerable de pacientes5–9. [GR B/C] Durante el puerperio se recomienda vigilar de forma estrecha la evolución clínica de la enfermedad para detectar las exacerbaciones y realizar los ajustes terapéuticos necesarios7. [GR B]
- •
La AR es una enfermedad que no contraindica el embarazo. Las pacientes deben de recibir el consejo médico necesario y estar conscientes de que aun cuando es altamente probable que en el embarazo exista una mejoría de la enfermedad, en el puerperio es probable la exacerbación de la AR. [PBP]
La regulación en la respuesta inmune celular durante el embarazo es uno de los factores propuestos que explican la mejoría clínica del dolor articular, la artritis y la rigidez articular matutina en las pacientes con AR y embarazo10. [NE IIa] El equilibrio en el perfil de citocinas Th1-Th2 en el embarazo cambia a favor de Th2, inmunidad humoral, lo cual induce la presencia de citocinas con efecto antiinflamatorio; este es otro de los mecanismos estudiados y que intervienen en la mejoría clínica en pacientes con AR y embarazo11. [NE IIa] La disparidad del HLA entre la madre y el feto es otro de los mecanismos implicados en la mejoría de la actividad clínica de la AR en mujeres embarazadas12. [NE IIa] En el posparto existe un incremento en el riesgo de presentar AR o de que se presente una exacerbación; existen 3 probables explicaciones: el microquimerismo, en relación con el papel de la persistencia de células fetales en la circulación materna seguido del desarrollo de la enfermedad (AR), el efecto de la paridad y el papel de la lactancia13. [NE IIa]
- •
Los mecanismos implicados en la mejoría clínica de la AR durante el embarazo y la exacerbación durante el posparto están parcialmente explicados y deben de extrapolarse a nuestra práctica clínica diaria. [PBP]
La aplicación del instrumento DAS28 en mujeres con embarazo normal resulta en adiciones espurias al puntaje global que se han estimado en 0,22 para la evaluación global de la salud, de 0,25 para la PCR y de 1,1 para la VSG14. [NE IIb] De las 4 variantes del instrumento DAS28, la que se realiza con PCR y sin el componente global de evaluación de la salud es la que correlaciona más estrechamente con el estado real de actividad clínica de la AR durante el embarazo14. [NE IIb] En la mujer embarazada con AR se recomienda el uso del instrumento DAS28 PCR sin el componente global de salud para la evaluación del estado clínico de actividad de la enfermedad14. [GR B]
- •
La valoración clínica de una mujer embarazada con AR debe incluir al menos cuantificación del número de articulaciones dolorosas e inflamadas, PCR e idealmente, de las escalas de evaluación funcional y del grado de actividad de la enfermedad. [PBP]
El embarazo por sí mismo resulta en un efecto aditivo espurio en la calificación del instrumento funcional HAQ, con una mediana estimada en 0,5 durante el tercer trimestre14. [NE IIb] Hasta que no se disponga de variantes adaptadas específicamente para el caso, en la mujer embarazada con AR, se recomienda tomar con precaución los resultados de la calificación HAQ, ya que esta puede estar sobrestimada, especialmente durante el tercer trimestre de la gestación14. [GR B]
En la mujer embarazada con AR, ¿cuál es el efecto predictivo de los anticuerpos (factor reumatoide y anticuerpos antipéptidos cíclicos citrulinados) sobre la actividad de la enfermedad?La negatividad simultánea para factor reumatoide (FR) y anticuerpos a péptidos cíclicos citrulinados (anti-PCC) al inicio del embarazo se asocia a mayor probabilidad de mejoría espontánea de la enfermedad durante el embarazo (75 vs. 39%, p=0,01)15. [NE IIb] En pacientes con AR activa al inicio del embarazo, se recomienda la determinación de factor reumatoide y anti-PCC, ya que la seronegatividad para ambos predice mejoría espontánea de la enfermedad15. [GR B]
- •
Es importante el conocimiento del estado de positividad al FR y los anti-PCC al inicio del embarazo de una mujer con AR, ya que permite pronosticar el curso de la actividad clínica de la enfermedad durante la gestación. [PBP]
En la mujer con AR seropositiva a FR y anti-PCC, los niveles séricos de estos anticuerpos no se modifican con respecto a los niveles preconcepcionales y no se asocian a cambios en el estado de actividad clínica de la enfermedad15. [NE IIb] No se recomienda la determinación seriada de los niveles de FR y anti-PCC durante el embarazo de mujeres con AR debido a que sus niveles no cambian con respecto al estado preconcepcional, permanecen estables durante el curso de la gestación y no se asocian con cambios en la actividad clínica de la enfermedad15. [GR B]
- •
No es necesaria la determinación seriada de los niveles de FR y anti-PCC durante el embarazo de una mujer con AR. [PBP]
En la mujer embarazada con AR activa se ha observado aumento en el riesgo de bajo peso al nacer (OR 1,47; IC95% 1,22-1,78), de productos de talla baja para la edad gestacional (OR 1,20; IC95% 1,05-138), de preeclampsia (OR 2,22; IC95% 1,59-3,11) y de nacimiento por cesárea (OR 1,19; IC95% 1,07-1,31)16. [NE IIb] En los productos nacidos de pacientes con AR usuarias de prednisona, la edad gestacional fue significativamente más baja (38,8 SDG vs. 39,9 SDG; p=0,001) y se observaron más frecuentemente partos pretérmino (8,6 vs. 6,2%; p=0,004) en comparación con los productos nacidos de mujeres de la población general17. [NE IIb] En la mujer con AR se ha observado un mayor riesgo de embarazos pretérmino (9,2 vs. 6,2%), mayor frecuencia de bajo peso al nacer (5,9 vs. 3,6%) y de óbitos (0,9 vs. 0,4%) que en la población general18. [NE IIb] Debido a que parece haber un incremento en el riesgo perinatal, en especial si hay enfermedad activa, se recomienda un control adecuada de la AR antes de planear un embarazo16. [GR B]
- •
En las mujeres con AR que desean un embarazo, es importante el adecuado control de la enfermedad, a fin de poder emitir consejo médico sobre si un embarazo es pertinente o no (fig. 1). [PBP]
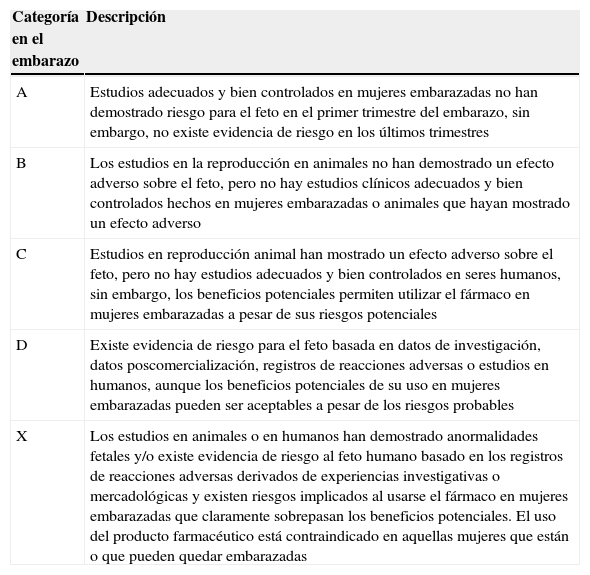
En modelos animales, los antiinflamatorios no esteroideos (AINE) a dosis suprafarmacológicas son teratogénicos si se administran en las etapas iniciales de la gestación19. [NE IV] En modelos animales y en humanos, los AINE administrados durante las etapas tardías de la gestación pueden producir cierre prematuro del conducto arterioso en el producto e hipertensión arterial pulmonar19. [NE IV] No se han descrito efectos graves de los glucocorticoides cuando son usados en dosis medias o bajas durante el embarazo19. [NE IV] La prednisona, la prednisolona y la metilprednisolona no atraviesan la barrera placentaria19. [NE IV] Hay información contradictoria con respecto al riesgo de malformaciones congénitas y pérdida gestacional en mujeres con AR que se expusieron a metotrexato de manera inadvertida durante el curso de un embarazo. Una revisión sistemática expuesta al sesgo de publicación no encontró incremento del riesgo, en tanto que una encuesta postal reportó malformaciones congénitas en mujeres con AR embarazadas expuestas a FARME solo en aquellas expuestas inadvertidamente a metotrexato20,21. [NE III] El metotrexato y la leflunomida están clasificados como fármacos de categoría X (tabla 1) en la clasificación de la Food and Drug Administration (FDA) sobre la teratogenicidad de los fármacos22. [NE IV] La hidroxicloroquina y la sulfasalazina no se asocian a incremento en la tasa de abortos espontáneos, muertes fetales o perinatales, parto pretérmino o defectos al nacimiento22,23. [NE IV] Los antagonistas del factor de necrosis tumoral, están clasificados como fármacos de categoría B por la FDA (tabla 2)24. [NE IV] El rituximab y el tocilizumab están clasificados como fármacos de categoría C por la FDA (tabla 2)24. [NE IV] En general, aún no se dispone de suficiente evidencia sobre la seguridad de los FARME biológicos durante el embarazo24. [NE IV] Se recomienda evitar en lo posible el uso de AINE durante el embarazo, en especial durante el primer trimestre, por el riesgo de teratogenicidad y en el último trimestre por el riesgo de cierre prematuro del conducto arterioso y complicaciones obstétricas, como disfunción contráctil del útero o sangrado obstétrico anormal25. [GR D] Los glucocorticoides en dosis bajas/medias (10-20mg/día de prednisona o su equivalente), específicamente la prednisona, la prednisolona o la metilprednisolona son los medicamentos de elección para el control sintomático de las reactivaciones moderadas a graves durante la gestación de las pacientes con AR22. [GR D] La hidroxicloroquina y/o la sulfasalazina son los únicos medicamentos, que por su seguridad demostrada, constituyen FARME recomendables como terapia de inicio o de mantenimiento durante el embarazo en pacientes con AR22,26. [GR D] El metotrexato y la leflunomida están contraindicados durante el embarazo, deben ser suspendidos inmediatamente apenas se detecte su concurrencia inesperada19,22,25. [GR D] Debido a que las evidencias actuales sobre su seguridad son aún limitadas, no se recomienda el uso de los FARME biológicos durante el embarazo. En caso de embarazo durante el tratamiento con terapia biológica se suspenderá el tratamiento24,27,28. [GR D]
- •
Las mujeres con AR en edad fértil, en especial las que tengan deseo presente o futuro de embarazarse, deben recibir información sobre el mejor tiempo para búsqueda del embarazo, las características de la necesidad y la temporalidad de la anticoncepción, el riesgo materno y fetal en caso de embarazo inesperado, el riesgo de recaída o mejoría de la AR durante el embarazo y el puerperio, así como la eficacia y la seguridad de los medicamentos, en especial de los FARME durante la gestación y el período de lactancia (fig. 1). [PBP]
Clasificación de los medicamentos durante el embarazo, según la Administración de Drogas y Alimentos de Estados Unidos (FDA)
| Categoría en el embarazo | Descripción |
|---|---|
| A | Estudios adecuados y bien controlados en mujeres embarazadas no han demostrado riesgo para el feto en el primer trimestre del embarazo, sin embargo, no existe evidencia de riesgo en los últimos trimestres |
| B | Los estudios en la reproducción en animales no han demostrado un efecto adverso sobre el feto, pero no hay estudios clínicos adecuados y bien controlados hechos en mujeres embarazadas o animales que hayan mostrado un efecto adverso |
| C | Estudios en reproducción animal han mostrado un efecto adverso sobre el feto, pero no hay estudios adecuados y bien controlados en seres humanos, sin embargo, los beneficios potenciales permiten utilizar el fármaco en mujeres embarazadas a pesar de sus riesgos potenciales |
| D | Existe evidencia de riesgo para el feto basada en datos de investigación, datos poscomercialización, registros de reacciones adversas o estudios en humanos, aunque los beneficios potenciales de su uso en mujeres embarazadas pueden ser aceptables a pesar de los riesgos probables |
| X | Los estudios en animales o en humanos han demostrado anormalidades fetales y/o existe evidencia de riesgo al feto humano basado en los registros de reacciones adversas derivados de experiencias investigativas o mercadológicas y existen riesgos implicados al usarse el fármaco en mujeres embarazadas que claramente sobrepasan los beneficios potenciales. El uso del producto farmacéutico está contraindicado en aquellas mujeres que están o que pueden quedar embarazadas |
La lactancia en el periodo posparto puede exacerbar la enfermedad en las pacientes con AR, debido al aumento de la prolactina, hormona cuyo papel inductor de autoinmunidad y proinflamatorio han sido demostrados29. [NE IIb] La recomendación es no contraindicar la lactancia en mujeres con AR, siempre y cuando no requieran medicamentos que sean incompatibles con la lactancia; es recomendable explicar el riesgo de exacerbación de la enfermedad a la paciente29. [GR B]
- •
La lactancia puede permitirse en pacientes con AR, siempre y cuando el tratamiento que reciben no contraindique la misma. La probabilidad de exacerbación de la enfermedad se debe exponer a las pacientes para tomar una decisión conjunta. [PBP]
El síndrome por anticuerpos antifosfolípidos (SAF) es una enfermedad autoinmune sistémica que se caracteriza por la presencia de anticuerpos antifosfolípidos y manifestaciones clínicas asociadas tales como trombosis arterial, trombosis venosa y/o complicaciones obstétricas, especialmente pérdidas recurrentes de la gestación30.
En la mujer con SAF, ¿cuáles son las opciones de anticoncepción más seguras?Los anticonceptivos orales combinados, los parches e implantes transdérmicos, el anillo vaginal, así como los anticonceptivos inyectables mensuales, bimensuales y trimestrales, están contraindicados en pacientes con lupus eritematoso sistémico (LES) y anticuerpos antifosfolípidos (aFL) positivos31,32. [NE Ib] No hay información directa obtenida de pacientes con SAF primario o secundario a LES; deben seguirse entonces las mismas recomendaciones que las de los pacientes con LES y aFL positivos. Por lo que en la mujer con SAF no se recomiendan los anticonceptivos orales combinados, los parches e implantes transdérmicos, el anillo vaginal, ni los anticonceptivos inyectables mensuales, bimensuales y trimestrales31,32. [GR A] En la mujer con SAF el DIU liberador de cobre es un método seguro. El DIU liberador de levonorgestrel puede usarse en casos individuales y bajo estrecha supervisión médica31,32. [GR A]
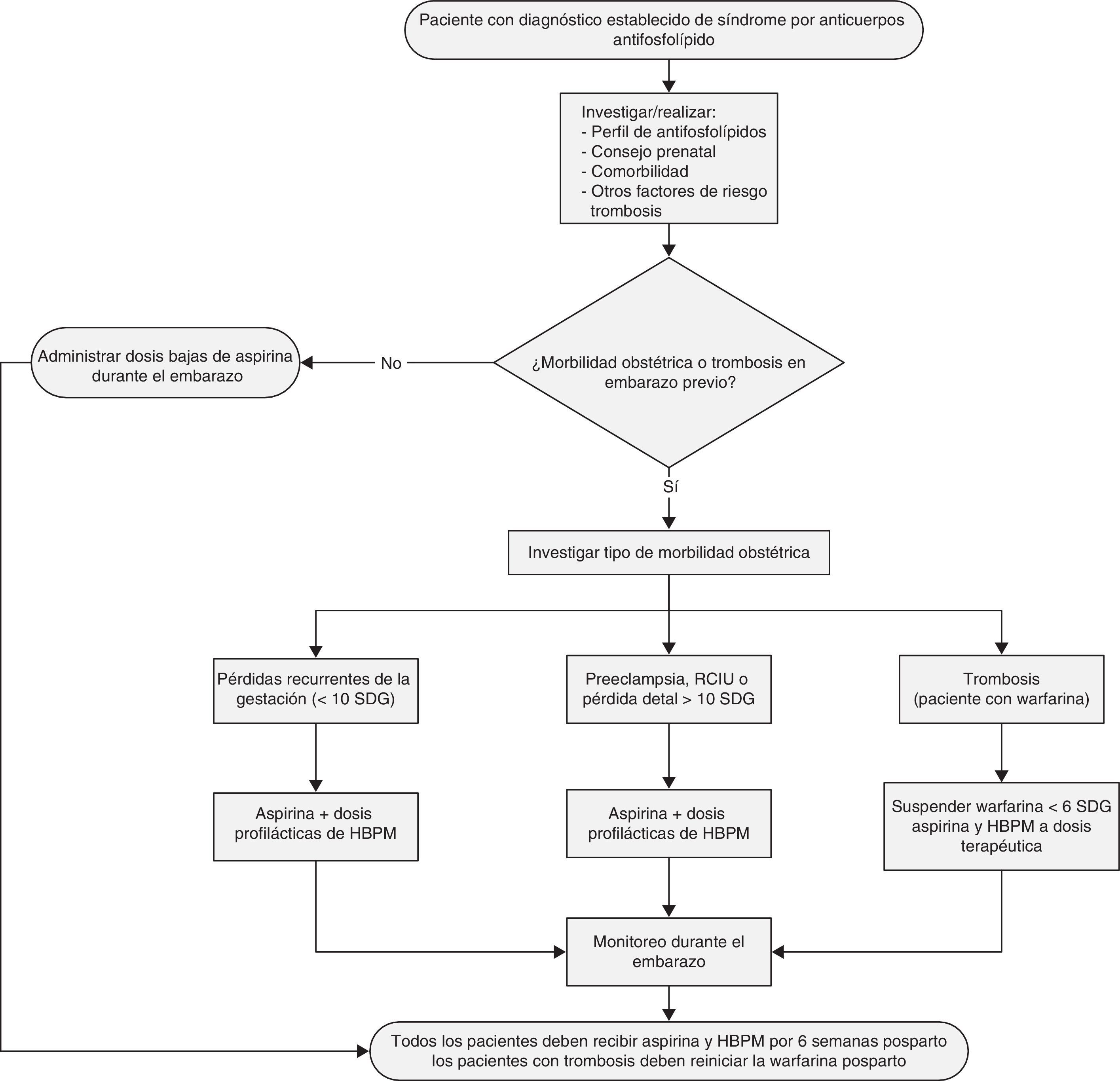
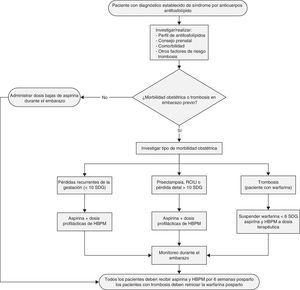
En la mujer con SAF, ¿cuáles son las acciones y procedimientos que se deben implementar durante el control prenatal?La hipertensión y la hipertensión arterial pulmonar durante el embarazo se asocian a diversas complicaciones materno-fetales tales como muerte materna y pérdidas de la gestación33,34. [NE IIa/III] Se sugiere evitar el embarazo en las mujeres con SAF secundario con historia de trombosis en los últimos 6 meses, HAP, HTA descontrolada o historia de HELLP o preeclampsia grave35. [GR D] Durante el planeamiento del embarazo, se recomienda realizar perfil de aFL y consejo preconcepcional sobre los riesgos de complicaciones del embarazo (fig. 2)35. [GR D] El US Doppler a partir del segundo trimestre de la gestación puede ser útil como predictor de preeclampsia e insuficiencia placentaria en pacientes con SAF primario o secundario a LES36. [NE III] En la mujer embarazada con SAF, es útil realizar US Doppler de arteria uterina y umbilical a partir del segundo trimestre y mensual como predictor de preeclampsia e insuficiencia placentaria36. [GR C] En las mujeres embarazadas con SAF se sugiere realizar visitas prenatales cada 2 semanas hasta la mitad de la gestación y luego semanalmente para detección temprana de proteinuria, trombocitopenia, control de la TA y US obstétrico y flujometría37. [GR D]
En la mujer embarazada con SAF, ¿cuáles son los factores de riesgo para desarrollar preeclampsia?El riesgo relativo (RR) de preeclampsia en portadoras de aFL es de 9,72 (IC%95 4,34-21,75). Otros factores de riesgo en la población general a considerar son historia previa de preeclampsia (RR 7,19), diabetes preexistente (RR 3,56), embarazos múltiples (RR 2,92), nuliparidad (RR 2,91), historia familiar (RR 2,9), TAD elevada (≥80mmHg) al inicio del embarazo (RR 1,38), IMC elevado antes del embarazo (RR 2,47) y edad materna ≥40 años (RR 1,96)38. [NE Ia]
En la mujer embarazada con SAF, con antecedente de 3 o más pérdidas tempranas (≤10 SDG) sin antecedente de trombosis previa ¿cuáles son las opciones de tratamiento de mayor eficacia (fig. 2)?La terapia combinada de aspirina a dosis bajas (81-100mgs/diarios) más heparina a dosis profilácticas (no fraccionada 5000 UI c/12h o heparina de bajo peso molecular), es más eficaz comparado con aspirina a dosis bajas sola para reducir la tasa de pérdida gestacional (>50%)38,39. [NE Ia] En un metaanálisis de 5 estudios (334 pacientes con pérdidas recurrentes de la gestación con aFL positivos) se encontró una tasa de nacidos vivos de 74,2 vs. 55,8% con heparina a dosis profilácticas más aspirina a dosis bajas vs. aspirina sola a dosis bajas, respectivamente40. [NE Ia] El tratamiento con heparina a dosis profilácticas debe iniciarse posterior a confirmarse el embarazo y continuarlo durante todo el período gestacional39,40. [GR A] El efecto de añadir prednisona en mujeres embarazadas con SAF no ha demostrado ser superior al régimen aspirina y/o heparina y sí incrementa el riesgo de complicaciones (hipertensión arterial, diabetes gestacional, prematuridad)41. [NE Ib] En una serie de 23 embarazos de mujeres con pérdidas gestacionales relacionadas con aFL refractarias a tratamiento, la adición de 10mg de prednisolona durante el primer trimestre al régimen de dosis bajas de aspirina más heparina mejoró la tasa de nacidos vivos (de un histórico de 4 a 61%) pero con un riesgo alto de complicaciones materno-fetales42. [NE III] No se recomienda añadir de manera sistemática prednisona al tratamiento convencional de SAF en mujeres embarazadas41. [GR A] El tratamiento con inmunoglobulina intravenosa no ha mostrado ser superior a heparina y aspirina a dosis bajas en mujeres con SAF y pérdidas gestacionales recurrentes, con una tasa de nacidos vivos de 39,5 vs. 72,5% (p=0,003), respectivamente43. [NE Ib] No se recomienda el uso sistemático de inmunoglobulina intravenosa en mujeres embarazadas con SAF43. [GR A]
En la mujer embarazada con SAF, con antecedente de al menos una muerte fetal (>10 SDG) o parto pretérmino (<34 SDG) debido a preclampsia grave o insuficiencia placentaria sin antecedente de trombosis previa ¿cuáles son las opciones de tratamiento de mayor eficacia (fig. 2)?La terapia combinada de aspirina a dosis bajas más heparina no fraccionada en dosis profilácticas (5000 UI c/12h) o heparina de bajo peso molecular es más eficaz comparado con aspirina sola a dosis bajas para reducir la pérdida gestacional (>50%)39,40. [NE Ia] El tratamiento con heparina se debe iniciar posterior a la confirmación del embarazo y utilizarse durante todo el período gestacional39,40. [GR A]
En la mujer embarazada con SAF, con antecedente de trombosis previa independientemente de su historia obstétrica, ¿cuáles son las opciones de tratamiento de mayor eficacia (fig. 2)?Las pacientes embarazadas con SAF e historia de trombosis previa han sido excluidas sistemáticamente de los ensayos clínicos controlados35. [NE IV] En las mujeres embarazadas con SAF y antecedente previo de trombosis, se recomienda el régimen terapéutico (tromboprofilaxis secundaria) con dosis bajas de aspirina más heparina de bajo peso molecular con dosis de anticoagulación (p. ej. enoxaparina 1mg/kg SC o dalteparina 100 U/kg, SC c/12 horas o enoxaparina 1,5mg/kg/día SC o dalteparina 200 U/kg/día SC35,44. [GR D] Se recomienda agregar al tratamiento calcio suplementario y vitamina D, para disminuir el riesgo de osteopenia35. [GR D] Los nuevos anticoagulantes orales como dabigatran, rivaroxaban o apixaban no están recomendados durante el embarazo45. [GR D]
En la mujer embarazada con SAF, ¿qué influencia tienen los anticuerpos antifosfolípidos en el curso clínico y en la decisión terapéutica?Los aFL pueden asociarse con pérdida fetal recurrente. El anticoagulante lúpico ha sido asociado a preeclampsia (OR 2,34, IC95%: 1,18-4,64), retardo en crecimiento intrauterino (OR 4,65, IC95% 1,29-16,71) y pérdida fetal tardía (OR 4,73, IC95% 1,08-20,81)46. [NE Ia] Las anticardiolipinas han sido asociadas a preeclampsia (OR 1,52, IC95% 1,05-2,20) y pérdida fetal tardía (OR 4,29, IC95% 1,34-13,68)46. [NE Ia] Los anticuerpos anti-B2GP1 han sido asociados a preeclampsia (OR 19,14, IC95% 6,34-57,7), retardo en el crecimiento intrauterino (OR 20,03, IC95% 4,59-87,43) y pérdida fetal tardía (OR 43,46, IC95% 1,21-456)46. [NE Ia] El anticoagulante lúpico es predictor primario (RR 12,5, IC95% 1,27-50,54) de resultado adverso en el embarazo después de 12 semanas de gestación47. [NE IIb] No existen estudios clínicos controlados estratificados que hayan evaluado el tratamiento del embarazo de acuerdo al perfil de antifosfolípidos48. [NE IV] En las mujeres con SAF y embarazo, el perfil de aFL determina un riesgo en el embarazo, no así el régimen de tratamiento44. [GR D]
En la mujer con SAF, ¿cuáles son las opciones de tratamiento de mayor eficacia en el puerperio?Durante las primeras 6 semanas posparto, la mujer tiene un riesgo elevado de presentar tromboembolismo venoso48. [NE Ia] En las mujeres con SAF obstétrico se recomienda continuar con la administración de heparina de bajo peso molecular durante 6 a 12 semanas posparto y en aquellas pacientes con antecedente de trombosis previa iniciar la administración de warfarina tan pronto se inicie la vía oral, siendo ambos fármacos seguros en la lactancia49. [GR B]
En la mujer con SAF, ¿cuáles son las opciones de tratamiento periparto o pericesárea?En las mujeres con SAF, se recomienda suspender el uso de heparina de bajo peso molecular 12 horas antes del procedimiento quirúrgico o al inicio del trabajo de parto y el uso de aspirina debe suspenderse al menos 7 días antes del procedimiento quirúrgico35. [GR D]
En los hijos de madres con SAF, ¿cuáles son las acciones y procedimientos que se deben implementar durante el seguimiento neonatal?En un seguimiento de hijos de madres con SAF a 5 años no se presentaron trombosis ni LES. Se ha reportado niños con alteraciones de la conducta (autismo, trastorno de hiperactividad, trastorno de la alimentación con retraso en el lenguaje e hipotonía axial con retraso psicomotor)50. [NE III] En los neonatos hijos de madres con SAF se recomienda el seguimiento posterior en busca de alteraciones de la conducta50. [GR C] La trombosis perinatal en hijos de madres con SAF es un evento raro con desenlace fatal51. [NE IV] En los neonatos hijos de madres con SAF con manifestaciones clínicas se recomienda realizar el perfil de aPL51. [GR D]
Fármacos antirreumáticosPlanear el embarazo en una mujer con enfermedad reumática requiere de un análisis cuidadoso de los fármacos con el objeto de mantener controlada la enfermedad y minimizar los riesgos fetales. La información del uso de los fármacos durante el embarazo es limitada y deriva en gran medida de la exposición inadvertida de los mismos durante embarazos no planeados (tabla 1).
En la mujer embarazada con enfermedad autoinmune, ¿cuál es el riesgo fetal de la exposición a antiinflamatorios no esteroideos/analgésicos?El uso de aspirina durante el primer trimestre del embarazo incrementa el riesgo de gastrosquisis en el recién nacido (OR 2,37, IC95% 1,44-3,88)52. [NE Ia] El uso de AINE durante el primer trimestre del embarazo incrementa el riesgo de malformaciones cardiacas congénitas (OR 1,86)53. [NE Ia] La exposición a AINE durante el tercer trimestre incrementa el riesgo de cierre prematuro del conducto arterioso54. [NE III] Para evitar el riesgo de cierre prematuro del conducto arterioso, no se recomienda el uso de AINE a partir de la semana 32 de gestación54. [GR C]
Un estudio de cohorte de base poblacional, concluyó que el uso prenatal de AINE incrementa en un 80% el riesgo de aborto (HR 1,8; IC95% 1,0 a 3,2)55. [NE III] El uso de AINE durante el tercer trimestre se asocia con disgenesia renal y oligohidroamnios56. [NE III] La administración de aspirina en dosis menor a 100mg/día es segura durante el embarazo57. [GR D] Todos los AINE, excepto la aspirina en dosis bajas, se deben suspender antes de las 32 semanas de gestación57. [GR D]
En la mujer embarazada con enfermedad autoinmune, ¿cuál es el riesgo materno/fetal de la exposición a glucocorticoides para el tratamiento de la enfermedad?Estudios de cohorte de base poblacional, no mostraron asociación significativa entre el uso de glucocorticoides no fluorados durante el embarazo y el desarrollo de malformaciones orofaciales (labio y paladar hendido)58,59. [NE IIb] Se pueden emplear durante el embarazo glucocorticoides no fluorados en las dosis requeridas durante el embarazo para control de la enfermedad58. [GR B]
En ensayos clínicos, la administración única de un curso de glucocorticoides fluorados en la mujer embarazada con amenaza de parto prematuro se asoció con una reducción significativa en las tasas de muerte neonatal, síndrome de dificultad respiratoria y hemorragia intraventricular60. [NE Ia] En ensayos clínicos, la administración de múltiples cursos de glucocorticoides fluorados antes del nacimiento no se relacionó con mejoría en la morbimortalidad neonatal61. [NE Ia] En mujeres con riesgo de parto prematuro entre las semanas 24 y 34 de gestación, de ser necesario, se recomienda indicar un ciclo único de glucocorticoide fluorado prenatal61. [GR A] La exposición prenatal a glucocorticoides no se relaciona con la presencia de sepsis en el recién nacido62. [NE III] Cuando se requiera el uso de glucocorticoides para el tratamiento de la enfermedad autoinmune de la madre, se recomienda emplear prednisona, prednisolona o metilprednisolona a la menor dosis y tiempo posibles62. [GR C]
En la mujer embarazada que toma glucocorticoides durante el embarazo, los riesgos de desarrollar diabetes mellitus, hipertensión arterial y osteoporosis, son los mismos que los de las mujeres no embarazadas63. [NE III] La mujer embarazada que requiere del uso crónico de glucocorticoides debe recibir las mismas medidas recomendadas para otras usuarias de estos fármacos, para la prevención de diabetes, sobrepeso, dislipidemia y osteoporosis63. [GR C]
En la mujer embarazada con enfermedad autoinmune, ¿cuál es el riesgo fetal de la exposición a antimaláricos, azatioprina, sulfasalazina, ciclosporina A, leflunomida, ácido micofenólico, ciclofosfamida y metotrexato?El uso de antimaláricos durante el embarazo no se relaciona con malformaciones congénitas, abortos espontáneos, muerte fetal ni prematuridad64. [NE Ia] El uso de antimaláricos durante el embarazo en pacientes con LES se asocia con disminución en la actividad de la enfermedad, menor tasa de recaídas y permite disminuir la dosis de prednisona65. [NE Ib] Durante el embarazo, es segura la administración de antimaláricos64. [GR A]
No existe asociación significativa entre el uso de sulfasalazina y malformaciones congénitas, óbitos, abortos, partos prematuros o productos con bajo peso al nacer66,67. [NE Ia] Los hallazgos de estudios observacionales, no documentan un incremento significativo en la prevalencia de malformaciones congénitas en los niños de las mujeres tratadas con sulfasalazina durante el embarazo68,69. [NE III] El embarazo es seguro en las pacientes tratadas con sulfasalazina. Por su mecanismo de acción se recomienda suplementar con ácido fólico57,69. [GR A]
El uso de azatioprina y 6-mercaptopurina en la concepción y el embarazo no se asocia a malformaciones congénitas o bajo peso al nacer, aunque sí con parto pretérmino70. [NE Ia] La exposición de los hombres a tiopurinas en el momento de la concepción, no se asocia con malformaciones congénitas. [NE Ia] La azatioprina puede emplearse durante el embarazo para el control de la enfermedad autoinmune71. [GR A]
El uso de ciclosporina A durante el embarazo no se asocia con malformaciones congénitas, parto pretérmino o bajo peso al nacer72. [NE Ia] En caso necesario la ciclosporina A puede emplearse durante el embarazo72. [GR A]
En animales expuestos a leflunomida existe un alto riesgo de teratogenicidad y muerte embrionaria; sin embargo, estudios en humanos no han mostrado efectos teratogénicos57,73,74. [NE III/IV] Un análisis prospectivo de 64 mujeres embarazadas con AR expuestas a leflunomida durante el primer trimestre (95% recibió colestiramina) no encontró diferencias en defectos estructurales mayores de los recién nacidos en comparación con mujeres no expuestas al fármaco o sanas (5,4 vs. 4,2%, p=0,13)73. [NE IIb] No se recomienda el uso de leflunomida durante el embarazo57,75. [GR D] Pacientes (hombres y mujeres) tratados con leflunomida que planeen un embarazo, deben suspender la leflunomida 2 años antes, o realizar protocolo de eliminación (colestiramina 8g cada 8h durante 11 días, midiendo niveles séricos y, de requerirlo, repetir el esquema de colestiramina)57,73–75. [GR D]
La exposición materna a ácido micofenólico durante el primer trimestre del embarazo se asocia a incremento en pérdidas fetales y una embriopatía característica (microtia, labio y paladar hendido, braquidactilia e involucro de órganos como corazón, riñón y sistema nervioso central)76,77. [NE IV] En caso de planear un embarazo, se recomienda suspender el ácido micofenólico tres meses antes de la concepción76–78. [GR D]
La administración de metotrexato durante el embarazo se asocia con incremento en la incidencia de abortos79. [NE IV] El metotrexato es un fármaco teratogénico que se asocia con el síndrome aminopterina (retraso en el crecimiento intrauterino, hipoplasia del hueso frontal, osificación anormal de cráneo, implantación baja de pabellones auriculares, micrognatia, anomalías en las extremidades y alteraciones cardiacas)56. [NE IV] El uso de metotrexato está contraindicado durante el embarazo56. [GR D] El metotrexato tiene una vida media prolongada y se deposita ampliamente en los tejidos hasta durante 4 meses63. [NE IV] Debido a la prolongada vida media de metotrexato, se debe suspender su uso de 3 a 6 meses antes de la concepción79. [GR D]
La ciclofosfamida se asocia con menopausia precoz, nuliparidad, falla ovárica prematura, alteración de la espermatogénesis y disminución en la frecuencia de embarazos80. [NE IIb] La ciclofosfamida es gonadotóxica en hombres y mujeres. En la mujer depende de la dosis acumulada y la edad; mientras que en los hombres no hay un umbral de dosis acumulada57. [NE IV] La administración de ciclofosfamida durante el primer trimestre del embarazo se asocia con embriopatía57. [NE IV] No se debe emplear ciclofosfamida durante el embarazo, especialmente en el primer trimestre57,63. [GR D] En mujeres premenopáusicas sin paridad satisfecha se sugiere la preservación de la función ovárica con el uso de antagonistas de la hormona liberadora de gonadotrofina81. [GR D]
No existe un incremento en el riesgo de aborto y malformaciones congénitas con el uso de tacrolimus82. [NE III] La evidencia disponible indica que el tacrolimus puede ser empleado durante el embarazo82. [GR C]
En la mujer embarazada con enfermedad autoinmune, ¿cuál es el riesgo fetal de la exposición a fármacos biológicos (anti-TNFα, rituximab y otros) (tabla 2)?En una revisión sistemática de la literatura de mujeres con enfermedad inflamatoria intestinal (EII) expuestas a agentes bloqueadores del TNFα (infliximab, adalimumab, certolizumab pegol) se encontró que la tasa de abortos espontáneos y anormalidades congénitas es similar a la población general o mujeres con EII no expuestas a estos fármacos83. [NE Ib] Se ha sugerido un posible efecto causal de la exposición in-utero a antagonistas del TNFα (infliximab y etanercept) y la asociación VACTERL (alteraciones vertebrales, atresia anal, defectos cardíacos, traqueoesofágica, renal y alteraciones en extremidades) en una revisión de la base de datos de la FDA de los Estados Unidos28. [NE III] En un estudio de base poblacional europea no se pudo confirmar la relación de los antagonistas del TNFα con la asociación VACTERL en mujeres con diversas enfermedades autoinmunes84. [NE III] Recientemente, en un estudio prospectivo de 86 mujeres embarazadas (principalmente con AR e EII) expuestas (97,6% en el primer trimestre) a agentes bloqueadores del TNFα no se encontró un mayor riesgo de teratogenicidad en comparación con controles no expuestas y no se encontraron casos de asociación VATER/VACTERL85. [NE IIb] No se recomienda el uso de agentes biológicos durante el embarazo, aunque valorando riesgo y beneficio, si la paciente ya los recibe, puede mantenerlos hasta la semana 20 de gestación86–88. [GR C]
Un análisis retrospectivo de 153 embarazos con exposición materna a rituximab encontró 21% de abortos, 90 nacidos vivos (76% a término) y 2% de anormalidades congénitas89. [NE III] La experiencia con el uso de rituximab, abatacept y tocilizumab es limitada para establecer conclusiones sobre la seguridad en el embarazo86. [NE IV] Se ha demostrado que abatacept cruza la placenta. Certolizumab carece de la porción Fc del anticuerpo, no obstante, el fragmento Fab puede cruzar de forma pasiva la placenta en niveles bajos durante el primer trimestre90. [NE III] No se debe iniciar o continuar abatacept, certolizumab, rituximab o tocilizumab durante el embarazo hasta que haya más información disponible86. [GR D] Con abatacept se recomienda el uso de anticoncepción hasta 10 semanas después de retirado el fármaco86. [GR D].
En la mujer con enfermedad autoinmune que se encuentra lactando, ¿cuáles son los medicamentos antirreumáticos que se pueden emplear con mayor seguridad (tabla 3)?La mayoría de los AINE se excretan en pequeñas cantidades en la leche materna91. [NE IV] Se recomienda administrar la dosis de AINE inmediatamente después de la alimentación del seno materno, con el propósito de minimizar la exposición del bebé 57,91,92. [GR D]
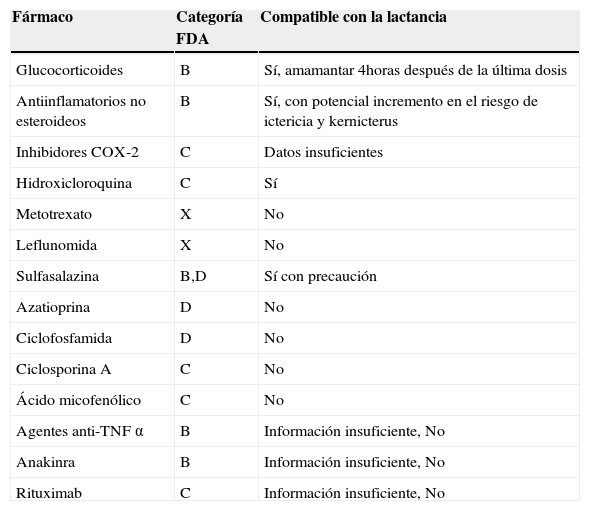
Fármacos antirreumáticos en el embarazo y la lactancia
| Fármaco | Categoría FDA | Compatible con la lactancia |
|---|---|---|
| Glucocorticoides | B | Sí, amamantar 4horas después de la última dosis |
| Antiinflamatorios no esteroideos | B | Sí, con potencial incremento en el riesgo de ictericia y kernicterus |
| Inhibidores COX-2 | C | Datos insuficientes |
| Hidroxicloroquina | C | Sí |
| Metotrexato | X | No |
| Leflunomida | X | No |
| Sulfasalazina | B,D | Sí con precaución |
| Azatioprina | D | No |
| Ciclofosfamida | D | No |
| Ciclosporina A | C | No |
| Ácido micofenólico | C | No |
| Agentes anti-TNF α | B | Información insuficiente, No |
| Anakinra | B | Información insuficiente, No |
| Rituximab | C | Información insuficiente, No |
FDA: Food and Drug Administration.
Las concentraciones de prednisona y prednisolona son muy bajas en la leche materna incluso en dosis mayores de 20mg por día63. [NE III] La mujer con enfermedad autoinmune que recibe glucocorticoide puede continuar la alimentación con el seno materno57,86,92. [GR C] Se recomienda amamantar 4 horas después de la ingestión de la dosis de glucocorticoiede o tomarla inmediatamente después de lactar63. [GR C]
La excreción de 6-mercaptopurina es baja en la leche materna. Estudios observacionales no analíticos concluyen que el uso de tiopurinas durante la lactancia es segura93–95. [NE IV] El uso de azatioprina y 6-mercaptopurina parecen ser seguros durante la lactancia88,93,96. [GR D]
No existe suficiente evidencia respecto a la seguridad de ciclosporina A durante la lactancia57. [NE IV] No se recomienda el uso de ciclosporina durante la lactancia57,92. [GR D]
No hay evidencia suficiente acerca de la seguridad de leflunomida durante la lactancia57. [NE IV] Ante la limitada evidencia respecto a la seguridad de leflunomida durante la lactancia no se recomienda su uso86,92. [GR D]
No existe evidencia en humanos respecto al uso de ácido micofenólico durante la lactancia76,78. [NE IV] No se recomienda el micofenolato de mofetilo durante la lactancia76,78. [GR D]
El metotrexato tiene una vida media prolongada y se deposita ampliamente en los tejidos hasta durante 4 meses63,86. [NE IV] El uso de metrotexato durante la lactancia se encuentra contraindicado78,86,92. [GR D]
La ciclofosfamida se excreta en la leche materna y puede causar supresión de la hematopoyesis en lactantes57. [NE IV] No se debe emplear ciclofosfamida durante la lactancia materna57,63,92. [GR D]
Existe poca evidencia (reportes de caso) del uso de anticuerpos anti-TNFα, moléculas de fusión anti-TNFα, abatacept, rituximab y tocilizumab en la lactancia86,88,92. [NE IV] No se recomienda el uso de agentes biológicos durante la lactancia hasta que haya más información disponible92. [GR D]
La administración materna de cumarínicos y heparina es segura para el recién nacido que recibe alimentación del seno materno97. [NE IV] Se pueden emplear cumarínicos o heparinas como anticoagulantes durante la lactancia debido a su baja excreción en la leche materna97. [GR C]
En la mujer embarazada con enfermedad autoinmune, ¿cuál es el riesgo fetal de la exposición a anticoagulantes orales y heparina?El uso de cumarínicos durante el primer trimestre del embarazo (6 a 12 semanas) se asocia con malformación congénita aislada y embriopatía asociada a warfarina98. [NE Ia] La warfarina atraviesa con facilidad la placenta, debido a su bajo peso molecular, por lo que se asocia con hemorragia intracraneal97. [NE IV] La exposición in utero a warfarina se ha asociado con labio y paladar hendido, atresia o estenosis de coanas, microftalmia, atrofia óptica, catarata, coartación de la aorta, situs inversus, pulmones bilobulados, así como hipoplasia de extremidades97. [NE IV] No se debe administrar warfarina durante el primer trimestre del embarazo97,98. [GR D] En ensayos clínicos se ha mostrado que el uso de heparina de bajo peso molecular durante el embarazo permite la disminución de la tasa de pérdidas fetales recurrentes en pacientes con trombofilia99. [NE Ia] El tratamiento materno con cumarínicos y heparina es seguro para el recién nacido que recibe alimentación del seno materno97. [NE IV] Se recomienda el uso de heparina no fraccionada y heparina de bajo peso molecular, como los anticoagulantes preferidos para uso durante el embarazo, ya que debido a su peso molecular no tienen paso transplacentario97. [GR D]
Comentario finalLa presente guía de práctica clínica puede ser fácil de difundir e implementar pero puede ser difícil de aplicar por diversas razones en el contexto de nuestro entorno sociocultural. Las pacientes tienen poca cultura acerca del impacto del embarazo en enfermedades reumáticas autoinmunes y en algunos sectores existe un acceso incompleto a los servicios de salud. Por otro lado, el conocimiento limitado de médicos no reumatólogos del efecto del embarazo sobre la enfermedad autoinmune y viceversa también puede ser una limitación en su completa aplicación. Esto requiere de una intervención educativa intensa en nuestra población para generar un cambio que redunde en una mejor atención de este grupo de pacientes, por lo que confiamos en que el presente manuscrito colabore en este cambio.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesEl Colegio Mexicano de Reumatología recibió un apoyo educacional irrestricto de la empresa UCB. El personal que labora en UCB no tuvo ninguna injerencia con la información vertida en este manuscrito ni participó en las reuniones del grupo de trabajo.