El embarazo en mujeres con enfermedades reumáticas autoinmunes se asocia a diversas complicaciones maternofetales. El desarrollo de guías de práctica clínica con la mejor evidencia científica disponible puede ayudar a homogeneizar la atención en estas pacientes.
ObjetivosProporcionar recomendaciones respecto al control prenatal, el tratamiento y el seguimiento más efectivo de la mujer embarazada con lupus eritematoso (LES), artritis reumatoide (AR) y síndrome por anticuerpos antifosfolípidos (SAF).
MetodologíaPara la elaboración de las recomendaciones se conformaron grupos nominales de expertos y se realizaron consensos formales, búsqueda sistematizada de la información, elaboración de preguntas clínicas, elaboración y calificación de las recomendaciones, fase de validación interna por pares y validación externa del documento final teniendo en cuenta los criterios de calidad del instrumento AGREE II.
ResultadosLos grupos de trabajo contestaron las 37 preguntas relacionadas con la atención maternofetal en LES, AR y SAF, así como de fármacos antirreumáticos durante el embarazo y la lactancia. Las recomendaciones fueron discutidas e integradas en un manuscrito final y se elaboraron los algoritmos correspondientes. En esta primera parte se presentan las recomendaciones para mujeres embarazadas con LES.
ConclusionesLa guía mexicana de práctica clínica para la atención del embarazo en mujeres con LES proporciona recomendaciones e integra la mejor evidencia disponible para el tratamiento y el seguimiento de estas pacientes.
Pregnancy in women with autoimmune rheumatic diseases is associated with several maternal and fetal complications. The development of clinical practice guidelines with the best available scientific evidence may help standardize the care of these patients.
ObjectivesTo provide recommendations regarding prenatal care, treatment, and a more effective monitoring of pregnancy in women with lupus erythematosus (SLE), rheumatoid arthritis (RA) and antiphospholipid antibody syndrome (APS).
MethodologyNominal panels were formed for consensus, systematic search of information, development of clinical questions, processing and grading of recommendations, internal validation by peers, and external validation of the final document. The quality criteria of the AGREE II instrument were followed.
ResultsThe various panels answered the 37 questions related to maternal and fetal care in SLE, RA, and APS, as well as to the use of antirheumatic drugs during pregnancy and lactation. The recommendations were discussed and integrated into a final manuscript. Finally, the corresponding algorithms were developed. We present the recommendations for pregnant women with SLE in this first part.
ConclusionsWe believe that the Mexican clinical practice guidelines for the management of pregnancy in women with SLE integrate the best available evidence for the treatment and follow-up of patients with these conditions.
Las enfermedades autoinmunes se desarrollan más comúnmente en mujeres en etapa reproductiva, por lo que el embarazo es un evento potencialmente frecuente en ellas. El embarazo requiere de la interacción de mecanismos endocrinos e inmunes, los cuales facilitan la comunicación maternofetal, regulan la implantación, promueven el crecimiento placentario y previenen el inmunorrechazo del feto semialogénico1. Estos cambios pueden afectar el curso clínico de las enfermedades autoinmunes, y estas a su vez pueden influir sobre el desenlace maternofetal, por lo que se consideran embarazos de alto riesgo2. El tipo y frecuencia de las complicaciones maternofetales varían con cada enfermedad autoinmune2. Sin embargo, en términos generales, el riesgo de un desenlace maternofetal adverso se puede reducir cuando el embarazo es planeado, sobre todo cuando la enfermedad esté controlada y puedan usarse medicamentos de riesgo mínimo durante la gestación. Por ello, se requiere de un equipo multidisciplinario que participe en el proceso de atención de este grupo de pacientes y contribuya a mejorar el desenlace maternofetal.
El embarazo en la mujer con enfermedad reumática autoinmune, especialmente aquella con lupus eritematoso sistémico (LES), supone un reto importante para los médicos que se ocupan del proceso de atención de este grupo de pacientes. El conocimiento sobre la seguridad de los medicamentos, el efecto del embarazo sobre la enfermedad, el efecto de la enfermedad sobre el embarazo, el asesoramiento preconcepcional y la participación de un equipo multidisciplinario, constituyen los pilares básicos para brindar una atención obstétrica y médica efectiva y segura. Un embarazo planeado asociado a una vigilancia obstétrica estrecha durante todo el embarazo y el puerperio incrementan la probablidad de obtener desenlaces favorables en el binomio madre-hijo.
El desarrollo de una guía de práctica clínica (GPC) para embarazo y enfermedades reumáticas autoinmunes surge de la necesidad de proporcionar recomendaciones sustentadas en la mejor evidencia científica disponible al profesional de la salud que atiende a este grupo de pacientes con la intención de reducir al mínimo posible la frecuencia de complicaciones maternofetales. En esta primera parte de la GPC se presenta el desarrollo y metodología de la misma, así como las recomendaciones en mujeres con LES.
Alcance y objetivos- •
Proporcionar recomendaciones respecto al control prenatal, el tratamiento y el seguimiento más efectivo de la mujer embarazada con LES, artritis reumatoide (AR) y síndrome por anticuerpos antifosfolípidos (SAF).
- •
Prevenir las principales complicaciones maternofetales en mujeres con enfermedades reumáticas autoinmunes.
- •
Identificar y disminuir el riesgo de reacciones y eventos adversos fetales relacionados con el uso de fármacos antirreumáticos en mujeres con enfermedades reumáticas autoinmunes.
La presente guía está dirigida a reumatólogos, gineco-obstetras, médicos internistas y neonatólogos.
Población blancoMujeres≥18 años de edad con diagnóstico establecido de LES, AR y SAF.
Nivel de atenciónSegundo y tercer nivel de atención. La aplicación de esta guía mejorará la efectividad, la seguridad y la calidad de la atención médica de la población blanco.
MetodologíaLa metodología utilizada en la elaboración del documento incluyó la conformación de grupos nominales de expertos, realización de consensos formales, búsqueda de información sistematizada, elaboración de preguntas clínicas, elaboración y calificación de recomendaciones, fase de validación interna por pares, así como la validación externa del documento final. Durante la elaboración de la guía se han tenido en cuenta los criterios de calidad del instrumento AGREE II3.
Grupo de trabajo. Para la conformación del grupo de trabajo se realizó una invitación a 30 reumatólogos miembros del Colegio Mexicano de Reumatología, de los cuales 2 declinaron la invitación a participar. En la selección de los mismos, se consideró la trayectoria profesional de los expertos, el juicio clínico, la diversidad geográfica (con representación razonable de distintos estados del país), la pertenencia a las principales instituciones de salud del país, tanto del segundo como del tercer nivel de atención, conocimiento y dominio en el tema, representatividad por género, con un equilibrio de hombres y mujeres en las mesas de trabajo, así como una capacitación en el desarrollo de GPC con metodología de medicina basada en la evidencia. Dada la importancia de integrar un grupo de trabajo multi- e interdisciplinario, además de reumatólogos, se solicitó la colaboración de otros especialistas cuya opinión ayudara a mejorar la atención a la enfermedad o la metodología de elaboración de las recomendaciones. Al final, el grupo quedó conformado por 23 reumatólogos, 2 médicos internistas, un pediatra-neonatólogo y 2 gineco-obstetras. Una vez seleccionados los integrantes del grupo de trabajo, y habiendo aceptado la participación en el proyecto, se convocó una reunión de grupo nominal. En esta reunión se llevó a cabo una exposición teórica de la metodología de trabajo de la GPC y se abrió un turno de debate para definir el título, el alcance, los objetivos y los usuarios de la guía, y se designó a los líderes de cada una de las mesas de trabajo. En la capacitación del grupo de trabajo se abordó el desarrollo de preguntas clínicas PICO (paciente, intervención, comparador y resultado o desenlace), elaboración y adaptación de GPC, elaboración y calificación de las evidencias y recomendaciones, así como protocolo de búsqueda. Los equipos de trabajo revisaron los siguientes temas: 1) LES I (morbilidad materna), 2) LES II (morbilidad fetal), 3) AR, 4) SAF, y 5) uso de fármacos antirreumáticos durante el embarazo y la lactancia.
Desarrollo de las recomendacionesLas recomendaciones elaboradas en el presente documento son de carácter general, basadas en la mejor evidencia científica disponible en el momento de su desarrollo y pretenden ser una herramienta útil que agilice la toma de decisiones en el proceso de atención de la paciente embarazada con LES, AR y SAF. De tal forma, que las recomendaciones aquí establecidas no definen un curso único de conducta en un procedimiento o tratamiento, por lo que al ser aplicadas en la práctica, podrían tener variaciones justificadas con fundamento en el juicio clínico de quien las emplea como referencia, así como en las necesidades específicas y preferencias de cada paciente en particular, los recursos disponibles en el momento de la atención y la normatividad establecida por cada institución o área de práctica.
Búsqueda sistemática. La búsqueda sistemática de la información se enfocó a GPC y estudios primarios y secundarios, acerca de la temática de LES, AR, SAF primario y fármacos antirreumáticos en embarazo y lactancia.
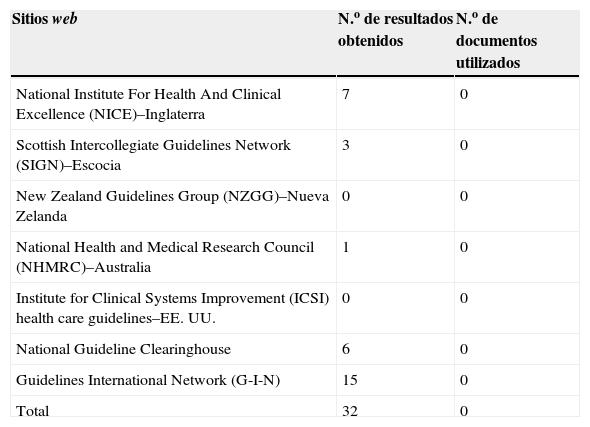
La búsqueda de GPC se realizó en sitios web de entidades elaboradoras y compiladoras de GPC. A continuación se presenta una tabla que muestra los sitios web consultados para la elaboración de esta guía (tabla 1).
Sitios web consultados para la elaboración de esta guía GCP
| Sitios web | N.o de resultados obtenidos | N.o de documentos utilizados |
|---|---|---|
| National Institute For Health And Clinical Excellence (NICE)–Inglaterra | 7 | 0 |
| Scottish Intercollegiate Guidelines Network (SIGN)–Escocia | 3 | 0 |
| New Zealand Guidelines Group (NZGG)–Nueva Zelanda | 0 | 0 |
| National Health and Medical Research Council (NHMRC)–Australia | 1 | 0 |
| Institute for Clinical Systems Improvement (ICSI) health care guidelines–EE. UU. | 0 | 0 |
| National Guideline Clearinghouse | 6 | 0 |
| Guidelines International Network (G-I-N) | 15 | 0 |
| Total | 32 | 0 |
Debido a que no se encontraron GPC que abordaran preguntas clínicas respecto a embarazo en las 3 enfermedades reumáticas de interés, no fue posible desarrollar la guía mediante el proceso de adaptación. Derivado de lo anterior, se procedió a realizar la elaboración de novo, por lo que se llevó a cabo una búsqueda de estudios primarios y secundarios en Pubmed, Tripdatabase y la biblioteca Cochrane, con base en los siguientes criterios de inclusión:
- •
Documentos escritos en inglés y español.
- •
Documentos publicados en los últimos 5 años (rango recomendado) o, en caso de encontrarse escasa o nula información, documentos publicados los últimos 10 años (rango extendido).
- •
Documentos enfocados al tratamiento.
La búsqueda de la literatura se realizó durante el mes de junio de 2013, se empleó el término MeSH Lupus Erythematosus, Systemic AND pregnancy. El protocolo de búsqueda empleado fue: («Lupus Erythematosus, Systemic/complications»[Mesh] OR «Lupus Erythematosus, Systemic/congenital»[Mesh] OR «Lupus Erythematosus, Systemic/drug therapy»[Mesh] OR «Lupus Erythematosus, Systemic/mortality»[Mesh] OR «Lupus Erythematosus, Systemic/pharmacology»[Mesh] OR «Lupus Erythematosus, Systemic/prevention and control»[Mesh] OR «Lupus Erythematosus, Systemic/therapy»[Mesh]) AND («pregnancy»[MeSH Terms] OR «pregnancy»[All Fields]) AND ((Clinical Trial[ptyp] OR Comparative Study[ptyp] OR Consensus Development Conference, NIH[ptyp] OR Controlled Clinical Trial[ptyp] OR Guideline[ptyp] OR Meta-Analysis[ptyp] OR Multicenter Study[ptyp] OR Observational Study[ptyp] OR Practice Guideline[ptyp] OR Randomized Controlled Trial[ptyp] OR Review[ptyp] OR systematic[sb]) AND «2004/04/27»[PDat]: «2013/09/24»[PDat] AND «humans»[MeSH Terms] AND (Spanish[lang] OR English[lang])). Se obtuvieron 110 resultados.
La búsqueda de la literatura para el tema AR empleó los terminos MeSH: Arthritis, Rheumatoid AND pregnancy. El protocolo de búsqueda empleado fue: («Arthritis, Rheumatoid/complications»[Mesh] OR «Arthritis, Rheumatoid/congenital»[Mesh] OR «Arthritis, Rheumatoid/drug therapy»[Mesh] OR «Arthritis, Rheumatoid/embryology»[Mesh] OR «Arthritis, Rheumatoid/mortality»[Mesh] OR «Arthritis, Rheumatoid/prevention and control»[Mesh] OR «Arthritis, Rheumatoid/therapy»[Mesh]) AND («pregnancy»[MeSH Terms] OR «pregnancy»[All Fields]) AND ((Clinical Trial[ptyp] OR Comparative Study[ptyp] OR Controlled Clinical Trial[ptyp] OR Guideline[ptyp] OR Multicenter Study[ptyp] OR Observational Study[ptyp] OR Practice Guideline[ptyp] OR Randomized Controlled Trial[ptyp] OR Review[ptyp] OR systematic[sb]) AND «2004/04/27»[PDat]: «2013/09/24»[PDat] AND «humans»[MeSH Terms] AND (English[lang] OR Spanish[lang])). Se obtuvieron 51 resultados.
La búsqueda de la literatura para el tema SAF empleó los terminos MeSH: Antiphospholipid Syndrome AND pregnancy. El protocolo de búsqueda empleado fue: («Antiphospholipid Syndrome/complications»[Mesh] OR «Antiphospholipid Syndrome/congenital»[Mesh] OR «Antiphospholipid Syndrome/drug therapy»[Mesh] OR «Antiphospholipid Syndrome/embryology»[Mesh] OR «Antiphospholipid Syndrome/genetics»[Mesh] OR «Antiphospholipid Syndrome/mortality»[Mesh] OR «Antiphospholipid Syndrome/prevention and control»[Mesh] OR «Antiphospholipid Syndrome/therapy»[Mesh]) AND («pregnancy»[MeSH Terms] OR «pregnancy»[All Fields]) AND ((Clinical Trial[ptyp] OR Comparative Study[ptyp] OR Controlled Clinical Trial[ptyp] OR Guideline[ptyp] OR Meta-Analysis[ptyp] OR Multicenter Study[ptyp] OR Observational Study[ptyp] OR Practice Guideline[ptyp] OR Review[ptyp] OR systematic[sb]) AND «2004/04/27»[PDat]: «2013/09/24»[PDat] AND «humans»[MeSH Terms] AND (English[lang] OR Spanish[lang])). Se obtuvieron 246 resultados.
El protocolo de búsqueda referente a la seguridad con el uso de fármacos antirreumáticos en mujeres con enfermedades reumáticas autoinmunes fue el siguiente: («antirheumatic agents»[Pharmacological Action] OR «antirheumatic agents»[MeSH Terms] OR («antirheumatic»[All Fields] AND «agents»[All Fields]) OR «antirheumatic agents»[All Fields] OR («antirheumatic»[All Fields] AND «drugs»[All Fields]) OR «antirheumatic drugs»[All Fields]) AND (autoimmune[All Fields] AND («rheumatic diseases»[MeSH Terms] OR («rheumatic»[All Fields] AND «diseases»[All Fields]) OR «rheumatic diseases»[All Fields])) AND ((Clinical Trial[ptyp] OR Comparative Study[ptyp] OR Controlled Clinical Trial[ptyp] OR Meta-Analysis[ptyp] OR Multicenter Study[ptyp] OR Observational Study[ptyp] OR systematic[sb]) AND «2004/04/27»[PDat]: «2013/09/24»[PDat] AND «humans»[MeSH Terms] AND (English[lang] OR Spanish[lang])). Se obtuvieron 96 resultados. De los 503 artículos obtenidos de los protocolos de búsqueda, se excluyeron 346 artículos, con base en la lectura de sus títulos y resúmenes, debido a que no cumplían con los objetivos de las preguntas planteadas en la presente guía.
Una vez realizada la búsqueda de información, se seleccionaron un total de 157 artículos para la elaboración del documento. Los artículos se remitieron al panel de expertos para su lectura crítica y evaluación del grado de evidencia. Para la gradación del nivel de evidencia se utilizó el Sistema de Clasificación de Shekelle et al.4. Esta clasificación permite calcular la fuerza de las recomendaciones y evaluar la calidad de la evidencia con base en el mejor diseño para contestar la pregunta (tabla 2). Aquellos aspectos que el equipo de trabajo redactor de la guía consideró necesario resaltar, porque constituyen un área con ausencia de evidencia concluyente o porque se trata de aspectos clínicos de especial relevancia, se marcaron con el signo [✓] y recibieron la consideración de punto de buena práctica [PBP] u opinión basada en la experiencia clínica y alcanzada mediante consenso.
Escala modificada de Shekelle et al
| Categoría de la evidencia | Fuerza de la recomendación |
|---|---|
| Ia. Evidencia para metaanálisis de los estudios clínicos aleatorizados | A. Directamente basada en evidencia categoría i |
| Ib. Evidencia de por lo menos un estudio clínico controlado aleatorizado | |
| IIa. Evidencia de por lo menos un estudio controlado sin aleatoriedad | B. Directamente basada en evidencia categoría ii o recomendaciones extrapoladas de evidencia i |
| IIb. Al menos otro tipo de estudio cuasi experimental o estudios de cohorte | |
| III. Evidencia de un estudio descriptivo no experimental, tal como estudios comparativos, estudios de correlación, casos y controles y revisiones clínicas | C. Directamente basada en evidencia categoría iii o en recomendaciones extrapoladas de evidencias categorías i o ii |
| IV. Evidencia de comité de expertos, reportes, opiniones o experiencia clínica de autoridades en la materia o ambas | D. Directamente basadas en evidencia categoría iv o de recomendaciones extrapoladas de evidencias categorías ii, iii |
Clasifica la evidencia en niveles (categorías) e indica el origen de las recomendaciones emitidas por medio del grado de fuerza. Para establecer la categoría de la evidencia utiliza números romanos del i al iv y las letras a y b (minúsculas). En la fuerza de recomendación se emplean letras mayúsculas de la A a la D.
Fuente: modificada de Shekelle et al.4.
Método de validación: Por pares clínicos.
Periodo de actualización: Esta guía será actualizada cuando exista evidencia que así lo determine o de manera programada, a los 3-5 años posteriores a la publicación.
Preguntas incluidasLupus eritematoso sistémico- 1.
En la mujer con LES, ¿cuáles son las opciones de anticoncepción más seguras?
- 2.
En la mujer con LES, ¿cuáles son las acciones que se deben implementar en el periodo preconcepcional?
- 3.
En la mujer embarazada con LES, ¿cuál es la frecuencia y factores de riesgo de recaída de la enfermedad?
- 4.
En la mujer embarazada con LES, ¿cuál es la frecuencia y factores de riesgo para desarrollar preeclampsia/eclampsia?
- 5.
En la mujer embarazada con LES, ¿cuáles son las opciones de tratamiento de mayor eficacia para prevenir y tratar una reactivación de la enfermedad?
- 6.
En la mujer embarazada con LES, ¿cuál es la frecuencia y los factores de riesgo asociados a pérdida fetal?
- 7.
En la mujer embarazada con LES, ¿cuál es la frecuencia y los factores de riesgo asociados a parto pretérmino?
- 8.
En los productos de mujeres embarazadas con LES, ¿cuál es la frecuencia y factores de riesgo asociados a bajo peso al nacer/restricción del crecimiento intrauterino/pequeño para edad gestacional?
- 9.
En la mujer con LES, ¿cómo se realiza el seguimiento durante el embarazo y el puerperio inmediato?
- 10.
En los productos de mujeres con anticuerpos anti-Ro y/o anti-La positivos, ¿cuáles son las opciones de prevención y tratamiento de mayor eficacia para el manejo del bloqueo cardiaco congénito (BCC)?
- 11.
En la mujer con AR, ¿cuál es el efecto de la enfermedad y su tratamiento sobre la fertilidad y la fecundidad?
- 12.
En la mujer con AR, ¿cuáles son las opciones de anticoncepción más eficaces?
- 13.
En la mujer con AR, ¿cuáles son las opciones de anticoncepción más seguras?
- 14.
En la mujer con AR, ¿cuál es la frecuencia de mejoría o recaída de la enfermedad durante el embarazo y el puerperio?
- 15.
En la mujer con AR, ¿cuáles son los factores asociados a mejoría o recaída de la enfermedad durante el embarazo y el puerperio?
- 16.
En la mujer con AR y embarazo, ¿cuál es el mejor instrumento para evaluar la actividad de la enfermedad?
- 17.
En la mujer con AR y embarazo, ¿cuál es el efecto de la gestación sobre los instrumentos clínicos de evaluación funcional?
- 18.
En la mujer embarazada con AR, ¿cuál es el efecto de los anticuerpos (factor reumatoide y anticuerpos antipéptidos cíclicos citrulinados) sobre la actividad de la enfermedad?
- 19.
En la mujer embarazada con AR, ¿cuál es la influencia de la actividad de la enfermedad sobre el desenlace fetal?
- 20.
En la mujer embarazada con AR, ¿cuáles son las opciones de tratamiento más seguras para el manejo de una reactivación de la enfermedad?
- 21.
En la mujer con AR que está lactando, ¿cuál es el efecto sobre la actividad de la enfermedad?
- 22.
En la mujer con SAF, ¿cuáles son las opciones de anticoncepción más seguras?
- 23.
En la mujer con SAF, ¿cuáles son las acciones y procedimientos que se deben implementar durante el control prenatal?
- 24.
En la mujer embarazada con SAF ¿cuáles son los factores de riesgo para desarrollar preeclampsia?
- 25.
En la mujer embarazada con SAF, con antecedente de 3 o más pérdidas tempranas (≤10SDG) sin antecedente de trombosis previa ¿cuáles son las opciones de tratamiento de mayor eficacia?
- 26.
En la mujer embarazada con SAF, con antecedente de al menos una muerte fetal (>10SDG) o parto pretérmino (<34SDG) debido a preeclampsia grave o insuficiencia placentaria sin antecedente de trombosis previa, ¿cuáles son las opciones de tratamiento de mayor eficacia?
- 27.
En la mujer embarazada con SAF, con antecedente de trombosis previa, independientemente de su historia obstétrica, ¿cuáles son las opciones de tratamiento de mayor eficacia?
- 28.
En la mujer embarazada con SAF, ¿qué influencia tienen los anticuerpos antifosfolípidos en el curso clínico y en la decisión terapéutica?
- 29.
En la mujer con SAF, ¿cuáles son las opciones de tratamiento de mayor eficacia durante el puerperio?
- 30.
En la mujer con SAF, ¿cuáles son las opciones de tratamiento periparto o pericesárea?
- 31.
En los hijos de madres con SAF, ¿cuáles son las acciones y procedimientos que se deben implementar durante el seguimiento neonatal?
- 32.
En la mujer embarazada con enfermedad autoinmune, ¿cuál es el riesgo fetal de la exposición a antiinflamatorios no esteroideos/analgésicos?
- 33.
En la mujer embarazada con enfermedad autoinmune, ¿cuál es el riesgo maternofetal de la exposición a glucocorticoides para el tratamiento de la enfermedad?
- 34.
En la mujer embarazada con enfermedad autoinmune, ¿cuál es el riesgo fetal de la exposición a antimaláricos, azatioprina, sulfasalazina, ciclosporina A, leflunomida, micofenolato de mofetilo, ciclofosfamida y metotrexato?
- 35.
En la mujer embarazada con enfermedad autoinmune, ¿cuál es el riesgo fetal de la exposición a fármacos biológicos (anti-TNF, rituximab y otros)?
- 36.
En la mujer con enfermedad autoinmune que se encuentra alimentando al seno materno, ¿cuáles son los medicamentos antirreumáticos que se pueden emplear con mayor seguridad?
- 37.
En la mujer embarazada con enfermedad autoinmune, ¿cuál es el riesgo fetal de la exposición a anticoagulantes orales y heparina?
El LES es una enfermedad autoinmune multisistémica de causa desconocida, caracterizada por la producción de diversos autoanticuerpos que afecta mayoritariamente a mujeres en etapa reproductiva con fertilidad habitualmente conservada5.
Morbilidad materna1. En la mujer con lupus eritematoso sistémico, ¿cuáles son las opciones de anticoncepción más seguras?El uso de anticonceptivos orales trifásicos (etinilestradiol más noretindrona) no está asociado con el riesgo de reactivación (valorada por SELENA-SLEDAI) de LES ni aumenta el riesgo de eventos adversos conocidos asociados a su ingesta en mujeres sanas6[NE Ib]. El uso de anticonceptivos orales combinados, progestágenos solos y dispositivo intrauterino sin hormonal, tampoco aumenta el riesgo de exacerbar la actividad de la enfermedad (valorada por SLEDAI) en pacientes con LES de leve a moderado; esto solo ha sido valorado en mujeres sin episodios previos de trombosis7[NE Ib]. La anticoncepción con acetato de ciproterona (50mg) y clormadinona (5mg) es bien tolerada y efectiva como método anticonceptivo en pacientes con LES con actividad leve, moderada o grave8[NE III]. Los anticonceptivos orales trifásicos y progestágenos no combinados pueden ser usados en pacientes con LES, ya que su uso no incrementa la actividad de la enfermedad ni el riesgo de eventos adversos, especialmente episodios de trombosis6,7[GR A]. No se recomienda el uso de anticonceptivos orales trifásicos y progestágenos no combinados en pacientes con antecedente de episodios previos de trombosis y/o factores de riesgo cardiovascular preexistentes, así como tampoco en pacientes con LES que tienen anticuerpos antifosfolípidos y/o SAF asociado6,7[GR A].
La anticoncepción con progestágenos (por diferentes vías de administración) es segura y efectiva para todo tipo de pacientes con LES con diferentes grados de actividad, y puede ser administrada en pacientes con anticuerpos antifosfolípidos positivos8,9[GR C]. El dispositivo intrauterino con progestágenos es seguro y efectivo, cuando se desea un método anticonceptivo a largo plazo (por lo menos 5 años) en mujeres con LES9[GR C]. La anticoncepción de urgencia a base de progestágenos es segura en la mujer con LES9[GR C]. Se pueden utilizar métodos anticonceptivos de barrera combinados (preservativo y espermicida) en pacientes con LES, sin embargo, se debe tomar en cuenta su baja efectividad como método anticonceptivo9. El método de anticoncepción definitivo (quirúrgico) es seguro y efectivo; en pacientes con LES, su uso está recomendado en aquellas pacientes con paridad satisfecha9[GR C].
- •
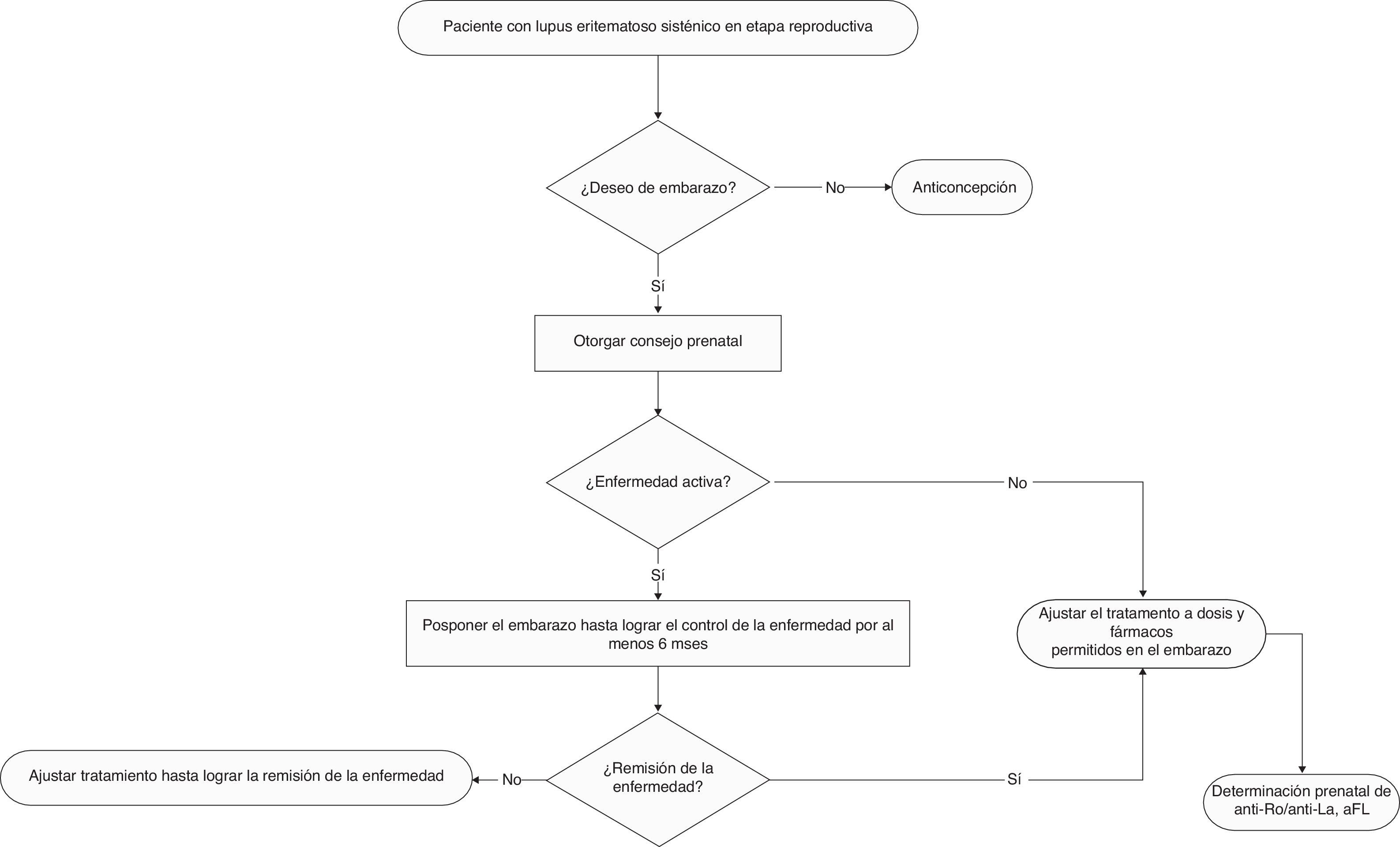
Todo médico que atienda mujeres con LES está obligado a proporcionar consejo sobre anticoncepción de manera individualizada a todas las pacientes en edad fértil (fig. 1) [PBP].
El embarazo de pacientes con LES, comparado con la población general, es un embarazo de alto riesgo debido una elevada tasa de complicaciones y mortalidad maternas10,11[NE III/IV]. La frecuencia de complicaciones maternofetales durante el embarazo de mujeres con LES es mayor cuando el embarazo no es planeado12[NE III]. El embarazo en pacientes con LES idealmente debe ser un evento planificado y debe existir vigilancia médica preconcepcional estrecha e individualizada para cada paciente12,13[GR C/D].
El objetivo primario del control preconcepcional, en pacientes con LES con deseo de embarazo, es lograr que la paciente se encuentre en remisión de la enfermedad por lo menos 6 meses antes de permitir el embarazo13[NE IV]. No se aconseja el embarazo en aquellas pacientes con LES que en los últimos 6 meses hayan recibido fármacos teratogénicos (dependiendo de cada fármaco y valorando el riesgo-beneficio de su uso) [GR D]. Se sugiere que en aquellas mujeres con LES que planifiquen un embarazo, se realicen determinaciones de anticuerpos antifosfolípidos, anti-DNAdc y anticuerpos anti-SSA/Ro y anti-SSB/La como parte de la evaluación preconcepcional14[GR D]. El embarazo en mujeres con LES debe ser planificado, vigilado y considerado de alto riesgo en todos los casos11,13[GR D]. El embarazo en pacientes con LES está contraindicado en aquellas con hipertensión arterial pulmonar grave, enfermedad pulmonar restrictiva, insuficiencia cardiaca, insuficiencia renal crónica (creatinina>2,8mg/dl), antecedente de preeclampsia grave o síndrome de HELLP (microangiopatía caracterizada por anemia hemolítica, elevación de enzimas hepáticas y trombocitopenia), evento vascular cerebral dentro de los 6 meses previos y recaída grave de LES en los últimos 6 meses [GR D]. Toda paciente con LES en edad fértil debe recibir consejo médico (que incluya a la paciente y su familia) en el periodo preconcepción por parte del reumatólogo y del gineco-obstetra.
- •
Si la paciente llega embarazada y activa a la consulta, debe tratarse inmediatamente la reactivación y explicarle el alto riesgo que tiene de desarrollar complicaciones maternofetales [PBP].
En un estudio prospectivo de mujeres embarazadas con LES comparadas con un grupo control (no embarazadas), se reportó exacerbación de la enfermedad en el 65% de las pacientes embarazadas vs. el 42% del grupo control (p=0,015)15[NE IIa]. Al menos 3 estudios prospectivos muestran que las mujeres con LES y embarazo tienen una mayor tasa de recaída de la enfermedad (entre el 58 y el 65%), en comparación con mujeres con LES no embarazadas15–17[NE IIa]. Al menos 4 estudios prospectivos de mujeres con LES mostraron una tasa de recaída de la enfermedad del 27-70% y no fue mayor en comparación con mujeres con LES no embarazadas18–21[NE IIa/IIb]. Se ha reportado una tasa de actividad de LES en pacientes embarazadas de 1,2 persona/año vs. 0,4 persona/año en no embarazadas (p<0,0001)22[NE IIb]. Un estudio prospectivo reportó como factores de riesgo de actividad de LES durante el embarazo un número elevado de recaídas de la enfermedad previas al embarazo (p<0,05), el suspender la cloroquina en el momento del embarazo (p<0,05) e índice de SLEDAI elevado (>5) antes del embarazo22. En un estudio retrospectivo se observó que la reactivación de la enfermedad en pacientes con LES es más común durante el embarazo (36,5±3,3%)23[NE III]. En mujeres con LES, el embarazo aumenta el riesgo de eventos trombóticos (enfermedad vascular cerebral, tromboembolismo cerebral y trombosis venosa profunda), infecciones graves y trombocitopenia10[NE III]. El embarazo en pacientes con nefropatía lúpica preexistente aumenta la actividad de la enfermedad renal (valorada por SELENA 2K); 47,5 vs. 13,4% (p=0,0001)24[NE III]. Las pacientes embarazadas con nefritis lúpica previa tienen mayor riesgo de actividad renal y en cualquier órgano, en comparación con aquellas pacientes que nunca han tenido afección renal (54,2 vs. 25%; p=0,004 y 45,7 vs. 6,6%; p=0,00001)25[NE III]. Se han descrito como factores de riesgo de recaída en pacientes con LES embarazadas, enfermedad activa dentro de los 6 meses previos a la concepción, exacerbaciones múltiples antes de la concepción, interrupción del tratamiento durante el embarazo y comorbilidades26[NE IV]. Las manifestaciones clínicas más frecuentes de actividad durante el embarazo son: mucocutáneas (25-90%), hematológicas (10-40%), articulares (20%) y renales (4-30%)15,16,26[NE IIa]. Se recomienda vigilancia médica estrecha y comunicación entre un equipo multidisciplinario, ya que el riesgo de recaída de la enfermedad es alto durante el embarazo y puerperio inmediato, en especial en aquellas pacientes con nefritis lúpica previa [GR C/D].
- •
La paciente embarazada con LES no debe abandonar el tratamiento [PBP].
En un metaanálisis se reportó que la frecuencia de preeclampsia en pacientes con LES es del 7,6% y de eclampsia del 0,8%. Asimismo, la presencia de afección renal activa en el momento del embarazo es factor de riesgo para el desarrollo de preeclampsia pero no de eclampsia27[NE Ia]. Un estudio multicéntrico de EE. UU. reportó una frecuencia del 22,5% de preeclampsia y del 0,5% de eclampsia en pacientes embarazadas con LES (OR: 3 y 4,4 respectivamente, IC 95%, p<0,001)10[NE III]. Un estudio de prevalencia de síndrome de HELLP en población abierta y pacientes con LES reportó una frecuencia de preeclampsia grave en pacientes embarazadas con LES del 10-20% y de síndrome HELLP del 0,5-0,9%28[NE III]. Un estudio retrospectivo que incluyó a pacientes embarazadas con LES (con y sin afección renal previa), reportó una frecuencia de preeclamsia del 22,8% en aquellas pacientes con actividad renal previa vs. al 13,3% sin ella (p=0,2)25[NE III]. Los factores de riesgo para el desarrollo de preeclamsia/eclampsia descritos en pacientes embarazadas con LES son el antecedente de nefritis lúpica clase histológica (OMS) iii y iv, antecedente de preeclampsia y síndrome de HELLP, hipertensión arterial preexistente, presencia de anticuerpos antifosfolípidos y LES activo29[NE IV]. La preeclampsia se presenta generalmente a partir de las 20 semanas de gestación, con ácido úrico elevado, C3, C4 normales y anticuerpos anti-DNA de doble cadena normales. En la nefropatía lúpica activa hay hipocomplementemia, anti-DNAdc elevado, ácido úrico normal o elevado, sedimento urinario activo y ocurre en cualquier momento de la gestación13,20[NE IV]. Se debe realizar diagnóstico diferencial entre nefropatía lúpica y preeclampsia en pacientes embarazadas con LES [GR D]. Hay que considerar que la paciente con LES y embarazo tiene un riesgo elevado para desarrollar preeclampsia; por lo tanto, elevaciones mínimas de la presión arterial y fluctuaciones que van desde presión arterial normal o baja hasta elevaciones menores puede ser el inicio de una preeclampsia. Las mujeres jóvenes o mayores de 35 años, primigestas, con antecedente de nefropatía lúpica y/o activas al inicio del embarazo son las de mayor riesgo30.
Dos metaanálisis mostraron que la administración temprana (≤16SDG) de dosis bajas diarias de aspirina (50-150mg) reducen el riesgo de desarrollar preeclampsia grave (RR: 0,22; IC 95%: 0,08-0,57) o preeclampsia (RR: 0,47; IC 95%: 0,36-0,62) en mujeres en riesgo de desarrollarla31,32[NE Ia]. En toda mujer embarazada con LES, si no existe contraindicación, se recomienda el uso de dosis bajas de aspirina para reducir el riesgo de desarrollar preeclampsia31,32[GR A].
5. En la mujer embarazada con lupus eritematoso sistémico, ¿cuáles son las opciones de tratamiento de mayor eficacia para prevenir y tratar una reactivación de la enfermedad?Un estudio prospectivo controlado con placebo, que incluyó a pacientes embarazadas con LES, demostró que la hidroxicloroquina disminuye el riesgo de exacerbaciones, pero no influye en el desenlace fetal33[NE Ib]. La suspensión de la hidroxicloroquina en el embarazo incrementa el riesgo de actividad de LES, incluyendo exacerbaciones graves tales como proteinuria y trombocitopenia grave34[NE IIa]. Se recomienda el uso de hidroxicloroquina para evitar recaídas del LES durante el embarazo33[GR A].
Un estudio prospectivo de pacientes embarazadas con LES concluyó que el uso de prednisona a dosis bajas no previene recaídas de la enfermedad15[NE IIb]. El uso de prednisona en dosis de más de 20mg/d en pacientes embarazadas con LES aumenta el riesgo de preeclampsia y diabetes gestacional35[NE IV]. Se recomienda el uso de glucocorticoides no fluorinados en pacientes embarazadas con LES para tratar la actividad de moderada a grave26[GR D].
Los antiinflamatorios no esteroideos (por ejemplo, naproxeno, ibuprofeno e indometacina) pueden ser usados en el embarazo para el control de las manifestaciones articulares, solo hay que evitar su uso en el tercer trimestre, para prevenir complicaciones fetales, especialmente el cierre prematuro del conducto arterioso13[GR D]. La azatioprina puede ser usada durante el embarazo en pacientes con LES, en caso de actividad de moderada a grave previa al embarazo (mantenerla si la estuviera recibiendo antes del embarazo o iniciarla en el embarazo, siempre y cuando se considere necesario)35[GR D]. Se recomienda continuar el tratamiento con azatioprina en aquellas pacientes embarazadas con LES que ya la tomaban previo al embarazo, así como el cambio a azatioprina (antes del embarazo) en aquellas pacientes que toman micofenolato de mofetilo u otro inmunosupresor y desean quedarse embarazadas35[GR D]. Metotrexato y leflunomida están contraindicados en forma absoluta durante el embarazo26[GR D]. En una serie de casos de pacientes embarazadas con LES expuestas a ciclofosfamida durante el primer o segundo trimestre de la gestación se reportó pérdida fetal en el 100% de los casos36[NE IV]. El uso de micofenolato de mofetilo y ciclofosfamida en pacientes embarazadas con LES solo debe reservase en los casos de actividad grave que ponga en riesgo la vida de la madre. Es fundamental informar sobre los posibles efectos teratógenos que pudieran presentarse en el producto o considerar la suspensión terapéutica del embarazo26[GR D]. El uso de gammaglobulina intravenosa (iv) en el embarazo de pacientes con LES es seguro y efectivo y representa una opción de tratamiento en aquellas pacientes con pérdidas fetales recurrentes37[NE III]. No hay estudios que analicen la seguridad del uso de medicamentos biológicos en pacientes embarazadas con LES, y la escasa información deriva de reportes de caso; por lo tanto, no deben usarse en el embarazo y deben ser suspendidos en caso de exposición accidental38[GR C]. Es recomendable que las pacientes con LES que se embarazan continúen con el tratamiento que tomaban antes del embarazo, siempre y cuando no se trate de fármacos con contraindicación absoluta durante el embarazo15. Hay que individualizar el tratamiento de la actividad de LES durante el embarazo, considerando la gravedad de la actividad y los posibles eventos adversos sobre el producto35,38[GR D].
- •
Hay que tener en cuenta que la mayor parte de reactivaciones del LES durante el embarazo y el posparto son leves a moderadas, por lo tanto hay que evitar el uso de pulsos de metilprednisolona excepto en situaciones con riesgo alto de pérdida de la vida [PBP].
En mujeres con nefritis lúpica se ha reportado una frecuencia del 16% de abortos espontáneos, del 3,6% de óbitos y del 2,5% de muerte neonatal27[NE Ia]. En un estudio prospectivo de mujeres embarazadas con LES se encontró que la frecuencia de abortos espontáneos fue del 14% y de muerte fetal del 12%22[NE IIb]. La hipocomplementemia (p<0,05), la hipertensión en el momento de la concepción (p>0,001) y los anticuerpos antifosfolípidos (p<0,05) son predictores de pérdida fetal en mujeres embarazadas con LES22[NE IIb]. La actividad de LES dentro de los 6 meses previos a la concepción se ha asociado a pérdida fetal en el 42% de los casos36[NE IIb]. La actividad clínica de la enfermedad asociada a hipocomplementemia y títulos elevados de anticuerpos anti-DNAdc se asocian a pérdida fetal en mujeres embarazadas con LES31[NE IIb]. No se recomienda el embarazo en mujeres con nefritis lúpica activa27[GR A]. La actividad de LES durante el embarazo debe ser identificada y tratada oportunamente para disminuir el riesgo de desenlace fetal adverso (pérdida fetal, prematurez y restricción del crecimiento intrauterino)39,40[GR B/C]. Se recomienda que en la paciente con LES se lleve un control adecuado de la enfermedad por lo menos desde 6 meses antes de planear un embarazo36[GR B].
El SAF asociado es un predictor de pérdida fetal (riesgo de 3,1 veces) y abortos espontáneos (riesgo de 5 veces). La trombocitopenia en el primer trimestre se asocia a pérdida fetal (riesgo de 3,3 veces)41[NE IIb]. La hipertensión en el primer trimestre de la gestación se asocia a pérdida fetal (riesgo de 2,4 veces) y óbitos (riesgo de 3,4 veces)41[NE IIb]. Se debe controlar la hipertensión arterial sistémica crónica (previa al embarazo o adquirida en el primer trimestre) para disminuir el riesgo de desenlace fetal adverso (pérdida fetal, prematurez y restricción del crecimiento intrauterino)22,40–42[GR B/C].
La hipocomplementemia y la proteinuria>1g/24h son factores predictores de pérdida fetal en mujeres con nefritis lúpica43[NE IIb]. La nefritis lúpica (OR: 7,3), los anticuerpos anticardiolipina (OR: 3,9) y la actividad de la enfermedad durante el embarazo (OR: 1,9) son predictores de pérdida fetal40[NE III]. En las mujeres con enfermedad renal crónica, el embarazo puede acelerar el deterioro de la función renal y empeorar la hipertensión y la proteinuria, con un mayor riesgo de mortalidad materna y complicaciones fetales (como retraso del crecimiento intrauterino)44[NE IV]. En mujeres con nefritis lúpica el embarazo puede planearse si la función renal es normal o tiene daño mínimo (creatinina sérica<1,5mg/dl, aclaramiento de creatinina≥60ml/min, proteinuria<1g/24h)43,45[GR C].
7. En la mujer embarazada con lupus eritematoso sistémico, ¿cuál es la frecuencia y los factores de riesgo asociados a parto de pretérmino?La frecuencia reportada de prematurez en productos de mujeres embarazadas con nefritis lúpica es del 39,4% (IC 95%: 32,4-46,4%)27[NE Ia]. La actividad clínica de la enfermedad aunada a la presencia de hipocomplementemia y títulos elevados de anticuerpos anti-DNAdc se asocian a prematurez en productos de mujeres con LES39[NE IIb]. Se recomienda la medición del complemento sérico (C3 y C4) y de anticuerpos anti-DNAdc para identificar a mujeres embarazadas con LES que tienen riesgo de pérdida fetal y prematurez39[GR B].
La hipertensión durante el embarazo y la preeclampsia incrementan el riesgo de prematurez en productos de mujeres embarazadas con LES22,42[NE IIb]. Los anticuerpos antifosfolípidos positivos (OR: 3,6; IC 95%: 1,5-8,7; p=0,004) y la enfermedad activa en el momento de la concepción (OR: 5,5; IC 95%: 2,3-12,8; p<0,0001) incrementan el riesgo de prematurez en productos de mujeres con LES46[NE III]. Un análisis retrospectivo de 396 embarazos encontró que la presencia de nefritis lúpica (OR: 18,8; IC 95%: 1,5-125,9; p=0,02), de anticuerpos anti-Ro (OR: 13,9; IC 95%: 1,0-116,4; p=0,04) y de recaídas de la enfermedad (OR: 2,4; IC 95%: 1,3-4,5; p=0,003) se asociaron a prematurez en mujeres embarazadas con LES40[NE III]. Se recomienda el control de la hipertensión y de la actividad de la enfermedad para disminuir el riesgo de prematurez en las mujeres embarazadas con LES22,40,42,46[GR B/C].
8. En los productos de mujeres embarazadas con lupus eritematoso sistémico, ¿cuál es la frecuencia y factores de riesgo asociados a bajo peso al nacer/restricción del crecimiento intrauterino/pequeño para edad gestacional?La frecuencia reportada de restricción del crecimiento intrauterino en productos de mujeres embarazadas con nefritis lúpica es del 12,7% (IC 95%: 32,4-46,4%)27[NE Ia]. La frecuencia de bajo peso al nacer es mayor en productos de mujeres con nefritis lúpica en comparación con aquellas sin esta (46 vs. 20%, p=0,01)24[NE IIb]. En un estudio prospectivo de mujeres embarazadas con LES se observó restricción del crecimiento intrauterino en el 35% de los casos22[NE IIb]. La enfermedad activa en el momento de la concepción ha sido asociada con restricción del crecimiento intrauterino (OR: 3,2; IC 95%: 1,3-7,6; p<0,007)46[NE IIb]. Un estudio prospectivo de 29 embarazos en mujeres con LES mostró que la albúmina sérica baja, los anticuerpos antifosfolípidos, la proteinuria gestacional, la hipertensión y los anticuerpos anti-Sm se asociaron con productos de bajo peso al nacer47[NE IIb]. En mujeres con LES la proteinuria ha sido asociada a productos pequeños para su edad gestacional48[NE III]. Un análisis retrospectivo de 396 embarazos en mujeres con LES encontró que la presencia de anticuerpos anti-La (OR: 11,4; IC 95%: 1,1-115,1; p=0,03), hipertensión (OR: 37,7; IC 95%: 3,6-189,7; p=0,02), fenómeno de Raynaud (OR: 12,2; IC 95%: 2,1-69,7; p=0,005) y actividad de la enfermedad (OR: 4,1; IC 95%: 1,3-13,1; p=0,01) se asociaron a restricción del crecimiento intrauterino40[NE III].
9. En la mujer con lupus eritematoso sistémico, ¿cómo se realiza el seguimiento durante el embarazo y el puerperio inmediato?El embarazo de una mujer con LES debe considerarse un embarazo de alto riesgo10[NE III]. La frecuencia de complicaciones durante el embarazo de mujeres con LES tales como recaídas de la enfermedad, pérdida fetal, prematurez y asfixia neonatal es mayor cuando el embarazo no es planeado12[NE III]. Durante el embarazo de una paciente con LES, el reumatólogo debe evaluarla cada 4 a 6 semanas, y el gineco-obstetra cada 4 semanas hasta la semana 20 de gestación, cada 2 semanas hasta la semana 28 de gestación y semanalmente hasta la resolución del embarazo35,49–51[GR D]. Al inicio del embarazo se deben determinar C3, C4, CH50, anticuerpos anti-Ro, anti-La, anti-Sm, anti-DNAdc y anticardiolipina, así como anticoagulante lúpico13,52[GR D]. Durante el embarazo de la mujer con LES se recomienda realizar mensualmente biometría hemática completa, bioquímica sanguínea, electrólitos séricos, examen general de orina, relación creatinina/proteína urinaria, C3, C4, CH50 y anti-DNAdc13,52[GR D]. Durante el embarazo de la mujer con LES se recomienda realizar ultrasonografía fetal entre las semanas 7 y 13 de gestación, y mensualmente después de la semana 16 de gestación, para determinar anomalías fetales y monitorizar el crecimiento52[GR D]. Se recomienda realizar pruebas de bienestar fetal semanalmente a partir de la semana 26 de gestación52[GR D].
10. En los productos de mujeres con anticuerpos anti-Ro y/o anti-La positivos, ¿cuáles son las opciones de prevención y tratamiento de mayor eficacia para el manejo del bloqueo cardiaco congénito?El riesgo de lupus neonatal cardiaco en niños de madres con anticuerpos anti-Ro es del 2% y con anticuerpos anti-La es del 5%53–55[NE IIb]. La tasa de recurrencia del BCC asociado a anticuerpos anti-Ro es del 17%56[NE IIb]. La tasa de mortalidad del lupus cardiaco neonatal es aproximadamente del 20%53,57[NE III]. En mujeres embarazadas con anticuerpos anti-Ro y/o anti-La positivos se debe realizar ecocardiografía fetal semanalmente de la semana 16 a la 26 de la gestación14,52,58[GR D].
Un estudio multicéntrico, abierto, sin selección aleatoria, no mostró beneficio con el uso de dexametasona para revertir el BCC de tercer grado o la no progresión del BCC de segundo a tercer grado59[NE IIb]. Un estudio retrospectivo, multinacional, multicéntrico de 175 pacientes no encontró diferencias significativas en la supervivencia fetal de los productos tratados o no con glucocorticoides fluorinados, independientemente de la dosis, del grado de BCC y/o la presencia de anticuerpos anti-Ro60[NE III]. No se recomienda el uso de glucocorticoides fluorinados en fetos con BCC de tercer grado59,60[GR C].
En un subanálisis de 2 estudios retrospectivos, de fetos de madres anti-Ro/anti-La positivas, se encontró una reversión del BCC de segundo grado a ritmo sinusal o bloqueo de primer grado en el 35% de los casos expuestos a dexametasona, en comparación con el 6,25% de los no expuestos (p=0,053)57,60[NE III]. Se recomienda el uso de glucocorticoides fluorinados en fetos con BCC de segundo grado57,60[GR C].
En 2 estudios prospectivos, multicéntricos, de mujeres embarazadas de<12SDG, con anticuerpos anti-Ro/anti-La positivos y al menos un nacido previo con BCC/lupus neonatal, el uso de gammaglobulina iv (400mg/kg) cada 3 semanas, de la semanas 12 a la 24 de gestación, no previno la recurrencia del BCC61,62[NE IIb]. No se recomienda el uso de gammaglobulina iv para la prevención de la recurrencia del BCC en mujeres embarazadas con anticuerpos anti-Ro/anti-La61,62[GR B].
Un estudio retrospectivo de 20 pacientes tratadas con gammaglobulina iv (1g/kg por 1-3 dosis), en combinación con glucocorticoides, mostró un 80% de nacidos vivos con lupus cardiaco neonatal establecido (cardiomiopatía)63[NE III]. Un reporte de 2 casos mostró la reversión del BCC de segundo a primer grado con el uso combinado de dexametasona 4mg/d, gammaglobulina iv (1g/kg cada 15 d) y plasmaféresis semanal hasta el nacimiento64[NE IV]. El uso de terapia combinada con glucocorticoides, gammaglobulina iv y plasmaféresis constituye intervenciones de segunda y tercera línea para revertir el BCC de segundo grado64[GR D].
Un estudio de casos y controles encontró que la exposición a hidroxicloroquina durante el embarazo en mujeres con LES con anticuerpos anti-Ro/anti-La positivos puede disminuir el riesgo de desarrollar lupus cardiaco neonatal (OR: 0,46; IC 95%: 0,18-1,18; p=0,10)65[NE III]. Un estudio de 3 cohortes retrospectivas encontró que el uso de hidroxicloroquina durante el embarazo en mujeres con LES con anticuerpos anti-Ro/anti-La positivos disminuye el riesgo de desarrollar lupus cardiaco neonatal recurrente (OR: 0,23; IC 95%: 0,06-0,92; p=0,037)66[NE III]. Se recomienda continuar el uso de hidroxicloroquina durante el embarazo de mujeres con anticuerpos anti-Ro/anti-La positivos para disminuir el riesgo de lupus cardiaco neonatal65,66[GR C].
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesEl Colegio Mexicano de Reumatología recibió un apoyo educacional irrestricto de la empresa UCB. El personal que labora en UCB no tuvo ninguna injerencia con la información vertida en este manuscrito ni participó en las reuniones del grupo de trabajo.