La hemorragia alveolar difusa (HAD) es una complicación infrecuente pero grave en pacientes con Lupus eritematoso sistémico (LES). Su tratamiento debe ser precoz, lo cual mejora la supervivencia. Las comunicaciones de factores predictores de HAD en pacientes con LES son escasas.
ObjetivoDescribir una serie de casos de HAD en pacientes con LES, del Servicio de Reumatología del Hospital J.M. Cullen, de Santa Fe, y compararlos con un grupo control de pacientes con LES del mismo Servicio y con los datos de la literatura.
Material y métodosSe incluyeron pacientes con LES (Criterios ACR 1982-1997) y HAD definida por parámetros clínicos (tos, disnea, hemoptisis), analíticos (caída de la hemoglobina por debajo de 12 g/dL o mayor a dos puntos respecto del basal en pacientes ya conocidos), imagenológicos (infiltrado radiológico y/o tomográfico bilateral o difuso) y lavado bronquioalveolar (BAL) (retorno sanguinolento en el lavado, más de 20% de siderófagos, sin evidencia de lesiones sangrantes), quienes concurrieron al servicio entre junio de 1987 y diciembre de 2019. Se analizaron datos demográficos, clínicos, de laboratorio, tratamientos y pronóstico de los pacientes.
ResultadosSe trabajó con una base de datos de 306 pacientes con diagnóstico de LES, evaluándose 25 de ellos (8,2%) que presentaron 29 episodios de HAD (ocho de ellos como forma de inicio de la enfermedad). El compromiso renal fue el más frecuentemente asociado a la HAD (previo o concomitantemente). La actividad de la enfermedad medida por SLEDAI fue alta durante el episodio, y su media fue de 16,8 puntos. En todos los casos se constató sangrado pulmonar por BAL o tubo endotraqueal. Se halló significación estadística al relacionar la mortalidad (40,7%) con requerimiento de asistencia respiratoria mecánica (ARM) (p = 0,006) y falla renal (p = 0,027). Los pacientes con SLEDAI mayor a 10 al inicio de la enfermedad presentaron más posibilidades de desarrollar HAD (OR = 2,68, p = 0,046).
Todos los pacientes recibieron metilprednisolona en pulsos y en menor porcentaje ciclofosfamida y plasmaféresis.
ConclusiónA pesar de los avances en los últimos años, en relación con el tratamiento del LES, sigue siendo alta la mortalidad de la hemorragia pulmonar. Sospechar su presencia nos obliga a estudiar rápidamente a estos pacientes, dado que el diagnóstico temprano y el tratamiento intensivo han demostrado mejorar la supervivencia. Hemos observado que aquellos pacientes con requerimiento de ARM y compromiso de la función renal son quienes presentan un mayor índice de mortalidad de manera estadísticamente significativa.
Pulmonary haemorrhage (PH) in systemic lupus erythematosus (SLE) is a rare but potentially fatal complication due to its high mortality. Early treatment benefits the outcome.
Reports on predictive factors of PH in SLE patients are scarce.
ObjectiveTo describe a case series of PH in SLE patients that were attended in the Rheumatology Section of the J. M. Cullen Hospital and to compare this data with published results.
MethodsPatients with SLE (1982-1997 ACR criteria) and PH diagnosed by clinical criteria (cough, dyspnoea, haemoptysis), haemoglobin below 12 g/dL or drop greater than 2 points, new radiological infiltrate and bronchioalveolar lavage, monitored between June 1987 and December 2019 were studied. Demographic, clinical, laboratory, treatment and prognosis data related to PH were analysed.
ResultsFrom a database of 306 SLE patients, 25 (8.2%) developed 29 episodes of PH. PH was the first manifestation of SLE in 8 patients. Renal involvement was the most frequent manifestation prior to the development of PH. SLE activity (measured by SLEDAI) was high during the episodes (mean: 16.8). Renal failure (p = 0.027) and mechanical respiratory support (p = 0.006) were related to mortality (40.7%) with statistical significance. Patients with SLEDAI higher to 10 at SLE onset showed more likelihood of developing PH. The OR was 2.68 (p = 0.046).
ConclusionsAlthough treatment in SLE has progressed in recent years, PH continues to be a rare and severe complication of this disease. When a PH is suspected, studies to confirm it must be done rapidly, since early diagnosis and aggressive treatment have been shown to improve survival. We observed that patients with renal involvement and mechanical respiratory support had higher mortality than SLE patients without them.
El termino hemorragia alveolar difusa (HAD) engloba una serie de entidades clínicas que generan hemorragia pulmonar secundaria a la lesión de la microvasculatura pulmonar (capilares alveolares, arteriolas y vénulas) en diferentes áreas y muchas veces de forma generalizada1. Agrupa una amplia gama de patologías que pueden manifestarse de manera limitada a pulmón o involucrar otros órganos como el riñón (síndrome riñón-pulmón). El síndrome de HAD puede presentarse con disnea, tos y hemoptisis, o tener un inicio más solapado o subclínico, solo evidenciado por caída de la hemoglobina. Por lo cual se necesita de una metodología rápida, y muchas veces invasiva, para arribar al diagnóstico certero ya que el tratamiento precoz ha demostrado ser lo único que mejora la sobrevida.
Usualmente se clasifica a las HAD en relación al cuadro histológico (según presenten o no capilaritis) y a la fisiopatología (como pauciinmunes asociadas a ANCA, por depósito de inmunocomplejos y un amplio y variado grupo de otras causas como drogas, infecciones, etc.). Dada la baja frecuencia de HAD, son pocas las series de casos que evalúan la etiología de las mismas. Algunas series de casos, como Travis et al.2, que presentaron 37 pacientes y Buendía Roldán et al.3, con 17 pacientes,observaron que las causas más frecuentes de HAD fueron vasculitis asociadas a ANCA. Ortiz et al. presentaron 14 pacientes con enfermedades del tejido conectivo y HAD donde el LES fue la enfermedad de base en 114.
La HAD es una complicación de muy baja prevalencia en pacientes con Lupus Eritematoso Sistémico (LES). Puede observarse durante la evolución en el 2-5% de los pacientes lúpicos y como manifestación inicial en el 11-20%3. Si bien su descripción es de larga data (Osler en 1904)5, la misma ha presentado escasos avances en el tratamiento en comparación con otras complicaciones del LES como el compromiso renal, tal vez debido a la baja prevalencia que presenta. Se desarrolla en pacientes con enfermedad basal activa, con una mortalidad de hasta el 80%. Se caracteriza clínicamente por la presencia de hemoptisis, disnea, infiltrados pulmonares, descenso del hematócrito y fiebre. Estas manifestaciones, asociadas con nuevos infiltrados en la radiografía de tórax, nos sugieren el diagnóstico, sobre todo en aquellos pacientes con LES ya conocido. Sin embargo, el problema radica en aquellos casos en los cuales constituye la primera manifestación de la enfermedad y en los que la expresión clínica del cuadro es escasa o nula (eventos subclínicos), evidenciando solo caída de la hemoglobina como única manifestación4. Más aún, el síntoma cardinal: la hemoptisis, no es el más frecuente de los síntomas comunicándose en 356 a 57%7 de los episodios, aún en hemorragias masivas8. Por estas razones (y la necesidad imperiosa de descartar infecciones previas al inicio de terapia inmunosupresora), es que el BAL adquiere un papel fundamental en el diagnóstico precoz y tratamiento oportuno de estos pacientes.
ObjetivoEl objetivo de este trabajo es describir las características clínicas, resultados de estudios complementarios y datos de relevancia de pacientes con diagnóstico de LES que desarrollaron HAD del Servicio de Reumatología del Hospital J.M. Cullen, de Santa Fe; y realizar un estudio comparativo de estos casos con una muestra de pacientes control sin HAD del mismo servicio, para evaluar factores que predigan el desarrollo de esta complicación y la asociación con mortalidad. Realizar una comparación de la literatura con los datos obtenidos en este trabajo.
Material y métodosSe realizó un estudio retrospectivo, descriptivo y transversal, mediante el análisis de las historias clínicas de pacientes (n = 306) con diagnóstico de LES (criterios ACR 1982-1997) que cumplieron con controles periódicos en la Sección de reumatología del Hospital J.M. Cullen, de la ciudad de Santa Fe, desde el año 1987 a 2019. Se procesaron datos demográficos, clínicos y analíticos durante el episodio, compromiso orgánico previo y características más relevantes de los pacientes en relación a su enfermedad de base.
Se definió HAD por criterios clínicos, analíticos e imagenológicos: A) descenso de la hemoglobina (Hb) de dos o más puntos, B) Hb menor a 12 g/dL, C) hemoptisis, D) hipoxemia, E) insuficiencia respiratoria, F) infiltrados radiológicos en 3/4 de campos pulmonares y/o G) lavado broncoalveolar (BAL) con siderófagos mayor a 20% o presencia de sangre en el tubo endotraqueal9.
Se excluyeron las HAD por otras causas (por ejemplo: tromboembolismo de pulmón, uremia, edema agudo de pulmón) y los casos que no fueron confirmados por BAL o tubo endotraqueal.
Se utilizó el Systemic Lupus Erythematosus Disease Activity Index (SLEDAI) para evaluar la actividad de la enfermedad de base al inicio de la misma y en el episodio de HAD. Se definió como compromiso renal a la presencia de proteinuria mayor a 0,5 g en 24 h, sedimento urinario activo, o falla renal con aclaramiento de creatinina por debajo de 60 mL/min/1,73m2; insuficiencia respiratoria con Presión parcial de oxígeno arterial (PO2) menor de 60 mmHg; trombocitopenia a menos de 100.000 plaquetas/mL y como tiempo de demora diagnóstica al tiempo transcurrido entre el primer síntoma atribuible a la HAD y su confirmación mediante BAL.
El análisis estadístico se realizó con el software SPSS® Statistics 19 y se expresaron los resultados en porcentajes, media y mediana según corresponda. La comparación de medias y proporciones se realizó con la Prueba U de Mann Whitney, Prueba de Chi Cuadrado y Test exacto de Fisher; con una significación estadística de α ≤ 0,05. Se calculó los Odds Ratio (OR) entre las variables investigadas en busca de factores que predigan la posibilidad de desarrollo de HAD en pacientes con LES; y dentro de estos episodios, cuales características se asociaron a mayor mortalidad, comparando los pacientes con HAD (n = 25) con una muestra de pacientes control con LES sin HAD (n = 100) pareados por sexo y edad.
Para el análisis de la evolución y complicaciones de los pacientes con HAD, se consideró cada episodio de HAD como diferente.
ResultadosEn la evaluación de las 306 historia clínicas de pacientes con diagnóstico de LES que se realizó, 25 de ellos (8,2%) presentaron 29 episodios de HAD (tres fueron recurrentes). 22/25 pacientes fueron mujeres (88%), con una edad media en el episodio de 33 años con un IC (28-38). La HAD se presentó en promedio a los 63 meses de evolución del LES; ocho de los 25 pacientes la presentaron como primera manifestación de la enfermedad representando el 32% de la muestra.
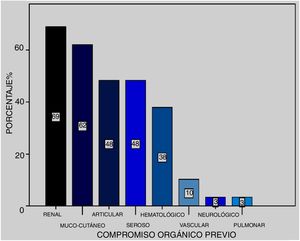
Al momento del episodio el SLEDAI fue de 16,8 con un IC (12-21). El compromiso orgánico previo en los 25 pacientes ordenados por frecuencia fue: renal (69%), mucocutáneo (62%), articular (48%), seroso (48%), hematológico (38%), vascular (10%) y neurológico (3%) (fig. 1).
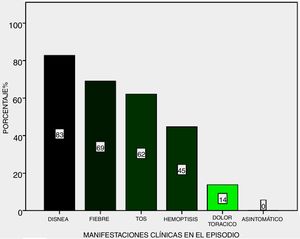
Clínica: los síntomas más frecuentes durante los 29 episodios fueron disnea (83%), fiebre (69%) y tos (62%), hemoptisis (45%) y finalmente dolor torácico (14%), ninguna hemorragia fue subclínica (fig. 2).
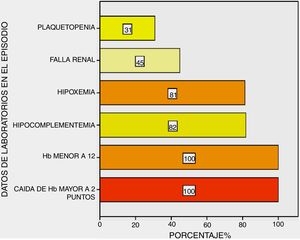
Todos los pacientes presentaron caída de la hemoglobina mayor a dos puntos y hemoglobina menor de 12 g/dL; hipocomplementemia en el 82%, insuficiencia respiratoria en el 81%, alteración en la función renal en el 45% y trombocitopenia en el 31% de ellos (fig. 3).
Todos los pacientes presentaron compromiso imagenológico en la radiografía y/o TAC, el patrón más frecuente fue de consolidaciones bilaterales parcheadas en vidrio esmerilado.
Se practicó BAL a todos los pacientes, excepto uno que fue intubado al ingreso observándose sangre por tubo endotraqueal. La media de siderófagos hallados fue del 35%. Seis de nuestros pacientes presentaron cultivos positivos en el BAL de ingreso con rescate de 3/6 Streptococcus pneumoniae, 2/6 Staphylococcus aureus sensible a meticilina y el ultimo una Klebsiellapenumoniae (con tratamineto antibiotico adecuado a la sensibilidad).
El promedio de demora diagnóstica de la HAD fue de 4,6 días (IC 2,5-6,7).
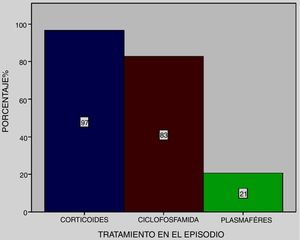
Todos los pacientes recibieron metilprednisolona en pulsos, excepto uno que falleció al ingreso a cuidados críticos, junto a ciclofosfamida en el 83% y plasmaféresis en el 21% (fig. 4).
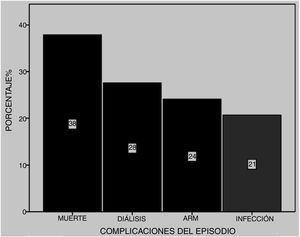
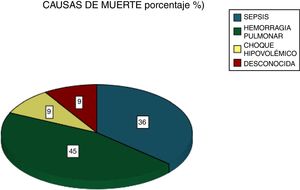
Dentro de las complicaciones más frecuentes se observaron infecciones en 21% (cinco a bacilos gramnegativos y una por Candida albicans), requerimiento de diálisis en 28% y ARM en 24% de los pacientes. De estos últimos, siete fallecieron (fig. 5). Seis pacientes recibieron plasmaféresis y cuatro de ellos fallecieron. En total murieron 11 (38%) pacientes, la mayoría a causa de la hemorragia pulmonar (fig. 6).
Encontramos mayor posibilidad de mortalidad de manera estadísticamente significativa en aquellos pacientes con una edad más tardía de inicio de LES (tabla 1), y en aquellos que en el episodio de HAD presentaron falla renal y requerimiento de ARM (OR = 6,9 y p = 0,027 y OR = 20,4 y p = 0,006 respectivamente) (tabla 2).
Características principales de la comparación de los pacientes con hemorragia alveolar difusa (HAD) vivos y fallecidos. La edad de inicio de la enfermedad demostró ser estadísticamente significativa
| Vivos(n = 18) | Fallecidos (n = 11) | P | |
|---|---|---|---|
| Sexo | |||
| Femenino | 13 | 10 | 0,36 |
| Masculino | 5 | 1 | |
| Edad de inicio del LES | 27,8 ± 9,8 | 31,3 ± 15,3 | 0,035 |
| Edad al momento de la HAD | 31,2 ± 12,9 | 35,1 ± 12,3 | 0,80 |
| HAD como inicio del LES | 5/8 | 3/8 | 1,00 |
| SLEDAI en el episodio | 16,1 ± 9,1 | 14,9 ± 12,3 | 0,56 |
| Hemoptisis | 5/12 | 7/12 | 0,12 |
| Hematócrito (media) | 23,7 ± 5,6 | 17,9 ± 3,7 | 0,45 |
| Plaquetas (media) | 221250 ± 135953 | 162000 ± 118452 | 0,29 |
| Complemento | 11/18 | 7/18 | 0,55 |
| Tratamiento previo con hidroxicloroquina | 7/9 | 2/9 | 0,41 |
| % de siderófagos en BAL (media) | 45,3 ± 23,3 | 37,1 ± 22,3 | 0,43 |
Factores de riesgo de mortalidad de pacientes con lupus eritematoso sistémico (LES) y hemorragia alveolar difusa (HAD). Tanto la falla renal, como el requerimiento de asistencia respiratoria mecánica (ARM) fueron estadísticamente significativos, aumento las probabilidades de mortalidad
| Características | Pacientes vivosN = 18 | Pacientes fallecidosN = 11 | p | OR |
|---|---|---|---|---|
| Falla renal (disminución de aclaramiento de Cr) | 5/18 (27,8%) | 8/11 (72,7%) | 0,027 | 6,93 (1,29-37,22) |
| ARM | 1/18 (5,6%) | 6/11 (54,5%) | 0,006 | 20,40 (1,96-211,79) |
| Infecciones | 4/18 (22,2%) | 2/11 (18,2%) | 1,00 | 0,78 (0,12-5,16) |
Se compararon una serie de pacientes con LES y HAD (casos) con 100 pacientes con LES sin HAD (controles), detectando que la anemia hemolítica y el compromiso renal como inicio de la enfermedad, fueron predominantes en los pacientes que presentaron HAD con un OR de 0,22 y una p = 0,05 y un OR = 0,25 y p = 0,004, sin aumentar las posibilidades de la misma y que el SLEDAI mayor a 10 puntos de inicio elevó las oportunidades de sufrir hemorragia en 2,68 veces con una p = 0,046. La posibilidad de muerte en los pacientes con HAD comparada con los controles es 4,56 veces mayor con una p = 0,005 (tabla 3).
Comparación de casos y controles. Los pacientes cuyo SLEDAI al inicio de la enfermedad fue mayor a 10, presentaron más probabilidades de desarrollar hemorragia alveolar difusa (HAD) y, por lo tanto, mayor mortalidad
| Casos (HAD n = 25) | Controles (N = 100) | P | OR | ||
|---|---|---|---|---|---|
| Sexo | Femenino | 3/25 (12%) | 11/100 (11%) | 1,00 | 0,91 (0,23 – 3,53) |
| Masculino | 22/25 (88%) | 89/100 (89%) | |||
| Edad deinicio delLES (años) | Mayor a 30 años | 10/25 (40%) | 37/100 (37%) | 0,82 | 1,13 (0,46 – 2,78) |
| Menor a 30 años | 15/25 (60%) | 63/100 (63%) | |||
| SLEDAIAl iniciode laenfermedad | Menor a 10 | 7/25 (28%) | 51/100 (51%) | 0,046 | 2,68 (1,02 – 6,96) |
| Mayor a 10 | 18/25 (72%) | 49/100 (49%) | |||
| Tiempo de evolución de la enfermedad | 3,8 años (DS 5,5) | 4,60 años (DS 5,4) | 0,82 | - | |
| Alopecia | 10/25 (40%) | 36/100 (36%) | 0,82 | 0,84 (0,34 – 2,07) | |
| Artritis | 13/25 (52%) | 65/100 (65%) | 0,25 | 1,71 (0,71 – 4,16) | |
| Eritema malar | 17/25 (68%) | 65/100 | 0,82 | 0,87 (0,34 – 2,23) | |
| Úlceras | 5/25 (20%) | 25/100 (25%) | 0,79 | 1,33 (0,45 – 3,92) | |
| Renal | 18/25 (72%) | 39/100 (39%) | 0,004 | 0,25 (0,09 – 0,65) | |
| Serositis | 7/25 (28%) | 24/100 (24%) | 0,79 | 0,81 (0,30 – 2,17) | |
| Neurológico | 1/25 (4%) | 8/100 (8%) | 0,69 | 2,08 (0,25 – 17,51) | |
| Anemia hemolítica | 4/25 (16%) | 4/100 (4%) | 0,05 | 0,22 ((0,05- 0,95) | |
| Anti-DNA | 15/25 (60%) | 49/100 (49%) | 0,38 | 0,41 (0,26 – 1,56) | |
| Hipocomplementemia | 21/25 (84%) | 89/100 (89%) | 0,49 | 1,54 (0,45 – 5,32) | |
| FallecidosN 93 pacientes (32 pérdida de seguimiento) | 11/25 (44%) | 10/68 (15%) | 0,005 | 4,56 (1,62 – 12,85) | |
LES: lupus eritematoso sistémico; SLEDAI: Systemic Lupus Erythematosus Disease Activity Index.
Dado lo infrecuente de esta complicación, la mayor parte del conocimiento sobre esta entidad se basa en el reporte de casos y series de diferentes centros como ya lo describen Martinez-Martinez y Abud-Mendoza, en su revisión del año 2014 sobre el tema (la tabla 4 es sustraída de dicha revisión con el permiso de los autores)10.
Características demográficas de diferentes series. Sustraído de Martinez-Martinez y Abud-Mendoza3. Reporte de casos de HAD publicados en la literatura
| Autores, año de publicacion | pais | Numero de episodios | frecuencia | mujeres | Edad (media) | Evolucion LES | Descenso medio de la hemoglobina (g/dl) |
|---|---|---|---|---|---|---|---|
| Araujo et al., 201221 | Brasil | 28 LESJ 13 LESA 15 | 1,6% | LESJ 77%LESA 87% | LESJ 15,3LESA28,7 | LESJ 2,6aLESA 5,6a | LESJ 2,9LESA 5,5 |
| Martinez-Martinez y Abud-Mendoza., 201122 | México | 29 | 9% | 75,9% | 25,1 | 1,5ª | 3,4 |
| Kowk et al., 201116 | Corea del Sur | 21 | 1,4% | 90,5% | 29,7 | 5,4a | 2,1 |
| Shen et al., 201017 | China | 29 | 1,4% | 86,2% | 31 | 42m | 3,2 (mediana) |
| Rojas-Serrano et al., 200811 | México | 14 | 0,6% | 96,8% | 22,4 | - | - |
| Cañas et al., 200712 | Colombia | 7 | 5,7% | 71,4% | 24,3 | 15,7m | - |
| Badsha et al., 200419 | Singapur | 22 | 1,5% | 91% | 31,6 | 0,96a | 3,2 |
| Chang et al.,200213 | Taiwán | 8 | 0,5% | 100% | 32,5 | 36m | 3,0 (mediana) |
| Lee et al., 200123 | Corea | 9 | - | 100% | 26 | 2m | 1,9 (mediana) |
| Santos-Ocampo et al., 200024 | EE.UU. | 11 | 1% | 81,8% | 31,1 | 4,5a | - |
| Lee et al.,200014 | Corea | 6 | - | 83,3% | 28 | 6m | 2,1 |
| Liu et al., 199825 | Taiwán | 13 | 4,3% | 92,3% | 26 | 23m | 2,4 |
| Zamora et al., 199720 | EE.UU. | 19 | 3,7% | 68,4% | 27 | 31m | 7,1%ht |
| Koh et al.,199726 | Singapur | 10 | - | 80% | 25 | 21,5m | - |
| Barile et al., 19979 | México | 34 | 5,4% | 94,1% | 34,5 | 14,1a | - |
| Schwab et al., 199327 | EE.UU. | 8 | - | 75% | 37,9 | 2,3a | - |
| Abud-Mendoza et al.,19858 | México | 12 | 1,6% | 100% | 25 | 24m | - |
| Mintz et al., 197815 | México | 7 | - | 100% | 30 | 3,2a | - |
-: no informado; a: años; ht: hematócrito; LESA: LES adultos; LESJ: LES juvenil; m: meses.
En este trabajo se evaluaron 306 pacientes con diagnóstico de LES, 25 de ellos (8,2%) presentaron 29 episodios de HAD. La prevalencia de esta complicación varía según las series desde el 0,611 al 5,7%12.
Se encuentran series que muestran únicamente afectación en mujeres8,13-15, en este estudio el 88% de los pacientes fueron mujeres, con una edad media de presentación de 33 años en coincidencia con los trabajos de Kwok et al.16 y Shen et al.17. En cambio, en la serie de Quintana et al. presentan menor porcentaje de mujeres (64,7%) con una edad de incidencia menor (28 años)18.
En cuanto a la aparición de la HAD en el transcurso de la evolución de la enfermedad es muy variable, existen series que reportan el evento desde dos meses14 hasta 14 años9 luego del inicio del LES, y de hecho un porcentaje no menor puede iniciar como HAD, dificultando su diagnóstico. En la casuística analizada se encontró que la hemorragia se presentó durante la evolución de la enfermedad a los 63 meses de su inicio con un IC (33-93), mientras que 8/25 (32%) pacientes lo hicieron como inicio de la enfermedad similar a lo reportado por Martinez-Martinez et al.19.
Los trabajos muestran que la HAD es una complicación que suele darse en el contexto de una enfermedad basal activa (media de SLEDAI mayor a 12 puntos), siendo en la serie trabajada la media de SLEDAI de 16,8 IC (12-21), donde el riñón fue el principal órgano que contribuyó al puntaje (similar a lo descrito enla mayoría de las series). Es de destacar que Humeira et al.20 informan un aumento del SLEDAI el mes previo al evento.
Se puso en evidencia que el compromiso orgánico previo al episodio en la serie presentada (n = 25) fue: renal (69%), mucocutáneo (62%), articular (48%), seroso (48%), hematológico (38%), vascular (10%) y psiquiátrico (3%). En este sentido Kowk et al.16 realizan un análisis univariado informando mayor riesgo de desarrollo de HAD en aquellos pacientes con serositis, lupus neurosiquiátrico, SLEDAI mayor a 10, nefritis e hipertensión pulmonar y, a través del análisis multivariado, las de significaciín estadóstica fueron el LES neuropsiquiátrico y el SLEDAI mayor a 10, demostrado también en el metanálisis de Xu et al.21. Cuando buscamos factores predictores de HAD en nuestros pacientes hallamos que el SLEDAI mayor a 10 puntos otorgaba una probabilidad de 2,68 veces de presentarla. Además, encontramos que la necesidad de ARM y la presencia de falla renal aumentaban la probabilidad de mortalidad en 20,4 y 6,93, respectivamente.
El cuadro clínico es muy sugestivo en la mayoría de los casos, pudiendo progresar a insuficiencia respiratoria con requerimiento de ARM, si bien existen reportes aislados de hemorragia pulmonar asintomática, aún siendo severas8. Ninguno de nuestros pacientes se presentó de esta manera. En relación a uno de los signos cardinales, como la hemoptisis, la mayoría de las series reporta alrededor del 50% como forma de presentación del cuadro, similar a lo hallado en la serie presentada.
En cuanto a los métodos complementarios, todos los pacientes presentaron caída de la hemoglobina mayor a dos puntos y hemoglobina menor de 12 g/dL; hipoxemia e hipocomplementemia en la mayoría de ellos y alteración en la función renal en la mitad.
Algunas series comunican una asociacion estadisticamente significativa de trombocitopenia con HAD, ya sea como predictor del evento en pacientes con LES16,22 o en el episodio de HAD con mayor mortalidad23. En nuestra casuística encontramos trombocitopenia en 31% de los pacientes en su mayoria leve-moderada (en tres fue severa con menos de 50.000) sin relevancia estadistica en el episodio (mortalidad) o previo a este (predictor de HAD); esto nos indica que la trombocitopenia contribuye al SLEDAI más que como factor independiente de HAD.
Todos los pacientes presentaron compromiso imagenológico en radiografía y/o TAC, existiendo comunicaciones como la de Ortiz et al.4 donde puede encontrarse HAD sin traducción imagenológica. En realidad, no existen datos clínicos, analíticos e imagenológicos patognomónicos de esta entidad y es considerable el número de patologías que pueden simular este cuadro como la insuficiencia cardíaca, el tromboembolismo de pulmón, la neumonitis lúpica24 y otras causas de daño alveolar difuso solo por mencionar algunas. Además, los agentes infecciosos pueden ser simples colonizadores de la vía aérea, disparadores o causantes del cuadro, por lo que creemos que el lavado bronquioalveolar (BAL) juega un papel fundamental en el diagnóstico precoz de HAD y para descartar infecciones19. En nuestra serie se practicó BAL a todos los pacientes excepto a uno, que fue intubabo al ingreso, siendo la media de siderófagos hallados del 35%; seis con cultivo positivo que recibieron antibioticoterapia ajustada al germen como parte del tratamiento inicial, similar a lo reportado en la literatura25.
El promedio de demora diagnóstica fue de 4,6 días con un IC (2,5-6,7). A pesar de una busqueda más precoz e intensiva ante la sospecha de HAD en estos pacientes, notamos que al prolongar la serie previamente reportada por este servicio6 no ha variado la demora diagnóstica.
En la mayoría de las series se ha usado combinación de esteroides en pulsos endovenosos (metilprednisolona 1 g/día por tres días) con otras terapias inmunodepresoras como ciclofosfamida, plasmaféresis y en menor medida rituximab. La dosis y la combinación de terapias se basa en reporte de casos. Zamora et al.26 informan en su serie una variación de la mortalidad en relación con el tratamiento, con mayor sobrevida en los pacientes que recibieron ciclofosfamida. En esta serie, todos los pacientes recibieron metilprednisolona en pulsos, excepto uno que falleció al ingreso a cuidados críticos, junto a ciclofosfamida en 83% de ellos, similar a lo observado en la serie recientemente publicada de Quintana et al.18.
Dentro de las complicaciones más frecuentes se observaron infecciones, requerimiento de diálisis y ARM. En total murieron 11 (38%) pacientes, la mayoría a causa de la hemorragia pulmonar. Este es un porcentaje superior al reportado en otras series7,11,22,27; tal vez la variabilidad en la mortalidad se deba a la heterogeneidad de los pacientes, su severidad, el abordaje diagnóstico y terapéutico. Es para destacar que no evidenciamos una mayor mortalidad en aquellos pacientes con cultivos positivos al ingreso en comparación con quienes no lo tuvieron (p = 1,0 - OR = 0,78) igual que en el trabajo de Sun et al.23.
ConclusiónLa HAD en los pacientes con LES es una complicación infrecuente pero que requiere siempre de un diagnóstico precoz y un tratamiento intensivo para mejorar la sobrevida.
Coincidiendo con alguna de las series, la necesidad de ventilación mecánica y el compromiso renal resultan en una mayor mortalidad, en forma estadísticamente significativa, con una mayor probabilidad de mortalidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.