Identificar herramientas diseñadas para evaluar la gravedad global de los pacientes con artritis reumatoide (AR) para su uso en la investigación de marcadores pronósticos de artritis precoz.
MétodosRevisión sistemática de estudios cuyo objetivo fuera el desarrollo o validación de índices de gravedad en AR. Se valoró la calidad metodológica mediante la lista de comprobación COSMIN. Además, se evaluó la claridad de definición, viabilidad y probabilidad de estar presente durante los 2 primeros años de evolución.
ResultadosDespués de revisar 3.519 artículos, se identificaron 3 índices de gravedad. La Patient Activity Scale (PAS) valoró si el tratamiento previo o actual predecía la gravedad de la AR, medida mediante el patient-reported PAS. Las variables de tratamiento no permitieron distinguir entre los cuartiles superior e inferior de la PAS. El CIRAS incluye las variables edad, sexo, síndrome de Felty, número de visitas al reumatólogo y al rehabilitador, factor reumatoide (FR), recuento de plaquetas, marcadores inflamatorios y paneles bioquímicos solicitados. Su correlación fue baja (r=0,56), con un índice previamente validado por el mismo grupo investigador, el RARBIS, con el DAS28-PCR (r = 0,07) y el Multidimensional Health Assesment Questionnaire (MD-HAQ) (r=0,008). Por último, el RARBIS, utilizado para validar el CIRAS, fue ideado como un índice de gravedad de AR basado en registros médicos. Incluye como dominios cirugía, radiología, manifestaciones extraarticulares, clínica y variables de laboratorio, elegidas previamente por un panel de expertos. Este índice presentó una correlación débil con la intensidad de tratamiento (r = 0,35) y con el DAS 28 (r = 0,41).
ConclusiónNo existe ningún índice para valorar la gravedad de la AR sobre la base del curso evolutivo de los 2 primeros años de seguimiento y que se adapte a la estrategia terapéutica actual. Por lo tanto, creemos razonable el desarrollo de un nuevo índice de gravedad ad hoc para pacientes con artritis de reciente comienzo.
To identify tools designed to evaluate the severity of patients with rheumatoid arthritis (RA) in order to use them in the investigation of prognostic markers in early arthritis.
MethodsWe conducted a systematic review of studies that developed/validated an index for RA disease severity. They were analyzed using the COSMIN checklist to assess their methodological quality. In addition, all the variables included were evaluated for their clarity of definition, feasibility and probability of being present in each outcome during the first 2 years of the disease course. To estimate redundancy, variables were grouped by domains.
ResultsAfter reviewing 3,519 articles, 3 studies were included. The first study, the PAS, assessed whether current and lifetime treatment with disease-modifying antirheumatic drugs and/or biologics accurately predicted RA severity, as measured by the patient-reported PAS. Treatment variables did not fully distinguish patients in the highest and lowest quartiles of PAS scores. Another severity index, the Claims-Based Index for RA Severity (CIRAS), included the variables age, sex, Felty's syndrome, number of rehabilitation and rheumatology visits, test for inflammatory markers, number of chemistry panels/platelet counts ordered and rheumatoid factor test. The correlation was low (r=0.56) with an index previously validated by the same research group, the RA medical records-based index of severity (RARBIS), with Disease Activity Score-C-reactive protein (DAS28-PCR) (r=0.07) and Multidimensional Health Assessment Questionnaire (MD-HAQ) (r=0.008). Finally, the RARBIS, used to validate the CIRAS, was devised as an RA severity index based on medical records. It includes as domains surgery, radiology, extra-articular manifestations, clinical and laboratory variables, previously chosen by an expert panel. RARBIS had a weak correlation with treatment intensity (r=0.35) and with DAS28 (r=0.41).
ConclusionThere is no index to assess the severity of RA based on the course of the first 2 years of follow-up that is adapted to the current strategy of therapeutic management of this disease. Therefore, we believe it is reasonable to develop a new ad hoc severity index for patients with early arthritis.
Las recomendaciones de manejo de la artritis reumatoide (AR) apoyan la puesta en práctica de estrategias terapéuticas intensivas, ya que la evidencia científica demuestra que mejoran la evolución de la enfermedad1–3. Estas estrategias intensivas se basan en 2 pilares clave: a) la medición estrecha del proceso inflamatorio («tight control» [TC])4–6, y b) el establecimiento de un objetivo terapéutico sobre la base de índices compuestos de actividad, lo que se conoce como «treat-to-target» (t2t)4–6.
Además, el inicio precoz de tratamiento con fármacos modificadores de la enfermedad (FAME) puede enlentecer o evitar la progresión y modificar, subsidiariamente, el exceso de riesgo asociado, hipótesis esta de la «ventana de oportunidad», que ha sido confirmada7–9.
La implantación en muchos países de las consultas de artritis de reciente comienzo (CARC) responde, precisamente, a la intención de utilizar de forma temprana estrategias terapéuticas dirigidas a mejorar los resultados clínicos y radiológicos10–13. Es más, la esperanza de que se pueda revertir el curso evolutivo en fases precoces de la enfermedad ha promovido el uso de estrategias terapéuticas intensivas incluso en pacientes con artritis indiferenciada14,15. Sin embargo, el tratamiento intensivo con FAME puede suponer también un aumento de la toxicidad16. El reconocimiento, al inicio de la enfermedad, de las características relacionadas con un peor curso evolutivo puede ayudar a mejorar la relación riesgo/beneficio y ajustar la instauración de un abordaje terapéutico precoz e intensivo en los casos con peor pronóstico17.
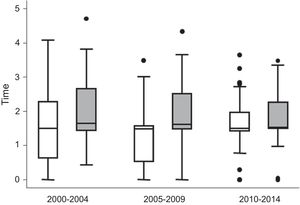
La puesta en marcha de las estrategias TC y t2t a lo largo de los últimos 10 años ha tenido, precisamente por su gran eficacia, una consecuencia inesperada en la investigación de biomarcadores. Puesto que los pacientes con peor pronóstico inicial son tratados de forma más intensiva, las variables de desenlace clásicas, como la consecución de remisión o la progresión radiológica a largo plazo, no muestran diferencias entre pacientes con peor o mejor pronóstico de inicio18. Es más, en los últimos años, en el estudio Princesa Early Arthritis Register Longitudinal (PEARL) se ha detectado que la intensidad de tratamiento entre pacientes ACPA positivo y negativo se ha ido igualando (fig. 1), probablemente con el objeto de aprovechar la ventana de oportunidad. Para obviar este problema, y poder explorar biomarcadores de mal pronóstico en pacientes con artritis de inicio, se han propuesto diferentes variables subrogadas de gravedad relacionadas con el uso de tratamiento más intenso, como la necesidad del uso de terapia biológica (TB)19 o la cantidad acumulada de tratamiento18,20 No obstante, la validez y las propiedades métricas de estas variables está por determinar.
Descripción del tratamiento recibido por los pacientes de la cohorte PEARL en los periodos 2000-2004, 2005-2009 y 2010-2014. Diferenciación de la variable tiempo con fármacos modificadores de la enfermedad (FAME) entre pacientes ACPA positivo (gris) y ACPA negativo (blanco). Los datos se muestran como la mediana de la variable FAME (línea dentro de la caja) y los percentiles 25,75 (bordes inferior y superior de la caja), 10 y 90 (extremos de las líneas fuera de la caja). Los puntos representan los casos fuera de este rango.
Confrontados, en este contexto, con la necesidad de disponer de una variable de gravedad válida que permitiera evaluar la utilidad de biomarcadores en artritis de reciente comienzo, nos planteamos realizar una evaluación de herramientas existentes. Para ello llevamos a cabo una revisión sistemática de la literatura con el objetivo de: 1) identificar índices o instrumentos que permitan discriminar entre pacientes con AR graves y no graves, y 2) evaluar su validez y aplicabilidad a partir de datos existentes en la historia clínica. Posteriormente, se exploró si los instrumentos identificados permitirían estimar la gravedad de pacientes con artritis de reciente comienzo en un momento suficientemente precoz del seguimiento para poder realizar estudios de biomarcadores eficientes, para lo que establecimos como punto de corte los 2 primeros años tras el diagnóstico.
MétodosSe realizó una revisión sistemática de estudios sobre desarrollo o validación de índices o variables de gravedad en pacientes adultos con AR.
Estrategia de búsquedaSe realizó una búsqueda sensible en MEDLINE (1950-enero del 2017) por una persona experimentada (LC), mediante términos Mesh y texto libre, sin restricción de idiomas. La estrategia incluyó sinónimos de «artritis reumatoide», «estudios de validación» o «desarrollo de («variables» o «índices» o «cuestionarios») o «Estudios pronósticos», y del término «gravedad». La estrategia de búsqueda está disponible como material suplementario.
Selección de estudiosLa selección de estudios fue realizada por un revisor entrenado (ET) en 3 pasos: 1) selección por títulos; 2) selección por resúmenes, y 3) recopilación del texto completo de las referencias seleccionadas y evaluación de los mismos, realizando la selección final en función de los criterios fijados con anterioridad. Se registró una razón para excluir un estudio en todos los casos no incluidos.
Evaluación de la calidad de los índicesLos índices o cuestionarios de gravedad encontrados en este proceso de búsqueda se analizaron mediante la lista de verificación de COnsensus-based Standards for the selection of health Measurement Instruments (COSMIN)21. Esta lista contiene normas para adecuar los requisitos de diseño y métodos estadísticos para estudios sobre propiedades psicométricas de instrumentos de medición de la salud y puede ser utilizada para determinar si un estudio cumple con los estándares de buena calidad metodológica. Contiene 4 pasos que permiten calcular la calidad metodológica de los distintos aspectos de la validación del instrumento de medida a estudio.
Finalmente, en cada una de las variables de los índices se analizaron las cualidades consideradas de especial relevancia para el grupo investigador como claridad de la definición, viabilidad, presencia en los 2 primeros años de evolución y dominio al que pertenecen.
ResultadosIdentificación de instrumentos para evaluación de gravedadLa estrategia de búsqueda identificó 3.519 artículos (véase la figura en el material suplementario), de los que se excluyeron 3.505 tras lectura de título y resumen. El motivo de exclusión fundamental fue no tener como objetivo la validación o desarrollo de un índice o cuestionario de gravedad en la AR. De los 14 restantes, se excluyeron otros 7 por el mismo motivo tras lectura en detalle (material suplementario). Finalmente, se incluyeron 7 artículos en la revisión sistemática cuyo objetivo fue el desarrollo o validación de un índice de gravedad en la AR. En total se encontraron 3 índices de gravedad en la AR, la Patient Activity Scale (PAS), el RARBIS y el CIRAS, cuyas características se describen a continuación.
Patient Activity ScaleLa escala de actividad del paciente (PAS) fue desarrollada por Wolfe et al.22 a partir de la media de las puntuaciones del Health Assesment Questionnaire (HAQ) (calibrado de 0 a 10), y 2 escalas visuales analógicas, una para el dolor y otra para la actividad total; variables todas proporcionadas por el paciente. Esta escala cumplimentada por el paciente había demostrado una fuerte correlación con la actividad de la enfermedad en ensayos clínicos. Wolfe et al. la emplearon como sinónimo de gravedad en un estudio en 200623 y la intentaron validar estudiando su capacidad de discriminación para pacientes con distinta carga de tratamiento.
Las características de los 7.541 pacientes incluidos en el estudio de validación de criterio se presentan en la tabla 1. De forma similar a los otros índices encontrados, no se incluye información de variables basales que típicamente están asociadas con mayor gravedad. La mayoría de los pacientes (87%) utilizaba, en el momento de la visita, un FAME y/o biológico (74,2% utilizaba un FAME, 33,1% un biológico y el 18,3% no utilizaba ni un FAME ni un biológico). La PAS medio fue 3,4. La puntuación mayor del índice PAS se alcanzó en pacientes que no tomaban ninguna medicación (PAS 3,7, rango intercuartil [IQR] 1,7-5,7) y en aquellos que no habían tomado con anterioridad FAME o biológicos (PAS 3,7, IQR 2,0-5,4).
Características de los índices incluidos en la revisión
| Índice | Dominios y variables | Rango | Validez aparente | Validez de constructo | Validez de criterio | Viabilidad | Justificable en los 2 primeros años |
|---|---|---|---|---|---|---|---|
| PAS | Dolor (EVA) Función (HAQ) Gravedada (EVA) | 0-10 | Obtenido a partir de los componentes del ACR core-set, pero no específicamente ligado a gravedad, sino a actividad Poca validez aparente COSMIN: + | Adecuada frente al constructo actividad: correlación fuerte con ACR20 y 50 y con DAS Menos clara frente a gravedad COSMIN:+ | AUC = 0,70 para diferenciar entre tratamiento con FAME y biológicos COSMIN: +++ | +++ Todas variables presentes | +++ (todas las variables presentes) |
| RARBIS | Cirugía (fusión C1-C2), cualquier articulación mano, cualquier articulación pie, articulaciones grandes (caderas, rodillas, hombros, codos) Radiología (subluxación C1-C2, cualquier erosión) Manifestaciones extraarticulares (vasculitis, nódulos pulmonares) Clínica (brote artritis, valoración global enfermedad médico, estado funcional, rigidez matutina) Laboratorio (FR > límite normalidad, VSG>edad/2 o PCR > límite normalidad o plaquetas>450.000) | 0-15b | Desarrollado a partir de Delphi Validez aparente apropiada COSMIN: ++ | Adecuada COSMIN: ++ | No evaluado | +++ | ++ (difícil variables cirugía y destrucción radiología) |
| CIRAS | Identificación/datos personales (edad, género) Variables analíticas inflamación (N.° marcadores inflamatorios) Utilización servicios sanitarios (visitas a rehabilitador) Variables inmunológicas Síndrome (FR) Manifestaciones extraarticulares (Felty) Variables analíticas inflamación (recuento plaquetas) Variables analíticas bioquímicas (paneles bioquímicos) | 6,5 | Desarrollado a partir del RARBIS. Sin embargo, está formado por variables que reflejan actividad médica y que puede «contaminarse» con las medidas propias del t2t Validez aparente en duda COSMIN: + | Adecuada COSMIN: ++ | No evaluado | ++ | +++ |
Calidad metodológica según COSMIN:+baja; ++ moderada; +++: excelente. Viabilidad:+ pocas variables presentes; ++: bastantes variables presentes; +++: todas las variables presentes. Justificable en los 2 primeros años: ++: bastante; +++: completamente.
NE: no evaluado.
Los autores valoraron la capacidad de las variables de tratamiento para predecir la puntuación PAS mediante el cálculo del área bajo la curva ROC (AUC) y el porcentaje de clasificación correcta, obteniéndose una AUC de 0,64 y un porcentaje de clasificación correcta del 60,5%. Wolfe et al. concluyen que el uso de variables demográficas y de tratamiento en bases de datos administrativos no permite diferenciar grupos de pacientes en función de su gravedad con adecuada sensibilidad y/o especificidad.
Rheumatoid Arthritis Records-Based Index of SeverityEl Rheumatoid Arthritis Records-Based Index of Severity (RARBIS) fue concebido como un índice de gravedad de AR basado en registros médicos. Utiliza una serie de indicadores de gravedad previamente elegidos mediante metodología Delphi por un panel de 6 expertos reumatólogos24. El RARBIS incluye 5 subescalas o dominios: cirugía, radiología, manifestaciones extraarticulares, clínica y variables de laboratorio. La subescala tratamiento fue finalmente excluida del RARBIS total. A aquellos dominios que habían sido valorados por el panel como muy relacionados con la gravedad se les asignó una puntuación mayor en el índice.
Posteriormente, se estudió el desarrollo del índice en una cohorte de veteranos25 y se exploró la validez de constructo mediante la comparación del RARBIS con la intensidad de tratamiento: baja (sin FAME ni tratamiento biológico), moderada (hidroxicloroquina, sales de oro o sulfasalazina), alta (metotrexato, azatioprina, leflunomida o ciclosporina) o muy alta (tratamiento biológico), demostrando correlación con la intensidad de tratamiento de la AR (validez de constructo)25, aunque la asociación era débil (r = 0,35, IC del 95%, 0,18-0,55).
En un estudio posterior se estableció la validez convergente con respecto al DAS2826. Se seleccionó para ello a 100 pacientes de la cohorte (Brigham and Women's Hospital Rheumatoid Arthritis Sequential Study (BRASS) con un DAS28 distribuido de forma equitativa en 4 cuartiles. La correlación entre el RARBIS total y el DAS28 fue débil (r = 0,41, IC del 95%, 0,23-0,56), así como la de las diferentes subescalas o dominios del índice RARBIS con el DAS28, que en algunos casos fue inexistente. No obstante, la correlación mejoró cuando los autores aumentaron el peso de la subescala clínica y disminuyeron el peso de la subescala cirugía (r = 0,48, IC del 95%, 0,31-0,62)21.
Claims-based Index for Rheumatoid Arthritis SeverityEl mismo grupo de investigación del RARBIS desarrolló con posterioridad el Claims-based Index for Rheumatoid Arthritis Severity (CIRAS)27, un índice de gravedad de la AR basado en indicadores potenciales de gravedad de diferentes dominios, tanto demográficos como clínicos y, sobre todo, de utilización de servicios sanitarios. Para ello se incluyó a 120 pacientes de la mencionada cohorte de veteranos del New England VA Health System que tuvieron al menos 2 visitas registradas con un diagnóstico de AR (CIE 9.ª edición, código 714.0), al menos 2 visitas hospitalarias entre julio de 1999 y junio del 2001, y entradas suficientes en el registro médico en relación con la enfermedad. Las características de los pacientes se detallan en la tabla 1.
Los autores desarrollaron el índice Claims-based Index of Rheumatoid Arthritis Severity (CIRAS) mediante modelos de regresión lineal, en función de diferentes variables extraídas de datos administrativos. Utilizaron diversos procedimientos de selección con el fin de lograr el mejor modelo, según su R2. El CIRAS final incluyó las variables administrativas presentes en el mejor modelo. Cada una de las variables fue ponderada por su coeficiente de correlación. Se evaluó la validez de constructo mediante análisis de correlación entre el CIRAS y el RARBIS, obteniéndose un coeficiente de correlación entre el índice CIRAS y el RARBIS, obteniéndose una rho=0,56 entre el CIRAS y el RARBIS con la subescala medicación, y una rho=0,51 sin la subescala medicación. En un estudio posterior con 315 pacientes28 se evaluó la validez convergente del CIRAS con respecto al DAS28-PCR y al Multidimensional HAQ (MD-HAQ). La correlación entre el CIRAS y el DAS28-PCR (r = 0,07) y el MD-HAQ (r = 0,008) fue muy baja. Finalmente, los resultados de un modelo de regresión lineal con variables adicionales extraídas de datos administrativos de la cohorte Medicare no incluidas en el CIRAS (afectación pulmonar intersticial, cirugía de mano, solicitud del test de la tuberculina, solicitud ACCP, corticoides, opioides, antiinflamatorios no esteroideos, número de fármacos biológicos y no biológicos) mostraron una escasa capacidad para explicar la variabilidad del DAS28-PCR (R2 = 0,23).
La descripción de las variables, dominios y puntuación de los 3 índices incluidos en la revisión se describen en la tabla 1.
Evaluación crítica de los índicesLos aspectos de la validación estudiados, así como las cualidades consideradas de especial relevancia por el grupo investigador se describen para los 3 índices en la tabla 1.
DiscusiónLa búsqueda de marcadores o factores pronósticos precisa de medidas de desenlace fiables. En enfermedades cuyas variables de desenlace son extremadamente objetivas y consistentes, como el cáncer (muerte o progresión tumoral) o la osteoporosis (aparición de nueva fractura o variación de la densidad mineral ósea), la medicina personalizada o, al menos, ajustada a perfiles de paciente parece cada día más viable. Sin embargo, y por el momento, en la AR carecemos de estas variables objetivas o consistentes. El principal «patrón de oro» disponible hasta hace unos años, la progresión radiológica, ha sucumbido ante las estrategias de tratamiento intensivas5 y la aparición de fármacos capaces de frenar la progresión radiológica incluso en pacientes sin una respuesta terapéutica mínima.
El objetivo del presente trabajo era identificar índices compuestos de gravedad, basados en diferentes dominios, que pudiesen ser aplicados a la búsqueda de factores predictivos de gravedad en la AR. La búsqueda sistemática realizada hasta 2017 solo permitió identificar 3 herramientas, los índices PAS22, el RARBIS25 y el CIRAS27,29. Su desarrollo se inició poco tiempo después del inicio de la era biológica en el campo de la Reumatología, hace aproximadamente 15 años, y supone un considerable esfuerzo por encontrar un índice capaz de estimar la gravedad de la AR.
El más antiguo de ellos, RARBIS, se basa en datos obtenidos de las historias clínicas y su principal defecto es que, por su antigüedad, pondera circunstancias como la presencia de síndrome de Felty, que en la actualidad prácticamente no vemos en nuestros pacientes. Algunas otras variables incluidas en este índice, especialmente en los dominios cirugía y radiología, no están presentes en los 2 primeros años de enfermedad. Por último, su pobre correlación con las necesidades de tratamiento o la actividad clínica de los pacientes llevó a sus autores a replantearse el acercamiento al problema.
Wolfe et al.22 utilizaron la PAS como variable de gravedad sin haber realizado previamente un estudio de validación, sino intercambiando simplemente el concepto de actividad por el de gravedad, sin obtener tampoco una buena capacidad de discriminación para el criterio «tratamiento con FAME y biológico».
El CIRAS se basa, fundamentalmente, en la obtención de información sobre la utilización de servicios sanitarios registrada electrónicamente. Aunque las variables incluidas en este índice sí pueden recogerse en los 2 primeros años de evolución de los pacientes con artritis de reciente comienzo, la incorporación de las estrategias TC y t2t en la práctica clínica habitual hace que el número de visitas al reumatólogo y la realización de múltiples determinaciones de laboratorio no tengan por qué estar relacionados con una mayor gravedad y sí con la puesta en práctica de esta estrategia terapéutica. Por otro lado, las visitas al rehabilitador, muy frecuentes en épocas anteriores, son excepcionales en la era biológica, gracias al mejor control de la actividad de la enfermedad en los primeros años de evolución. Además, el índice CIRAS incluye variables que, aunque relacionadas con la utilización de los servicios sanitarios (solicitud de marcadores de inflamación, de recuento de plaquetas y de otros parámetros bioquímicos), permiten poner en práctica la estrategia t2t sin que eso signifique un incremento de la gravedad. Otras variables incluidas, como el síndrome de Felty, tienen una presencia clínica excepcional.
Por otro lado, la validación de estos índices plantea algunos problemas metodológicos. Aunque el desarrollo del RARBIS se basó en un panel de expertos, las subescalas (dominios) y los indicadores (variables) se ponderaron de acuerdo con el criterio del panel según la correlación con la gravedad. Para valorar la posible interdependencia o contribución relativa de las variables seleccionadas no se utilizó ninguna técnica de reducción de ítems que evitara posibles redundancias. En el CIRAS las variables incluidas se eligen como parte del mejor modelo identificado, no en función de aspectos relevantes del constructo, sino en función de la disponibilidad de recogida en registros de salud, sin plantearse si reflejan todos los aspectos relevantes del constructo «gravedad». En ambos índices únicamente se contempla la validez de constructo (validez convergente), sin tener en cuenta otros aspectos de la validación ni la fiabilidad. La correlación con el constructo utilizado en ambos casos fue débil, tal y como se ha explicado con anterioridad. Además, por el hecho de utilizar la misma cohorte de pacientes para el desarrollo de ambos índices, algunas correlaciones encontradas eran esperables. El desarrollo de la PAS plantea 2 limitaciones importantes; la primera de ellas es la utilización de medidas autorregistradas por el paciente, lo que puede originar un sesgo en la evaluación de la gravedad; la segunda es que solo se contempló la validez de criterio, con una baja capacidad predictivo de pacientes graves.
El diseño del estudio escandinavo NORD-STAR30, recientemente publicado, es el primer ensayo aleatorizado independiente que compara el tratamiento con FAME sintéticos y 3 líneas distintas de TB en un análisis «head to head» en una población de AR de inicio. El objetivo del estudio es identificar el mejor tratamiento de inducción de la remisión, pero también mejorar las estrategias de optimización terapéutica. A la espera de los primeros resultados, pone en práctica los mencionados conceptos t2t y TC, y permite fantasear con la idea de realizar un tratamiento individualizado para conseguir la remisión y, una vez lograda, utilizar la mejor estrategia de optimización terapéutica. En pacientes con AR de inicio, la buena respuesta mantenida en una gran proporción de pacientes después de la suspensión del anti-TNF apoya la idea de la ventana de oportunidad7–9. La clasificación de los pacientes en función de su gravedad, así como la evaluación de la utilidad de biomarcadores gracias a esta variable de gravedad, nos acercará a la idea de medicina personalizada que permitirá elegir el tratamiento de forma individualizada y, por qué no, reducir los costes directos e indirectos derivados de la enfermedad y del tratamiento. En definitiva, la presente revisión constata que no existe ningún índice que permita estimar la gravedad de la AR de forma temprana en los 2 años de seguimiento y que se adapte a la estrategia actual de manejo terapéutico. Por todo lo expuesto, creemos razonable el desarrollo de un nuevo índice de gravedad ad hoc para pacientes de una CARC en la actualidad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste estudio ha sido realizado gracias a fondos de los proyectos RD12/0009/0017 y PI14/00442 del Ministerio de Economía y Competitividad (Instituto de Salud Carlos III), cofinanciados por el Fondo Europeo de Desarrollo Regional (FEDER).
Conflicto de interesesEl Dr. González-Álvaro declara haber recibido financiación del Instituto de Salud Carlos III para la realización de este estudio. Además, sin relación con el presente trabajo, durante los últimos 5 años ha recibido pagos por asesoría o presentaciones de Abbvie, BMS, Lilly, UCB y Pfizer; financiación para proyectos de investigación no restringidos de Roche y UCB; apoyo para asistencia a congresos de Abbvie, BMS, MSD, Pfizer y UCB. Por último, tiene presentada y aprobada la patente PCT/ES2015/070182 a nivel europeo.