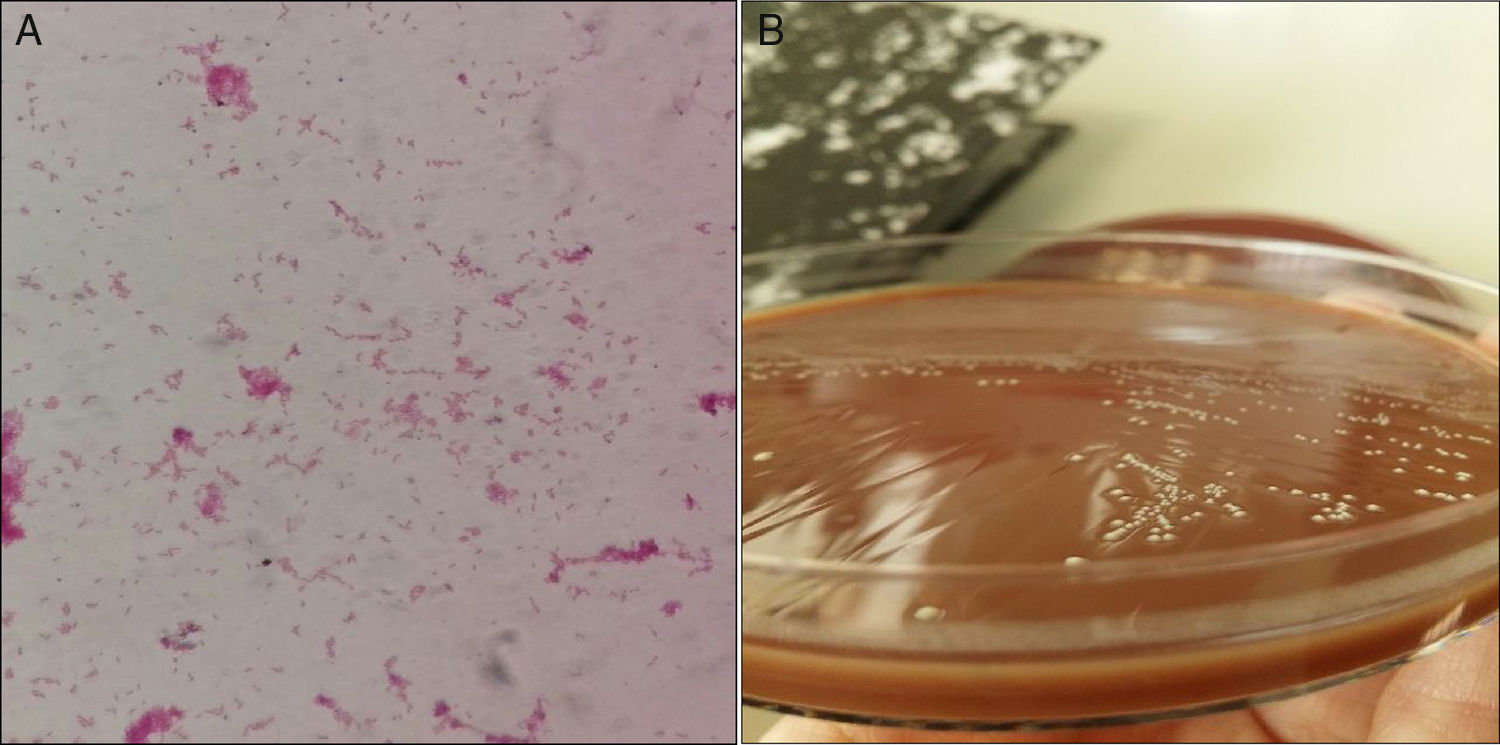
El Streptococcus mutans (Sm) es un microorganismo de la microbiota oral, causante de caries dental, bacteriemia y endocarditis. Solo hay publicado un único caso de artritis por este microorganismo1.
Presentamos un caso de infección de prótesis articular por Sm. Se trata de un varón de 73 años que presentó edemas y celulitis distal en el miembro inferior izquierdo (MII). Antecedentes: obesidad mórbida, hipertensión arterial, dislipemia, diabetes mellitus tipo 2 y enfermedad renal crónica. Se le colocaron prótesis totales de cadera derecha e izquierda (1998-1999); prótesis de rodilla izquierda (2014) por gonartrosis con varo, compartimental media y femorotibial. Tuvo celulitis no complicada en MII hace 2 años. No constaban antecedentes de manipulación oral. Los hallazgos del eco doppler venoso fueron: edema del tejido celular subcutáneo en el MII, con derrame articular en el compartimento anterior de la rodilla. Se diagnosticó posible infección de prótesis total y celulitis de rodilla izquierda; se realizó extracción del espaciador de cemento con extracción del componente tibial y femoral. Se quitó el polietileno de patela y se extrajo la faceta externa fragmentada. Se colocó la prótesis de rodilla cementada, semiconstreñida, platillos fijos, SAMO trecking; no se prostetizó la patela. No presentaba signos clínicos ni datos de laboratorio compatibles con sepsis o bacteriemia. No existían signos clínicos o radiológicos compatibles con osteomielitis. Mediante artrocentesis evacuadora se obtuvieron 100cc de líquido seropurulento. Se remitió líquido sinovial inoculado en botellas de hemocultivo al laboratorio de microbiología. Se inició antibioterapia con vancomicina y rifampicina intravenosas. A las 30h de incubación en Bactec 9240 (BD) se identificó Sm, directamente de botella aerobia, mediante espectrometría de masas (MALDI-TOF®, Bruker). En la tinción de Gram (fig. 1A), se observaron bacilos Gram variables pleomórficos. El aspecto de las colonias se representa en la figura 1B. La identificación fenotípica directa de botella (panel WalkAway®, Beckman) a las 48h siguientes, era compatible con la identificación de MALDI-TOF®. La sensibilidad antibiótica se realizó, además de microdilución (panel WalkAway®), mediante gradiente de concentración (E-test®, Bio-Merieux), siguiendo las directrices de EUCAST versión 6.0 2016-01-01. El microorganismo era sensible a penicilina, cefotaxima, clindamicina y vancomicina. Concentración mínima inhibitoria (CMI), levofloxacino≤1, linezolid≤1 y daptomicina≤0,5.
A los 12 días de ingreso se procedió a la intervención quirúrgica, remitiéndose nuevamente líquido sinovial y volviéndose a identificar, Sm.
El paciente presentó una evolución favorable con una mejoría clínica evidente en comparación a su situación prequirúrgica, por lo que tras 18 días de ingreso fue dado de alta con tratamiento antibiótico ambulatorio (levofloxacino 500mg/12h vía oral/42 días).
El Sm es un estreptococo pleomórfico (bacilar en medio ácido y cocáceo en un medio neutro o alcalino). Descrito por Clarke en 1924 (caries dental), posteriormente se observó su capacidad para producir endocarditis. El grupo de Sm comprende especies aisladas en humanos (mutans, sobrinus, criceti, ratti y downei) y otras aisladas en animales. La especie mutans es productora de caries y la transmisión madre-hijo probablemente sea a través de secreciones orales, siendo la especie que con mayor frecuencia se asocia a bacteriemia. Puede ser confundido con otros estreptococos y enterococos. Su aislamiento e identificación puede resultar difícil, así lo corroboraron Emmerson y Eykyn, así como Schelenz y Cois, reportando casos de endocarditis en los que el agente había sido identificado erróneamente como difteroide1–3. Muestra resistencia a la fagocitosis por los leucocitos polimorfonucleares4 y podría participar en la patogénesis de la ateroesclerosis5. Existen múltiples publicaciones asociando Sm con la producción de biofilm en la placa dental y en materiales utilizados en odontología6, pero son escasos o inexistentes los estudios de adherencia de Sm a materiales utilizados en prótesis o tejidos osteoarticulares. Se ha sugerido que la pared bacteriana podría contribuir a la inducción de la artritis en modelos animales7. La proteína bacteriana I/II (pathogen-associated molecular pattern [PAMP]) podría contribuir a la evolución desfavorable en osteoartritis8. Se ha descrito que los serotipos no C pueden sufrir una translocación extra-oral9. Se ha asociado con afecciones como enfermedad Behçet, síndrome de Sjögren y artritis reumatoide4,8.
Son escasas las infecciones articulares comunicadas. Antes de disponer de técnicas de identificación molecular (secuenciación) y proteinómicas (MALDI-TOF®), la identificación podía constituir un desafío diagnóstico debido a la capacidad de Sm de presentarse como «bacilo grampositivo» a la tinción de Gram y poder ser confundido con otros microorganismos