Las infecciones en pacientes con vasculitis sistémica representan una de las principales causas de mortalidad. Son factores de riesgo conocidos la edad, el compromiso orgánico asociado, el uso de corticoides y de inmunosupresores, asi como el requerimiento de diálisis, entre otros.
ObjetivoDeterminar la prevalencia de infección grave y factores asociados en pacientes diagnosticados de vasculitis asociada a ANCA poliarteritis nudosa (PAN).
MétodosEstudio retrospectivo realizado en un único centro de reumatología entre los años 2000 y 2018. Se incluyó a pacientes con granulomatosis con poliangitis, granulomatosis eosinofílica con poliangitis, poliangitis microscópica y PAN. Se registraron episodios infecciosos graves que requirieron hospitalización o tratamiento antibiótico/antiviral prolongado, infección recurrente por virus del herpes zóster o infecciones oportunistas.
ResultadosSe incluyó a 105pacientes, la mediana del tiempo de seguimiento fue de 18 meses; el 58,7% eran mujeres, con una mediana de edad de 52 años; el 41,9% presentaban poliangitis microscópica, el 16,2% granulomatosis eosinofílica con poliangitis, el 40% granulomatosis con poliangitis y el 1,9% PAN. Los compromisos constitucional, pulmonar, renal y otorrinolaringológico fueron los más frecuentes.
La prevalencia de infecciónfue del 34,2% con una mediana de 3 meses desde el diagnóstico de vasculitis. Las infecciones de vías respiratorias bajas (42,8%), la sepsis (31,4%) y el tracto urinario (14,3%) fueron los sitios de infección más comunes. Predominó la etiología bacteriana (67,7%). La mortalidad en el primer episodio fue del 14,3%. Se encontraban en fase de inducción de tratamiento el 72,2%. Las infecciones se asociaron significativamente con edad >65 años (p=0,030), compromiso pulmonar (p=0,016), renal (p=0,001), BVAS3>15 y mortalidad (p=0,0002).
ConclusionesLa prevalencia de infecciones graves fue del 34,2%. Las infecciones pulmonares, septicemia y las urinarias fueron las más frecuentes y se asociaron a compromiso renal y pulmonar, así como a mortalidad, especialmente en pacientes de edad avanzada.
Infections in patients with systemic vasculitis represent one of the main causes of mortality. Corticosteroid use, immunosuppressive therapy, age, associated organic involvement and dialysis dependence are risk factors of infection.
ObjectivesTo determine the prevalence of severe infection and associated factors in patients diagnosed with ANCA-associated vasculitis and polyarteritis nodosa (PAN).
MethodsRetrospective study was conduced in a single rheumatology center (2000-2018). We included patients diagnosed with ANCA-associated vasculitis (granulomatosis with polyangiitis, eosinophilic granulomatosis with polyangiitis and microscopic polyangiitis and PAN. Serious infectious events requiring hospitalization or prolonged antibiotic/antiviral treatment, recurrent infection of herpes zoster virus or opportunistic infections were evaluated. Sites of infection, isolated microorganisms and mortality related were analyzed.
ResultsA total of 105 patients were analyzed, follow-up time median 18 months, 58.7% were women and median age was 52 years. Types of vasculitis: 41.9% microscopic polyangiitis, 16.2% eosinophilic granulomatosis with polyangiitis, 40% granulomatosis with polyangiitis, 1.9% PAN. Constitutional, pulmonary, renal and otorhinolaryngology manifestations were the most frequent.
The prevalence of infectionwas 34,2%, with a median of 3 months from diagnosis of vasculitis to the infectious event. Low respiratory tract (42.8%), sepsis (31.4%), and urinary tract (14.3%) were the most common sites of infections. Bacterial etiology was the most prevalent (67.7%). Mortality at the first event was 14.3% and a 72.2% of patients were in the induction phase of treatment.
Infectious events were significantly associated with age> 65 years (P=0.030), presence of lung (P=0.016) and renal involvement (P=0.001), BVASv3> 15 and mortality (P=0.0002).
ConclusionsThe prevalence of infection was 34.2%. Lower airway infections, septicemia and urinary tract infections were the most prevalent. Infections were associated with renal and pulmonary involvement, age older than 65 years and score BVAS>15. Severe infections were associated with mortality, especially in elderly patients.
Las vasculitis necrosantes sistémicas comprenden un grupo heterogéneo de entidades caracterizadas por inflamación de los vasos sanguíneos con grados variables de compromiso orgánico. A su vez, presentan una morbimortalidad cercana al 90% a los 2 años del diagnóstico si los pacientes no reciben tratamiento adecuado1.
Se caracterizan por alta morbilidad y carga social, por lo que es importante su diagnóstico temprano y el tratamiento oportuno.
Las vasculitis de pequeño vaso asociadas a ANCA comparten determinadas características clínicas, anatomopatológicas y de laboratorio que permiten su agrupación pole incluyen: la granulomatosis con poliangitis (GPA), la poliangitis microscópica (PAM) y la granulomatosis eosinofílica con poliangitis (EGPA).
Por otra parte, la panarteritis nudosa (PAN) es una vasculitis necrosante con manifestaciones sistémicas como consecuencia del compromiso de arterias musculares de pequeño y mediano calibre2,3.
La introducción de corticoesteroides y la terapia inmunosupresora en las últimas 4décadas ha modificado la mortalidad, transformando estas entidades en enfermedades crónicas con morbimortalidad a largo plazo1,4. Estas terapias, habitualmente utilizadas, están dirigidas a múltiples blancos del sistema inmune, incluyendo linfocitos T y B. En cuanto al riesgo de infección en las vasculitis, parece relacionado con la adquisición de defectos inmunes por la enfermedad subyacente y con la utilización de terapias inmunosupresoras como la ciclofosfamida, azatioprina, metotrexato, micofenolato de mofetilo y agentes biológicos, como rituximab, entre otras5-7.
La mayoría de las muertes en vasculitis asociadas a ANCA ocurren en los 3primeros meses de tratamiento, cuando los corticosteroides se utilizan en dosis altas y la actividad de la enfermedad es mayor6.
Datos de 4 estudios clínicos aleatorizados y controlados que incluyeron 524 pacientes, reportaron que la causa infecciosa contribuía en un 50% a la mortalidad durante el primer año de seguimiento, comparado con el 14% como consecuencia de la vasculitis por sí mismas. Las complicaciones infecciosas más frecuentemente reportadas fueron las infecciones respiratorias y la septicemia5-7. Asimismo, se han identificado factores de riesgo predictores de infección tales como la utilización de corticoides, la intensidad de la terapia inmunosupresora, la edad, la presencia de linfopenia, de hipogammaglobulinemia, el compromiso orgánico asociado y la dependencia de diálisis en vasculitis asociadas a ANCA6-14. Sin ambargo, la mayoría de estos trabajos han sido realizados en cohortes de pacientes de centros europeos o estadounidenses, y se desconoce su prevalencia en nuestro país, aunque se ha descrito la mayor gravedad de las vasculitis en pacientes hispanos15. Por otra parte, la infección en pacientes con vasculitis constituye una de las primeras causas de muerte dentro del primer año de diagnóstico.
Objetivos- a)
Determinar la prevalencia de infección en pacientes con diagnóstico de: GPA, EPGA, PAM y PAN, las características clínicas y de laboratorio relacionadas y los factores de riesgo predictores de infección en pacientes asistidos en el Hospital Interzonal de Agudos General San Martín de La Plata.
- b)
Evaluar la mortalidad asociada a infecciones graves comparada con aquellos pacientes que no las presentaron.
El diseño del estudio fue analítico, observacional, retrospectivo, sin intervención, de casos y controles. Se recolectaron datos de las historias clínicas de pacientes con diagnóstico de vasculitis de pequeño vaso asociadas a ANCA (GPA, EPGA, PAM) y PAN que reunían criterios de clasificación ACR 1990 o según la nomenclatura de la Conferencia de Consenso de Chapel Hill de 2012, asistidos entre los años 2000 y 2018.
Se excluyó a pacientes con diagnóstico de vasculitis secundarias, vasculitis de grandes vasos, Kawasaki, vasculitis de vaso variable, vasculitis limitada a un órgano y vasculitis de pequeño vaso por inmunocomplejos.
Se registró la siguiente información sobre los datos demográficos: género, edad al diagnóstico de la vasculitis, edad al momento de la infección, tipo de vasculitis, tiempo de evolución de la enfermedad hasta el episodio infeccioso.
Manifestaciones clínicas atribuidas a la enfermedad de baseEl compromiso orgánico fue definido por la presencia de las manifestaciones clínicas incluidas en los ítems: cutáneo, otorrinolaringológico, pulmonar, cardiovascular, renal, neurológico, síntomas constitucionales sistémicos, ocular y gastrointestinal de la escala modificada de actividad Birmingham Vasculitis Activity Score (BVAS v3).
La enfermedad renal terminal se definió por el requerimiento de diálisis o trasplante renal.
- -
La actividad de la enfermedad fue evaluada por el BVAS v3.
- -
En el laboratorio: se registraron datos de hemograma, presencia de leucocitopenia (<4.000 /mm3), linfopenia (<1.000 /mm3), creatinina sérica (mg/dL), filtrado glomerular (mL/min), proteinuria en orina de 24 h (g/24 h), albúmina sérica (g/dL), hipogammaglobulinemia (g/L) y reactantes de fase aguda ERS (mm/h) y PCR (mg/dL).
Inmunológico: se detectaron los anticuerpos ANCA C o P por inmunofluorescencia indirecta o según especificidad antigénica (ANCA-PR3, ANCA-MPO) por técnica de enzimoinmunoanálisis (ELISA). En los pacientes registrados desde el año 2000 hasta el 2010, la técnica utilizada para cribado o detección de los pacientes con sospecha de vasculitis asociada a ANCA fue la inmunofluorescencia indirecta, a partir del año 2010 se complementó con las determinaciones por técnica de ELISA para determinación de ANCA y a partir de las recomendaciones de consenso para las prubas de ANCA 2017 se utilizan las técnicas de ELISA como método de cribado primario.
Tratamiento recibido al momento del episodio infeccioso- 1.
Dosis de corticosteroides previas al inicio del episodio infeccioso: se consideraron dosis bajas de prednisona o equivalente ≤ 7,5mg/día, dosis medias entre 7,5 y 30mg/día y dosis altas ≥30mg/día16.
- 2.
Fármacos inmunosupresores utilizados en el último mes, tiempo transcurrido entre el inicio de la inmunosupresión y el primer episodio infeccioso, discriminando si el paciente se encontraba en periodo de inducción o mantenimiento de su vasculitis.
Se consideró infección grave a aquella que requirió hospitalización o tratamiento antibiótico/ antiviral intravenoso o prolongado, recurrencias de virus de herpes zóster o infecciones oportunistas. Se considero infección oportunista a aquella causada por un microorganismo (bacteria, virus, hongo o protozoo) con baja capacidad de virulencia, pero causante de enfermedad en huésped inmunocomprometido. No se consideraron infecciones leves tales como rinitis, bronquitis o cistitis.
Se registró el foco infeccioso y los microorganismos aislados.
Se analizó la mortalidad relacionada con el episodio infeccioso.
Consideraciones éticasEl estudio fue evaluado y aprobado para su realización por el Comité de Ética y Docencia del Hospital San Martín de La Plata y desarrollado de acuerdo con los estándares éticos locales y según lo establecido en la Declaración de Helsinki de 2013.
Análisis estadísticoSe realizó un análisis descriptivo utilizando, para las variables numéricas continuas, la media y mediana como medidas de tendencia central y como medidas de dispersión la desviación estándar y el intervalo intercuartil, según la distribución de la variable analizada. Para las variables categóricas se utilizaron como medidas de resumen las frecuencias absolutas y relativas. Las comparaciones de medias entre grupos se realizaron mediante la prueba de Mann-Whitney y las proporciones de variables categóricas se compararon con el test de χ2. Se construyó un modelo de regresión logística para ajustar la influencia para el desarrollo de infección de las potenciales variables predictoras, como edad, marcadores de enfermedad renal y de afectación de otros órganos. Se retuvieron en el modelo aquellas variables predictoras que tuvieran significación estadística según la prueba de Wald (valor de p<0,05) o modificara el coeficiente β de la variable indicadora de infección grave en más de 20% (indicando confusión).
Se estudió la asociación entre infección y mortalidad mediante la prueba de χ2 y se ajustó por edad mayor a 65 años mediante regresión logística.
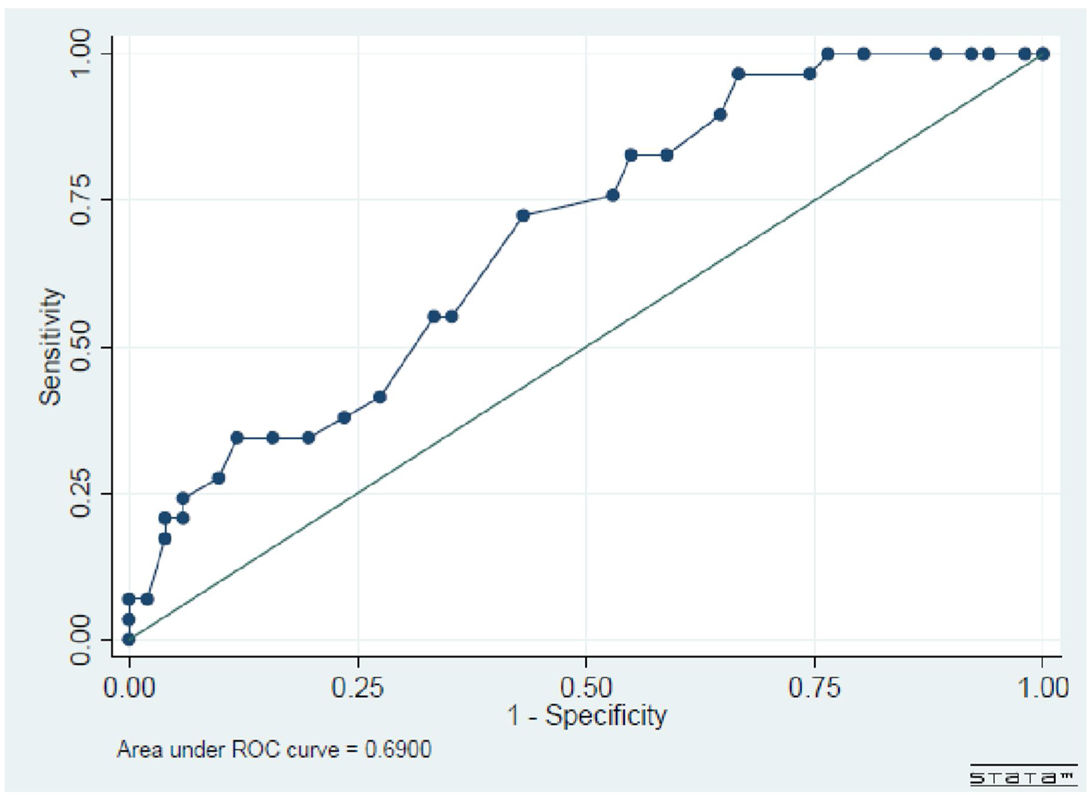
Se construyó una curva ROC con el fin de buscar un punto de corte de BVAS que se asociara con una mayor frecuencia de infecciones.
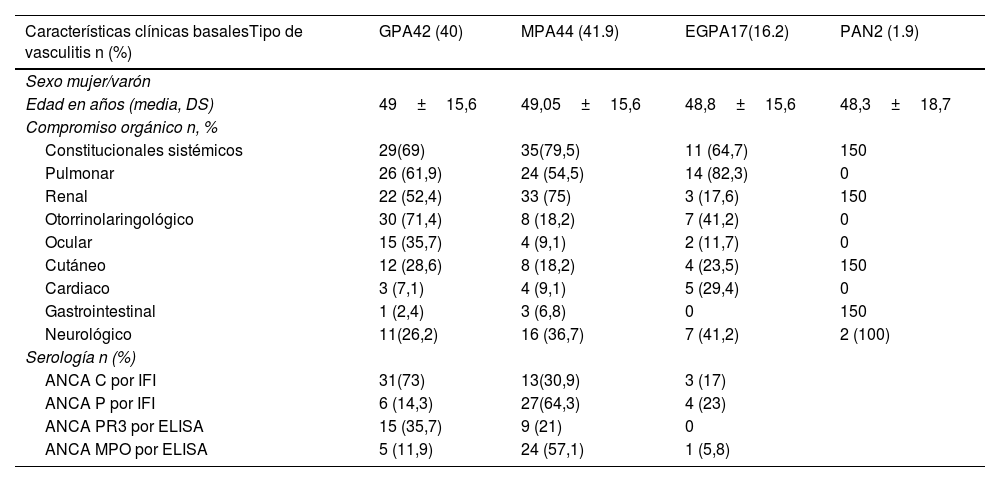
ResultadosSe incluyeron un total de 105 pacientes, de los cuales el 58,7% fue de sexo femenino. La mediana de edad al diagnóstico fue de 52 años (RIC 40-61). La mediana del tiempo de seguimiento en meses fue de 18 (RIC 6-39). Se registraron: PAM (41,9%; 44), GPA (40%; 42), EGPA (16,2%; 17) y PAN no asociada a HBV (1,9%; 2). El compromiso sistémico ocurrió en el 73,8% de los casos, predominando el compromiso pulmonar (63,1%), renal (58,4%) y otorrinolaringológico (43,7%). En la tabla 1 se describen las características clínicas, inmunológicas y la frecuencia de compromiso clínico asociado según el tipo de vasculitis.
Características clínicas y compromiso orgánico asociado
| Características clínicas basalesTipo de vasculitis n (%) | GPA42 (40) | MPA44 (41.9) | EGPA17(16.2) | PAN2 (1.9) |
|---|---|---|---|---|
| Sexo mujer/varón | ||||
| Edad en años (media, DS) | 49±15,6 | 49,05±15,6 | 48,8±15,6 | 48,3±18,7 |
| Compromiso orgánico n, % | ||||
| Constitucionales sistémicos | 29(69) | 35(79,5) | 11 (64,7) | 150 |
| Pulmonar | 26 (61,9) | 24 (54,5) | 14 (82,3) | 0 |
| Renal | 22 (52,4) | 33 (75) | 3 (17,6) | 150 |
| Otorrinolaringológico | 30 (71,4) | 8 (18,2) | 7 (41,2) | 0 |
| Ocular | 15 (35,7) | 4 (9,1) | 2 (11,7) | 0 |
| Cutáneo | 12 (28,6) | 8 (18,2) | 4 (23,5) | 150 |
| Cardiaco | 3 (7,1) | 4 (9,1) | 5 (29,4) | 0 |
| Gastrointestinal | 1 (2,4) | 3 (6,8) | 0 | 150 |
| Neurológico | 11(26,2) | 16 (36,7) | 7 (41,2) | 2 (100) |
| Serología n (%) | ||||
| ANCA C por IFI | 31(73) | 13(30,9) | 3 (17) | |
| ANCA P por IFI | 6 (14,3) | 27(64,3) | 4 (23) | |
| ANCA PR3 por ELISA | 15 (35,7) | 9 (21) | 0 | |
| ANCA MPO por ELISA | 5 (11,9) | 24 (57,1) | 1 (5,8) | |
Todos los pacientes incluidos recibieron tratamiento: una fase de inducción de 6 meses con ciclofosfamida o rituximab en caso de enfermedad grave y una fase de mantenimiento de al menos 24 meses con azatioprina, metotrexato o micofenolato de mofetilo. Se realizó, además del tratamiento antes mencionado de inducción, plasmaferésis en caso de glomerulonefritis rápidamente evolutiva o hemorragia alveolar grave, según las recomendaciones EULAR 2016 para el manejo de las vasculitis ANCA17.
Durante el tratamiento de inducción todos recibieron corticosteroides orales en dosis 1mg/kg al día sin superar los 60mg al día o en pulsos intravenosos en caso de enfermedad grave (500-1.000mg al día durante 3 días).
El tratamiento de la PAN se basó en la presencia o ausencia de factores pronóstico de mortalidad según la Five Factors Score (FFS).
Se registraron 46 episodios infecciosos en 36/105 pacientes. El tiempo de seguimiento al momento de la complicación infecciosa fue de una mediana 18 meses (RIC 6-39). La prevalencia de infección fue del 34,3% al primer episodio, con una mediana de 3 meses (RIC 1-15 m) de tiempo desde el diagnóstico de vasculitis hasta el primer episodio infeccioso. Los focos más frecuentes fueron las infecciones respiratorias bajas (42.8%), sepsis sin foco (31,4%) e infecciones del tracto urinario (14,3%). El 27,7% de estos pacientes presentó un segundo episodio infeccioso, con las vías respiratorias bajas como el sitio más frecuente (60%). Dos pacientes presentaron un tercer episodio (infección de partes blandas, shock séptico). La etiología bacteriana fue la más prevalente (67,6%). Los microorganismos frecuentemente aislados fueon Klebsiella pneumoniae y Acinetobacter spp. en el 21,4%, respectivamente, y el cultivo polimicrobiano en 14,3%. En la tabla 2 se describen los sitios de infección y los microorganismos aislados.
Focos de infección y aislamiento bacteriológico
| Foco de infección | Vías respiratorias bajas 42,8%(n=15) |
| Primer episodio (n=36) | Acinetobacter spp., n=3 |
| Klebsiella pneumoniae n=1 | |
| Pseudomonas aeruginosa n=2 | |
| S. coagulasa negativo n=1 | |
| Polimicrobiano n=2 | |
| Sin aislamiento microbiológico n=6 | |
| Sepsis sin foco 31,4% (n=14) | |
| S. aureus n=3 | |
| S. epidermidis n=1 | |
| Klebsiella spp. n=3 | |
| Candida spp. n=2 | |
| Bulrkholderia cepacia+Enterococcus spp. n=1 | |
| Acinetobacter spp. n=2 | |
| Sin aislamiento n=2 | |
| Tracto urinario 14,3% (n=4) | |
| Enterococcus spp. n=1 | |
| Escherichia coli n=1 | |
| Klebsiella spp. n=1 | |
| Morganella morganii n=1 | |
| Piel y partes blandas 8,5% (n=3) | |
| Herpes zóster diseminado n=3 | |
| Gastrointestinal 1,5% (n=1) | |
| Sin aislamiento | |
| Osteoarticular 1,5% (n=1) | |
| Klebsiella spp. n=1 | |
| Foco de infección | Vías respiratorias bajas 60%(n=6) |
| Segundo episodio (n=10) | E. coli n=1 |
| Aspergillus spp. n=1 | |
| Scedosporium apiospermum n=1 | |
| Polimicrobiana=2 | |
| Klebsiella spp.=1 | |
| Piel y partes blandas 10% (n=1) | |
| Herpes zóster diseminado n=1 | |
| Sepsis sin foco 20% (n=2) | |
| Klebsiella spp.+Acinetobacter spp. n=1 | |
| Acinetobacter n=1 | |
| Osteoarticular (10%) n=1 | |
| S. aureus resistente a meticilina |
No se encontró en esta cohorte infección por Mycobacterium tuberculosis; 60/105 (57,2%) pacientes tenían prueba de Mantoux previa a la inmunosupresión y en 4 (7%) de ellos la prueba fue positiva (>5mm), por lo que se inició tratamiento para infección tuberculosa latente.
El 72,2% (n = 26) de los pacientes que presentaron complicación infecciosa se encontraba en fase de inducción del tratamiento.
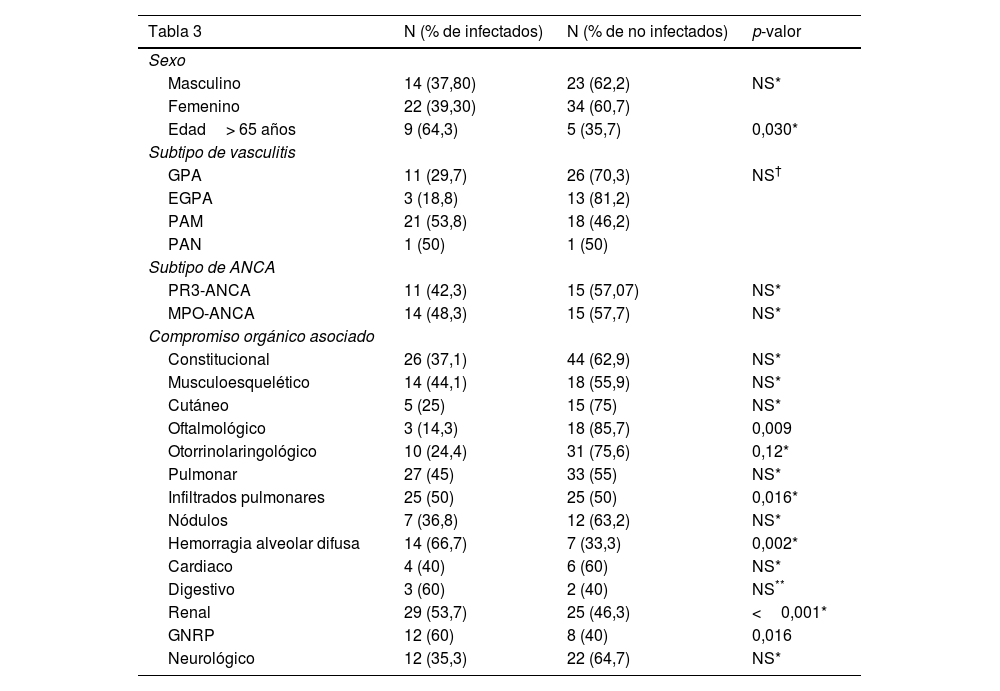
Los inmunosupresores utilizados en los meses previos al episodio infeccioso fueron: 52,7% (n:19) ciclofosfamida; 11,1% (n=4) azatioprina; 8,3% (n=3) metotrexato; 2,2% (n=2) rituximab; 2,7% (n=1) micofenolato de mofetilo y 19,4% (n=7) ninguno. Recibían dosis altas de esteroides el 45,7% de los pacientes, dosis medias el 8,6% y dosis bajas el 28,6%. Entre los factores asociados a infección se identificaron en pacientes con episodios infecciosos la presencia de: leucocitopenia (22%), linfopenia (41,9%), hipoalbuminemia (26,9%), insuficiencia renal (58%) y la dependencia de hemodiálisis (36,3%). En el análisis bivariado (tabla 3), encontramos que los episodios infecciosos se asociaron de manera significativa a la edad mayor a 65 años (p=0,030), a la presencia de compromiso pulmonar con infiltrados pulmonares (p=0,016), hemorragia alveolar (p=0,002), presencia de compromiso renal (<0,001), a la presencia de GNRP (p=0,016) y a puntuación de actividad evaluadas por BVAS más altos, mediana: 20 RIC 17-27 (p=0,005). Se calculó como punto de corte de BVAS extrapolado por cálculo de área bajo la curva (ROC): el puntaje> 15 (sensibilidad de 82,76% y especificidad 41,2%; p=0,069). En el análisis por la prueba de χ2, el valor de BVAS>15 se asoció significativamente a mayor frecuencia de infección grave (p-valor = 0,028; OR: 3,4; IC95%: 1,1-10,2) comparado con aquellos pacientes con BVAS 3 <15.
Análisis bivariado
| Tabla 3 | N (% de infectados) | N (% de no infectados) | p-valor |
|---|---|---|---|
| Sexo | |||
| Masculino | 14 (37,80) | 23 (62,2) | NS* |
| Femenino | 22 (39,30) | 34 (60,7) | |
| Edad> 65 años | 9 (64,3) | 5 (35,7) | 0,030* |
| Subtipo de vasculitis | |||
| GPA | 11 (29,7) | 26 (70,3) | NS† |
| EGPA | 3 (18,8) | 13 (81,2) | |
| PAM | 21 (53,8) | 18 (46,2) | |
| PAN | 1 (50) | 1 (50) | |
| Subtipo de ANCA | |||
| PR3-ANCA | 11 (42,3) | 15 (57,07) | NS* |
| MPO-ANCA | 14 (48,3) | 15 (57,7) | NS* |
| Compromiso orgánico asociado | |||
| Constitucional | 26 (37,1) | 44 (62,9) | NS* |
| Musculoesquelético | 14 (44,1) | 18 (55,9) | NS* |
| Cutáneo | 5 (25) | 15 (75) | NS* |
| Oftalmológico | 3 (14,3) | 18 (85,7) | 0,009 |
| Otorrinolaringológico | 10 (24,4) | 31 (75,6) | 0,12* |
| Pulmonar | 27 (45) | 33 (55) | NS* |
| Infiltrados pulmonares | 25 (50) | 25 (50) | 0,016* |
| Nódulos | 7 (36,8) | 12 (63,2) | NS* |
| Hemorragia alveolar difusa | 14 (66,7) | 7 (33,3) | 0,002* |
| Cardiaco | 4 (40) | 6 (60) | NS* |
| Digestivo | 3 (60) | 2 (40) | NS** |
| Renal | 29 (53,7) | 25 (46,3) | <0,001* |
| GNRP | 12 (60) | 8 (40) | 0,016 |
| Neurológico | 12 (35,3) | 22 (64,7) | NS* |
Respecto del uso de corticoides, todos los pacientes en quienes se utilizaron dosis>30mg al día presentaron infecciones, comparado con un 33% de los que no tenían esteroides (p<0,001).
La mortalidad general en 82/105 pacientes ocurrió en 16 pacientes (19,5%) durante el tiempo de seguimiento y fue asociada a episodio infeccioso en 13 casos. En 24 pacientes no se encontraron datos con relación a mortalidad debido a pérdida de seguimiento.
La mortalidad relacionada con el primer episodio infeccioso fue del 14,3% (n=4); el shock séptico fue la causa en 3 pacientes. Otra paciente que se encontraba en tratamiento con voriconazol por aislamiento de Scedosporium apiospermun en las vías respiratorias presentó una hemorragia pulmonar asociada a su enfermedad de base.
Murieron 13/36 infectados (37%) y 3/47 no infectados (6%). Según la prueba de χ2 (p valor: 0,001) (OR: 8,67; IC 95%: 2,03-50,89).
También hubo una asociación lógica entre edad>65 y mortalidad, murieron 8/12 mayores de 65 (67%) y 9/74 menores de 65 (12%), prueba de χ2 (p valor: 0,001) (OR: 14,44; IC 95%: 2,99-76,02).
El OR de la asociación mortalidad e infección ajustado por edad fue: 6,26 (1,49-26,39).
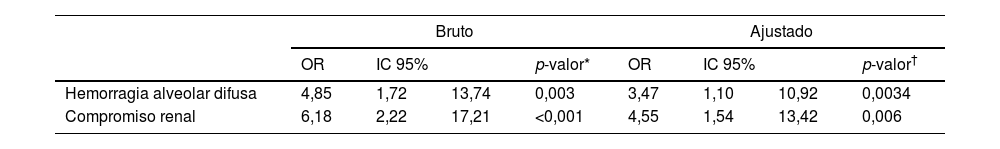
En el análisis multivariado de variables significativas ajustado por edad> 65 años, persistió la asociación positiva entre infecciones y la presencia de hemorragia alveolar difusa, como una de las manifestaciones del compromiso pulmonar ajustado por regresión logística (OR: 3,47; IC 95%: 1,10-10,92; p=0,0034) y la presencia de compromiso renal (OR: 4,55; IC 95%: 1,54-13,42; p=0,006) se asociaron significativamente a la presencia de infección en esta cohorte de pacientes (tabla 4).
DiscusiónEn nuestra cohorte de pacientes con vasculitis necrosantes sistémicas encontramos una prevalencia de infección del 34,2%. Este dato es comparable con reportes de estudios previos. En la publicación de Charlier et al. encontraron 53 episodios infecciosos mayores en 35/113 pacientes con diagnóstico de GPA (31%), en tanto que Fauchais et al. reportaron 14 infecciones graves en 35 GPA (40%)7.
La mayoría de las infecciones ocurrió dentro de los 3 meses de diagnóstico de la vasculitis, durante el periodo de tratamiento de inducción, con mayor exposición a dosis altas de glucocorticoides e inmunosupresores. Las infecciones fueron principalmente de etiología bacteriana (67,6%), de las que los focos infecciosos más frecuentes fueron el respiratorio, la septicemia y el urinario. Debouverie et al., en una cohorte de 82 pacientes, reportaron la etiología bacteriana en un 60% de los episodios infecciosos, con las infecciones respiratorias (bronconeumonía) como las más frecuentes5. García-Vives et al., en una cohorte de 132 pacientes, con una media de seguimiento de 140 meses (96-228) encontraron un total de 300 infecciones graves, principalmente bacterianas (87%), que ocurrieron en el 60% de los pacientes durante el seguimiento18.
En nuestro estudio no encontramos diferencias en la frecuencia de infecciones graves entre aquellos pacientes con VAA-PR 3 positivo vs. VAA-MPO positivo. Caballero-Islas et al. describieron en una cohorte de 108 pacientes con VAA las características y resultados de aquellos con infecciones graves de acuerdo con el fenotipo clínico (VAA no grave, VAA grave-MPO, VAA grave PR3), encontrando mayor frecuencia de infecciones graves en aquellos con compromiso pulmonar por vasculitis y fenotipo VAA grave-PR3 que recibieron bolos de metilprednisolona. Por otro lado, aquellos con VAA grave MPO e infecciones graves tuvieron mayor edad y requrieron internación en unidades de cuidados intensivos19.
Destacamos los resultados del análisis univariado en que la edad>65 años al diagnóstico se asoció significativamente a altos índices de infección, lo que puede explicarse por la inmunosenescencia del sistema inmune y la mayor prevalencia de comorbilidades en este grupo etario.
También fue significativa la asociación entre insuficiencia renal y la presencia de infección, en la que el compromiso renal es por sí mismo un factor de riesgo conocido de infección por empeoramiento en la respuesta inmune y porque su presencia se asocia a enfermedad más grave, con requerimiento de altas dosis de glucocorticoides e inmunosupresores20.
Por otro lado, la presencia de hemorragia alveolar como manifestación de inicio se correlacionó significativamente con infección, posiblemente con relación al requerimiento de terapia de inicio con altas dosis de corticoides e inmunosupresores por la gravedad de dicha manifestación. Juyoungyoo et al. demostraron en una cohorte retrospectiva de 154 pacientes que la manifestación pulmonar al inicio puede ser predictor de hospitalización por infección, tanto por aumento en el índice de infecciones del tracto respiratorio debido a infecciones bacterianas como a gérmenes oportunistas21.
Destacamos que no hubo casos de tuberculosis a pesar de ser una infección endémica de nuestro país y asociada con frecuencia a pacientes inmunocomprometidos. Esto lo consideramos resultado de las conductas preventivas implementadas en nuestro centro en conjunto con el Servicio de Infectología. De hecho, se detectaron casos de tuberculisis latente que fueron tratados adecuadamente.
En nuestro estudio, un BVAS> 15 se asoció a mayor frecuencia de infecciones graves, a diferencia de los resultados publicados por Juyoungyoo et al., quienes encuentran que un BVAS>20,5 fue predictor de hospitalización por infecciones graves21.
Con relación a la mortalidad, observamos una asociación significativa, en la que los episodios infecciosos son la causa de muerte en más de la mitad de los casos. En el estudio de García Vives et al., la muerte debida a infección fue del 50%, directamente relacionada con infección en el 34% de los casos o asociada a enfermedad activa en el 16%. Los pacientes con infecciones graves experimentaron un incremento de la mortalidad por cualquier causa18.
Este estudio presenta varias limitaciones con relación a su naturaleza retrospectiva, que conduce a la inherente pérdida de datos para su análisis y al bajo número de pacientes. No hemos analizado la relación de infecciones con dosis acumulativas de esteroides ni con la vía de administración.
Resaltamos la necesidad de implementar una conducta preventiva activa, así como identificar y tratar de manera oportuna las infecciones en pacientes con vasculitis necrosante, sobre todo en los 3primeros meses del diagnóstico, debido a que contribuye a ser una de las principales causas actuales de mortalidad, más que la actividad de la vasculitis en sí misma. Por otra parte, es indispensable seguir trabajando en forma global para lograr la utilización de dosis menores de corticosteroides y extremar la protección en pacientes mayores así como en aquellos con fallo renal o compromiso pulmonar.
Conflicto de interesesNo se declaran conflictos de interés.
Al Dr. Enrique Martins, del Laaboratorio del Hospital de Alta Complejidad en Red Hospital el Cruce, por su contribución desinteresada con el análisis estadístico.