La eficacia terapéutica de los anticuerpos monoclonales en enfermedades inflamatorias y autoinmunes sistémicas es indiscutible, pero con frecuencia su contribución al tratamiento se ve comprometida con la aparición de eventos adversos y ausencia o pérdida de eficacia. Además, puede haber una inadecuada adherencia del paciente, por su vía de administración parenteral. Por estos motivos es importante disponer de opciones terapéuticas eficaces y seguras que amplíen el arsenal terapéutico disponible y faciliten la adherencia del paciente1,2. El diseño y la aplicación terapéutica de moléculas dirigidas contra enzimas fosfodiesterasas (phosphodiesterase [PDE]) para enfermedades inflamatorias y autoinmunes es muy prometedor. Este editorial resume el origen y el mecanismo de acción de los inhibidores de PDE de tipo 4 (PDE4), especialmente del apremilast, con motivo de su reciente comercialización en España.
El potencial antiinflamatorio de los inhibidores de las enzimas PDE se conoce desde principios de los años setenta del siglo pasado, y el uso de moléculas selectivas dirigidas contra la PDE4 para el tratamiento de enfermedades inflamatorias y autoinmunes se ha demostrado en los últimos años3,4. Después del fármaco inhibidor no selectivo de PDE4 de primera generación —rolipram—, cuyo desarrollo clínico tuvo que ser interrumpido debido a efectos adversos (principalmente náuseas y vómitos)5, se desarrolló otro inhibidor selectivo de PDE4, el roflumilast (Daxas®, Takeda). Este fármaco fue autorizado en 2011 para el tratamiento de la enfermedad pulmonar obstructiva crónica (EPOC) grave asociada a bronquitis crónica en adultos y se está ensayando en pacientes con asma bronquial grave6,7. Otros inhibidores, como el cilomilast (Ariflo®, GlaxoSmithKline), están siendo evaluados también para el tratamiento de la EPOC8. Fármacos como el CHF6001 (Chiesi Farmaceutici S.p.A.) y el GSK256066 se encuentran en ensayos faseii para el tratamiento del asma bronquial y la rinitis alérgica, respectivamente9,10. Otros ensayos clínicos de faseii están evaluando inhibidores de la PDE4, como el ibudilast (MediciNova) en asma bronquial, esclerosis lateral amiotrófica, esclerosis múltiple, dependencia a las metanfetaminas y migraña crónica11 (www.clinicaltrials.gov). Fármacos como el NCS-613, el ASP3258 y el etazolato han demostrado ser eficaces en modelos animales como antiinflamatorios en procesos pulmonares, y actualmente se estudia su acción antidepresiva12-14.
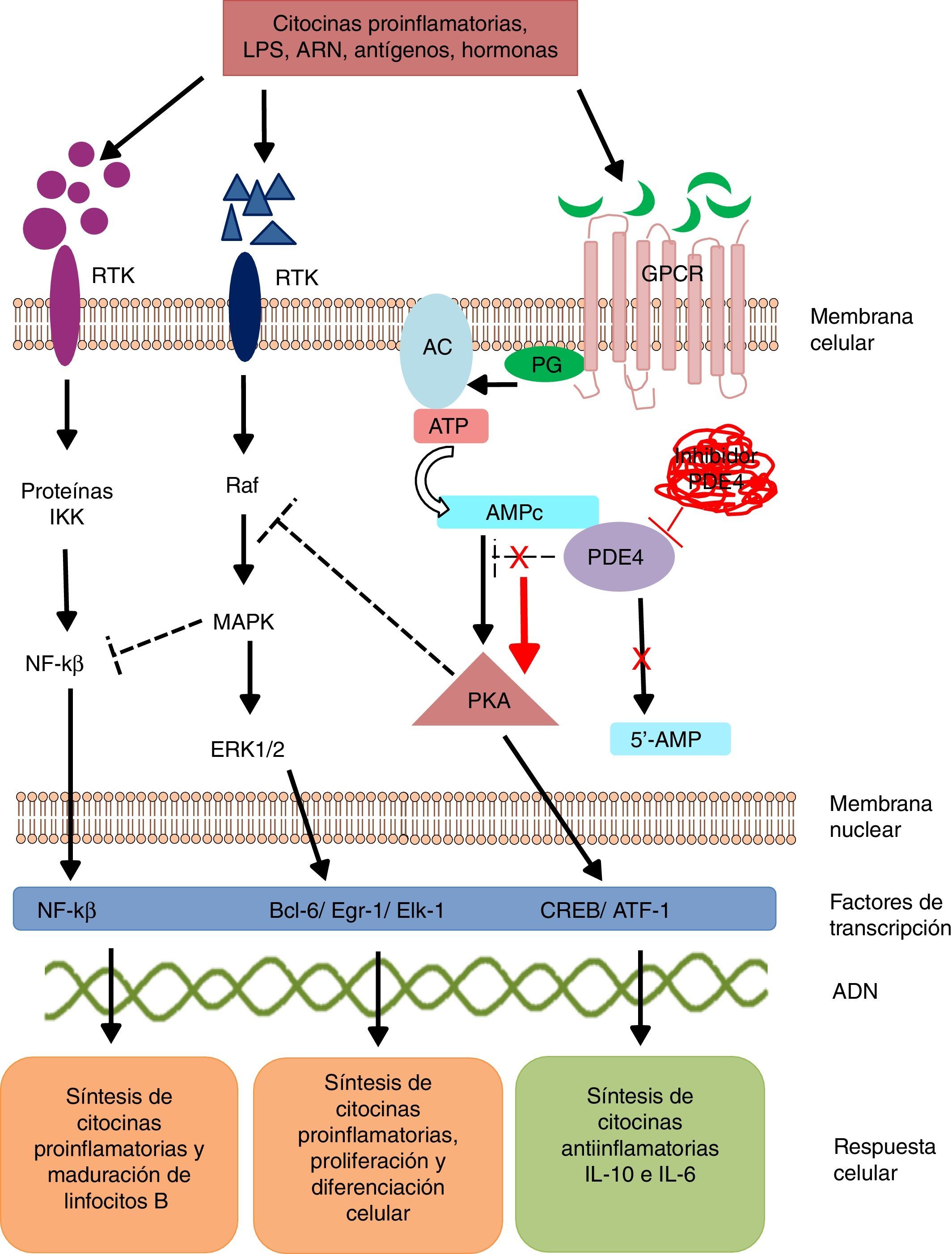
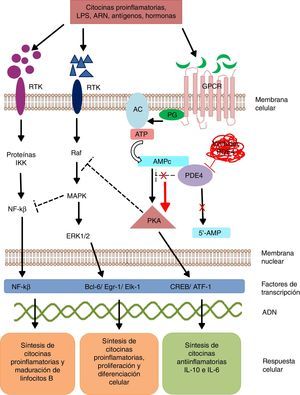
Los mecanismos de señalización intracelular modulan la síntesis y producción de señales y factores pro y antiinflamatorios, los cuales ejercen sus efectos a nivel local y/o sistémico. Estos mecanismos de señalización se desencadenan a partir de la unión de un ligando específico a receptores de la superficie celular. Estos receptores son activados en presencia de estímulos extracelulares como lipopolisacáridos, leucotrienos, ácidos nucleicos, prostaglandinas, neuropéptidos, citocinas y quimiocinas, los cuales desencadenan una respuesta a manera de cascada dentro de la célula15. La activación de receptores transmembrana de 7 dominios (GPCR) o receptores acoplados a proteínasG (PG) inducen un cambio conformacional de su estructura y posterior activación de la PG16. La PG es una enzima heterotrimérica, y en su proceso de activación se escinde y activa enzimas como la adenilato y/o guanilato ciclasa (fig. 1). Estas enzimas a su vez convierten el adenosín trifosfato (ATP) en AMPc. El incremento en la concentración de AMPc favorece la activación de enzimas como la proteína quinasaA (PKA) y quinasaG (PKG)17. Estos mecanismos de señalización son fundamentales para la traducción de estímulos extracelulares en señales de maduración y diferenciación celular y producción de citocinas.
Mecanismo de acción de PDE4 y efecto de su inhibición.
AC: adenilato ciclasa; 5’-AMP: 5’-adenylic acid; ATF: activating transcription factor 1; ATP: adenosín trifosfato; Bcl-6: B-cell lymphoma protein 6; c-AMP: cyclic adenosine monophosphate; CREB: cAMP responsive element; Egr-1: early growth response protein 1; Elk-1: E-26-like protein 1; ERK: extracellular signal-regulated kinase; GPCR: G protein-coupled receptors; IKK: inhibitor of nuclear factor kappa-B kinase subunit beta; MAPK: mitogen-activated protein kinases; NFKB: nuclear factor KB; PDE4: phosphodiesterase type 4; PG: G protein; PKA: protein kinase A; Raf: rapidly accelerated fibrosarcoma protein kinases; RTK: receptor tyrosine kinases.
Las PDE son una familia de enzimas que catalizan la inactivación de los nucleótidos cíclicos adenosín monofosfato (AMPc) y guanosín monofosfato (GMPc) en 5’-AMP y 5’-GMP, respectivamente, por lo cual las PDE controlan la concentración de estos nucleótidos y la actividad que ejercen sobre las cascadas de señalización intracelular18.
La fosforilación de las PDE favorece:
- I.
La transcripción de cAMP response element-binding protein (CREB) y del factor activador-1 (ATF-1), los cuales inducen la síntesis de citocinas antiinflamatorias y regulan la expresión de genes relacionados con el crecimiento y la supervivencia celular19.
- II.
La inhibición indirecta del factor de transcripción nuclear kappa β (NF-kβ) mediante el bloqueo de enzimas tirosín quinasas como las mitogen activated protein kinase (MAPK)20. El NF-kβ es un complejo proteico indispensable en la activación de la inmunidad innata y adquirida, respuesta al estrés celular, inflamación y maduración de linfocitosB21.
La señalización intracelular por medio de la PKA regula procesos de maduración celular y favorece la síntesis de señales antiinflamatorias que inhiben la producción de mediadores inflamatorios. Las bajas concentraciones de AMPc favorecen la inflamación por incremento de IL-8, IL-12, IL-17, IL-22, IL-23, factor de necrosis tumoral alfa, interferón gamma, chemokine C-X-C motif ligand 9 (CXCL9) y CXCL10, y cuando esa concentración aumenta, se induce una respuesta antiinflamatoria de citocinas antiinflamatorias por producción de IL-6 e IL-1022.
En los mamíferos se han descrito 11 familias de PDE (PDE1-11) que codifican hasta 100 isoformas diferentes. Estas enzimas se clasifican de acuerdo a sus propiedades bioquímicas, estructura molecular, respuesta a estímulos específicos y/o afinidad por los nucleótidos cíclicos. Por ejemplo, algunas de estas proteínas, como las PDE5, PDE6 y PDE9, hidrolizan de forma selectiva el GMPc, y otras, como las PDE4, PDE7 y PDE8, el AMPc. Las enzimas PDE1, PDE2, PDE3, PDE10 y PDE11 pueden hidrolizar ambos nucleótidos cíclicos23. Las PDE se localizan en cerebro, bronquios, tracto gastrointestinal, bazo, pulmón, corazón, riñón y testículos, así como en células endoteliales, queratinocitos, membrana sinovial, neuronas, linfocitosT y B, monocitos, eosinófilos, basófilos y neutrófilos24. La PDE4 tiene 4 isoformas (PDE4A, PDE4B, PDE4C y PDE4D), las cuales se expresan en la mayoría de los leucocitos. Las isoformas PDE4A y B tienen un papel relevante en la inflamación debido a que se expresan principalmente en linfocitosT y B, monocitos y neutrófilos25-27. Estas regulan múltiples procesos fisiológicos relacionados con la respuesta inmunológica y la inflamación. La inhibición selectiva de la PDE4 impide la hidrólisis de los nucleótidos cíclicos, favoreciendo el incremento en la concentración de AMPc intracelular y la activación de vías de señalización para la síntesis de CREB y ATF-1.
El apremilast (Otezla®, Celgene Corporation, Summit, Nueva Jersey, EE.UU.), una pequeña molécula sintética de administración oral, es el primer fármaco de esta clase aprobado por la Food and Drug Administration (FDA) estadounidense para el tratamiento de la artritis psoriásica (marzo de 2014) y para la psoriasis cutánea en pacientes adultos (septiembre de 2014). En Europa ha sido aprobado por la European Medicines Agency (EMA) en enero de 2015 y ha sido comercializado en España en febrero de 2016. La dosificación indicada en ficha técnica es de 30mg 2veces al día utilizando un programa inicial de escalada de dosis para reducir los efectos adversos gastrointestinales; ha demostrado ser eficaz y tener un buen perfil de seguridad en pacientes con artritis psoriásica y psoriasis28-30.
Tras la administración de apremilast se alcanza el pico plasmático de concentración entre 2-6h, con una biodisponibilidad del 73%, tiene una vida media de 8,2h y un catabolismo metabólico por múltiples vías, incluyendo la vía del citocromo P450 (CYP); solo el 3% de la dosis se excreta sin cambios en la orina31. La biodisponibilidad se reduce cuando se administra de forma concomitante con inductores potentes de CYP (como por ejemplo rifampicina, fenobarbital, carbamazepina, fenitoína y la hierba de San Juan), pudiendo dar lugar a una respuesta clínica reducida. No se han descrito interacciones farmacocinéticas significativas con inhibidores de CYP, como anticonceptivos orales, ketoconazol o metotrexato32,33.
La enzimas PDE se expresan ampliamente en el sistema nervioso central, haciéndolas particularmente atractivas para el diseño de nuevas dianas para el tratamiento de trastornos psiquiátricos y neurodegenerativos; esto explicaría que náuseas, vómitos y cefalea sean efectos adversos comunes del uso de apremilast. También se ha descrito la posible aparición de dispepsia, diarrea, gastroenteritis, infecciones del tracto respiratorio superior y fatiga3. No se han comunicado infecciones oportunistas, reactivación de tuberculosis, neoplasias, desmielinización o síndrome lupus-like; de igual forma, las alteraciones en los parámetros de laboratorio (hemoglobina, recuento leucocitario y función hepática), en la presión arterial o en el electrocardiograma han sido anodinas hasta la fecha.
Actualmente apremilast se encuentra en fase de ensayo clínico para su aprobación en otras enfermedades inflamatorias y autoinmunes crónicas, incluyendo espondilitis anquilosante, enfermedad de Alzheimer, sarcoidosis, lupus eritematoso sistémico, enfermedad inflamatoria intestinal, dermatitis atópica, artritis reumatoide, esclerosis múltiple y enfermedad de Behçet.
¿En que podría beneficiarnos disponer de una nueva diana terapéutica con un mecanismo de acción completamente diferente? A pesar del desarrollo y de la comercialización más recientes de anticuerpos monoclonales dirigidos contra la subunidad proteica p40 compartida por IL-12 e IL-23 (ustekinumab) e IL-17A (secukinumab), las opciones terapéuticas estaban reducidas hasta la fecha a fármacos modificadores de la enfermedad y anticuerpos monoclonales dirigidos contra el factor de necrosis tumoral. La modulación de otras dianas terapéuticas ofrece la disponibilidad de otras opciones de tratamiento para nuestros pacientes con artritis psoriásica y psoriasis, ya que aproximadamente un 30% de los pacientes no responden o responden de forma inadecuada a las actuales opciones terapéuticas. Apremilast ha demostrado ser eficaz en los pacientes refractarios a los tratamientos convencionales, incluidos los anticuerpos monoclonales, siendo una de sus ventajas más importantes la administración oral, lo que facilitaría la adherencia del paciente al tratamiento. En este sentido, y por los resultados obtenidos en los últimos años con otros fármacos inhibidores de proteínas asociadas a las vías de señalización intracelular, como las Janus protein tyrosine kinases (JAK cinasas), los fármacos orales podrían representar una opción eficaz y segura en el tratamiento de diversas enfermedades inflamatorias y autoinmunes crónicas, reduciendo los costes asociados a su administración.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesDHF: ninguno que declarar. LV: Abbvie, Roche Farma, Bristol-Myers Squibb, Pfizer, UCB, MSD y GSK.
Las autoras agradecen a los Dres. Francisco Javier López Longo, Juan Carlos Nieto (Servicio de Reumatología, Hospital General Universitario Gregorio Marañón. Madrid) y Gustavo Centeno Soto (Servicio de Farmacología Clínica, Hospital Puerta de Hierro. Madrid) por la lectura crítica y las correcciones realizadas a este manuscrito.