Estudiar si en la artritis psoriásica (APs) hay asociación entre la obesidad, el control de la actividad inflamatoria y el aumento de efectos adversos con los fármacos modificadores de la enfermedad (FAME).
MétodosRevisión sistemática de la literatura utilizando las bases de datos Medline y Embase según las guías del consenso MOOSE. Se incluyeron estudios en pacientes con APs, en los que la obesidad fuera factor predictor de efectos adversos y el desenlace fuera toxicidad, incluido fallo de eficacia. La calidad se evaluó mediante una escala de riesgo de sesgos ad hoc. Se realizó un análisis cualitativo por tipo de estudio y población estudiada, calidad y resultados específicos.
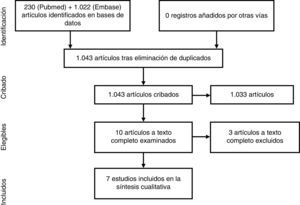
ResultadosSe encontraron 1.043 artículos, la mayoría se descartaron por título y abstract. Se estudiaron en detalle 10, excluyéndose finalmente 3. La mayoría concluye con resultados estadísticamente significativos que la obesidad en pacientes con APs e inhibidores del TNF-α (iTNF-α) se asocia a una probabilidad menor de alcanzar y mantener la mínima actividad inflamatoria, con mayor tasa de interrupción del tratamiento y menor tasa de respuesta cutánea. En relación con los FAME sintéticos convencionales, se observó en obesos una tendencia a un aumento moderado de las transaminasas con metotrexato (MTX).
ConclusionesLa obesidad es un factor predictivo negativo de la respuesta clínica en pacientes con APs e iTNF-α. Exceptuando la hepatotoxicidad por el MTX, no se encontraron otros efectos adversos ni por otros fármacos en relación con la obesidad.
To assess the association between obesity, control of inflammatory activity and increased adverse effects in psoriatic arthritis (PsA) with disease-modifying anti-inflammatory drugs (DMARD).
MethodsA systematic literature review was performed using MEDLINE and EMBASE databases following the guidelines of the Meta-analysis Of Observational Studies in Epidemiology (MOOSE) consensus statement. Studies were selected if they included patients with PsA, obesity was studied as a predictive factor, and the outcome was adverse effects, including efficacy failure. Quality was assessed using an ad hoc risk of bias tool. A qualitative analysis was carried out by type of study and study population, quality and specific results.
ResultsWe found 1043 articles, discarding most of them on the basis of title and abstract. Ten articles were studied in detail and finally excluded three. The majority concluded, with statistically significant results, that in patients with PsA and treated with TNFα inhibitors (TNFαi), obesity is associated with poorer chances of achieving and maintaining a minimal disease activity, higher treatment discontinuation rates, and lower skin response. Regarding conventional synthetic DMARD, a trend toward a moderate increase in transaminases with methotrexate (MTX) was observed in obese patients with PsA.
ConclusionsObesity is a negative predictor of clinical response in patients with PsA being treated with TNFαi. Except MTX hepatotoxicity, no other adverse effects, either with TNFαi or other drugs, were found in relation to obesity in PsA.
La obesidad y sus complicaciones son frecuentes en los pacientes con enfermedad psoriásica1-5. Diversos estudios epidemiológicos han identificado un mayor riesgo de desarrollar algunas alteraciones metabólicas en los pacientes con psoriasis y artritis psoriásica (APs), dentro de las cuales destaca la obesidad. Ello es así porque la obesidad y la psoriasis parecen estar vinculadas por un mecanismo fisiopatológico común, que se explica por una inflamación crónica de bajo grado2, con elevación de marcadores inflamatorios a nivel local y sistémico. En la obesidad se produce en los adipocitos un desequilibrio en las citocinas con una secreción excesiva de las más perjudiciales desde el punto de vista cardiovascular, como IL-6, IL-18, TNF-α y leptina, y una liberación disminuida de las citocinas protectoras, como la adiponectina2,6.
Es conocido que la obesidad se asocia a una mayor incidencia y gravedad de psoriasis, así como que su presencia afecta a la respuesta terapéutica7-9. Esta relación está menos estudiada en APs. Por otro lado, el tratamiento con inhibidores del TNF-α (iTNF-α) se ha asociado con aumento de peso tanto en psoriasis como en APs10, lo que habría que tener en cuenta en el seguimiento de estos pacientes. Es por ello que nos propusimos estudiar si la obesidad se asocia a una mayor frecuencia de efectos adversos de los tratamientos de fondo en la APs, incluyendo la falta de respuesta como efecto adverso.
MétodosSe llevó a cabo una revisión sistemática de la literatura. Se trata de una revisión de estudios observacionales y se utilizaron las guías del consenso MOOSE11.
Estrategia de búsquedaSe realizó una búsqueda en las bases de datos Medline (vía PubMed) y Embase (hasta el 28/05/2015). Los términos PICO principales utilizados para la búsqueda fueron «obesidad» y «artritis psoriásica». La tabla 1 muestra los términos utilizados en las búsquedas. No se introdujeron límites, ni de idioma, ni de fechas, ni de edades, únicamente se consideraron estudios en humanos.
Estrategias de búsqueda
| Medline | Embase |
|---|---|
| «Obesity» [Mesh] Obesity [tw] Obesity [ti] Obesity [ab] «Overweight» [Mesh] «Overweight» [tw] «Overweight» [ti] «Overweight» [ab] «Body Mass Index» [Mesh] «Body Mass Index» [tw] «Body Mass Index» [ti] «Body Mass Index» [ab] «Body Weight/adverse effects» [Mesh] «Body Weight/drug effects» [Mesh] «Abdominal Obesities» OR «Abdominal Obesity» OR «Obesities, Abdominal» OR «Central Obesity» OR «Central Obesities» OR «Obesities, Central» OR «Obesity, Central» OR «Obesity, Visceral» OR «Obesities, Visceral» OR «Visceral Obesities» OR «Visceral Obesity» OR «Morbid Obesities» OR «Obesities, Morbid» OR «Obesity, Severe» OR «Obesities, Severe» OR «Severe Obesities» OR «Severe Obesity» OR «Morbid Obesity» («Arthritis, Psoriatic» [Mesh] OR «psoriatic arthritis» OR (psoriasis AND arthritic) OR (arthritic AND psoriasis) OR «Psoriasis Arthropathica» OR (arthritis AND psoriasis)) | «obesity»/exp «overweight»/exp ––––––––––––– weight gain/exp ––––––––– adipose tissue hyperplasia adipositas adiposity alimentary obesity body weight, excess fat overload syndrome nutritional obesity obesitas overweight IMC (body mass index) body ban mass body mass index Quetelet index weight increase ––––––– «psoriasis» AND «arthritic» «psoriatic» AND «arthritis» «psoriasis» AND «arthritis» «psoriatic arthritis»/exp OR «psoriatic arthritis» |
Se establecieron los siguientes criterios de selección: 1) todos los pacientes debían tener APs o existir un análisis diferenciado de pacientes con APs; 2) el efecto del factor obesidad o índice de masa corporal (IMC) se debe haber estudiado como factor predictor principal o secundario; 3) el estudio debía ser un ensayo clínico, un estudio longitudinal prospectivo o retrospectivo o un caso-control pero no se aceptaban series de casos, y 4) el desenlace (variable principal) debería ser toxicidad, sea esta específica o en general: hepatotoxicidad (aumento enzimas, fibrosis, cirrosis, hepatocarcinoma), resistencia a la insulina, dislipidemia, hipertensión arterial, hiperuricemia, menor supervivencia del tratamiento o menor eficacia terapéutica.
Dos revisores realizaron el cribado por título y abstract, y mantuvieron para revisión detallada todos aquellos que ofrecían dudas de si cumplían o no criterios de selección. Se obtuvieron todos los artículos seleccionados por este sistema, así como los que no tenían. Se recogió el motivo de exclusión en la revisión detallada.
Variables y recogida de datosDe los artículos revisados en detalle, se recogieron todos los datos de la descripción de la muestra y el objetivo del estudio, el diseño y duración del seguimiento, los fármacos empleados, la definición de obesidad y las variables utilizadas y su medida, con y sin ajuste, así como las variables incluidas en el ajuste.
La calidad se evaluó mediante una escala de riesgo de sesgos ad hoc, que incluía: 1) diseño (sesgo bajo en longitudinales prospectivos, sesgo alto en retrospectivos o casos y controles); 2) tiempo de exposición a fármacos (sesgo alto si el tiempo es corto, inferior a 3 meses); 3) claridad en la definición, tanto del factor (obesidad) como del desenlace (toxicidad), y 4) medida del efecto (sesgo alto si no se presenta ajustada).
AnálisisSe realizó un análisis cualitativo de la información recogida por tipo de estudio y población estudiada, por calidad y por resultados específicos. Se realizó una evaluación cualitativa de la heterogeneidad.
ResultadosLa estrategia de búsqueda encontró 1.043 títulos, de los cuales la mayoría se descartaron por título y abstract (fig. 1). Se estudiaron en detalle 10 estudios12-21, de los que finalmente se excluyeron 3: el estudio de Santiago Garcia et al., por tratarse de un estudio transversal20; el de Koehm et al., porque no incluye la obesidad entre los predictores de efectos adversos o de fallo de eficacia19, y el de di Minno et al. de 2014, por tratarse en realidad de un ensayo clínico para ver el efecto de la pérdida de peso sobre la actividad, que es una pregunta de investigación distinta14. De los 7 estudios incluidos, uno era un ensayo multicéntrico y el resto eran estudios observacionales longitudinales (3 prospectivos y 3 retrospectivos) (tabla 2).
Tabla de evidencia de los estudios incluidos
| Autores, año Tipo de estudio y duración | Pacientes incluidos | Fármacos incluidos | Variables obesidad/IMC estudiado | Variables de desenlace estudiadas |
|---|---|---|---|---|
| Schmajuk et al., 201421 Retrospectivo (227±147 días) | 659 pacientes AR: 379 (57%) Ps/APs: 142 (22%) Otros: 138 (21%) Obesos: 203 (31%) | Metotrexato (a dosis media<15mg/sem) | Obesidad: IMC ≥ 30kg/m2 | Hepatotoxicidad |
| Greenberg et al., 201116 Retrospectivo Registro CORRONA 2/02-03/11 | 392 pacientes con APs | Etanercept Adalimumab Infliximab | Obesidad: IMC ≥ 30 | Supervivencia del fármaco |
| Di Minno et al., 201313 Prospectivo 24 meses | 135 pacientes con APs y sobrepeso/obesos 135 pacientes con APs con peso normal | Etanercept Adalimumab Infliximab | Sobrepeso: IMC 25-30 Obesidad: IMC > 30 o circunferencia de cintura > 102cm en hombres y > 88cm en mujeres | Eficacia terapéutica |
| Iannone et al., 201218 Retrospectivo 36 meses (media; rango 6-79) | APs: 135 obesos 47 sobrepeso Peso normal | Etanercept Adalimumab Infliximab | Peso normal: IMC < 25kg/m2 Sobrepeso: IMC 25-30kg/m2 Obesidad: IMC > 30kg/m2 | Eficacia terapéutica |
| Cassano et al., 200812 Ensayo abierto multicéntrico prospectivo a 12 semanas (objetivo primario) 24 semanas (seguimiento) | 147 con APs activa y placas de Ps crónica (BSA>10% y PASI ≥ 10) o BSA<10% pero Ps en zonas visibles o difíciles de tratar 144 completan 12 semanas | Adalimumab 40mg/2 sem×12 sem 40mg/sem (en pacientes no respondedores en la semana 12) hasta la semana 24 | Obesidad: IMC > 30kg/m2 | Eficacia terapéutica |
| Eder et al., 201515 Prospectivo 2003 a 2012 | 557 pacientes 36% sobrepeso 35% obesos | FAME sintético iTNF-α | Peso normal: IMC < 25kg/m2 Sobrepeso: IMC 25-30kg/m2 Obesidad: IMC > 30kg/m2 | Eficacia terapéutica |
| Haddad et al., 201317 Prospectivo (sin especificar) | 227 pacientes | iTNF-α FAME sintético AINE | Mayor IMC (no definición de obesidad) | Eficacia terapéutica |
AINE: antiinflamatorio no esteroideo; APs: artritis psoriásica: AR: artritis reumatoide; BSA: Body Surface Area; FAME: fármaco modificador de la enfermedad; IMC: índice masa corporal; iTNF-α: inhibidor del TNFα; PASI: Psoriasis Area Activity Index; Ps: psoriasis.
El estudio de Greenberg et al.16 analiza si la obesidad contribuye a la supervivencia del tratamiento y el de Schmajuk et al.21 el efecto de la obesidad sobre las transaminasas. El resto de los estudios incluidos analizan el efecto sobre la respuesta. Según nuestra escala de riesgos de sesgos, los diseños son apropiados pero, salvo en el estudio de Schmajuk et al., las variables de desenlace no son exactamente toxicidad.
La población estudiada incluía pacientes con APs activa y distintos grados de IMC y en mayor medida estaban tratados con iTNF-α. La mayoría de los estudios definen obesidad como un IMC>30kg/m2, si bien en el Haddad et al.17 no se define. En cuanto a las medidas de desenlace, estudian principalmente el porcentaje de pacientes en mínima actividad de enfermedad (MAE), pero también otras medidas de la respuesta en APs.
Cuatro estudios evalúan el impacto de la obesidad en la respuesta clínica en pacientes con APs en tratamiento con iTNF-α. Tres de ellos concluyen con resultados estadísticamente significativos que el sobrepeso y la obesidad se asocian a una menor probabilidad de alcanzar la MAE y de mantenerla en el tiempo. En el ensayo clínico de Cassano et al. que valora respuesta PASI50, los resultados obtenidos señalan de forma significativa que la tasa de respuesta de la psoriasis al tratamiento con adalimumab es menor en paciente con IMC>30kg/m212. El estudio de Iannone et al.18 es el único en el que el IMC no parece influir en las tasas de remisión de la enfermedad en pacientes con APs y tratamiento con iTNF-α (para un resumen de los resultados, véase la tabla 3).
Resultados sobre efecto de la obesidad en la respuesta
| Autor, año | Medida de desenlace | Resultados en relación con la asociación a obesidad / IMC |
|---|---|---|
| Di Minno, 201313 | MAE(12 meses) MAE sostenida (12-24 meses) | La prevalencia de obesidad es más alta en los pacientes que no alcanzan la MAE con respecto a los que si la alcanzan (64.0% vs 25.5% p< 0,001) No alcanzan MAE pacientes con IMC> 30kg/m2 HR 4.90 95% [95% CI] 3.04-7.87; P<0.001) IMC 30-35 kg/m2 HR 3.98 95% CI 1.96 – 8.06, P<0.001 IMC 35-40 kg/m2 HR 5.40 95% CI 3.09 –9.43, P<0.001 Obesidad se asoció con peor probabilidad de mantener MAE a los 24meses HR 2.04, 95% CI 1.015–3.61;P=0.014 |
| Greenberg 201116 | Supervivencia del fármaco | Retención empeora con la obesidad. Riesgo de interrupción en IMC>30: HR ajustada= 1.52 [95% IC 1.08-2.1] p=0.017 Retención del tratamiento a 18 meses IMC<30 vs IMC>30: 80% vs 63%. Dosis fija de iTNFa tiene más riesgo de suspensión que dosis ajustada al peso: HR ajustada 1.3 [95% IC 0.9 -2.1]p=0.140 Retención a los 18 meses del iTNFa de dosis ajustada vs dosis fija: 75% vs 70%. |
| Iannone 201218 | Peso normal | Sobrepeso | Obeso | P | ||||
| Media (SD) | Mediana (IQR) | Media (SD) | Mediana (IQR) | Media (SD) | Mediana (IQR) | |||
| HAQ | 0.79 (0.9) | 0.5 (1.2) | 0.47 (0.8) | 0.0 (0.7) | 0.81 (0.8) | 0.75 (1.5) | 0.06 | |
| DAS28 | 3.1 (1.6) | 2.7 (1.5) | 2.9 (1.6) | 2.7 (2.7) | 3.2 (1.5) | 3.3 (2.4) | 0.42 | |
| SDAI | 14.2 (13) | 14.7 (11) | 11.6 (12) | 8.0 (17) | 13.0 (12) | 14.0 (6) | 0.44 | |
| DAS28<2.6 | 44% | 46% | 37% | 0.31 | ||||
| SDAI<3.3 | 21% | 38% | 21% | 0.07 | ||||
| Respuesta EULAR | 61.5% | 63.8% | 62.8% | 0.05 | ||||
| Cassano 200812 | PASI 50 | IMC<30 | IMC>30 | P |
| 79% | 58% | 0,02 | ||
| Eder 201515 | MAE sostenida durante al menos un año | IMC 25-30 | IMC>30 | |
| OR | 0.64 | 0.52 | ||
| P | 0.001 | 0.0001 | ||
| Haddad 201317 | MAE | 146 pacientes alcanzaron la MAE después de una duración media de 1,3 años. Los pacientes que no alcanzaron MAE presentaban al inicio >IMC (31,6 vs 28,5) p=0,02 | ||
DAS28: Disease Activity Score; HAQ: Health Assessment Questionay; IMC: índice masa corporal; MAE: mínima actividad de la enfermedad; PASI: Psoriasis Area Activity Index; SDAI: Simplified Disease Activity Index.
El estudio de di Minno et al.13 valora 135 pacientes con APs con sobrepeso y/u obesidad y 135 pacientes con APs con peso normal. La prevalencia de obesidad es más alta en los pacientes que no alcanzan la MAE a los 12 meses (64,0% vs. 25,5% p < 0,001) y se asocia a una menor probabilidad de mantenerla a los 24 meses (HR 2,04, IC del 95%, 1,015-3,61; p=0,014).
El estudio de Iannone et al.18 no obtiene los mismos resultados y presenta como limitaciones que es retrospectivo, la cohorte de pacientes es menor y los pacientes presentan diferentes características (no presentan afectación axial, PASI muy bajo y muy pocos tienen segundo grado de obesidad)13.
El estudio de Greenberg et al.16, con datos del registro CORRONA, evalúa la influencia del peso y el IMC en la persistencia del tratamiento con iTNF-α en pacientes con APs y observa de forma significativa que el riesgo de interrupción es mayor en pacientes con IMC ≥ 30. El riesgo ajustado de interrupción del tratamiento en personas con IMC ≥ 30 es de HR=1,52 (IC del 95% de 1,08 a 2,1) p=0,017, siendo la persistencia a los 18 meses del 80% frente al 63% en obesos. Los pacientes con dosis fija de iTNF-α mostraron mayor riesgo de interrupción (no se especifica la causa) que con dosis en relación con el peso, siendo la HR ajustada de 1,3 (IC del 95% de 0,9 a 2,0) y la persistencia del 75% frente al 70% a los 18 meses. Adicionalmente, se evalúan otras variables determinantes del riesgo de interrupción del tratamiento, incluyendo dolor en la visita basal, género, discapacidad previa y comorbilidad CV, obteniéndose diferencias significativas en el caso de género (mujer vs. hombre p = 0,004), dolor basal (≥ 4 vs. < 4, p 0,026) y comorbilidad CV (p = 0,007).
Por último, en el estudio de Schmajuk et al.21, que incluye a 659 pacientes, de los cuales 142 (22%) tienen psoriasis/APs y el 31% tiene un IMC ≥ 30,0kg/m2, se observa una tendencia al aumento moderado de transaminasas en pacientes obesos en tratamiento con metotrexato (tabla 4).
Resultados de hepatotoxicidad en el estudio de Schmajuk et al., 201421
| AST/ALT normal (n = 533) | AST/ALT < 1,5×ULN (n = 81) | AST/ALT ≥ 1,5×ULN (n = 45) | P | |
|---|---|---|---|---|
| IMC ≥ 30kg/m2 | 159 (30%) | 24 (30%) | 20 (44%) | 0,12 |
| Ajuste OR (IC del 95%) IMC ≥ 30 vs.< 30kg/m2 | Análisis primario ≥ 1,5×ULN | Análisis secundario ≥ 2×ULN | ||
| 1,9 (1,0-3,6) | 1,7 (0,6-4,3) |
AST límite alto normalidad=35mg/ml. ALT límite alto normalidad=60mg/ml.
Alteración: leve: < ULN×1,5; moderada: ≥ ULN×1,5; severa: > ULN×10.
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; ULN: upper limit of normal.
Tomado de Schmajuk et al.21.
Esta revisión concluye que la obesidad asocia un mayor riesgo de no alcanzar y mantener la MAE en APs y es, en definitiva, un factor predictivo negativo de la respuesta clínica con los fármacos iTNF-α12. Existen pruebas con riesgo moderado de sesgo de que la obesidad se asocia a una menor supervivencia del fármaco. Esta probablemente sea debida más a ineficacia por los motivos mencionados anteriormente que a toxicidad. También se observa una tendencia a menor supervivencia con los fármacos iTNF-α a dosis fija como muestra el estudio de Greenberg et al.16.
Sin embargo, el estudio de di Minno et al.13, en función de sus resultados (MAE alcanzada en el 15,6% de los pacientes con infliximab, el 21,3% con etanercept y el 18,6% con adalimumab), cuestiona que la obesidad deba ser considerada como un factor determinante en la indicación de tratar con iTNF-α con dosis en relación con el peso en pacientes con APs.
En el ensayo clínico de di Minno et al.14, finalmente excluido en esta revisión, se observa que una pérdida de peso (≥ 5% con respecto a la basal) se asocia a una mayor probabilidad de alcanzar la MAE a los 6 meses (OR=4,20; IC del 95%, 1,82-9,66; p < 0,001). Además, esta probabilidad de alcanzar la MAE aumenta proporcionalmente a la pérdida de peso; pérdidas de peso de < 5%, 5-10% y > 10% se asocian a MAE en el 23,1%, el 44,8% y el 59,5%, respectivamente.
Así mismo, en pacientes obesos con APs con metotrexato se ha encontrado evidencia moderada a un aumento de las transaminasas. Desafortunadamente, no hemos encontrado ningún artículo que aborde otros efectos adversos distintos de la hepatotoxicidad y con otros fármacos. De modo que la pregunta solo queda parcialmente respondida. Por otra parte, la evolución de la esteatosis hepática no parece estar influenciada por el tratamiento biológico en pacientes con APs y se relaciona con factores de riesgo, como el síndrome metabólico y con la propia actividad de la enfermedad22.
En resumen, la obesidad es un factor predictivo negativo de la respuesta clínica en pacientes con APs a los fármacos iTNF-α y de, probablemente, algo mayor hepatotoxicidad con el metotrexato. Hemos encontrado, con un nivel de evidencia 3, que la obesidad se asocia a una menor respuesta terapéutica a los fármacos iTNF-α y probablemente a otros tratamientos en la APs. Por lo tanto, la obesidad debería ser considerada como indicación de ajuste de dosis de fármacos iTNF-α con dosis ajustada al peso. Así mismo, y aunque pendiente de confirmar en otros estudios, la obesidad se asocia a una elevación moderada de transaminasas en pacientes en tratamiento con metotrexato y APs, por lo que, o bien se debe recomendar al paciente que adelgace, o se vigilan las enzimas hepáticas, o ambas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónMerck Sharp & Dohme España financió la realización de la revisión sistemática como parte de un documento global de recomendaciones del manejo de la comorbilidad en APs.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.