Las miopatías inflamatorias son enfermedades poco comunes y con características heterogéneas. La mayoría de los estudios clínicos y terapéuticos difieren en cuanto a criterios de diagnóstico, inclusión y mejoría, lo que dificulta obtener conclusiones válidas respecto a la evolución y respuesta terapéutica de este grupo de padecimientos. En forma reciente, varios grupos dedicados al estudio de las miopatías han desarrollado y validado instrumentos de evaluación tanto de actividad como de daño. Su uso permitirá uniformar los estudios clínicos, con la posibilidad de obtener resultados más confiables e incluso realizar comparaciones válidas entre los estudios individuales.
Inflammatory myositis are rare and heterogeneous diseases. Most clinical and therapeutic studies differ in diagnostic and inclusion criteria as well as in improvement measures. Several collaborative study groups have recently developed and validated outcome measures for both activity and damage of these diseases. The broad use of these core set measures will result in standardized clinical studies, with more reliable results that will allow comparing between individual studies.
Las miopatías inflamatorias (MI) constituyen un grupo de enfermedades autoinmunes en cierto modo heterogéneo. Es indudable que, además de la poca frecuencia de estos padecimientos, lo que dificulta el reunir grupos grandes de pacientes para los estudios clínicos, uno de los principales obstáculos al evaluar la evolución y la respuesta a las diferentes opciones terapéuticas disponibles, ha sido la falta de uniformidad en los parámetros evaluados como respuesta, así como la subjetividad de éstos.
Cuando se revisa la literatura médica disponible, los parámetros más empleados para definir la mejoría de un paciente con MI han sido los siguientes:
- a)
calificación subjetiva: mejor, igual o peor;
- b)
escalas análogas visuales;
- c)
escalas numéricas de fuerza, y/o
- d)
determinación periódica de niveles enzimáticos.
Sin embargo, sabemos que este tipo de evaluación no deja de ser deficiente; diversos estudios han demostrado que la clasificación de la fuerza en 5 grados, tan empleada en los estudios clínicos de las MI, carece de sensibilidad al cambio, en especial entre la calificación 4 (vence resistencia en forma parcial) y la 5 (vence resistencia en forma completa). También se sabe que los niveles de creatina cinasa u otras enzimas musculares no siempre reflejan la evolución de la debilidad muscular y, otro aspecto importante, los parámetros empleados anteriormente no incluyen datos sobre las características extramusculares de las MI, que ocurren entre un 10 y un 80% de los pacientes, y que incluso en algunos casos pueden ser las manifestaciones predominantes (v. gr., dermatomiositis amiopática)1,2.
Es por ello de gran importancia contar con herramientas confiables y validadas que permitan evaluar la actividad de este grupo de padecimientos (tanto a nivel muscular como extramuscular), así como el daño causado por éstos. Sólo contando con estos instrumentos será posible definir con exactitud la evolución de estos padecimientos, así como la respuesta a los tratamientos, tanto convencionales como innovadores, de que se dispone en la actualidad. Además, su uso generalizado permitirá que los resultados obtenidos de los diferentes estudios clínicos sean, hasta cierto punto, comparables entre sí.
De hecho, en un metaanálisis realizado en el año 2005 por Choy et al, en relación con las opciones terapéuticas para las MI, la conclusión de los autores fue que “No existe suficiente investigación con diseño adecuado para poder obtener ninguna conclusión al respecto”3. Esta afirmación destaca la necesidad urgente de contar con métodos aceptados internacionalmente para evaluar estas enfermedades.
El esfuerzo por desarrollar instrumentos uniformes de evaluación en las MI es relativamente reciente. Fue en junio de 1999, durante el Congreso de la Liga Europea contra el Reumatismo (EULAR) realizado en Glasgow, cuando el grupo del IMACS (Internacional Myositis Outcome Assessment Collaborative Study Group) comenzó con esta iniciativa2. En forma paralela, el grupo PRINTO (Paediatric Rheumatology International Trials Organization) ha comenzado el desarrollo y validación de instrumentos de evaluación para las dermatomiositis juveniles (DMJ)4.
Parámetros básicos de evaluación. En el año 2001 el grupo IMACS propuso, después de la realización de un consenso internacional, un conjunto de parámetros para definir la actividad y la evolución en las MI tanto en adultos como en niños5,6. Las evaluaciones abarcan cinco dominios y los autores proponen que, para afirmar que existe mejoría debe lograrse una mejoría ≥20% en 3 de las evaluaciones, sin que más de 2 (que no sean la fuerza muscular) empeoren en ≥25%. Asimismo, se han definido en forma preliminar en un taller del IMACS los criterios de empeoramiento6,7. La tabla 1 resume la propuesta del grupo IMACS, y los instrumentos específicos pueden consultarse en la dirección de Internet https://dir-apps.niehs.nih.gov/imacs/index.cfm?action=security.login.
Criterios para evaluar la actividad de la enfermedad, propuestos por el Myositis Outcome Assessment Collaborative Study Group5
| Dominio | Medida de evaluación |
| Actividad global | EVA o escala de Likert para actividad global de la enfermedad por el médico |
| EVA o escala de Likert para actividad global de la enfermedad por el paciente/padres | |
| Fuerza muscular | MMT con escala de 0–10 o 0–5 puntos ampliada para incluir músculos proximales, distales y axiales |
| Función física | HAQ, CHAQ, CMAS |
| Laboratorio | Por lo menos dos enzimas musculares: CK, aldolasa, DHL, ALT, AST |
| Afección extramuscular | Instrumento validado: v. gr., MITAX, MYOACT |
ALT: alanino aminotransferasa; AST: aspartato aminotransferasa; CHAQ: Childhood HAQ; CK: creatina cinasa; CMAS: Childhood Myositis Assessment Scale; DHL: deshidrogenasa láctica; EVA: escala visual análoga; HAQ: Health Assessment Questionnaire; IMACS: Internacional Myositis Outcome Assessment Collaborative Study Group; MITAX: Myositis Intention to Treat Index; MMT: Manual Muscular Testing; MYOACT: Myositis Disease Activity Assessment Visual Analogue Scale.
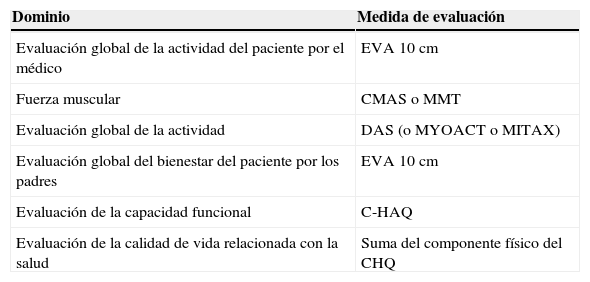
El grupo PRINTO, en asociación con el grupo PRCSG (Pediatric Rheumatology Collaborative Study Group) propuso y validó un conjunto de evaluaciones específicas para medir la respuesta terapéutica en la DMJ8,9, que ha sido avalado por el Colegio Americano de Reumatología (ACR) y la EULAR. La tabla 2 muestra los parámetros propuestos por estos grupos. Los parámetros para DMJ, a diferencia de los sugeridos por el IMACS, no incluyen enzimas musculares, evalúan calidad de vida y, por supuesto, emplean algunos instrumentos validados específicamente en niños (CHAQ [Childhood Health Assessment Questionnaire], CMAS [Childhood Myositis Assessment Scale] y CHQ [Child Health Questionnaire], ver adelante).
Dominios y variables para evaluar la respuesta terapéutica en dermatomiositis juvenil9
| Dominio | Medida de evaluación |
| Evaluación global de la actividad del paciente por el médico | EVA 10cm |
| Fuerza muscular | CMAS o MMT |
| Evaluación global de la actividad | DAS (o MYOACT o MITAX) |
| Evaluación global del bienestar del paciente por los padres | EVA 10cm |
| Evaluación de la capacidad funcional | C-HAQ |
| Evaluación de la calidad de vida relacionada con la salud | Suma del componente físico del CHQ |
C-HAQ: Childhood Health Assessment Questionnaire; CHQ: Child Health Questionnaire; CMAS: Childhood Myositis Assessment Scale; DAS: Disease Activity Score; EVA: Escala Visual Análoga, MITAX: Myositis Intent to Treat Activity Index; MMT: Manual Muscular Testing; MYOACT: Myositis Disease Activity Assessment Visual Analogue Scale.
Pruebas de fuerza muscular. Son muchas las pruebas de fuerza muscular que se han empleado y validado en MI, como la del MRC (Medical Research Council), que ha sufrido varias adaptaciones, las que emplean dinamómetros manuales u otras2,10–12.
Actualmente, la prueba MMT (Muscular Manual Testing) 8 es la más empleada para medir la fuerza muscular en estudios de respuesta terapéutica. Evalúa 8 grupos musculares de tipo axial, proximal y distal en forma unilateral y su rango de calificación va de 0=peor a 80=la mejor. Es rápida y fácil de realizar en pacientes mayores de 4 años de edad12.
La escala CMAS va de 0=peor a 52=la mejor, evalúa fuerza, resistencia y función muscular, considerando músculos tanto axiales como proximales de extremidades superiores e inferiores, no en forma individual, sino por medio de actividades (p. ej., pasar de posición supina a sentado). Es fácil y rápida de aplicar, por lo que se considera de elección para evaluar la afección muscular en niños pequeños, en los que la prueba MMT no es tan accesible13,14.
Índices de capacidad funcional. Como índices funcionales, se han empleado y validado en MI el Stanford HAQ (Health Assessment Questionnaire) y el CHAQ para DMJ15–18. Estos instrumentos, de uso frecuente en múltiples enfermedades reumáticas, han sido adaptados a diferentes lenguas y culturas19,20.
Existen dos índices funcionales específicos para miositis: el MAP (Myositis Activities Profile) y el MFI (Myositis Function Index). El MAP fue desarrollado originalmente en Suecia y ha sido traducido al inglés; aún debe validarse en estudios clínicos21. El otro índice funcional, el MFI, es una alternativa poco práctica porque requiere equipo especializado (manómetro y flujómetro), la evaluación es tardada y algunas maniobras no pueden realizarse en niños22.
Calidad de vida. Desde el punto de vista de la percepción de la enfermedad por parte del paciente, se ha reportado y validado el uso del SF-36 (Medical Outcomes Study 36-item Short Form)17,23. En niños se ha validado también el CHQ, un instrumento que incluye 15 parámetros que se resumen en un componente físico y otro psicosocial. A mayor calificación, mejor calidad de vida relacionada con la salud24. El MACTAR (McMaster Toronto Arthritis Patient Preference Questionnaire), un índice que evalúa salud general, calidad de vida, función física y función social, ha sido validado para pacientes adultos con MI25.
Índices de actividad y daño. También como resultado de este trabajo de consenso, se han elaborado varios índices que intentan evaluar de modo consistente actividad y daño. Los índices de actividad (MITAX [Myositis intention to treat index] y MYOACT [Myositis disease activity assessment visual analogue scale]) miden un proceso reversible debido a un cambio inflamatorio, mientras que el índice de daño (MDI [Myositis damage index]) implica un cambio permanente sin importar si se debe a actividad previa del padecimiento, a complicaciones de la terapia o a otras condiciones concomitantes. La aplicación de estos instrumentos a pacientes en forma estructurada ha demostrado su adecuada confiabilidad, así como un buen coeficiente de correlación tanto intra como interobservador. Aún deberá evaluarse su sensibilidad al cambio en estudios longitudinales1,26.
MITAX. Este índice, a semejanza del BILAG empleado en forma habitual en lupus eritematoso generalizado, se basa en el principio de intención terapéutica por parte del médico. Se califica en grados (A a E), en donde las manifestaciones clínicas, individuales o en combinación:
- A:
justifican la prescripción de dosis altas de esteroides y/o inmunosupresores
- B:
ameritan dosis bajas de inmunosupresores, antimaláricos o esteroides tópicos
- C:
implican actividad persistente pero leve
- D:
ya no están activas pero antes lo estuvieron
- E:
nunca ha habido actividad a ese nivel1.
MYOACT. Éste es un índice de actividad formado por una serie de escalas análogas visuales en las que el médico define el grado de afección constitucional, muscular, articular, pulmonar, cardíaca, gastrointestinal y cutánea1.
MDI. El MDI es un instrumento de evaluación de daño. El primer componente fue elaborado a partir del índice de daño de lupus del ACR (SLICC). El segundo componente se denomina MYODAM (Myositis damage score) y, a semejanza del MYOACT, cuantifica la severidad del daño ocurrido en diferentes órganos y sistemas por medio de escalas análogas visuales1.
Afección cutánea. Debido a la importancia de las manifestaciones cutáneas en la DMJ, el Juvenile Dermatomyositis Disease Activity Collaborative Study Group ha desarrollado y validado en forma preliminar una herramienta para evaluar la afección cutánea: la CAT (Cutaneous Assessment Tool). Éste es un instrumento semicuantitativo con un componente de actividad (que se califica de 0 a 96) y uno de daño (con calificación de 0 a 20)27
Guías para realizar ensayos terapéuticos. Diversos grupos han realizado esfuerzos para unificar las definiciones y criterios empleados en los estudios clínicos28,29. Como parte de las actividades del grupo IMACS, en 2005 se publicaron los lineamientos, resultado de un consenso internacional, para intentar unificar las características que deben tener los ensayos terapéuticos en MI29. Los lineamientos definen aspectos como criterios de inclusión y exclusión, subgrupos de miopatías que pueden o no incluirse, tratamiento concomitante aceptado, duración del estudio y del uso de placebo, intervalos de evaluación, evaluaciones de seguridad, así como definiciones de mejoría, empeoramiento, respuesta clínica completa y remisión clínica.
Recientemente, el grupo IMACS creó un sistema de recopilación estructurada de datos (Clinical Study Data Repository), que permitirá concentrar los datos de diferentes estudios clínicos y analizarlos en conjunto en un futuro. La información sobre este sistema se encuentra en la página de Internet http://www.niehs.nih.gov/research/resources/collab/imacs/outcomerepository.cfm29.
No hay duda de que los esfuerzos actuales por constituir grupos cooperativos de estudio en MI, el desarrollo de instrumentos uniformes de desenlace y la estandarización en el diseño metodológico de los estudios terapéuticos incrementarán nuestro conocimiento sobre este grupo poco frecuente de enfermedades, permitiéndonos definir mejor la evolución, la respuesta terapéutica a los tratamientos tradicionales y novedosos y el pronóstico de este grupo de padecimientos.