Desde su llegada hace casi 2 décadas, los fármacos biológicos han demostrado ser herramientas muy eficaces para el tratamiento de los pacientes con enfermedades reumáticas inflamatorias crónicas1 con mala respuesta a fármacos antirreumáticos modificadores de la enfermedad (FAME) convencionales2. A pesar de su capacidad para mejorar la calidad de vida de muchos de estos pacientes, el alto coste justificado por la complejidad del desarrollo y la producción3 de estos compuestos ha limitado su uso generalizado4. Es de esperar que el descenso en el precio estimulado por la competencia de la llegada de fármacos biosimilares favorezca, por un lado, el uso de los biológicos en estadios más precoces de las enfermedades y, por otro, una mayor equidad en su acceso5. Aunque desconocemos casos puntuales, francamente no creemos que en nuestro sistema de salud exista inequidad generalizada en el acceso a los fármacos biológicos.
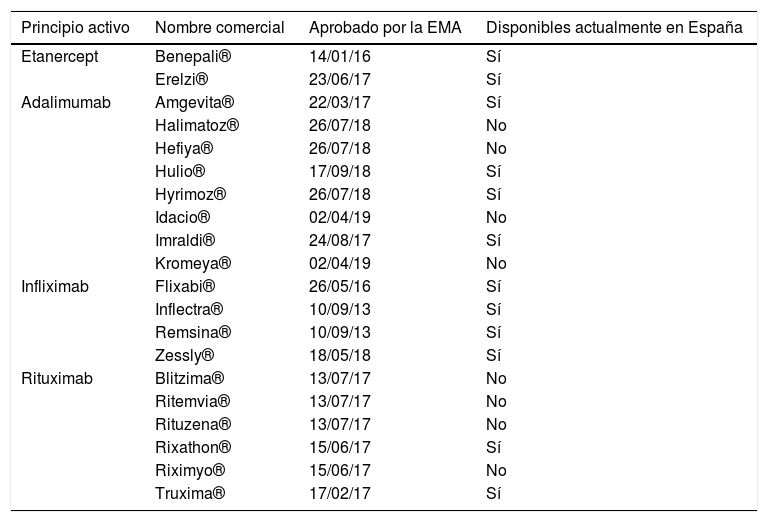
Un biosimilar es un fármaco biológico que contiene una versión de la sustancia activa de un agente biológico original ya aprobado (producto de referencia), y puede ser utilizado de la misma manera y, mediante un ejercicio de extrapolación, en las mismas indicaciones que el producto al que imita. Para su aprobación, los biosimilares son sometidos a ensayos clínicos «head to head» contra su producto de referencia, donde deben demostrar que su perfil de seguridad y eficacia son indistinguible del comparador. Hoy en día están disponibles en nuestro país biosimilares de infliximab, etanercept, rituximab y adalimumab, y es muy probables que nuevos biosimilares de estos y otros biológicos con indicación en enfermedades reumáticas estén disponibles en un futuro próximo. La tabla 1 muestra los biosimilares de estas moléculas que han sido aprobados hasta la actualidad por la European Medicines Agency (EMA) y de ellos los que están disponibles en nuestro país.
Fechas de aprobación por la EMA de fármacos biosimilares con indicación en reumatología y su disponibilidad en España
| Principio activo | Nombre comercial | Aprobado por la EMA | Disponibles actualmente en España |
|---|---|---|---|
| Etanercept | Benepali® | 14/01/16 | Sí |
| Erelzi® | 23/06/17 | Sí | |
| Adalimumab | Amgevita® | 22/03/17 | Sí |
| Halimatoz® | 26/07/18 | No | |
| Hefiya® | 26/07/18 | No | |
| Hulio® | 17/09/18 | Sí | |
| Hyrimoz® | 26/07/18 | Sí | |
| Idacio® | 02/04/19 | No | |
| Imraldi® | 24/08/17 | Sí | |
| Kromeya® | 02/04/19 | No | |
| Infliximab | Flixabi® | 26/05/16 | Sí |
| Inflectra® | 10/09/13 | Sí | |
| Remsina® | 10/09/13 | Sí | |
| Zessly® | 18/05/18 | Sí | |
| Rituximab | Blitzima® | 13/07/17 | No |
| Ritemvia® | 13/07/17 | No | |
| Rituzena® | 13/07/17 | No | |
| Rixathon® | 15/06/17 | Sí | |
| Riximyo® | 15/06/17 | No | |
| Truxima® | 17/02/17 | Sí |
EMA: European Medicines Agency.
Desde hace un tiempo el mercado de los biosimilares se encuentra bajo la presión que genera la reducción de precios. Una tendencia que comenzó en los países nórdicos y que se ha extendido por Reino Unido, Francia, Alemania, Italia y España. Esto ha llevado a los fabricantes de biosimilares a ofrecer descuentos de hasta el 70% respecto del innovador, aunque con variaciones significativas, tanto entre países como dentro de un mismo país. Esta política ha empujado a las empresas de innovadores a reducir precio con la finalidad de retener mercado, lo que ha resultado en un descenso muy importante del coste por paciente de los fármacos biológicos que tienen biosimilares. En este sentido, la Sociedad Española de Reumatología (SER) ha manifestado su alineamiento inequívoco con la sostenibilidad del sistema sanitario y ha mostrado su preferencia por el uso de las terapias de menor coste cuando estas hayan demostrado una eficacia y seguridad comparables a las alternativas más gravosas6.
La llegada de muchos biosimilares de productos con los que los reumatólogos estamos familiarizados y a precios inimaginables hace tan solo 6 meses va a impactar en el hábito de prescripción de los biológicos en reumatología, una nueva etapa que ya está aquí y que va a suponer nuevos retos para los reumatólogos:
- 1.
La llegada de todas estas nuevas moléculas refuerza la necesidad de realizar la prescripción de biológicos por nombre comercial con la finalidad de asegurar su trazabilidad. Diferentes países han adoptado enfoques distintos para garantizar una trazabilidad precisa de los productos biológicos. La UE aprobó una legislación que exige el registro del nombre comercial y el número de lote7, mientras que EE. UU. y Japón han seguido utilizando nombres específicos no registrados. Esto último ha hecho que el nombre de los biosimilares se haya vuelto complejo e inconsistente a nivel mundial. Es esencial que todos los productos biológicos puedan identificarse con un nombre único. Esto se aplica tanto a los biosimilares como a los productos originales y es particularmente importante para la prescripción, la trazabilidad del producto y la farmacovigilancia. Por consiguiente, la prescripción de los biológicos incluyendo los biosimilares debe de hacerse siempre por nombre comercial.
- 2.
Al existir varios biológicos con biosimilares y además varios biosimilares de una misma molécula de referencia se incrementa la complejidad de nombres a recordar lo que puede suponer una fuente de errores.
- 3.
Como ya hemos comentado, en los últimos meses se ha iniciado una política de precios muy agresiva en muchas comunidades autónomas de nuestro país en las que algunos biosimilares se ofertan con un precio de hasta 4 veces menor que su producto de referencia, lo que los sitúa en el rango de precio de FAME como el metotrexato subcutáneo. Esto es en sí mismo una buena noticia que, sin duda va a influir sobre las actuales costumbres de prescripción de los reumatólogos. Por un lado, va a suponer en los pacientes «naive» a biológicos, la lógica priorización de la prescripción de los biosimilares respecto, no solo de sus innovadores, sino también de otras moléculas con dianas diferentes, biológicas o no, que están aceptadas en primera línea. Por otro lado, esta política de reducción de precios va a incrementar la presión por parte de los gestores sanitarios sobre los reumatólogos para que en las pacientes con buena respuesta clínica se intercambien los biológicos innovadores por sus biosimilares. A este respecto la legalidad vigente en nuestro país impide la sustitución por parte del farmacéutico hospitalario de los productos biológicos y la SER, en su último posicionamiento sobre biosimilares6 defiende que el intercambio de un biológico por su biosimilar debe ser realizado exclusivamente por el médico prescriptor siendo aceptable este intercambio en el caso de pacientes con enfermedad estable. En cualquier caso, la SER defiende que esta debe ser una decisión individualizada y con el consentimiento del paciente.
- 4.
La actual agresividad comercial puede ocasionar que las farmacias hospitalarias cambien de biosimilares de una misma molécula a lo largo del tiempo, lo que puede llevar a las gerencias de los hospitales a recomendar el intercambio entre biosimilares de un mismo innovador. Estas situaciones deberán de analizarse con cuidado ya que: 1) no existe ningún estudio que avale la seguridad y la efectividad del intercambio entre biosimilares; 2) complica la trazabilidad de los productos; 3) favorece una visión mercantilista de la medicina, y 4) apoya el concepto de que los biosimilares son productos genéricos, algo que está en contra de su propia naturaleza.
Es indudable que se pueden lograr ahorros sustanciales de costes si los pacientes «naive» a biológicos comienzan el tratamiento con biosimilares. En los pacientes que ya estén con biológicos y que muestren buena respuesta, su intercambio por un biosimilar puede ser otra fuente de ahorro, pero hay que tener en cuenta el efecto nocebo en estas circunstancias. Este efecto puede ser responsable de un aumento subjetivo de la actividad de la enfermedad que favorezcan la falta de adherencia. Consideramos que las condiciones óptimas para el intercambio por un biosimilares en pacientes en tratamiento con un biológico incluirían: remisión o baja actividad, respuesta rápida (menos de 6 meses) y en primera o segunda línea.
Para garantizar una integración óptima y racional de los biosimilares en la práctica de la reumatología y aprovechar las posibilidades de ahorro de costes que aportan, los reumatólogos debemos ser consciente de que la información franca a nuestros pacientes sobre el ahorro, la eficacia y la seguridad de los biosimilares, es la clave para asegurar el uso de estos compuestos a largo plazo. Entendemos que la medida que tiene un mayor impacto para el uso racional de los biosimilares es el reconocimiento por parte de médicos, pacientes y autoridades sanitarias de la necesidad de generar ahorros para el sostenimiento de nuestro sistema de salud. Solo desde el diálogo basado en el conocimiento y la comprensión hacia la sensibilidad de los pacientes se podrá lograr el uso racional y consensuado de los biológicos y biosimilares en esta nueva era que se avecina.
FinanciaciónEste manuscrito no ha recibido financiación.