La dificultad para el diagnóstico y la variedad de manifestaciones clínicas que pueden determinar la elección del tratamiento del síndrome antifosfolípido (SAF) primario ha impulsado a la Sociedad Española de Reumatología (SER) en la elaboración de recomendaciones basadas en la mejor evidencia posible. Estas recomendaciones pueden servir de referencia para reumatólogos y otros profesionales implicados en el manejo de pacientes con SAF.
MétodosSe creó un panel formado por 4reumatólogos, una ginecóloga y una hematóloga, expertos en SAF, previamente seleccionados mediante una convocatoria abierta o por méritos profesionales. Las fases del trabajo fueron: identificación de las áreas claves para la elaboración del documento, análisis y síntesis de la evidencia científica (utilizando los niveles de evidencia de SIGN, Scottish Intercollegiate Guidelines Network) y formulación de recomendaciones a partir de esta evidencia y de técnicas de «evaluación formal» o «juicio razonado».
ResultadosSe han elaborado 46 recomendaciones que abordan 5áreas principales: diagnóstico y evaluación, medidas de tromboprofilaxis primaria, tratamiento del SAF o tromboprofilaxis secundaria, tratamiento del síndrome antifosfolípido obstétrico y situaciones especiales. Está incluido también el papel de los nuevos anticoagulantes orales, el problema de las recurrencias o los principales factores de riesgo identificados en estos individuos. En este documento se reflejan las últimas 25, referidas a las áreas de: SAF obstétrico y situaciones especiales. El documento contiene una tabla de recomendaciones y algoritmos de tratamiento.
ConclusionesSe presentan las recomendaciones de la SER sobre SAF. Este documento corresponde a la parte 2.ª relacionada con el SAF obstétrico y las situaciones especiales. Estas recomendaciones se consideran herramientas en la toma de decisiones para los clínicos, teniendo en consideración tanto la decisión del médico experto en SAF como la opinión compartida con el paciente. Se ha elaborado también una parte I que aborda aspectos relacionados con el diagnóstico, evaluación y tratamiento.
The difficulty in diagnosis and the spectrum of clinical manifestations that can determine the choice of treatment for antiphospholipid syndrome (APS) has fostered the development of recommendations by the Spanish Society of Rheumatology (SER), based on the best possible evidence. These recommendations can serve as a reference for rheumatologists and other specialists involved in the management of APS.
MethodsA panel of 4rheumatologists, a gynaecologist and a haematologist with expertise in APS was created, previously selected by the SER through an open call or based on professional merits. The stages of the work were: identification of the key areas for the document elaboration, analysis and synthesis of the scientific evidence (using the Scottish Intercollegiate Guidelines Network, SIGN levels of evidence) and formulation of recommendations based on this evidence and formal assessment or reasoned judgement techniques (consensus techniques).
ResultsForty-six recommendations were drawn up, addressing 5main areas: diagnosis and evaluation, measurement of primary thromboprophylaxis, treatment for APS or secondary thromboprophylaxis, treatment for obstetric APS and special situations. These recommendations also include the role of novel oral anticoagulants, the problem of recurrences or the key risk factors identified in these subjects. This document reflects the last 25, referring to the areas of: obstetric APS and special situations. The document provides a table of recommendations and treatment algorithms.
ConclusionsUpdate of SER recommendations on APS is presented. This document corresponds to part II, related to obstetric SAF and special situations. These recommendations are considered tools for decision-making for clinicians, taking into consideration both the decision of the physician experienced in APS and the patient. A part I has also been prepared, which addresses aspects related to diagnosis, evaluation and treatment.
El total de recomendaciones formuladas sobre síndrome antifosfolípido (SAF) primario es de 46, que abordan 5áreas principales: diagnóstico y evaluación, tromboprofilaxis primaria, tratamiento del SAF primario o tromboprofilaxis secundaria, tratamiento del SAF obstétrico y situaciones especiales. En este documento se reflejan las últimas 25, referidas a las áreas de: SAF obstétrico y situaciones especiales (tabla 1).
Recomendaciones SER sobre síndrome antifosfolípido primario (parte 2)
| Tratamiento del SAF obstétrico | G R |
|---|---|
| Recomendación: Se sugiere el uso preconcepcional de ácido acetilsalicílico a dosis de 100 mg/día en todas las pacientes con SAF obstétrico que quieran quedarse embarazadas, y su mantenimiento durante todo el embarazo | C |
| Recomendación: En las pacientes con SAF obstétrico se recomienda como tratamiento profiláctico secundario añadir al ácido acetilsalicílico la heparina de bajo peso molecular en el momento en que se confirme el embarazo y mantenerlo durante toda la gestación. Se debe individualizar la dosis de heparina según el riesgo de cada paciente | C |
| Recomendación: En el SAF obstétrico refractario al tratamiento convencional se recomienda iniciar hidroxicloroquina previa al embarazo, y mantenerla durante toda la gestación, sola o asociada a prednisona o equivalente desde el inicio del embarazo (≤10 mg/día durante el primer trimestre) | D |
| Recomendación: En pacientes que desarrollan complicaciones relacionadas con insuficiencia placentaria (preeclampsia o retraso crecimiento intrauterino) a pesar del tratamiento convencional, se recomienda asociar pravastatina (20 mg/día) desde el inicio de la complicación | C |
| Recomendación: No se recomienda el uso inicial de inmunoglobulina intravenosa y plasmaféresis, si bien podría considerarse en ausencia de respuesta a otros tratamientos | √ |
| Recomendación: En pacientes con SAF trombótico previamente anticoaguladas se debe reintroducir los antagonistas de la vitamina K en el posparto inmediato | √ |
| Recomendación: En mujeres con SAF obstétrico se recomienda después del parto realizar tromboprofilaxis con heparina de bajo peso molecular a dosis profilácticas al menos durante 6 semanas | √ |
| Recomendación: En pacientes con SAF trombótico, que por algún motivo no están no anticoaguladas a largo plazo, se recomienda tromboprofilaxis con heparina de bajo peso molecular, a dosis intermedias e individualizando por riesgo durante al menos 6-12 semanas después del parto | D |
| Recomendación: En las pacientes con SAF que van a realizar técnicas de reproducción asistida, se recomienda individualizar el riesgo para asociar, como anticoagulante de elección, heparina de bajo peso molecular, en dosis profilácticas o terapéuticas | D |
| Recomendación: Las pacientes con SAF y anticoagulación oral cambiarán a heparina de bajo peso molecular, a dosis terapéuticas, antes de la estimulación ovárica y la continuarán durante todo el embarazo | D |
| Recomendación: Para las pacientes con SAF sin anticoagulación crónica, se aconseja que realicen tratamiento con ácido acetilsalicílico a dosis antiagregantes y heparina de bajo peso molecular, a dosis individualizadas, desde el inicio de la estimulación ovárica y que lo mantengan durante toda la gestación | D |
| Recomendación: En mujeres con anticuerpos antifosfolípidos con triple positividad o altos niveles de AAF, tanto por riesgo de trombosis como por aparición de complicaciones obstétricas, se recomienda utilizar heparina de bajo peso molecular más ácido acetilsalicílico. | D |
| Recomendación: Se recomienda evitar el síndrome de hiperestimulación ovárica, que es un factor de riesgo de trombosis secundario a las técnicas de reproducción asistida, mediante el uso de protocolos hormonales de bajo riesgo de esta complicación | D |
| Recomendación: En las pacientes con SAF obstétrico aislado se recomienda realizar seguimiento después del embarazo y puerperio debido a que tienen un riesgo trombótico más elevado que la población general. | C |
| Recomendación: En dicho seguimiento se recomienda individualizar el riesgo cardiovascular (identificar la presencia de hipertensión arterial, diabetes mellitus, sedentarismo, obesidad, hábito tabáquico, dislipidemias, etc.) e informar, eliminar o controlar los factores de riesgo cardiovascular existentes. | B |
| Recomendación: Durante el seguimiento conviene individualizar el consejo sobre el uso de ácido acetilsalicílico a dosis bajas como profilaxis antitrombótica primaria. No hay pruebas concluyentes sobre si debe administrarse solo a las pacientes de mayor riesgo trombótico (aquellas con positividad del anticoagulante lúpico o pacientes con triple positividad de anticuerpos) | B |
| Recomendación: Se recomienda el uso de heparina de bajo peso molecular subcutánea en situaciones de alto riesgo de trombosis venosa | √ |
| Situaciones especiales | |
| Recomendación: Se recomienda un control riguroso de la anticoagulación antes y después de un trasplante de órgano sólido, especialmente en caso de trasplante renal | √ |
| Recomendación: Se recomienda el despistaje rutinario de anticuerpos antifosfolípidos antes del trasplante de órgano sólido en todos los pacientes con antecedentes de eventos tromboembólicos | √ |
| Recomendación: Se recomienda realizar tromboprofilaxis con heparina de bajo peso molecular en pacientes con perfil serológico de alto riesgo y neoplasias, especialmente en aquellas situaciones de aumento de riesgo tromboembólico (cirugía, implantación de catéter, inicio de quimioterapia) | √ |
| Recomendación: Se recomienda suspender la anticoagulación en caso de procedimientos invasivos con moderado o alto riesgo hemorrágico y realizar terapia puente | D |
| Recomendación: Como terapia puente se recomienda utilizar heparina de bajo peso molecular a dosis individualizadas ajustadas por peso y función renal y suspenderla al menos 24 h antes del procedimiento invasivo | D |
| Recomendación: En pacientes embarazadas con SAF que utilizan heparina de bajo peso molecular a dosis terapéuticas o intermedias, se recomienda suspenderla al menos 24 h antes del parto u otros procedimientos. Durante el parto, no es necesario suspender el tratamiento en las pacientes que están utilizando ácido acetilsalicílico a dosis de 100mg | D |
| Recomendación: En un paciente con SAF catastrófico el tratamiento inicial debe incluir la denominada triple terapia, que comprende: anticoagulación, preferentemente con heparina no fraccionada intravenosa, asociada a glucocorticoides a dosis altas, plasmaféresis y/o inmunoglobulinas intravenosas | D |
| Recomendación: En los casos refractarios a la triple terapia se puede considerar asociar rituximab o eculizumab | D |
AAF: anticuerpos antifosfolípidos; GR:grado de recomendación (ver anexo 1)
En una paciente con SAF obstétrico, ¿qué tratamientos se muestran más eficaces?
Recomendación: Se sugiere el uso preconcepcional de ácido acetilsalicílico a dosis de 100mg/día en todas las pacientes con SAF obstétrico que quieran quedarse embarazadas y su mantenimiento durante todo el embarazo (Recomendación de grado C).
Recomendación: En las pacientes con SAF obstétrico se recomienda como tratamiento profiláctico secundario añadir al ácido acetilsalicílico la heparina de bajo peso molecular (HBPM) en el momento en que se confirme el embarazo y mantenerla durante toda la gestación. Se debe individualizar la dosis de heparina según el riesgo de cada paciente (Recomendación de grado C).
Las pacientes con SAF obstétrico presentan buen pronóstico gestacional en un porcentaje reducido de los casos si no se realiza un tratamiento médico profiláctico adecuado durante la gestación1. Las complicaciones gestacionales incluyen abortos de repetición, muertes fetales, preeclampsia y parto prematuro, entre otros, que se deben a diversos mecanismos, incluyendo disfunción placentaria, trombosis e infartos placentarios. Por ello, el tratamiento del SAF durante la gestación se ha basado tradicionalmente en atenuar el estado protrombótico de estas pacientes.
En los últimos años se han usado diferentes tratamientos preventivos entre los que se incluyen el AAS, heparina no fraccionada, HBPM, prednisona y otros glucocorticoides e inmunoglobulinas intravenosas (IGIV), como tratamiento único o combinado con la intención de mejorar el pronóstico gestacional. Por todo, ello resulta pertinente valorar la eficacia de estos fármacos con el objetivo de ver cuál es el mejor tratamiento para administrar a estas pacientes.
Tratamiento preconcepcionalExisten muy pocos estudios que valoren la necesidad de realizar un tratamiento profiláctico preconcepcional. En un ensayo clínico aleatorizado2 se evaluó enoxaparina (41mg) y AAS (81mg) versus placebo en pacientes con SAF y abortos previos y se demostró que la combinación de enoxaparina y AAS utilizada de forma profiláctica no mejoró estadísticamente la tasa de nacidos vivos; sin embargo, mejoró la tasa de embarazos de 0-6 meses y disminuyó la tasa de los abortos espontáneos (NE 1+). Por otro lado, una serie de casos valoró a 21 gestantes con SAF primario que recibieron AAS a dosis bajas de forma preconcepcional. En la gestación previa sin recibir el tratamiento la tasa de nacidos vivos fue del 6,1% (46 pérdidas fetales previas y 3 niños vivos), y tras el tratamiento preconcepcional se obtuvo un 90,5% de buen resultado con niño nacido vivo (21 gestaciones y 19 nacidos vivos)3(NE 3).
Tratamiento durante la gestaciónSe han identificado 10estudios que valoran el tratamiento durante la gestación y el uso de AAS y heparina en pacientes con SAF obstétrico. Dos revisiones sistemáticas4,5 mostraron que la combinación de AAS y heparina podría reducir la pérdida de embarazos en mujeres con anticuerpos antifosfolípidos (AAF) (NE 1+). En otra revisión sistemática y metaanálsisis6 se propuso que la combinación de heparina no fraccionada (5.000-10.000 unidades cada 12 h) y AAS (81mg), dadas preconcepcionalmente frente a la AAS en monoterapia, fue significativamente más beneficiosa en la tasa de nacidos vivos. No obstante, existen muy pocos estudios y además tienen un nivel menor de calidad de evidencia que valoren la combinación de HBPM y AAS como tratamiento del SAF obstétrico durante la gestación y, por el momento, esta combinación no ha demostrado su claro beneficio para mejorar la tasa de nacidos vivos (NE 1−). Finalmente, la última revisión sistemática7 valoró la tasa de abortos de repetición tanto en pacientes con trombofilia como en pacientes con SAF y no encontró resultados significativos en la combinación de HBPM+AAS vs. AAS sola o placebo en ambos grupos. Sin embargo, para los pacientes con SAF la heparina no fraccionada asociada a AAS fue el mejor tratamiento para reducir las pérdidas fetales (NE 1+).
Un ensayo clínico aleatorizado8 mostró que el tratamiento preventivo con HBPM y AAS presentó mayor tasa de nacimientos que las IGIV en el tratamiento de mujeres con SAF y abortos de repetición (NE 1+). Otro ensayo clínico aleatorizado9 comparó 2dosis de enoxaparina (20mg vs. 40mg) y AAS sin mostrar diferencias entre los grupos (NE 1−). El tercer ensayo10 comparaba HBPM y AAS versus inmunoglobulina intravenosa (IGIV) y evidenció que el tratamiento con HBPM presentó mejor tasa de nacimientos vivos (NE 1-). El cuarto de estos ensayos11 comparó dalteparina y AAS vs. AAS en monoterapia y no halló diferencias en trastornos hipertensivos entre los grupos (NE 1-).
Finalmente, un estudio de cohortes12 mostró que la combinación HBPM y AAS es mejor que la AAS aislada para prevenir abortos y otro segundo estudio de cohortes13 no encontró diferencias entre el uso de AAS solo o combinado con HBPM para evitar complicaciones maternas y fetales, como estados hipertensivos de la gestación, prematuridad, retraso de crecimiento intrauterino o muerte neonatal (NE 2+). También se han identificado otros estudios que evalúan el uso de otros tratamientos preventivos, especialmente las IGIV o glucocorticoides. En cuanto al uso de IGIV en el SAF, los resultados de los diferentes estudios son controvertidos. En un estudio de cohortes14 no se objetivaron diferencias en cuanto al pronóstico del embarazo al añadir IGIV al tratamiento convencional con AAS y HBPM (NE 2+). Por otro lado, en otro estudio de cohortes15 se demostró que el uso de IGIV es mejor que el uso de prednisona y AAS en embarazadas con SAF obstétrico para prevenir el desarrollo de diabetes gestacional y preeclampsia, pero no para mejorar el pronóstico fetal (NE 2−).
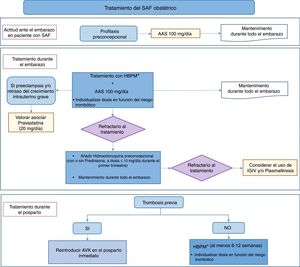
A la vista de todos estos resultados y a pesar de la escasez de estudios y la baja calidad de la evidencia encontrada, el grupo de trabajo considera adecuado recomendar la combinación de HBPM y AAS a dosis profilácticas en todas las pacientes con SAF obstétrico. La AAS se debe iniciar preconcepcionalmente por el posible beneficio y el bajo riesgo de esta actuación profiláctica y la HBPM, tan pronto sea confirmado el embarazo. Tanto la AAS como la HBPM deben mantenerse durante toda la gestación. A pesar de la discordancia en algunos estudios, el uso combinado de HBPM y AAS a dosis bajas, además de incrementar la tasa de nacidos vivos, también puede prevenir otras complicaciones durante el embarazo en pacientes con SAF obstétrico: su efecto es superior a la utilización de tratamiento con AAS en monoterapia. Sin embargo, el grupo de panelistas reconoce que se debe individualizar la dosis de HBPM según el riesgo de cada paciente.
Síndrome antifosfolípido obstétrico refractarioEn pacientes con SAF obstétrico que presentan una nueva complicación obstétrica a pesar del tratamiento convencional, ¿cuál debe ser la actitud terapéutica?
Recomendación: En el SAF obstétrico refractario al tratamiento convencional se recomienda iniciar hidroxicloroquina previamente al embarazo y mantenerla durante toda la gestación, sola o asociada a prednisona o equivalente desde el inicio del embarazo (≤10mg/día durante el primer trimestre) (Recomendación de grado D).
Recomendación: En pacientes que desarrollan complicaciones relacionadas con insuficiencia placentaria (preeclampsia o retraso de crecimiento intrauterino) a pesar del tratamiento convencional se recomienda asociar pravastatina (20mg/día) desde el inicio de la complicación (Recomendación de grado C).
Recomendación: No se recomienda el uso inicial de IGIV y plasmaféresis, si bien podría considerarse en ausencia de respuesta a otros tratamientos (Recomendación de grado √).
El tratamiento convencional del SAF obstétrico es la combinación de aspirina a dosis antiagregante y HBPM a dosis profilácticas5. Sin embargo, entre un 20 y un30% de estas pacientes no consiguen alcanzar el objetivo final de un nacimiento vivo16. Los principales factores de riesgo asociados con el fracaso del tratamiento convencional se relacionan con la historia obstétrica previa y con el perfil de autoanticuerpos, especialmente con la triple positividad de AAF17-19. La identificación de estos factores de riesgo, junto a un mejor conocimiento de los mecanismos de acción de la HBPM y a la utilización de nuevos fármacos, ha hecho que se diseñen nuevas estrategias terapéuticas para el SAF obstétrico refractario20.
La heparina, además de su efecto antitrombótico, tiene un amplio rango de propiedades antiinflamatorias e inmunomoduladoras21. La actitud actual de la mayoría de los expertos es utilizar la aspirina y la heparina a dosis profilácticas de forma mantenida durante todo el embarazo. El inicio de la administración de la heparina puede ser determinante en su eficacia y se debe administrar en los primeros estadios de la gestación. En pacientes con SAF obstétrico se ha observado que, con el ajuste de la dosis profiláctica de heparina por peso de la paciente de forma progresiva durante todo el embarazo, se obtienen mejores resultados comparado con una dosis mantenida22. Sin embargo, en el SAF obstétrico refractario, los estudios que evaluaron la modificación de la dosis de heparina durante el embarazo no han mostrado resultados concluyentes23,24.
La hidroxicloroquina (HCQ) se usa comúnmente en las enfermedades autoinmunes, especialmente en el lupus eritematoso sistémico (LES), para el que se recomienda su uso en el embarazo25. Aunque la información referente a SAF obstétrico es escasa y se limita a estudios retrospectivos, las propiedades antiinflamatorias, inmunorreguladoras y antiagregantes hacen de la HCQ una buena opción terapéutica26. Además, tanto in vitro como en diversos modelos animales, la HCQ es capaz de corregir diversas funciones biológicas alteradas por los AAF27-30. Varios estudios retrospectivos muestran la eficacia de la HCQ asociada a la terapia convencional, tanto en pacientes con SAF obstétrico como en pacientes con SAF obstétrico refractario18,26,31-36. En este sentido, un estudio retrospectivo reciente ha demostrado que el uso de HCQ a dosis de 400mg, especialmente iniciándola de forma preconcepcional, es de utilidad en pacientes con SAF refractario sin episodios trombóticos previos36.
Los glucocorticoides inhiben la vía del complemento y disminuyen el número de células NK, por lo que se ha propuesto su posible efecto beneficioso en pacientes con abortos recurrentes. En un estudio abierto, con un número limitado de pacientes, la prednisona a dosis de 10mg/día durante el primer trimestre del embarazo incrementa significativamente la tasa de nacimientos vivos sin aumento de los efectos secundarios en pacientes con SAF obstétrico refractario37. Recientemente, en un estudio multicéntrico retrospectivo18 en el que se incluyó a 49 pacientes con SAF obstétrico refractario, la asociación de glucocorticoides o HCQ al tratamiento convencional también se asoció a un aumento significativo de nacidos vivos. El efecto beneficioso del tratamiento con glucocorticoides también se mantuvo en el análisis multivariable18.
Las IGIV han sido utilizadas en SAF obstétrico con resultados contradictorios. Algunos estudios no encuentran diferencias significativas entre las pacientes tratadas con IGIV solas o asociadas al tratamiento convencional cuando se comparan con las que solo reciben este último10,38. Otros autores han señalado resultados positivos39. A pesar de los resultados discordantes, consecuentemente el uso de las IGIV estaría reservado a casos seleccionados de pacientes con SAF obstétrico refractario. En el momento actual, no existe acuerdo sobre la duración, frecuencia o las dosis óptimas de las IGIV40.
En el SAF obstétrico con factores de alto riesgo, como trombosis previas, complicaciones graves durante el embarazo y refractariedad al tratamiento convencional, junto a la triple positividad de los AAF, se han utilizado diferentes procedimientos de aféresis como la plasmaféresis o inmunoadsorción41,42. En un estudio reciente25, 14 pacientes embarazadas con SAF de alto riesgo recibieron el tratamiento convencional y se añadieron aféresis e IGIV semanalmente, y se obtuvo un 94% de éxitos. Estos resultados preliminares han sido confirmados recientemente en un estudio retrospectivo que incluía un número más elevado de pacientes con SAF obstétrico refractario36.
El SAF es uno de los principales factores de riesgo para el desarrollo de preeclampsia y esta, a su vez, es una de las principales complicaciones maternas durante el embarazo. Por otra parte, la prematuridad y el retraso del crecimiento intrauterino son las 2principales complicaciones fetales43. Recientemente, en un estudio prospectivo abierto44, se ha descrito el efecto beneficioso de la asociación de pravastatina a dosis de 20mg/d al tratamiento convencional en pacientes con SAF que desarrollaron preeclampsia o retraso del crecimiento intrauterino. En este estudio, la asociación de pravastatina desde el inicio de estas complicaciones mejoró las cifras de presión arterial, aumentó el flujo placentario y, lo que es más importante, obtuvo una tasa de nacidos vivos del 100%.
Posparto¿Cuál debe ser la duración de la profilaxis trombótica en el posparto en pacientes con síndrome antifosfolípido?
Recomendación: En pacientes con SAF trombótico previamente anticoaguladas se debe reintroducir los antagonistas de la vitamina K en el posparto inmediato (Recomendación de grado √).
Recomendación: En mujeres con SAF obstétrico se recomienda después del parto realizar tromboprofilaxis con heparina de bajo peso molecular a dosis profilácticas al menos durante 6 semanas (Recomendación de grado √).
Recomendación: En pacientes con SAF trombótico, que por algún motivo no están no anticoaguladas a largo plazo, se recomienda tromboprofilaxis con heparina de bajo peso molecular, a dosis intermedias e individualizando por riesgo, durante al menos 6-12 semanas después del parto (Recomendación de grado D).
En el campo de la prevención de las complicaciones obstétricas existen diferentes recomendaciones de los expertos, pero no hay consenso. En la población general, la enfermedad tromboembólica venosa aparece en un 0,5-2,2 por 1.000 embarazos (riesgo entre 15 y 35 veces mayor que las mujeres no embarazadas) y puede aparecer tanto durante la gestación como en el puerperio. Aunque el número absoluto es bajo, sigue siendo una de las primeras causas de morbimortalidad en el embarazo y puerperio. En el posparto, el riesgo de trombosis es mayor en las primeras 3-6 semanas, aunque puede persistir hasta la semana 1245,46.
La evidencia sobre este tema es muy escasa. Las recomendaciones publicadas en guías de práctica clínica sobre la presencia de trombofilia adquirida como los AAF carecen de consistencia, al estar basadas en estudios observacionales y en la extrapolación de estudios de mujeres no embarazadas. Una revisión sistemática de Bain et al. también concluyó que no encontraron estudios con suficiente calidad para establecer recomendaciones en el manejo posnatal de la enfermedad tromboembólica45-51.
Teniendo en cuenta esta falta de evidencia, diferentes sociedades científicas y grupos de expertos han realizado las siguientes recomendaciones47-50:
- •
En mujeres con SAF (AAF+tromboembolia venosa previos sin recibir anticoagulación indefinida) recomiendan 6 semanas con dosis intermedias o altas de HBPM o paso a antagonistas de la vitamina K (AVK) (The American Congress of Obstetricians and Gynecologists, ACOG; Societat Catalana d’Obstetrícia i Ginecologia, SCOG; Royal College of Obstetricians and Gynaecologists, RCOG y las American College of Clinical Pharmacy, ACCP).
- •
En mujeres con SAF trombótico ya previamente anticoaguladas, se recomienda el paso a HBPM a dosis terapéuticas durante el embarazo y, tras el parto, reiniciar AVK lo antes posible (ACOG, SOGC, RCOG y ACCP).
- •
En cuanto a la prevención poscesárea, recomiendan realizar tromboprofilaxis al menos 6 semanas si hay antecedentes de trombosis, preeclampsia con retraso de crecimiento intrauterino, comorbilidades como LES, o trombofilia conocida (ACCP).
- •
Los resultados de los distintos estudios identificados no son consistentes, por lo tanto, la eficacia de la intervención no ha sido comprobada con ensayos clínicos aleatorizados y se basan en recomendaciones de expertos, que en la mayoría de los posibles escenarios se decantan por la realización de tromboprofilaxis, al menos 6 semanas.
- •
Es un tema controvertido, pero dada su relevancia clínica, a pesar de que no hay ensayos clínicos ni estudios de calidad, todas las guías recomiendan tromboprofilaxis52-54. Además, siempre se debe tener en cuenta la opinión de la paciente. El grupo de panelistas considera que, dado el alto riesgo trombótico de las mujeres con SAF trombótico o SAF obstétrico durante el puerperio, se debe realizar tromboprofilaxis a dosis profilácticas o intermedias entre 6 y 12 semanas en el periodo posparto (tabla 2 y tabla 3).
Tabla 2.Dosis de heparina de bajo peso molecular profilácticas
Peso (kg) Enoxaparina (Clexane©) mg/día Bemiparina (Hibor©) U/día Tinzaparina (Innhoep©) U/día <50 20 2.500 3.500 50-90 40 3.500 4.500 91-130 60 7.000 131-170 80 9.000 >170 0,6 mg/kg/día 75 U/kg/día Alta profilaxis 40 mg/12 h 4.500 U/12 h Tabla 3.Dosis de heparina de bajo peso molecular intermediasa
Fármaco Dosis Bemiparina (Hibor©) 5.000 U/d sc (75 UI/d sc aprox.) Enoxaparina (Clexane©) 1mg/kg/día Tinzaparina (innohep©) 8.000 UI/d sc
¿Cuál debe ser la actitud terapéutica en mujeres con síndrome antifosfolípido durante las técnicas de reproducción asistida?
Recomendación: En las pacientes con SAF que van a realizar técnicas de reproducción asistida, se recomienda individualizar el riesgo para asociar, como anticoagulante de elección, HBPM en dosis profilácticas o terapéuticas (Recomendación de grado D).
Recomendación: Las pacientes con SAF y anticoagulación oral cambiarán a heparina de bajo peso molecular, a dosis terapéuticas, antes de la estimulación ovárica y la continuarán durante todo el embarazo (Recomendación de grado D).
Recomendación: Para las pacientes con SAF sin anticoagulación crónica se aconseja tratamiento con ácido acetilsalicílico a dosis antiagregantes y heparina de bajo peso molecular, a dosis individualizadas, desde el inicio de la estimulación ovárica y que lo mantengan durante toda la gestación (Recomendación de grado D).
Recomendación: En mujeres con anticuerpos antifosfolípidos con triple positividad o altos niveles de AAF, tanto por riesgo de trombosis como por aparición de complicaciones obstétricas, se recomienda utilizar heparina de bajo peso molecular más ácido acetilsalicílico (Recomendación de grado D).
Recomendación: Se recomienda evitar el síndrome de hiperestimulación ovárica, que es un factor de riesgo de trombosis secundario a las técnicas de reproducción asistida, mediante el uso de protocolos hormonales de bajo riesgo de esta complicación (Recomendación de grado D).
El incremento de las concentraciones séricas de estrógenos durante la estimulación ovárica o inducción de la ovulación al realizar TRA produce cambios en la coagulación que inducen un estado de hipercoagulabilidad. Debido a estos cambios, el riesgo de trombosis durante las TRA está discretamente incrementado en la población general, pero este riesgo es mayor en pacientes con trombofilias congénitas o adquiridas55. Existe evidencia científica que avala la seguridad y eficacia de las TRA en las pacientes con SAF siempre que se administre una pauta antitrombótica adecuada56-60. Aunque establecer recomendaciones fijas sobre el tratamiento antitrombótico más adecuado durante las TRA en pacientes con SAF es complejo, la evidencia científica actual permite establecer recomendaciones antitrombóticas que deben individualizarse.
No existen suficientes estudios que permitan conocer con un alto nivel de calidad metodológica la prevalencia de trombosis y la importancia del tratamiento preventivo de trombosis durante las TRA en pacientes con SAF o portadoras de AAF56. Solamente se han encontrado publicadas algunas series de casos57-60(NE 3). Las recomendaciones actuales se basan en los resultados de estos estudios y en las recomendaciones formuladas en guías de práctica clínica de diferentes sociedades científicas26,49,61(NE 3 y 4). Así, en general, se aconseja el mismo tratamiento que en las pacientes gestantes, como profilaxis de trombosis y de complicaciones obstétricas26,49,61-63(NE 3 y 4). La duración y la dosis de la tromboprofilaxis durante y después de las TRA tampoco es bien conocida, aunque son similares a otros procedimientos quirúrgicos de bajo riesgo de sangrado64,65(NE 4). En cuanto al tratamiento anticoagulante durante la punción folicular, los expertos concluyen que la HBPM debe suspenderse al menos 12 h antes de realizarla y se reiniciará a partir de las 6-12 h tras la punción, para reducir el riesgo de sangrado56-60(NE 4).
Como las diferentes guías de práctica clínica publicadas recientemente son concordantes y recomiendan el mismo tratamiento tromboprofiláctico, el grupo elaborador de este documento reconoce que estas recomendaciones son de aplicación directa a nuestro sistema sanitario y son generalizables a todas las TRA. Así, aunque la evidencia científica es baja, y a pesar del riesgo de hemorragia, se recomienda instaurar el tratamiento antitrombótico en las pacientes con SAF o portadoras de AAF que van a realizar TRA. No obstante, no se recomienda determinar AAF a todas las pacientes que van a realizar TRA56.
Después del embarazo y puerperioEn pacientes con síndrome antifosfolípido obstétrico sin manifestaciones trombóticas, ¿se debe realizar seguimiento fuera del periodo de embarazo?
Recomendación: En las pacientes con SAF obstétrico aislado se recomienda realizar seguimiento después del embarazo y puerperio debido a que tienen un riesgo trombótico más elevado que la población general (Recomendación de grado C).
Recomendación: En dicho seguimiento se recomienda individualizar el riesgo cardiovascular (identificar la presencia de hipertensión arterial, diabetes mellitus, sedentarismo, obesidad, hábito tabáquico, dislipidemias, etc.) e informar, eliminar o controlar los factores de riesgo cardiovascular existentes (Recomendación de grado B).
Recomendación: Durante el seguimiento conviene individualizar el consejo sobre el uso de ácido acetilsalicílico a dosis bajas como profilaxis antitrombótica primaria. No hay pruebas concluyentes sobre si debe administrarse solo a las pacientes de mayor riesgo trombótico (aquellas con positividad del anticoagulante lúpico o pacientes con triple positividad de anticuerpos) (Recomendación de grado B).
Recomendación: Se recomienda el uso de heparina de bajo peso molecular subcutánea en situaciones de alto riesgo de trombosis venosa (Recomendación de grado √).
Existe evidencia científica clara sobre la conducta adecuada en los pacientes con SAF trombótico (trombosis como manifestación única de SAF o acompañado del antecedente de complicaciones obstétricas), pero en la actualidad sigue habiendo pocos estudios que valoren la conducta a largo plazo en pacientes con SAF obstétrico puro sin antecedente de trombosis previas. Se requiere conocer el riesgo trombótico de estas pacientes y valorar e individualizar el uso de profilaxis antitrombótica.
Diferentes estudios prospectivos y retrospectivos de cohortes y series de casos43,66-71 señalan un incremento del riesgo trombótico en el seguimiento a largo plazo en pacientes con antecedente de SAF obstétrico sin trombosis previas (NE 4). La mayoría de estos estudios o bien no aportan suficientes datos sobre el uso de AAS a dosis bajas o pautan a todas las pacientes dicho tratamiento, por lo que no ayudan a conocer el papel protector de este como profilaxis primaria antitrombótica. Existen 2estudios retrospectivos caso-control54,72 que incluyen pacientes con SAF y abortos de repetición o pérdidas gestacionales que también muestran un aumento del riesgo trombótico en este subgrupo de pacientes con SAF obstétrico (NE 3b). Todos los estudios concluyen en la necesidad de realizar un seguimiento e informar a estas pacientes del riesgo trombótico y de la importancia de controlar los factores de riesgo cardiovascular asociados.
La prevención primaria de trombosis a largo plazo con AAS a dosis bajas en todas las pacientes con SAF obstétrico aislado es controvertida. No existen estudios aleatorizados que aclaren el beneficio del tratamiento con AAS a dosis bajas en todas estas pacientes ni se dispone de estudios que estratifiquen e individualicen el riesgo trombótico de estas pacientes. La recomendación actual de tratamiento se basa en los resultados de un reciente metaanálisis que evaluó a pacientes portadores de AAF sin trombosis previas y subanalizó el grupo de pacientes con SAF obstétrico aislado73. Dicho estudió mostró un efecto protector del AAS a dosis bajas en las pacientes con SAF obstétrico aislado, en pacientes asintomáticos portadores de AAF y en pacientes con LES (NE 3). Como consecuencia, los autores concluyen que durante el seguimiento se debería aconsejar el uso de AAS a dosis bajas como profilaxis antitrombótica primaria en las pacientes con SAF obstétrico aislado. No obstante, el análisis individualizado de estas pacientes según el riesgo cardiovascular, el perfil de positividad de AAF y el tratamiento con HCQ, publicado posteriormente por el mismo grupo, no halló efecto protector en las pacientes con SAF obstétrico aislado74(NE 3). Probablemente, según los autores, la ausencia de relación se debía al número limitado de pacientes con SAF obstétrico aislado incluido en este último metaanálisis. Por todo ello, y debido al riesgo hemorrágico del tratamiento con AAS a dosis bajas, no está claro el beneficio de administrar dosis bajas de AAS a todas las pacientes con SAF obstétrico sin antecedente de trombosis. Las conclusiones obtenidas son administrarlo en pacientes seleccionadas de alto riesgo, como se hace en individuos sanos portadores de AAF y, durante el seguimiento, individualizar el riesgo trombótico, detectar y tratar los factores de riesgo cardiovascular asociados en estas pacientes e informar sobre su riesgo trombótico, así como usar HBPM profiláctica en situaciones de alto riesgo trombótico75-78(NE 4).
Los resultados de los distintos estudios identificados son consistentes, ya que todos señalan un incremento del riesgo trombótico en este subgrupo de población y ponen énfasis en la necesidad de estratificar el riesgo trombótico (según su perfil de anticuerpos, factores de riesgo cardiovascular asociados o la presencia de otras enfermedades autoinmunes) y detectar y controlar los factores de riesgo cardiovascular. Todos los estudios indican la necesidad de administrar AAS a dosis bajas en las pacientes seleccionadas de mayor riesgo trombótico y no dejan claro el beneficio de administrar dicho tratamiento a todas las pacientes sin individualizar el riesgo.
Dado que el número de pacientes con SAF obstétrico aislado no es despreciable y debido a que los diferentes estudios, a pesar de sus limitaciones, muestran un aumento de riesgo trombótico en este subgrupo de población, el grupo elaborador considera que debe realizarse un seguimiento y asesoramiento de estas pacientes. El seguimiento, el control de los factores de riesgo cardiovascular y la prevención primaria de trombosis con AAS a dosis bajas, al menos en el subgrupo de pacientes de alto riesgo trombótico, tienen un beneficio claro frente a no realizar ninguna de estas intervenciones.
Situaciones especialesTrasplante de órgano sólidoEn pacientes con síndrome antifosfolípido que precisen un trasplante de órgano sólido, ¿cuál debe ser la actitud terapéutica?
Recomendación: Se recomienda un control riguroso de la anticoagulación antes y después de un trasplante de órgano sólido, especialmente en caso de trasplante renal (Recomendación de grado √).
Recomendación: Se recomienda el despistaje rutinario de anticuerpos antifosfolípidos antes del trasplante de órgano sólido en todos los pacientes con antecedentes de eventos tromboembólicos (Recomendación de grado √).
El origen de la trombosis en los pacientes que precisan un trasplante de órgano sólido es multifactorial, sea cual sea la localización del trasplante. La propia cirugía, la enfermedad de base que indica el trasplante y la inmovilización prolongada que ambas situaciones conllevan son factores de riesgo de trombosis. En especial, la insuficiencia renal terminal, la diálisis y los accesos vasculares permanentes constituyen factores de riesgo de trombosis, siempre en el caso del trasplante renal, pero también en el trasplante de otros órganos sólidos. Además, los pacientes con SAF o con AAF que precisan trasplante presentan un riesgo adicional de pérdida del injerto por trombosis sistémica, trombosis del injerto o trombosis de la anastomosis vascular79-84. El riesgo es mayor en pacientes con SAF y trasplante renal85-95, aunque no hay metaanálisis ni estudios controlados. Cuatro estudios retrospectivos que suman 2.918 trasplantes renales coinciden en que la detección de AAF en el momento del trasplante se asocia con mayor número de complicaciones y más pérdidas del injerto, tanto en pacientes con LES como en pacientes con otras enfermedades86,87,90,92. En un estudio retrospectivo de 178 trasplantes renales sin LES, Ducloux et al.87 encuentran trombosis venosas postrasplante en el 18% de los pacientes con AAF y en el 6,2% de los pacientes sin dichos anticuerpos, respectivamente (p<0,001). Las trombosis arteriales postrasplante también son más frecuentes en pacientes con AAF (8 versus 2,3%, respectivamente; p <0,001). En 85 pacientes con LES, Stone et al.92 encuentran manifestaciones de SAF en 15 de 25 trasplantes renales con AAF y en 5 de 60 trasplantes renales sin dichos anticuerpos (p <0,0001).
Cuatro estudios prospectivos que suman 2.215 trasplantes renales encuentran más complicaciones en los pacientes con SAF o con AAF88,89,94,95. En cuanto a la evolución del riñón trasplantado, los datos son contradictorios. Wagenknecht et al.95 encuentran más AAF en el grupo con pérdida del injerto que en el grupo con trasplante funcionante (57 versus 35%; p = 0,02). Forman et al.89 no relacionan los anticuerpos anticardiolipina con la pérdida del injerto. Fernández-Fresnedo et al.88, en un estudio prospectivo de 197 trasplantes renales, la detección de AAF antes del trasplante (27%) no se asocia con mayor riesgo de complicaciones postrasplante. Sin embargo, el 15,7% de los pacientes con AAF de novo después del trasplante sí presentan un aumento significativo de rechazo agudo del injerto.
En el caso de los trasplantes hepático y cardiaco, tampoco existen metaanálisis ni estudios controlados que evalúen el riesgo de complicaciones en pacientes con SAF o AAF. Un estudio retrospectivo de 35 pacientes con trasplante hepático83 encuentra anticuerpos anticardiolipina en los 7 pacientes con trombosis de la arteria hepática y en 15 de los 28 trasplantes sin trombosis (53,5%), pero otros estudios no confirman estos hallazgos. Dos estudios prospectivos que incluyen 45 pacientes96,97 y 2retrospectivos con 299 pacientes98,99 no encuentran mayor riesgo de trombosis después del trasplante hepático.
A pesar del riesgo de sangrado100,101, hay acuerdo entre los expertos en recomendar un control riguroso de la anticoagulación antes y después del trasplante94,100. Si bien es cierto que se prefiere utilizar HBPM o heparina no fraccionada por su menor vida media102, los resultados son similares con anticoagulantes orales93.
Por último, dado el aumento del riesgo de trombosis y que la trombosis fulminante intra- o postrasplante puede constituir la primera manifestación de un SAF catastrófico o de un SAF no diagnosticado81,103, algunos expertos recomiendan un despistaje rutinario en todos los pacientes antes del trasplante renal91. Otros solo lo recomiendan en pacientes con antecedentes de trombosis arterial o venosa86,101.
Anticuerpos antifosfolípidos y neoplasiasEn pacientes con anticuerpos antifosfolípidos y neoplasias, ¿cuál debe ser la actitud terapéutica?
Recomendación: Se recomienda realizar tromboprofilaxis con heparina de bajo peso molecular en pacientes con perfil serológico de alto riesgo y neoplasias, especialmente en aquellas situaciones de aumento de riesgo tromboembólico (cirugía, implantación de catéter, inicio de quimioterapia) (Recomendación de grado √).
Los pacientes con tumores, tanto sólidos como hematológicos, tienen mayor prevalencia de AAF que los controles104,105. Cuando se evalúa si existe una mayor incidencia de las manifestaciones tromboembólicas en estos pacientes, los resultados son contradictorios. Hay estudios que encuentran un aumento de trombosis en los pacientes que tienen AAF106, otros no encuentran esta asociación107,108.
La mayor incidencia de trombosis se ha descrito en tumores sólidos y en relación con AAF de isotipos IgG o IgA109,110 y anticuerpos dirigidos contra el dominio I de la aβ2GPI111. Aunque la presencia de AAF puede contribuir a un aumento de riesgo de trombosis en pacientes con malignidad112, no parece claro que los niveles de los AAF contribuyan en el mecanismo de la producción de trombosis en estos pacientes. Por el contrario, determinadas neoplasias como son las hematológicas o las linfoproliferativas pueden tener efecto en la producción de AAF, pero predominan los isotipos IgM, sin tener más riesgo de producir trombosis108. También es conocido que los niveles de AAF pueden ir disminuyendo, incluso desaparecer, después de la instauración del tratamiento quimioterápico113. Por lo tanto, en estos pacientes los expertos coinciden en que es importante la tromboprofilaxis con HBPM, sobre todo en situaciones de riesgo de tromboembolia (reposo prolongado, intervenciones quirúrgicas o la implantación de un catéter). Algunos estudios concluyen que la instauración de determinados tratamientos quimioterápicos tienen más riesgo de producir trombosis114,115. Basándose en esto, los expertos entienden que sería recomendable la utilización de tromboprofilaxis primaria y que, además, en estos pacientes en los que han disminuido o desaparecido los niveles de AAF, se podría plantear la sustitución de anticoagulación por antiagregación.
El seguimiento de individuos sanos con AAF mostró un aumento de incidencia de tumores linfoproliferativos, concretamente con linfoma no Hodgkin, respecto a la población general. Los autores concluyeron que la presencia de AAF puede ser un factor de riesgo para padecer neoplasias hematológicas y que debería ser tenido en cuenta en la evaluación inicial de pacientes de mayor edad, con títulos altos de AAF y ante la presencia de trombosis sin causa conocida116. Otros estudios encuentran neoplasias hematológicas en un 26% de los pacientes con AAF113, con un riesgo 2,6 veces mayor de presentar este tipo de neoplasia117. Además, la neoplasia es una de las principales causas de muerte en estos pacientes43. En un estudio retrospectivo, se comparó en pacientes con neoplasia sólida la presencia de AAF con o sin manifestaciones tromboembólicas y con un grupo control. Encontraron un 8% de AAF en los pacientes con trombosis frente al 1,4 sin trombosis; solo en 4 pacientes se mantuvo la positividad de AAF; en los pacientes con trombosis y AAF no hubo diferencias en las características demográficas, ni en el patrón clínico ni en el pronóstico cuando se compararon con los pacientes con trombosis sin AAF. Ante estos resultados, junto con la baja titularidad y transitoriedad de los AAF, los autores concluyeron la ausencia del papel patogénico de los AAF en la trombosis en pacientes con cáncer sólido y trombosis118.
Suspensión temporal de la anticoagulaciónEn caso de necesidad de suspensión temporal de la anticoagulación en pacientes con síndrome antifosfolípido, ¿cuál debe ser la actitud terapéutica?
Recomendación: Se recomienda suspender la anticoagulación en caso de procedimientos invasivos con moderado o alto riesgo hemorrágico y realizar terapia puente (Recomendación de grado D).
Recomendación: Como terapia puente se recomienda utilizar heparina de bajo peso molecular a dosis individualizadas ajustadas por peso y función renal y suspenderla al menos 24 h antes del procedimiento invasivo (Recomendación de grado D).
Recomendación. En pacientes embarazadas con SAF que utilizan heparina de bajo peso molecular a dosis terapéuticas o intermedias, se recomienda suspenderla al menos 24 h antes del parto u otros procedimientos. Durante el parto, no es necesario suspender el tratamiento en las pacientes que están utilizando ácido acetilsalicílico a dosis de 100mg (Recomendación de grado D).
Es escasa la evidencia sobre cómo suspender la anticoagulación en pacientes con SAF o presencia de AAF. Teniendo en cuenta que el 10% de los pacientes anticoagulados (con o sin SAF) van a ser intervenidos en un año, el manejo del perioperatorio en estos pacientes que pueden ser de alto riesgo trombótico es de vital importancia119.
El estudio BRIDGE, que solo incluía pacientes con arritmia anticoagulados, no encontró diferencias significativas en el riesgo trombótico entre los pacientes que llevaron terapia puente y los que no, pero sí se observó un aumento del riesgo hemorrágico comparado con los que no realizaron terapia puente, tanto del sangrado total (13,1 frente a 3,4%), como del sangrado mayor (4,2 frente a 0,9%)119. Los diferentes metaanálisis han mostrado resultados similares120,121.
Otros ensayos clínicos incluyen pacientes muy heterogéneos o el tamaño muestral de pacientes con SAF es insuficiente120-122, lo que dificulta establecer recomendaciones. Así las recomendaciones encontradas en la literatura se basan, principalmente, en las guías del ACCP (2012), en las que se distingue en función del riesgo trombótico del paciente y del riesgo hemorrágico de la intervención o procedimiento119,123.
Posteriormente, extrapolando los datos del estudio BRIDGE, grupos de expertos han elaborado nuevas recomendaciones para pacientes con riesgo trombótico bajo o intermedio, como sería la presencia de trombofilia adquirida124. Así, se concluye lo siguiente: 1) en los pacientes con SAF (alto riesgo trombótico o trombosis venosa reciente <3 meses) pueden darse 2situaciones: a) si el riesgo hemorrágico es moderado o alto, se debe suspender el AVK al menos 3 o 4 días antes e iniciar heparina a dosis intermedias y reiniciar la anticoagulación lo antes posible con HBPM a dosis intermedias o terapéuticas si el paciente no tiene riesgo de sangrado; b) si el riesgo hemorrágico es bajo, no se debe suspender el AVK. 2) si el paciente es de riesgo trombótico intermedio (como la presencia de AAF o una trombosis venosa los 3 meses anteriores), si el riesgo hemorrágico es intermedio o alto, se debe suspender el AVK al menos 3 o 4 días antes e iniciar HBPM a dosis profilácticas, y mantener hasta poder reiniciar AVK, solapando ambos tratamientos durante al menos 4 días; si el riesgo hemorrágico es bajo, se recomienda no suspender AVK.
Por lo que respecta a los anticoagulantes orales de acción directa (ACOD), las recomendaciones vienen de registros internacionales, o de estudios pivotales. En general, los expertos no recomiendan utilizar HBPM, desde que se suspende el anticoagulante oral de acción directa, al menos 72, 48 o 24 h antes del procedimiento (se basan en la función renal del paciente para suspender antes) y si la duración del postoperatorio o la situación del paciente no permite reiniciar dicho anticoagulante, se recomienda iniciar HBPM a dosis profilácticas y manejarlo en función de la evolución del paciente124,125.
Grupos de expertos internacionales recomiendan, en mujeres con SAF obstétrico embarazadas, que están con HBPM a dosis terapéuticas o intermedias, suspender el tratamiento al menos 24 h antes del procedimiento. En el caso de que utilicen AAS, la terapia se puede mantener y reiniciar la HBPM a dosis adecuadas en menos de 24-48 h123.
El grupo de panelistas considera que los resultados del ensayo BRIDGE y de los metaanálisis son consistentes con respecto al alto riesgo hemorrágico de la terapia puente en general, y que en los casos de bajo riesgo se recomienda no utilizar HBPM; pero existe poca evidencia con respecto a los pacientes con alto riesgo de trombosis como los pacientes con SAF. Por ello, el grupo de panelistas ha tenido en cuenta las recomendaciones de otros grupos de expertos y ha decidido recomendar, en pacientes con SAF, una terapia puente que sea un balance entre el riesgo/beneficio de trombosis, pero minimizando el riesgo de sangrado de la cirugía.
Además, como en muchos pacientes con SAF existe un alto riesgo de recurrencia en el periodo de suspensión de la anticoagulación, el grupo de panelistas considera que en estos pacientes se debe evaluar el riesgo hemorrágico de la intervención y establecer terapias puente adaptadas a este riesgo, de manera personalizada.
Síndrome antifosfolípido catastróficoEn un paciente con síndrome antifosfolípido catastrófico, ¿cuál debe ser la actitud terapéutica?
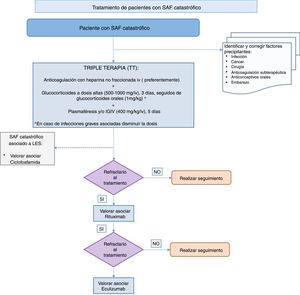
Recomendación: En un paciente con SAF catastrófico el tratamiento inicial debe incluir la denominada triple terapia, que comprende: anticoagulación, preferentemente con heparina no fraccionada intravenosa, asociada a glucocorticoides a dosis altas, plasmaféresis o inmunoglobulinas intravenosas (Recomendación de grado D).
Recomendación: En los casos refractarios a la triple terapia se puede considerar asociar rituximab o eculizumab (Recomendación de grado D).
Debido a que la prevalencia del SAF catastrófico es muy baja (<1% de todos los casos del SAF), toda la información más relevante disponible sobre esta rara pero grave situación clínica proviene de los datos del registro internacional de SAF catastrófico y que, según las cifras actualizadas, incluye información de aproximadamente 500 pacientes126.
Aunque la mortalidad del SAF catastrófico ha disminuido en los últimos años, continúa siendo muy alta (actualmente es del 63%)127. La mejoría en el pronóstico del SAF catastrófico puede haber sido debida a factores como: un reconocimiento más precoz, la corrección y tratamiento de los factores precipitantes (por ejemplo, la infección) y, como consecuencia de todo ello, la instauración del tratamiento más rápidamente128.
El diagnóstico del SAF catastrófico se realiza basándose en los criterios de clasificación actualizados en 2005129 (ver tabla 2 de la parte I). Al ser una entidad poco frecuente, los expertos coinciden en sospechar de un SAF catastrófico, sobre todo en aquellos pacientes con aparición rápida de trombosis en varios órganos junto a la presencia de AAF. También como clave del diagnóstico diferencial, los estudios destacan la exclusión de otras enfermedades que afectan fundamentalmente a la microcirculación, como son la anemia hemolítica microangiopática o la púrpura trombopénica trombótica130; así como la eclampsia, la preeclampsia o el síndrome HELLP (hemólisis, elevación de enzimas hepáticas y trombocitopenia) en las pacientes embarazadas131. Por último, y debido a que en las 2/3 partes de los pacientes con SAF catastrófico hay algún factor precipitante, se incide en la identificación de estos factores, ya que su tratamiento o corrección puede mejorar la evolución del SAF catastrófico127. Entre estos factores se incluyen especialmente las infecciones (47%), el cáncer (18%), la cirugía (17%), la anticoagulación subterapéutica (11%), los anticonceptivos orales (7%) y el embarazo129,131.
La evidencia encontrada al respecto del tratamiento del SAF catastrófico se limita a estudios de series de casos y de consenso de expertos.
La anticoagulación es considerada el tratamiento fundamental del SAF catastrófico. La evidencia proviene del análisis de 280 pacientes con SAF catastrófico, de los cuales 244 recibieron cualquier tipo de anticoagulación, frente a 36 pacientes que no la recibieron. La supervivencia fue significativamente mayor en los pacientes anticoagulados (63 vs. 22%; p <0,0001)129. Aunque no existen estudios para determinar el tipo de anticoagulación específica, los autores concluyen en la utilización de la heparina no fraccionada debido sobre todo a la reversibilidad de su efecto y a la preferencia de la vía intravenosa en pacientes más críticos128.
No hay estudios prospectivos ni tampoco datos claramente significativos de la utilización de los glucocorticoides en el SAF catastrófico. La mayoría de los expertos recomiendan su uso para disminuir la respuesta inflamatoria tan intensa que se produce en el SAF catastrófico128. En la mayor parte de los casos descritos en la literatura se ha utilizado la combinación de anticoagulación y glucocorticoides126,128. Cuando se ha analizado de forma específica el impacto de los glucocorticoides en el pronóstico del SAF catastrófico no se han encontrado diferencias significativas132. Sin embargo, un gran número de los pacientes incluidos en el registro internacional de SAF catastrófico y en los casos aislados publicados eran tratados con esta combinación. Por esto, los grupos de expertos recomiendan siempre junto a la anticoagulación la utilización de glucocorticoides a dosis altas en bolos intravenosos (500-1.000mg/iv/3 días) seguidos de glucocorticoides por vía oral (1mg/kg)128. En el caso de infecciones graves asociadas, se debería considerar la utilización de dosis más moderadas de glucocorticoides.
Debido al papel beneficioso de la plasmaféresis en pacientes con diferentes tipos de microangiopatía trombótica, así como el mecanismo patogénico aceptado que tienen los AAF133, la plasmaféresis también ha sido propuesta como potencial tratamiento asociado a la anticoagulación y a los glucocorticoides en los pacientes con SAF catastrófico134. En un estudio en el que 18 pacientes fueron tratados con triple terapia frente a 19 pacientes que solo se trataron con anticoagulación y glucocorticoides, se mostró una mayor supervivencia (77,8 vs. 55,4%; p=0,083) en los que recibieron triple terapia135.
Con relación a las IGIV asociadas a la anticoagulación y los glucocorticoides, los estudios muestran que los pacientes que recibieron esta combinación tuvieron mayor supervivencia frente a los que no las recibieron128. Sin embargo, en la mayoría de los pacientes las IGVI se han utilizado de forma conjunta con la plasmaféresis y también se ha visto mayor supervivencia con la combinación. Aunque no hay una dosis estandarizada definitiva131, se utiliza la pauta de 0,4 g/kg durante 5 días128. Hay autores que recomiendan administrar la IGIV después de la plasmaféresis; sin embargo, otros expertos lo hacen coincidir con la plasmaféresis, suplementando al día siguiente 200mg/kg, para compensar las inmunoglobulinas que se han podido retirar durante la plasmaféresis.
En un último análisis del registro internacional de SAF catastrófico (registro CAPS)136, se evaluó la relación de la triple terapia con la mortalidad en estos pacientes. La triple terapia se asoció con una mayor supervivencia cuando se comparó con el grupo que no recibía el mismo tratamiento (OR ajustado 7,7; IC 95%: 2,0-29,7) o de otras combinaciones de tratamiento incluidas en la triple terapia (OR ajustado 6,8; IC 95%: 1,7-26,9). La triple terapia dio lugar a una reducción del 47,1% de la mortalidad comparada con el grupo que no la recibía y del 34,4% cuando fue comparada con cualquier otra combinación de tratamientos. Los autores concluyeron que la triple terapia se asocia de forma independiente a una mayor tasa de supervivencia en pacientes con SAF catastrófico136. Por tanto, la actitud terapéutica actual de los expertos, ante el SAF catastrófico, es la utilización de la triple terapia: anticoagulación, glucocorticoides, recambios plasmáticos o IGIV.
En la revisión del registro internacional de SAF catastrófico137, se han analizado los pacientes que han estado en tratamiento con rituximab. Se identificó a 20 pacientes en tratamiento con rituximab, en 8 de ellos como primera línea de tratamiento, y en el resto el rituximab fue administrado como terapia de rescate. En 15 de los 20 pacientes se describió una respuesta adecuada a rituximab.
El eculizumab es un anticuerpo monoclonal humanizado que inhibe la activación de la fracción C5 del complemento, y que está indicado en el síndrome urémico-hemolítico atípico y en la hemoglobinuria paroxística nocturna138. Como la activación del complemento ha sido considerada un factor clave en modelos animales de SAF139, el eculizumab ha sido utilizado en casos aislados graves de SAF catastrófico140. Teniendo en cuenta que el eculizumab solo se ha utilizado en un número muy reducido de pacientes con SAF catastrófico, a la espera de ensayos clínicos bien diseñados, los autores concluyen que el eculizumab podría utilizarse en situaciones de SAF catastrófico refractario a la triple terapia139,140.
Algunos autores recomiendan utilizar ciclofosfamida en el SAF catastrófico asociado a LES. En un estudio se compararon las características demográficas, clínicas y de laboratorio de 103 pacientes con LES y SAF catastrófico asociado frente a 127 pacientes solo con SAF catastrófico primario141. En el 47% de los pacientes LES-SAF a los que se les administró la ciclofosfamida disminuyó significativamente la mortalidad (odds ratio=0,20; 0,006-0,71; p=0,013). Los pacientes con SAF catastrófico sin LES asociado presentaron un incremento de la mortalidad (odds ratio=8,5; 1,91-37,83), aunque estos pacientes eran más graves y con mayor número de órganos afectados.
ConclusionesSe presenta el primer consenso oficial de la SER sobre el diagnóstico y tratamiento del SAF primario. Tras una exhaustiva revisión de la evidencia científica y al no existir muchos estudios de alta calidad, las recomendaciones se han basado fundamentalmente en revisiones sistemáticas, estudios de cohortes y de casos y controles, y en la opinión de expertos.
Se han elaborado 25 recomendaciones para las áreas de tratamiento del SAF obstétrico y situaciones especiales, como el SAF catastrófico. A partir de las recomendaciones se han elaborado algoritmos de manejo que presentan de forma resumida la aproximación al tratamiento del SAF (figs. 1 y 2).
En cuanto al tratamiento en el SAF obstétrico, basándose en la evidencia científica que hay actualmente, se recomienda el uso preconcepcional de dosis antiagregantes de AAS y HBPM desde del inicio del embarazo. Este tratamiento se mantendrá durante toda la gestación. La heparina debe continuarse después del parto entre 6 y 12 semanas, dependiendo del riesgo trombótico de cada paciente. En los casos de aparición de nuevas complicaciones obstétricas a pesar del tratamiento estándar, el panel de expertos recomienda añadir HQC, sola o asociada a prednisona a dosis bajas. En pacientes que a pesar del tratamiento estándar desarrollen preeclampsia o CIR graves, puede considerarse asociar pravastatina (a dosis 20mg) al tratamiento convencional. La utilización de IGIV y plasmaféresis en el SAF obstétrico sigue siendo una opción terapéutica muy controvertida, pero, no obstante, el panel de expertos la considera como una última opción en ausencia de respuesta a los otros tratamientos.
En pacientes con SAF obstétrico sin trombosis, después del embarazo existe mayor riesgo de eventos trombóticos que en la población general, por lo que el panel de expertos recomienda el seguimiento y corregir los factores de riesgo cardiovascular. En aquellas pacientes consideradas de mayor riesgo trombótico se debe considerar asociar profilaxis con dosis antiagregantes de AAS.
Como novedoso de estas recomendaciones, se ha revisado la evidencia existente sobre la actitud terapéutica para mujeres con SAF durante las TRA. No existen suficientes estudios de calidad que permitan establecer unas normas terapéuticas en esta situación. Basándose sobre todo en estudios de series de casos y en las recomendaciones de las guías de práctica clínica existentes, el panel de expertos recomienda evitar el síndrome de hiperestimulación ovárica mediante el uso de protocolos hormonales de bajo riesgo de esta complicación. También, durante la técnica de reproducción de forma individualizada, se recomienda la misma profilaxis de trombosis y complicaciones obstétricas (AAS a dosis bajas asociada a dosis profilácticas o terapéuticas de HPBM) que para la mujer gestante con SAF.
Finalmente, el panel de expertos ha realizado recomendaciones en lo que ha denominado como situaciones especiales. En los pacientes con SAF y que necesiten trasplante de órgano sólido se recomienda un control riguroso de la anticoagulación antes y después del trasplante, sobre todo renal. En situaciones de procedimientos invasivos de moderado y alto riesgo de sangrado, se recomienda suspender la anticoagulación y realizar un control riguroso de la terapia puente con heparina. Por último, en el SAF catastrófico, una situación de especial gravedad clínica, el panel de expertos, basándose fundamentalmente en los resultados del registro de pacientes con SAF catastrófico, recomienda junto a la pronta identificación y corrección de los factores precipitantes, iniciar la denominada triple terapia consistente, en heparina no fraccionada a dosis terapéutica, asociada a corticoides, plasmaféresis e IGIV.
Después de la exhaustiva revisión del diagnóstico y tratamiento del SAF, es evidente que se necesitan ensayos multicéntricos bien diseñados en los que se estratifique a los pacientes no solo de acuerdo con las diferentes manifestaciones clínicas sino también de acuerdo con el perfil serológico y la presencia de comorbilidades y que permitan determinar cuál es la mejor opción terapéutica en cada situación clínica. También son necesarios más estudios que proporcionen un conocimiento más profundo de la patogenia de la enfermedad, así como nuevos estudios que permitan aclarar el papel de los AAF no incluidos en los criterios de clasificación y su posible utilidad en pacientes con sospecha de SAF, pero que no cumplen los criterios vigentes en este momento.
Estas recomendaciones derivan de los datos disponibles en la actualidad y deben ser consideradas como una ayuda a la toma de decisiones del clínico directamente implicado en el cuidado del paciente con SAF. Las recomendaciones se consideran herramientas en la toma de decisiones para los clínicos, pero hay que tener en consideración tanto la decisión del médico experto en SAF como la opinión compartida con el paciente.
Agenda de investigaciónDespués de la revisión sistemática sobre la evidencia científica existente para el manejo del SAF primario, realizada para la elaboración de estas recomendaciones, el panel de expertos considera que quedan múltiples aspectos por incluir en la futura agenda de investigación. Entre otros se pueden mencionar los siguientes:
SAF obstétrico:
- -
Se necesitan más ensayos clínicos aleatorizados, con calidad metodológica, para investigar la eficacia de la HBPM y el AAS a dosis bajas como tratamiento en el SAF obstétrico en sus diferentes variantes, así como el uso de otros tratamientos aislados o combinados.
- -
Se constata la necesidad de realizar estudios, bien diseñados y a largo plazo, sobre el seguimiento y manejo individualizado de las pacientes con SAF obstétrico tras el embarazo.
- -
Son necesarios estudios de calidad sobre la necesidad de administrar profilaxis antitrombótica a las pacientes con SAF que van a realizar técnicas de reproducción asistida.
SAF obstétrico refractario:
- -
Se deben desarrollar nuevas herramientas o scores que permitan identificar a aquellos pacientes con SAF obstétrico que presenten un alto riesgo de recurrencia.
- -
Es necesario diseñar estudios prospectivos multicéntricos que permitan determinar cuál es el papel de la HCQ o de la prednisona en el tratamiento del SAF obstétrico refractario.
SAF recurrente:
- -
Se necesitan estudios prospectivos multicéntricos que permitan determinar el papel de la HCQ en la prevención de recurrencia trombótica en pacientes de alto riesgo.
- -
Es necesario diseñar estudios prospectivos multicéntricos que permitan determinar el papel del rituximab en la prevención de recurrencia trombótica en pacientes de alto riesgo.
SAF catastrófico:
- -
Hay que desarrollar nuevas herramientas o scores que permitan identificar a aquellos individuos con SAF en alto riesgo de desarrollar un SAF catastrófico.
- -
Son necesarios más estudios prospectivos multicéntricos que permitan determinar el papel de la terapia biológica en pacientes con SAF catastrófico refractario a la triple terapia.
Fundación Española de Reumatología.
Conflicto de interesesRafael Cáliz Cáliz ha recibido financiación de Abbvie, Pfizer, Roche, Novartis, MSD, UCB y GSK para la asistencia a cursos/congresos y ha recibido honorarios de la SER en concepto de ponencias y redacción de capítulos de libros.
Víctor Manuel Martínez Taboada ha recibido financiación de Abbvie, Menarini y Pfizer para la asistencia a cursos/congresos; honorarios de Abbvie, MSD, Novartis, BMS y Roche en concepto de ponencias; financiación de Servier por participar en una investigación; ayuda económica de Roche para la financiación de un proyecto de investigación independiente y ayuda económica de Servier y Hospira en concepto de consultoría para compañías farmacéuticas u otras tecnologías.
María Galindo ha recibido financiación de Pfizer, UCB, Lilly, Abbvie, Menarini y MSD para la asistencia a cursos/congresos; honorarios de Rubió, Abbvie, MSD, UCB, BMS, Lilly y GSK en concepto de ponencias y ayuda económica de GSK, Lilly, Celgene y UCB en concepto de consultoría para compañías farmacéuticas u otras tecnologías.
Francisco Javier López Longo ha recibido financiación de MSD, GSK, UCB y Pfizer para la asistencia a cursos/congresos; honorarios de GSK y Roche en concepto de ponencias; financiación de UCB y Roche para programas educativos o cursos; financiación de GSK por participar en una investigación y ayuda económica de Sanofi-Aventis en concepto de consultoría para compañías farmacéuticas u otras tecnologías.
María Ángeles Martínez Zamora ha declarado ausencia de intereses.
Amparo Santamaría Ortiz ha recibido financiación de Pfizer, Bayer, Boehringer, Daichi Saikyo, Sanofi, Leopharma, Rovi, CSL Behring, Sobi, Werfen, Octopharma, NovoNordisk, Roche para la asistencia a cursos/congresos y honorarios en concepto de ponencias y consultorías para compañías farmacéuticas u otras tecnologías.
Olga Amengual Pliego ha declarado ausencia de intereses.
M. José Cuadrado Lozano ha declarado ausencia de intereses.
M. Paloma Delgado Beltrán ha declarado ausencia de intereses.
El grupo de expertos del presente trabajo quiere manifestar su agradecimiento a Mercedes Guerra Rodríguez, documentalista de la SER, por su colaboración en las estrategias de búsqueda de la evidencia y al Dr. Sixto Zegarra Mondragón por su colaboración en las revisiones de los informes de revisiones sistemáticas. También quieren agradecer al Dr. Federico Díaz González, director de la Unidad de Investigación de la SER, por su participación en la revisión del manuscrito final y por contribuir a preservar la independencia de este documento.