La asociación entre las infecciones y la inflamación articular ha existido desde tiempos remotos y continúa siendo compleja. El diagnóstico es frecuentemente difícil de determinar, a pesar de la presencia de hallazgos clínicos que sugieren un proceso infeccioso. En las últimas décadas, han ocurrido considerables avances en metodología tanto diagnóstica como terapéutica. Sin embargo, la morbilidad y la mortalidad de la artritis séptica siguen siendo altas. Grandes adelantos han ocurrido en el diagnóstico, patogénesis y manejo terapéutico de la artritis reactiva, y hay evidencia de que cuando el patógeno responsable es Chlamydia trachomatis puede haber remisión completa y la cura es posible. Algunas infecciones emergentes, especialmente virales han sido reconocidas, por ejemplo, virus de inmunodeficiencia humana (VIH), de la hepatitis C, y más recientemente, el virus de Chickengunya. En los casos de VIH, la asociación de manifestaciones articulares y la introducción de la terapia antrirretroviral altamente activa (TARAA) han resultado en una disminución en la incidencia y el desarrollo de nuevas complicaciones, tales como el síndrome de reconstitución inmunológica. La infección como causa de la artritis reumatoide (AR) está siendo considerada nuevamente y la asociación con enfermedad periodontal ha vuelto a ser tema de gran interés e investigación. La microbiota intestinal también está siendo investigada y nuevos e interesantes datos han surgido, como es el papel potencial de los organismos comensales en el intestino como agentes causales en la AR.
The association between microbes and joints has existed since antiquity, and remains complex. Diagnosis is often times difficult to determine despite highly suspicious clinical characteristics for the presence of an underlying infection. Over the several past decades, considerable advances have occurred in diagnostic methodologies and therapy. However, the morbidity and mortality of septic arthritis remains high. Great advances have occurred in the diagnosis, pathogenesis, and therapeutic management of reactive arthritis, and there is evidence that when the responsible microorganism is Chlamydia trachomathis, complete remission and cure is possible. Emergent infections, especially viral, has been recognized, i.e. HIV, hepatitis C, and most recently Chikengunya virus, and in the case of HIV associated articular manifestations, the introduction of HAART has resulted in a decrease in the incidence and development of newer complications such as the immune reconstitution syndrome. The infectious etiology of rheumatoid arthritis is being strongly considered once again, and the exciting association with periodontal disease is at the forefront of intense research. The gut microbiota is also being investigated and new and most interesting data is being gathered of the potential role of commensal gut organisms and the pathogenesis of rheumatoid arthritis.
La asociación entre las infecciones y la inflamación articular ha existido desde tiempos remotos, y ya en la época de Hipócrates se describía la presencia de inflamación articular en varones jóvenes después de su primera experiencia sexual. Esto implicaba la existencia de una artritis séptica o reactiva, posiblemente secundaria a una infección gonocócica, ya sea de vías urinarias o intestinales. La relación entre infección y artritis fue críticamente analizada en un simposio organizado por la Organización Mundial de la Salud con el Consejo de Artritis y Reumatismo para Investigación en Londres en el año 19741. El consenso acordado clasificó la relación entre infección y compromiso articular en 4 grandes categorías. El grupo 1, artritis infecciosa o artritis séptica, estaba definido por la presencia de infección en algún lugar del organismo e identificación del agente infeccioso o producto microbiano en la articulación; el grupo 2, artritis post infecciosa, se caracterizaba por la presencia de infección e identificación del producto bacteriano o antígeno en la articulación, por ejemplo, artritis secundaria a meningococcemia; el grupo 3, artritis reactiva, se definía como un proceso articular inflamatorio en el que la infección se conocía, ya fuese de vías urinarias o tracto digestivo, pero en el cual no se detectaba ningún producto del agente infeccioso o antígenos en la articulación, y el grupo 4 se caracterizaba por un proceso o síndrome articular inflamatorio en el cual ni el agente infeccioso ni sus productos o antígenos se detectaban o identificaban en la articulación, por ejemplo, la artritis reumatoide. Ziff, en el mismo simposio, mencionaba 4 enfermedades reumáticas claramente asociadas con infección: fiebre reumática, poliartritis secundaria a hepatitis B, síndrome de Reiter y enfermedad de Whipple2.
Los adelantos que han ocurrido en las últimas décadas, sobre todo con la identificación de agentes infecciosos y sus antígenos por medio de pruebas de biología molecular, genéticas e inmunológicas, hacen imperativo que la relación entre infección y artritis sea actualizada. En esta revisión intentaremos actualizar nuestro conocimiento sobre la relación entre infección y artritis, enfatizando el estado actual de 4 temas de gran interés: artritis séptica o infecciosa, artritis reactiva, artritis asociada a la infección por el virus de inmunodeficiencia humana (VIH) e infección en la patogénesis de la artritis reumatoide (AR).
Artritis séptica o infecciosaLa artritis séptica permanece como una de las pocas emergencias en reumatología, y a pesar de los grandes adelantos ocurridos en microbiología, biología molecular, imagenología y terapia, la morbimortalidad no ha cambiado drásticamente en los últimos 25 años.
La epidemiología de la artritis séptica es difícil de estudiar por varios motivos, especialmente por lo difícil de establecer un diagnóstico bacteriológico preciso en un buen numero de casos y por que la mayoría de los estudios son retrospectivos y series de casos3. La incidencia anual ha sido reportada, especialmente en países europeos, entre 4-10 por 100.000 pacientes por año, y hasta 30-100 casos por 100.000 habitantes en pacientes con enfermedades crónicas, tales como la AR, pacientes con prótesis articular, ancianos, pacientes inmunocomprometidos y poblaciones indígenas4-8. La incidencia está aumentando en los últimos años debido a una serie de factores, incluyendo resistencia antimicrobiana, envejecimiento de la población, aumento del uso de procedimientos invasivos y de pacientes con inmunosuprimidos9.
Los factores de riesgo (tabla 1) más importantes no han cambiado mayormente en los últimos años. Extremos de la vida, ancianos y niños, enfermedad articular preexistente, pacientes con estado inmunológico comprometido, pacientes en hemodiálisis o con uso de drogas por vía intravenosa, diabetes, infecciones cutáneas, procedimientos ortopédicos como la artroscopia o las inyecciones intraarticulares son los factores predisponentes más importantes para la artritis séptica9-11.
Artritis séptica: factores de riesgo
| Compromiso del sistema inmunológico-supresión inmunitaria |
| Extremos de la vida-niños y ancianos |
| Diabetes mellitus |
| Enfermedad articular previa: artritis reumatoide |
| Articulación prostética |
| Hemodiálisis |
| Uso de drogas vía intravenosa |
| Úlceras cutáneas/infección cutánea |
| Enfermedad hematológica-anemia por células falciformes |
| Uso de catéteres por vía intravenosa |
La artritis séptica ocurre comúnmente a consecuencia de una diseminación hematógena en la membrana sinovial después de un episodio de bacteriemia, lo cual se facilita por su alta vascularidad y debido a que la membrana sinovial no cuenta con una membrana basal. Raramente, sin embargo, la infección articular puede ocurrir a consecuencia de una inyección intraarticular o durante un procedimiento de aspiración articular.
Los estudios de Tarkowsi et al. en modelos animales nos han proporcionado un mayor entendimiento de los factores bacterianos y del huésped en la patogenia de la artritis séptica12. En su modelo experimental de artritis séptica mediada por Staphylococcus aureus (S. aureus), la inoculación de la bacteria por vía hematógena indujo a las 24 h en casi 100% de los ratones una artritis séptica, con cambios articulares, muy similar a la que ocurre en humanos12. En este modelo los autores encontraron que depleciones genéticas de citocinas derivadas de macrófagos, tales como linfotoxina-α, factor de necrosis tumoral (TNF) y el receptor de la interleucina-1 (IL-1), disminuyen la protección del huésped contra infección por S. aureus, lo que causa un aumento de la morbimortalidad13. De igual manera, se ha demostrado en modelos murinos deficientes de IL-10 un aumento en la susceptibilidad a la artritis séptica debido a una reducción en la eliminación del patógeno de la articulación14. Por otro lado, en ratones deficientes de IL-4 se ha demostrado una disminución en la incidencia y la mortalidad, que se ha atribuido al papel de la IL-4 en promover el crecimiento bacteriano y la reducción en la eliminación de la bacteria del espacio articular15. La actividad de esta citocina en la patogenia de la artritis séptica en humanos no ha sido bien estudiada.
La virulencia de ciertos factores extracelulares ha sido estudiada en el modelo murino experimental de Tarkowski13 y muestra que algunos de ellos tienen un papel importante en el desarrollo del daño articular erosivo en artritis séptica. Componentes de la pared celular bacteriana también modulan la virulencia bacteriana. Por ejemplo, estudios de cepas de S. aureus deficientes de proteína A se asocian a enfermedad menos severa en ratones16. Algunas cepas de S. aureus, que son positivas al factor de virulencia citotoxina leucocidina Panton-Valentine (PVL), el cual les permite sobrevivir en neutrófilos, se asocian a infecciones fulminantes, incluyendo infección articular en pacientes previamente saludables y con una tasa más alta de complicaciones que en cepas negativas para PVL17. El aumento en cepas MRSA positivas a PVL se ha asociado a un aumento en la frecuencia de artritis séptica en los EE. UU.18.
S. aureus y Streptococcus son los agentes microbianos más comúnmente asociados a la artritis séptica, incluyendo a los niños. Gran preocupación existe en los EE. UU. y algunos países europeos por el aumento en la prevalencia de S. aureus resistente a la meticilina (MRSA), sobre todo asociado a pacientes que usan drogas por vía intravenosa, adultos mayores y sujetos con infecciones relacionadas a procedimientos ortopédicos19. Las infecciones con microorganismos gramnegativos están aumentadas en poblaciones de más edad20. La infección articular gonocócica ocurre con menor frecuencia en países occidentales comparadas con ciertas comunidades africanas y aborígenes australianas8,21.
El cuadro clínico de la artritis séptica no ha cambiado mayormente; esto incluye los casos en pacientes con infección por el VIH22. La presencia de una articulación, especialmente grande, inflamada, roja y caliente, es motivo suficiente para incluir a la artritis séptica en el diagnostico diferencial. La gran mayoría de los pacientes (> 75%) se presentan con compromiso monoarticular; sin embargo, en años recientes el compromiso poliarticular se está viendo en forma más frecuente, especialmente en pacientes con factores de riesgo. En niños, la artritis séptica de la cadera es bastante difícil de diferenciar de la sinovitis transitoria. Por varios años, los criterios de Kocher se han utilizado para establecer el diagnóstico diferencial23. Cuando los 4 criterios están presentes, es decir, dificultad para tolerar el peso del cuerpo, fiebre mayor de 38,5 °C (101,3 °F), velocidad de sedimentación globular mayor de 40mm/h y cuenta de leucocitos en sangre periférica mayor de 12.000 células/mm3, la probabilidad de tener artritis séptica llega al 99,6%. Sin embargo, un trabajo más reciente en el que se incorpora un quinto criterio, consistente en proteína C reactiva (PCR) ≥ 20mg/l, mostró que cuando los 5 criterios estuvieron presentes, la probabilidad predictiva solo fue del 59,9%, y fiebre fue el mejor predictivo de la artritis séptica24.
El estándar de oro en el diagnóstico de artritis séptica sigue siendo el aislamiento de la bacteria del líquido sinovial y, aunque de menor utilidad, la detección en otros tejidos, especialmente en la sangre. Estos métodos, sin embargo, carecen de sensibilidad y el cultivo toma tiempo para establecer el diagnóstico. En años recientes, técnicas más sensibles y rápidas se han introducido, como las basadas en ADN por espectroscopia en masa o reacción en cadena de polimerasa25. Estas técnicas moleculares, sin embargo, no son suficientemente sensibles ni reproducibles para ser usadas en la práctica clínica.
De las pruebas de laboratorio rutinariamente utilizadas, la PCR parece ser de mayor utilidad diagnóstica que la velocidad de sedimentación globular26.
El dilema clínico frecuentemente observado en pacientes con enfermedades reumáticas preexistentes, como la AR, es establecer el diagnóstico diferencial con artritis séptica. Muy recientemente, un grupo de investigación japonés ha reportado que la expresión del marcador de neutrófilo CD64 (CD64) es bastante útil para diferenciar artritis séptica en pacientes con AR. Ellos mostraron un aumento de este marcador en articulaciones infectadas, con una sensibilidad del 76% y especificidad del 94,4%27.
Un gran índice de sospecha e inicio temprano de terapia con antibióticos, además del drenaje de la articulación, son necesarios para una buena respuesta terapéutica en la artritis séptica. La elección de antibióticos debe ser guiada por los patrones de sensibilidad. El tratamiento empírico con antibióticos debe ser modificado de acuerdo con los resultados de la tinción de Gram y los cultivos.
Clerc et al. recientemente publicaron su experiencia hospitalaria sobre artritis séptica en el Hospital Universitario en Lausanne, Suiza28. El objetivo fue revisar la epidemiología de artritis séptica y el establecer los criterios locales para la terapia empírica con antibióticos. El estudio fue retrospectivo, basado en cultivos positivos de líquido sinovial. Los resultados microbiológicos y las historias médicas fueron revisados. Entre 1999 y 2008, identificaron 233 episodios de artritis séptica. S. aureus fue el organismo más comúnmente identificado (44,6%), seguido por Streptococcus (14,2%). Solamente 11 casos (4,7%) de artritis por MRSA fueron diagnosticados, de los cuales 5 (45,5%) ocurrieron en portadores conocidos. La mayoría de los pacientes presentó compromiso de las articulaciones grandes 147 (63%), de los cuales el 40% tenía compromiso de la rodilla. Compromiso de articulaciones pequeñas, principalmente manos y pies, se observó en el 37% de los casos. En pacientes con compromiso de las articulaciones pequeñas, la mayoría tenía una afectación preexistente (65%) y eran diabéticos (42%); la mayoría de los pacientes presentó una infección contigua, ya sea osteomielitis o infección de los tejidos blandos (94%). En comparación, la vía hematógena fue la principal forma de infección en el 76% de los pacientes con compromiso de las articulaciones grandes. Los autores concluyen que, en su área, la amoxicilina-clavulanato o la cefuroxima serían adecuadas para cubrir empíricamente la artritis séptica de las grandes articulaciones. Sin embargo, en pacientes diabéticos con artritis séptica de pequeñas articulaciones, los antibióticos de amplio espectro serían significativamente superiores. El tratamiento sistémico de MRSA no esta justificado en su área.
Este estudio es representativo de la región y puede ser aplicado a otras áreas u hospitales que comparten una epidemiología similar. Por otro lado, refuerza estudios que han demostrado la falta de evidencia clara respecto de la selección de antibióticos o a la duración del tratamiento. Es la epidemiología del área y especialmente los patrones de sensibilidad local que tienen que ser tomados en cuenta al iniciar el tratamiento con antibióticos en la artritis séptica. La emergencia de resistencia microbiana, especialmente en ciertas áreas geográficas, hace necesarios el desarrollo y el uso de antibióticos nuevos, solos o en combinación. La introducción de nuevas modalidades terapéuticas es objeto de intensa investigación, especialmente el uso de citocinas, glucocorticoides y otros péptidos antimicrobianos, ya sea como adjuntos a la terapia con antibióticos o como antimicrobianos29-31.
Artritis reactivaLa artritis reactiva se clasifica dentro del grupo de la espondiloartritis, que incluye espondilitis anquilosante, artritis psoriásica, artritis asociada a enfermedad intestinal inflamatoria, uveítis anterior aguda, espondiloartritis juvenil, sacroileítis y las espondiloartritis indiferenciadas. La prevalencia total del grupo es entre el 2 y el 3%, la cual representa por lo menos 3 veces mas frecuente que la prevalencia de AR32-34.
Se considera que la artritis reactiva es una enfermedad que fue reconocida desde los tiempos de Hipócrates en el iv a. C. Sin embargo, la relación entre infección en el tracto urinario y artritis fue por primera vez reconocida en el año 1818 por Sir Benjamin Brodie, que describió la tríada de artritis, uretritis y conjuntivitis en un grupo de pacientes. Además, Brodie también reconoció la naturaleza recurrente, con exacerbaciones y remisiones, de la enfermedad. En el año 1879, Neisser identificó el gonococo. Por otro lado, la asociación entre artritis y disentería fue establecida por Sydenham en el siglo xvii. Sin embargo, esta asociación entre infección en el tracto digestivo y artritis quedó claramente identificada en el año 1916, al final de la Primera Guerra Mundial, cuando varios autores europeos, principalmente de Alemania y Francia, describen varios pacientes con diarrea y que posteriormente, 3 a 4 semanas más tarde, desarrollan artritis, conjuntivitis y algunos uretritis. Las publicaciones más destacadas de esta época fueron las de Fiesinger y LeRoy en Francia y Hans Conrad Reiter en Alemania. En Francia, esta enfermedad aún se conoce con el nombre de Fiesinger y LeRoy. Sin embargo, en la literatura inglesa el epónimo de Reiter quedó establecido gracias a una publicación de Walter Bauer y Efrain Engleman, que publicaron una serie de pacientes con artritis, conjuntivitis y uretritis y usaron una sola referencia, la de Reiter. En los últimos 10 años, el pasado nefasto de Reiter durante la Segunda Guerra Mundial, que incluía experimentación humana en campos de concentración nazis, ha salido a relucir, por lo cual varios grupos y reumatólogos prominentes han solicitado que la enfermedad se denomine artritis reactiva35-38.
Al final de la Segunda Guerra Mundial ocurrió un experimento natural de gran envergadura para la historia de la artritis reactiva. En el año 1944, en Finlandia ocurrió una epidemia de disentería secundaria a Shigella que comprometió a más de 150.000 individuos, de los cuales 344 (< 1%) desarrollaron artritis y conjuntivitis, o artritis reactiva. Estos pacientes fueron seguidos a través de los años y la mayoría de ellos permanecieron sintomáticos, con un espectro clínico que abarcaba desde artralgias, artritis, sacroileítis hasta espondilitis anquilosante. Aun mas, en los años sesenta se determinó la presencia del antígeno de histocompatibilidad B-27 y el 90% fue positivo. De esta manera, se puede apreciar la historia natural de la enfermedad39.
Otra manera de clasificar la artritis reactiva de acuerdo con la presencia o ausencia de HLA-B2740.
La epidemiología de la artritis reactiva es difícil de precisar por la falta de criterios diagnósticos, por la dificultad en identificar, reconocer y tratar los microorganismos causales que pueden alterar el curso subsiguiente de la enfermedad, la variabilidad genética del HLA-B27 y la presencia de factores ambientales locales que también desempeñan un papel, como por ejemplo infección por Yersinia enterocolitica, que es más común en ciertas áreas geográficas que en otras40.
La prevalencia es de alrededor del 0,1% en la población general, con una incidencia anual de 10 casos por 100.000 habitantes. Esta cifra representa una estimación bastante baja debido a que no existe una diferenciación clínica clara, especialmente en los estadios tempranos, entre los subgrupos de espondiloartritis, y a que una proporción grande de pacientes afectados tienen infección asintomática —alrededor del 36% en Chlamydia y 26% en entericas40.
Esencialmente, cualquier microorganismo infeccioso puede dar lugar a una artritis reactiva, pero los organismos más comúnmente involucrados son Chlamydia trachomatis (C. trachomatis), Yersinia, Salmonella, Campylobacter y Streptococcus (tabla 2).
La patogénesis de la artritis reactiva es bastante compleja, multifactorial; en ella existe participación del medio ambiente, los factores genéticos y el sistema inmunológico. Los factores ambientales están representados por los agentes infecciosos, especialmente microorganismos gramnegativos. En el humano, el HLA-B27 desempeña un papel de gran importancia, aunque el mecanismo exacto de cómo ejerce su función se desconoce41,42.
El trabajo de Taurog et al. en la rata transgénica para HLA-B27 humano y β2-microglobulina claramente estableció la importancia del HLA-B27 en su patogénesis43,44. La mayoría de las ratas son normales al nacer, pero a partir de la segunda y la tercera semanas, comienzan a desarrollar diarrea, conjuntivitis, uretritis, artritis de las articulaciones periféricas y axiales, así como compromiso cutáneo que semeja psoriasis. La presencia de otro antígeno de histocompatibilidad no induce este proceso inflamatorio, lo que claramente establece al HLA-B27 como desencadenante del proceso. Por otro lado, la participación del medio ambiente también quedó claramente establecida con la segunda parte del estudio. Si las ratas al nacer son mantenidas en un ambiente estéril, no desarrollan el proceso inflamatorio, lo que indica que la flora comensal es importante en el desencadenamiento o inicio del proceso inflamatorio. Estos hallazgos son indicativos del papel que desempeña la flora comensal y son apoyados por la detección de organismos comensales por PCR en el líquido sinovial de pacientes con artritis reactiva44. Esta es un área de investigación intensa, como lo vamos a apreciar mejor cuando discutamos la participación de infecciones en la patogenia de la AR.
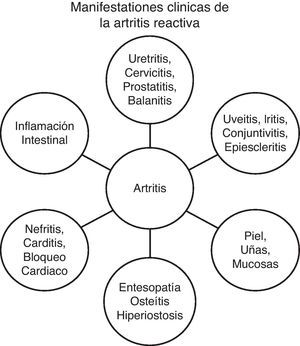
La artritis reactiva es una enfermedad sistémica que afecta a gente joven entre la segunda y la cuarta décadas de la vida. Puede afectar a niños y a individuos de mayor edad. Generalmente, ocurre de 2 a 4 semanas después de una infección genitourinaria (hombre:mujer, 9:1) o entérica (hombre:mujer, 1:1)40.
Las características clínicas asociadas a infección genitourinaria son virtualmente idénticas a aquellas asociadas a infección entérica. Clínicamente, existen 4 síndromes40 (fig. 1):
- 1.
Síndrome entesopático.
- 2.
Artritis periférica: aguda asimétrica o subaguda oligoarticular, que compromete los miembros inferiores.
- 3.
Síndrome axial y pélvico: compromiso espinal con sacroileítis.
- 4.
Síndrome extramusculoesquelético.
Los resultados de laboratorio son completamente inespecíficos. La velocidad de sedimentación globular y la PCR están elevadas en menos del 50% de los pacientes. La presencia del HLA-B27 se detecta en alrededor del 60% de los pacientes y en mucho menor porcentaje en poblaciones no caucásicas. Positividad para p-ANCA se detecta en el 20-30% de los pacientes, pero este hallazgo no es específico. Tanto el líquido sinovial como la membrana sinovial, al igual que la imagenología, no aportan mucho al diagnóstico.
La falta de criterios diagnósticos validados representa un problema para el diagnóstico de artritis reactiva. Los criterios del Colegio Americano de Reumatología requieren de la identificación o documentación de una infección urogenital por C. trachomatis o de una infección entérica por un organismo relevante. Los pacientes que reúnen todos los requisitos, excepto el de una infección relevante, se clasifican como monoartritis u oligoartritis indiferenciada. La clasificación del Grupo de estudio Europeo de Espondiloartritis es bastante usada, pero no ha sido validada45.
El diagnóstico diferencial incluye otros miembros del grupo de las espondiloartritis, artritis séptica, enfermedad de Still, enfermedad Behçet y sarcoidosis.
El pronóstico es variable. La mayoría de los pacientes permanecen sintomáticos, con artralgias, dolor de espalda y desarrollo de espondilitis anquilosante a largo plazo (más de 15-20 años). Otro grupo entra en remisión permanente y una minoría tiene un curso recurrente. Se han identificado ciertos factores de riesgo o mal pronóstico: naturaleza de la infección-infección persistente con Chlamydia es de mal pronóstico, presencia del HLA-B27 (compromiso axial, ocular), el sexo masculino es peor, artritis recurrente e historia familiar de la enfermedad.
La gran mayoría de los pacientes afectados con artritis reactiva responde al tratamiento con antiinflamatorios no esteroideos (AINE), pero una proporción importante necesita tratamiento con agentes de segunda línea o modificadores de la enfermedad. Los agentes biológicos, especialmente los bloqueadores del TNF, han tenido gran impacto en el tratamiento de los pacientes con artritis reactiva refractarios al uso de tratamiento convencional46. El otro avance en el manejo de la artritis reactiva es la evidencia demostrada de que el uso combinado de antibióticos puede inducir remisión completa y hasta curación de la artritis reactiva inducida por Chlamydia47.
Está claramente establecido en la literatura que en la infección por microorganismos artritogénicos se puede presentar un proceso articular agudo y que en una proporción variable, y dependiendo del organismo involucrado en el proceso agudo, puede originarse un proceso crónico, con manifestaciones clínicas variables, que incluyen un espectro clínico de artralgias, artritis recurrente o crónica, sacroileítis y espondilitis anquilosante franca. Por otro lado, y tomando como ejemplo a la infección con Chlamydia, la evidencia presentada ha mostrado que la Chlamydia puede ser identificada serológicamente y cultivada hasta en un 62% de pacientes con espondiloartritis crónicas, incluyendo pacientes con artritis reactiva, artritis psoriásica y espondilitis anquilosante48. Estos hallazgos sugerían que la infección con Chlamydia ocurre en algún momento en el curso de la enfermedad y apoyan el uso de antibióticos47. Recientemente, estos hallazgos fueron corroborados en un grupo de pacientes con espondiloartritis indiferenciada y usando una técnica más sensible para detectar ADN de Chlamydia por PCR tanto en sangre periférica como en membrana sinovial49. Los hallazgos mostraron la presencia de ADN de Chlamydia en la membrana sinovial en el 62% de los pacientes con espondiloartritis indiferenciada, comparando con paciente con osteoartritis (p < 0,0001).
Estos hallazgos se suman a una serie de estudios que muestran la persistencia de ADN de Chlamydia por PCR en la membrana sinovial de pacientes con artritis reactiva50-54. Además, se ha demostrado que la Chlamydia está metabólicamente activa, es morfológicamente diferente y la expresión genética es diferente en el estadio de persistencia55. En el estadio de persistencia, los genes de proliferación celular, tales como los genes de la proteína de la membrana externa-1, están deprimidos, mientras que los genes de las proteínas de choque térmico están regulados diferencialmente56. Esto último apoya la noción de que proteínas de choque térmico (HSP, por sus siglas en inglés) son de gran importancia en el estadio de persistencia de Chlamydia. Las HSP permiten a las células sobrevivir a ataques letales porque previenen la desnaturalización de proteínas. HSP-60 desempeña un papel crítico en la inhabilidad de las células infectadas con Chlamydia de desarrollar apoptosis. Por lo tanto, es bastante probable que la eliminación de las HSP de Chlamydia sea importante en la prevención de secuelas57,58.
El uso benéfico de antibióticos en pacientes con artritis, particularmente aquellos de acción intracelular, han sido reportados desde principios de los años noventa47. Desde aquella época, se han publicado una serie de estudios, la gran mayoría de ellos abiertos y no controlados, mostrando cierto beneficio especialmente en paciente con artritis reactiva secundaria a infección de las vías genitourinarias59-61.
Por otro lado, existe evidencia in vitro que apoya el uso de ciertos antibióticos en la infección por Chlamydia. Se ha demostrado que la monoterapia con doxiciclina o azitromicina conduce a la Chlamydia a un estadio de persistencia intracelular, mientras que el uso de rifampicina induce resistencia a la infección por Chlamydia y además inhibe todas las transcripciones, incluyendo las HSP mediante inhibición general de su expresión genética62,63. Además, se ha demostrado que la combinación de rifampicina y azitromicina ejerce una acción sinérgica capaz de erradicar la Chlamydia en células crónicamente infectadas y los pacientes con artritis inducida por Chlamydia experimentan una mejoría significativa con la combinación de rifampicina y doxiciclina por 9 meses, comparada con la monoterapia con doxiciclina64.
La evidencia discutida apoyaba la noción de que el uso prolongado de la combinación de antibióticos con acción antimicrobiana y capacidad para inhibir la producción de la HSP-60 de Chlamydia podía curar la artritis reactiva crónica inducida por Chlamydia, algo similar a lo que ocurre con otros organismos intracelulares persistentes, tales como Mycoplasma tuberculosis. Esto fue la base para el estudio prospectivo, controlado, del uso de terapia con combinación de antibióticos en pacientes con artritis reactiva crónica inducida por Chlamydia65.
El objetivo principal del estudio fue investigar si un curso de 6 meses de antibióticos en combinación era efectivo para pacientes con artritis reactiva crónica inducida por Chlamydia. Este estudio fue de una duración de 9 meses, prospectivo. Los pacientes elegibles tenían que ser positivos para C. trachomatis o C. pneumoniae por PCR. Los grupos recibieron: a) doxiciclina y rifampicina más placebo en lugar de azitromicina; b) azitromicina y rifampicina más placebo en lugar de doxiciclina, o c) placebos en lugar de azitromicina, doxiciclina y rifampicina. El objetivo primario final fue reportar número de pacientes que mejoraron 20% o más en por lo menos 4 de 6 variables, sin empeoramiento en ninguna variable, en ambos grupos con combinación de antibióticos y en el grupo placebo, a 6 meses, en comparación con el estado basal. El objetivo final primario fue logrado en 17 de 27 pacientes (63%) que recibieron combinación de antibióticos y en 3 de 15 pacientes (20%) que recibieron placebo. Los objetivos secundarios finales de eficacia mostraron resultados similares. Seis de 27 pacientes (22%) que recibieron combinación de antibióticos creyeron que su enfermedad remitió completamente, mientras que ningún paciente con placebo alcanzo remisión. Más pacientes en el grupo de tratamiento activo se volvieron negativos en forma significativa para C. trachomatis o C. pneumoniae por PCR a 6 meses. Las reacciones adversas fueron leves, sin diferencia alguna entre los grupos. Se concluyó que los datos sugieren que un curso de 6 meses de combinación de antibióticos es un tratamiento efectivo para la artritis reactiva crónica inducida por Chlamydia65.
Es importante reproducir estos resultados en artritis reactiva temprana, al igual que estudiar artritis reactivas inducidas por otros gérmenes.
Artritis asociada a infección por el virus de la inmunodeficiencia humanaLa pandemia de infección por el VIH se originó hace más de 3 décadas y la asociación entre VIH y artritis fue reconocida a comienzos de los años ochenta66-68. El espectro clínico y la frecuencia de manifestaciones inflamatorias articulares asociadas con el VIH han cambiado a través de los años, especialmente con la introducción de la TARAA en los años noventa69,70. Artritis y otras manifestaciones articulares de carácter inflamatorio se siguen observando en asociación con el VIH, pero la frecuencia es menor y el tipo de manifestación clínica ha evolucionado también.
Las manifestaciones reumáticas asociadas al VIH se observan con cualquier estadio de la infección por el VIH; sin embargo, en el mundo occidental ellas tienden a verse más comúnmente en estadios avanzados iiiy iv, mientras que en África y otros países en desarrollo generalmente se presentan en estadios i y ii. No es raro en estos últimos que la artritis u otras manifestaciones musculoesqueléticas de tipo inflamatorio sean las formas de presentación del VIH71,72.
La patogenia de la artritis y demás manifestaciones inflamatorias asociadas a la infección por el VIH no están claramente establecidas, son bastante complejas y multifactoriales; intervienen factores relacionados con el medio ambiente (infecciones bacterianas) y factores genéticos (HLA-B27 y MICA), así como el sistema inmunitario nativo y la inmunidad celular73-78.
Las manifestaciones inflamatorias articulares antes de la era de la TARAA se pueden apreciar en la tabla 379-85.
Manifestaciones articulares asociadas a la infección por el virus de la inmunodeficiencia humana: antes y después de terapia antrirretroviral altamente activa
| Antes de TARAA |
| Artralgias |
| Artritis |
| Artritis reactiva |
| Artritis psoriásica |
| Espondiloartritis indiferenciada |
| DILS |
| Miopatía-polimiositis, dermatomiositis, cuerpos de inclusión |
| Vasculitis |
| Gota |
| Infecciones: artritis séptica, osteomielitis, piomiositis |
| Después de TARAA |
| Síndrome inflamatorio de reconstitución inmunológica: sarcoidosis, lupus, artritis reumatoide, DILS |
| Condiciones inducidas por drogas |
| Miopatía por zidovudina |
| Barras de nemalina |
| Rabdomiólisis |
| Gota e hiperuricemia |
| Lipodistrofia |
| Condiciones metabólicas e infecciosas |
| Osteoporosis |
| Necrosis avascular |
| Osteomielitis |
| Piomiositis |
| Artritis séptica |
DILS: síndrome de linfocitosis infiltrativa difusa; TARAA: terapia antrirretroviral altamente activa.
Las artralgias fueron las manifestaciones más comunes, tanto como parte del síndrome viral agudo como en cualquier estadio de la enfermedad. La duración es corta, raramente mayor de 2 semanas, y compromete las rodillas, los hombros y los codos con mayor frecuencia. La respuesta a analgésicos y AINE es bastante buena.
El síndrome agudo articular doloroso intermitente es característico de estadios avanzados del VIH; es de corta duración pero de pronóstico malo. El uso de opioides es necesario para su control.
La artritis asociada al VIH puede ocurrir en cualquier estadio de la enfermedad, es usualmente de corta duración (no mayor de 6 semanas), afecta a 3-4 articulaciones grandes en los miembros inferiores y es no erosiva. Usualmente, hay derrame articular, particularmente en las rodillas, y el carácter del líquido sinovial es no inflamatorio, con cultivos negativos, pudiéndose demostrar la presencia de inclusiones tubulorreticulares. El antígeno P-24 del VIH ha sido detectado en el tejido sinovial y en linfocitos CD4 y CD886. La artritis asociada al VIH es generalmente autolimitada y responde bien a AINE o a dosis bajas de prednisona. Ocasionalmente, requiere del uso de hidroxicloroquina y sulfasalazina. La presencia de artropatía de Jaccoud ha sido descrita ocasionalmente87.
Las espondiloartritis, incluyendo artritis reactiva, artritis psoriásica, espondilitis anquilosante y espondiloartritis indiferenciada, se asocian a infección por el VIH. Estas formas de artritis fueron las primeras en reportarse e inicialmente constituían cerca del 30 al 40% de las manifestaciones articulares inflamatorias asociadas al VIH. En poblaciones caucásicas se asocian fuertemente al HLA-B27; sin embargo, en otras poblaciones, especialmente en África Central, son bastantes comunes y no están asociadas a HLA-B27. Aun más, en África Central, antes de la pandemia del VIH, no se observaba prácticamente ninguna forma de espondiloartritis, a pesar de que las infecciones bacterianas son bastante prevalentes88. Las manifestaciones extraarticulares características de las espondiloartritis, especialmente cutáneas, están presentes. La vía de contaminación parece influenciar la expresión clínica asociada al VIH y las espondiloartritis se observan con menor frecuencia en individuos que usan drogas por vía intravenosa. La mayoría de los pacientes responde a AINE, aunque un buen porcentaje de pacientes va a necesitar tratamiento con metotrexato, hidroxicloroquina o dosis bajas de glucocorticoides. Pacientes con compromiso axial y pacientes con formas severas de artritis psoriásica se benefician del uso de agentes biológicos, especialmente inhibidores del TNF89.
El síndrome de linfocitosis infiltrativa difusa (DILS) está caracterizado por la presencia de crecimiento masivo de las glándulas parótidas y lacrimales, en forma bilateral e indolora, así como por síndrome seco y linfocitosis periférica por CD890. A menudo, se confunde con síndrome de Sjögren, pero la ausencia de autoanticuerpos anti SS-A y SS-B y la presencia de manifestaciones extraglandulares, tales como neumonía intersticial linfocítica, que ocurre en el 30-50%, y parálisis facial, que ocurre en el 30% de los pacientes con VIH, facilitan el diagnostico diferencial91. Existe cierta distribución geográfica para este síndrome, siendo más común en África que en los EE. UU. El tratamiento es usualmente sintomático; son necesarias las dosis altas de glucocorticoides y la TARAA.
El compromiso muscular inflamatorio es relativamente común en pacientes infectados por el VIH. Mialgias, polimiositis, dermatomiositis, miositis por cuerpos de inclusión, miopatía a barras de nemalina, rabdomiólisis y el síndrome de consumo pueden observarse durante el curso de la enfermedad. La polimiositis es el síndrome más común; ocurre por lo general en los estadios iniciales de la infección, pero puede ocurrir en cualquier estadio. Es un proceso inflamatorio asociado a elevación de enzimas, especialmente creatincinasa, infiltración con células CD8, e identificación de antígenos del VIH. El curso clínico y la respuesta terapéutica son muy similares a los de la forma idiopática. El síndrome de consumo generalmente se observa como parte del complejo sida; se acompaña de atrofia muscular severa, pérdida del 10% de peso, diarrea, debilidad y fiebre. En la actualidad, se observa muy raramente.
La fibromialgia es común en pacientes con VIH, se asocia a depresión y la terapia es similar a la de pacientes no infectados.
La vasculitis que compromete vasos de pequeño, mediano y grande calibre, se puede observar en la infección por el VIH. Puede ocurrir en cualquier estadio de la enfermedad, generalmente ocurre en gente joven y un amplio espectro clínico puede estar presente92.
Procesos infecciosos, que incluyen artritis séptica, piomiositis y osteomielitis, pueden observarse en pacientes con VIH. Las infecciones, especialmente oportunistas, del aparato musculoesquelético generalmente ocurren en pacientes con inmunosupresión severa, con cuentas de linfocitos CD4 por debajo de 200 células/mm3. El comportamiento clínico y la respuesta terapéutica son muy similares a los que ocurren en pacientes no infectados93.
La hiperuricemia y la gota son altamente prevalentes en pacientes con VIH, y su presencia puede tener implicaciones pronósticas.
Los procesos reumáticos que se han presentado en la era de la TARAA se pueden apreciar en la tabla 3.
La TARAA ha revolucionado la historia natural, la morbilidad y la mortalidad de la población infectada por el VIH, y también ha influenciado en forma positiva en la frecuencia y la expresión clínica de las manifestaciones inflamatorias articulares asociadas. En la actualidad, al menos en los países occidentales, aún se observan espondiloartritis, pero la frecuencia es cada vez menor. La presencia de complicaciones sépticas y neoplásicas es mayor en ciertas regiones geográficas incluyendo la nuestra y la frecuencia de DILS se reporta con menor frecuencia por algunos investigadores94. Sin embargo, nuevos síndromes, especialmente el síndrome inflamatorio de reconstitución inmunológica (IRIS), y complicaciones musculoesqueléticas directamente relacionadas con el uso de TARAA han sido reconocidos93.
El IRIS es un proceso sistémico inflamatorio que ocurre en pacientes con VIH después del inicio de la TARAA y está caracterizado por una elevación de las células CD4, aumento de la tasa CD4+/CD8+, y elevación de citocinas proinflamatorias circulantes, como IL-6 e interferón gamma. Otras anormalidades inmunológicas incluyen un desequilibrio de Th1/Th2 y una expresión aumentada de CCR-3 y CCR-5 en monocitos y granulocitos. La mayoría de los casos de IRIS ocurren 3-24 meses después del inicio de la TARAA y pueden ocurrir una serie de padecimientos que semejan síndromes autoinmunitarios, tales como lupus, sarcoidosis o enfermedad de Graves93.
La miopatía inducida por zidovudina fue una de las primeras complicaciones relacionadas con la terapia del VIH. Se acompaña de mialgias, dolor y debilidad muscular proximal, y generalmente ocurre después del primer año de terapia. Parece ser secundaria a disfunción mitocondrial y el cuadro clínico y la elevación de las enzimas musculares desaparecen después de que se discontinúa la zidovudina. El uso de inhibidores de proteasas puede inducir casos más severos de compromiso muscular, incluyendo rabdomiólisis, especialmente cuando se usan en combinación con estatinas.
Una serie de complicaciones en los tejidos blandos, incluyendo capsulitis adhesiva, contracturas de Dupuytren, tendinitis de DeQuervain y disfunción de la articulación temporomandibular, han sido descritas con el uso de inhibidores de proteasas.
Complicaciones metabólicas, tales como resistencia a la insulina, dislipidemia, hiperuricemia y gota, así como trastornos del metabolismo óseo, que incluyen osteopenia y osteoporosis, osteomalacia y, potencialmente, osteonecrosis, han sido descritas en asociación con la TARAA. La patogenia exacta de estas asociaciones no está claramente elucidada, pero la TARAA participa de cierta manera95.
La etiología infecciosa de la artritis reumatoideLa causa de la AR no está bien esclarecida. El tabaquismo es el factor de riesgo ambiental más fuerte y otros como el alcoholismo, la ingesta de antioxidantes y la contaminación ambiental también pueden desempeñar un papel. Se ha postulado una causa infecciosa para la AR, pero hasta la fecha ningún microorganismo ha sido convincentemente implicado. Desde el siglo pasado, se ha postulado que es bastante razonable que la enfermedad dependa de un proceso infeccioso de algún tipo. Esto no debe ser interpretado como la presencia de una infección definida en la articulación. Esta situación puede ocurrir, pero en la mayoría de los casos la artritis parece ser dependiente de una infección local en alguna parte del cuerpo, con diseminación y absorción de mediadores de inflamación en la articulación. Existen ciertas características en la AR que hacen pensar en la presencia de una infección, como son las peculiaridades del ataque, que a menudo sugieren una infección aguda, así como la presencia de ciertas complicaciones, como la pericarditis y la pleuritis. Dos lugares han sido por mucho tiempo considerados como fuentes posibles de infección, en primer lugar, el intestino, que podría dar lugar a la entrada de microorganismos, los cuales no necesariamente serían patogénicos bajo condiciones ordinarias; la vía oral podría ser otra fuente de focos de microorganismos, los cuales podrían ser continuamente ingeridos y eventualmente darían lugar a un proceso inflamatorio. Este punto de vista sugiere que la artritis es secundaria a una infección de algún tipo, probablemente con varios organismos envueltos, y como resultado final se presentaría el proceso inflamatorio articular. Esta hipótesis sugerida por Osler y McCrae hace más de 100 años fue compartida por muchos otros investigadores de la época96.
Varios estudios recientes apoyan la causa infecciosa de la AR. Rosenau y Schur recientemente publicaron evidencia que sugiere que el virus del sarampión podría ser el responsable97. El objetivo del estudio fue identificar un virus en la membrana sinovial reumatoide. Esta fue obtenida durante reemplazos de rodilla y examinada para virus (efectos citopáticos). Al mismo tiempo, los sueros de 50 pacientes con factor reumatoide fueron examinados para anticuerpos IgM al agente viral. Los resultados mostraron que el virus del sarampión fue identificado y 11 de 50 (22%) de los sueros fueron positivos para anticuerpos IgM. Los autores concluyeron que existe una asociación entre el virus del sarampión y la AR97. Otro grupo de autores investigó la importancia de las características al nacer y de la presencia de infecciones al comienzo de la vida, en el riesgo de contraer AR y artritis idiopática juvenil. Los resultados mostraron que las infecciones contraídas durante el primer año de vida estuvieron asociadas a un riesgo aumentado de desarrollar artritis seronegativa, pero no de desarrollar artritis seropositiva ni artritis idiopática juvenil. La conclusión fue que las infecciones durante el primer año de vida, y posiblemente también factores relacionados con el crecimiento fetal y el tiempo de nacimiento, pueden ser de importancia en las causas de la AR y de la artritis idiopática juvenil98.
Los componentes bacterianos y virales son una fuente atractiva de antígenos capaces de inducir AR. Antígenos micobacterianos y estreptocócicos también son buenos inductores de artritis experimental. Rubéola, parvovirus B19 y arbovirus pueden causar artritis en humanos. El uso de RT-PCR ha mostrado una plétora de secuencias de ARNr bacteriano en la membrana sinovial, hallazgo que es poco probable que sea causado por contaminación. Sin embargo, no se ha identificado un organismo claramente asociado a la AR. La presencia de estos antígenos microbianos se correlaciona mejor con inflamación que con el diagnóstico. La membrana sinovial normal no contiene ARNr bacteriano y es bastante probable que el sinovio inflamado sea colonizado por bacterias, especialmente comensales del intestino y la piel. Las articulaciones en la AR permanecen estériles por cultivo convencional.
La colonización del sinovio inflamado por bacterias y productos bacterianos es relativamente común y podría contribuir a la patogenia de la AR. Las bacterias y sus productos (LPS, peptidoglucanos y ADN bacterianos) son potentes activadores del sistema inmunitario innato y sirven como adyuvantes, permitiendo la respuesta adaptativa, tanto de células T como B. Los receptores tipo «Toll», especialmente TLR9, reconocen el ADN bacteriano y pueden ser importantes en la inducción de artritis en modelos animales dependiente del TNF. Además, la activación de células presentadores de antígeno, tales como las células dendríticas, por ADN bacteriano y otros ligandos de receptores tipo «Toll» puede permitir la generación de una respuesta a autoantígenos dentro de la articulación.
De gran interés, con respecto a la causa infecciosa de la AR, es la relación entre periodontitis, Porphyromonas gingivalis (P. gingivalis), anticuerpos antipéptidos cíclicos citrulinados (anti-PCC), y la enfermedad99-106. La prevalencia de enfermedad periodontal está aumentada 2 veces en pacientes con AR, lo cual no se debe a la presencia de síndrome de Sjögren secundario. La periodontitis y la AR comparten mecanismos patogénicos, factores ambientales de riesgo, tales como el tabaquismo, y se asocian en estudios epidemiológicos107. Una prevalencia aumentada del epítopo compartido HLA-DRB1*0104, respuesta aumentada de células T con niveles tisulares altos de IL-17 y respuestas exageradas de células B con un predominio de células plasmáticas en el tejido gingival afectado existen en ambas entidades103,108. Además, el ADN de P. gingivalis se encuentra frecuentemente en el sinovio reumatoide y los niveles de anticuerpos contra la bacteria son más altos en pacientes con AR, que tienen anticuerpos anti-PCC positivos que en aquellos que los tienen negativos. Estos hallazgos sugieren que la periodontitis puede contribuir a la patogenia de la AR.
P. gingivalis es una causa común de periodontitis y ha sido propuesta como el nexo etiológico entre la AR y la periodontitis103. Además, P. gingivalis posee enzimas proteolíticas (gingipains) responsables de la virulencia del microorganismo109. P. gingivalis es el único organismo procariótico que expresa la enzima deiminasa peptidilarginina (PAD), la cual convierte arginina a citrulina en tejidos normales105. La citrulinación de proteínas bacterianas por la PAD es característica de P. gingivalis y no está presente en otros organismos orales comensales. La evidencia acumulada sugiere que la presencia de autoinmunidad a proteínas citrulinadas es específica en la patogenia de la AR. La citrulinación, también denominada deiminación, es una modificación de las cadenas laterales de arginina, catalizada por las enzimas PAD. Esta modificación postranslacional tiene el potencial de alterar la estructura, la antigenicidad y la función de las proteínas fibrinógeno, vimentina, colágeno tipo ii y enolasa-alfa. Todas estas proteínas están expresadas en la articulación. Los anticuerpos a fibrinógeno y colágeno tipo ii promueven la inflamación mediante la formación de complejos inmunitarios105. Los anticuerpos a proteínas citrulinadas se asocian a alelos del epítopo compartido y a autoinmunidad al péptido CEP-1 de la enolasa-alfa citrulinada y muestran asociación con el tabaquismo y HLA-DRB1*0401*, 0404, 620W y PTPN22.
Es posible concluir que existe evidencia que apoya la relación entre la enfermedad periodontal y el desarrollo de AR. Los patógenos periodontales tienen acceso sistémico directo a la circulación sanguínea. La enzima PAD representa un factor importante patogénico para la AR. En la actualidad, P. gingivalis es la única bacteria que expresa la enzima PAD y desempeña un papel en la respuesta humoral inmunitaria y en la presencia de anticuerpos anti-PCC en pacientes con AR. La higiene oral y el tabaquismo representan factores ambientales que son capaces de influenciar el riesgo para el desarrollo de AR. La evidencia discutida es de bastante interés e importancia, pero existe la necesidad de más estudios clínicos, especialmente longitudinales, para establecer en forma clara y definida la relación entre la AR y la enfermedad periodontal.
El otro aspecto que debe ser discutido es la relación entre las bacterias intestinales y la AR. Estos estudios han sido posibles usando tecnología de ADN para poder evitar los difíciles y tediosos cultivos bacterianos. Los investigadores están usando secuencias de ADN para identificar todas las bacterias presentes en la boca y el intestino de participantes en los estudios. Scher et al. han estudiado hasta la fecha a 90 pacientes, 55 adultos con AR y 35 controles sanos110. Respecto de la microbiota oral, los hallazgos muestran que los pacientes con AR temprana tienen de 3 a 4 veces más P. gingivalis que los controles sanos. En general, la enfermedad periodontal estaba presente en el 82% de los pacientes con AR crónica y en el 75% de los pacientes con AR temprana. Respecto de la microbiota intestinal, las bacterias intestinales asociadas con inflamación fueron más prevalentes en pacientes con AR que en controles sanos. La especie Prevotellaceae fue identificada en cerca del 80% de los pacientes con AR, en comparación con el 20% usualmente encontrado en controles sanos. Estos hallazgos preliminares apoyan los datos de estudios previos y muestran una prevalencia alta de enfermedad oral en pacientes con AR. Este estudio continúa realizándose y los autores están contemplando el uso de antibióticos para modificar la microflora del cuerpo y establecer cómo la bacteria causa inflamación. Los hallazgos podrían conducir al desarrollo de estrategias para reducir o prevenir la inflamación antes de que precipite la AR.
En conclusión, la relación entre los gérmenes microbianos y las articulaciones es bastante común y compleja. El espectro clínico que se observa es amplio y va desde una artritis séptica, en la que se demuestra la presencia del germen en la articulación, hasta enfermedades sistémicas como la AR, en la cual, utilizando tecnología sensible, se está demostrando cierto papel etiopatogénico de las bacterias comensales. Esta revisión no incluye ciertas infecciones virales que están emergiendo en el mundo occidental, tales como la artritis inducida por el virus alfa Chikengunya111 o como el viejo enigma de enfermedades articulares clarificadas con tecnología PCR, como la enfermedad de Whipple112. Por otro lado, llama la atención que la terapia biológica no esté asociada a un aumento en la prevalencia de artritis séptica113. Es obvio que la relación entre infección y artritis aún está vigente y debemos mantenernos alertas ante la posible emergencia de nuevos patógenos y de complicaciones asociadas a las nuevas terapias que estamos usando en reumatología.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.