La enfermedad celíaca es una enfermedad autoinmune sistémica que tiene entre sus manifestaciones clínicas síntomas frecuentes en las enfermedades reumatológicas, como dolor musculoesquelético crónico, astenia y fatiga mental. Se asocia a otras enfermedades autoinmunes, como la enfermedad de Sjögren. Es una enfermedad bien caracterizada con pruebas diagnósticas específicas.
La sensibilidad al gluten no celíaca es una entidad emergente, con sintomatología similar a la de la enfermedad celíaca, pero sin pruebas diagnósticas específicas. Se revisan el concepto y los problemas diagnósticos de la sensibilidad al gluten no celíaca y se propone como hipótesis la asociación de la sensibilidad al gluten no celíaca a la fibromialgia, las espondiloartropatías y las enfermedades autoinmunes. Se describen observaciones clínicas que apoyan esta hipótesis, destacando el beneficio clínico del tratamiento de la sensibilidad al gluten.
Celiac disease is an autoimmune systemic disease having among its clinical manifestations frequent symptoms common to rheumatologic diseases such as musculoskeletal pain, asthenia, and cognitive fatigue. It is associated with other autoimmune diseases like Sjögren disease. It is a well-characterized disease with specific diagnostic tests.
Non-celiac gluten sensitivity is an emerging entity with symptoms similar to celiac disease, but without specific diagnostic tests. The concept of non-celiac gluten sensitivity and its diagnostic problems are reviewed, and the hypothesis of its association with fibromyalgia, spondyloarthritis, and autoimmune conditions is proposed. Clinical observations supporting the hypothesis are described, highlighting the benefit of treating non-celiac gluten sensitivity.
La enfermedad celíaca (EC) ha sido considerada tradicionalmente una enfermedad digestiva pediátrica, caracterizada por malabsorción y retraso en el desarrollo; sin embargo, esta perspectiva ha cambiado mucho en los últimos años. Hoy se considera una enfermedad autoinmune frecuente que se puede presentar a cualquier edad, con manifestaciones tanto digestivas como extradigestivas1-6. Aunque el objetivo de este artículo no es revisar la EC, es importante destacar algunos puntos que se deben tener en cuenta por el reumatólogo: a) la EC puede estar presente en ausencia de síntomas digestivos, de hecho casi la mitad de los celíacos diagnosticados en la edad adulta no tienen síntomas digestivos relevantes; b) además de la clásica anemia ferropénica, diarrea y osteoporosis, la EC es causa de síntomas como astenia, fatiga mental y dolor musculoesquelético crónico, que acompañan a muchas enfermedades sistémicas7; de hecho la EC ha sido denominada el gran simulador8, y c) la EC tiene reconocida asociación a enfermedades autoinmunes, las más frecuentes son la enfermedad tiroidea autoinmune y la enfermedad de Sjögren. La tabla 1 muestra las enfermedades asociadas a la EC9. Las enfermedades reumatológicas asociadas a la EC son suficientes como para considerar la realización de serología de EC a los pacientes reumatológicos con astenia, anemia, dolor musculoesquelético crónico o enfermedades sistémicas. En un estudio realizado en 211 pacientes con manifestaciones articulares no explicadas, la frecuencia de serología de EC positiva fue muy superior a la de la población control. Los anticuerpos antiendomisio IgA (la serología más específica de EC) fueron positivos en el 2,37% de los pacientes y solo en el 0,28% de los donantes de sangre como grupo control10.
Grupos de riesgo de enfermedad celíaca
| Familiares en primer grado |
| Pacientes con enfermedades asociadas |
| Enfermedades autoinmunes |
| Diabetes mellitus tipo 1 |
| Tiroiditis autoinmune |
| Déficit selectivo de IgA |
| Enfermedad inflamatoria intestinal |
| Síndrome de Sjögren |
| Lupus eritematoso sistémico |
| Enfermedad de Addison |
| Nefropatía por IgA |
| Hepatitis crónica autoinmune |
| Cirrosis biliar primaria |
| Artritis reumatoide |
| Psoriasis, vitíligo y alopecia areata |
| Trastornos neurológicos y psiquiátricos |
| Encefalopatía progresiva |
| Síndromes cerebelosos |
| Demencia con atrofia cerebral |
| Leucoencefalopatía |
| Epilepsia y calcificaciones |
| Esquizofrenia |
| Otras asociaciones |
| Síndrome de Down |
| Síndrome de Williams |
| Síndrome de Turner |
| Fibrosis quística |
| Enfermedad de Hartnup |
| Cistinuria |
| Colitis microscópica |
| Cardiomiopatía |
| Fibromialgia |
| Síndrome de fatiga crónica |
Tomado de Diagnóstico precoz de la enfermedad celíaca. Ministerio de Sanidad y Consumo, 20089.
La EC se considera una enteropatía autoinmune debida a la exposición al gluten que solo puede suceder en sujetos genéticamente predispuestos. Los sujetos HLA DQ2.5 (DQA1*05-DQB1*02) o DQ8 (DQA1*0301-DQB1*0302) pueden hacer una respuesta inmune adaptativa frente al gluten con producción de autoanticuerpos (antitransglutaminasa tisular [anti-TGt] y antiendomisio), con infiltración del epitelio intestinal por linfocitos CD3 (linfocitosis intraepitelial) que cuando es severa lleva a la atrofia de las vellosidades intestinales que se observa en la biopsia duodenal (lesión tipo 3 de Marsh). La tríada susceptibilidad genética con HLA DQ2 o DQ8, anticuerpos específicos (anti-TGt, antiendomisio) y atrofia de vellosidades intestinales en la biopsia duodenal es lo que caracteriza y define a la EC.
La sensibilidad al gluten no celíaca (SGNC) es una entidad emergente caracterizada por síntomas digestivos y extradigestivos dependientes del gluten en pacientes con pruebas de EC negativas y, por lo tanto, considerados no celíacos11-14. Las observaciones clínicas de pacientes que responden a la dieta sin gluten (DSG) en los que no se confirma la EC datan al menos de 1978. En los últimos años, esta entidad está adquiriendo un importante protagonismo y no se considera una rareza. La SGNC se considera más frecuente que la EC, que afecta al 1% de la población. Aunque no hay estudios epidemiológicos reglados debido a que no hay un marcador diagnóstico que permita hacer estos estudios, se estima que la SGNC afecta a alrededor del 5% de la población.
Para la concepción más prevalente acordada en una reunión de expertos en Oslo, la EC y la SGNC son 2 problemas diferentes dentro de trastornos relacionados con el gluten, que incluyen también la alergia al trigo15. Como no hay prueba diagnóstica para la SGNC, esta se define por la exclusión de la EC (ausencia de anti-TGt y de atrofia de vellosidades intestinales en la biopsia duodenal) y de la alergia al trigo en pacientes con síntomas dependientes del gluten. Desde el punto de vista sintomático, la EC y la SGNC son indistinguibles, aunque se considera que la SGNC no tiene asociación a enfermedades sistémicas. La tabla 2 muestra los síntomas de la SGNC observados en 347 casos. En cuanto al HLA, solo alrededor de la mitad de los pacientes con SGNC son DQ2.5 o DQ8. En la EC predomina la respuesta del sistema inmunitario adaptativo con producción de autoanticuerpos: antiendomisio y anti-TGt, que conduce a permeabilidad intestinal y atrofia de vellosidades intestinales. También hay anticuerpos antipéptido deaminado de gliadina, que son casi tan específicos de EC como los anti-TGt. En la SGNC se considera que predomina la respuesta del sistema inmunitario innato. Los anticuerpos IgG antigliadina nativa, que son poco específicos de atrofia de vellosidades intestinales y no son útiles para el diagnóstico de la EC, son útiles para detectar la SGNC, aunque poco sensibles.
Síntomas de la sensibilidad al gluten no celíaca
| Intestinales | |
| Dolor abdominal | 68% |
| Diarrea | 33% |
| Náuseas | |
| Pérdida de peso | |
| Distensión abdominal, flatulencia | |
| Cutáneos | 40% |
| Eritema | |
| Eccema | |
| Generales | |
| Cefalea | 35% |
| Dolor óseo y articular | 11% |
| Contracturas musculares | 34% |
| Parestesias manos, pies | 20% |
| Cansancio crónico | 33% |
| Comportamiento | |
| Disminución de atención | |
| Depresión | 22% |
| Hiperactividad | |
| Orales | |
| Estomatitis ulcerativa crónica | |
Tomado de Czaja-Bulsa11.
Sin embargo, la aproximación operativa y dicotómica de considerar la EC y la SGNC como entidades diferentes no recoge la complejidad de una patología que probablemente es la expresión de un continuo biológico. Son muchos los ejemplos de pacientes que no se pueden considerar celíacos con criterios estrictos, pero que tienen un importante solapamiento con la EC. El ejemplo más claro son los pacientes con enteropatía por gluten sin atrofia de vellosidades. En sujetos sanos, los linfocitos intraepiteliales son pocos y distribuidos predominantemente en la base de la vellosidad. La enteropatía por gluten puede manifestarse sin atrofia de vellosidades, solo como aumento del número de los linfocitos intraepiteliales a lo largo de la vellosidad intestinal, más de 25 linfocitos CD3 por 100 enterocitos, característicamente presentes en la punta de la vellosidad16. Hay pacientes con síntomas concordantes con EC, anticuerpos específicos negativos y sin atrofia de vellosidades, pero con susceptibilidad HLA y linfocitosis intraepitelial en la biopsia duodenal, y que responden a la DSG. Se considera que estos pacientes tienen enteropatía por gluten a pesar de no tener atrofia de vellosidades, y que los marcadores serológicos de EC son sensibles para detectar la atrofia de vellosidades, pero poco sensibles para detectar la enteropatía por gluten no atrófica. Esta enteropatía por gluten, denominada EC Marsh 1, que aplicando criterios estrictos es «no celíaca», ha sido demostrada en varias situaciones clínicas como en familiares de celíacos y en pacientes con intestino irritable17-20. Es importante señalar que la linfocitosis intraepitelial en la biopsia duodenal puede ser infraestimada. Una buena evaluación requiere realizar tinciones con inmunohistoquímica y que las biopsias sean analizadas por un patólogo con experiencia en esta patología. Por otra parte, el aumento de linfocitos intraepiteliales es un hallazgo inespecífico que puede observarse en otras patologías, como la infección por el Helicobacter o la intolerancia a la lactosa. Además de los casos de SGNC que tienen claro solapamiento con la EC, hay pacientes con sensibilidad al gluten claramente fuera del espectro de la EC al no ser ni DQ2.5 ni DQ8, pero con cuadro clínico similar a la EC y respuesta a DSG, con o sin alteraciones en la biopsia duodenal.
Diagnosticar la SGNC es complicado porque no tiene una prueba diagnóstica. La tipificación HLA y la biopsia duodenal solo tienen valor orientativo. Es el conjunto de los datos clínicos, la tipificación HLA y la linfocitosis intraepitelial en la biopsia duodenal, lo que orienta hacia la SGNC, que se confirma con la respuesta a la DSG, e idealmente el empeoramiento tras la provocación doble ciego con gluten. Para complicarlo todavía más, en nuestra experiencia la respuesta a la DSG con frecuencia no es inmediata y puede demorar meses, como sucede en la EC.
La aproximación clínica a la sospecha de EC y SGNC debe tener en cuenta esta complejidad. Si la pregunta es: ¿el paciente es celíaco? Llegar a la respuesta es relativamente sencillo realizando las pruebas que confirman o descartan la EC: los anti-TGt, y la biopsia duodenal si los anti-TGt son positivos. Si hay fuerte sospecha clínica de EC y hay susceptibilidad HLA, está justificado realizar la biopsia duodenal aunque los anti-TGt sean negativos. Pero si la pregunta es: ¿el paciente es sensible al gluten?, el problema es mucho más complejo, ya que no hay pruebas que confirmen o descarten la SGNC después de haber descartado la EC. Hay que tener en cuenta que la serología y la biopsia se deben hacer antes de iniciar una DSG de prueba.
La idea que ha guiado el desarrollo clínico que recoge este artículo es que la SGNC es frecuente y causante de varios problemas reumatológicos. En los siguientes apartados se describen casos clínicos que apoyan esta hipótesis y cómo se ha ido desarrollando el modelo que relaciona la sensibilidad al gluten con problemas reumatológicos.
Sensibilidad al gluten no celíaca y fibromialgiaLa primera situación clínica en la que se buscó la sensibilidad al gluten fue en los pacientes con fibromialgia (FM) refractaria. Son característicos de la FM el cansancio, el dolor musculoesquelético crónico, el intestino irritable y la fatiga mental. Pareció razonable hacer este planteamiento, puesto que estos síntomas también se dan en la EC y el diagnóstico de FM no deja de ser un diagnóstico descriptivo sindrómico. Todavía no estaba acuñado el concepto de SGNC, pero ya se conocía que había pacientes celíacos con anti-TGt negativos, y también la existencia de la enteropatía tipo 1 de Marsh por gluten, sin criterios de EC. Los inicios fueron frustrantes; en muy pocos casos la serología de EC fue positiva, experiencia que coincide con la de otro grupo que no encontró aumento de incidencia de EC en los pacientes con FM realizando serología de EC21. Con autorización del Comité Ético de Investigación Clínica y el acuerdo de cada uno de los pacientes informados, se realizaron gastroscopia y biopsias duodenales a pesar de serología de EC negativa. De nuevo fue frustrante, no se observó atrofia de vellosidades en prácticamente ningún caso. A pesar de ello, se recomendó dieta estricta sin gluten con la ayuda de la Asociación de Celíacos de Madrid, que en la actualidad ya se llama Asociación de Celíacos y Sensibles al Gluten de Madrid. Se recomendó también retirar lácteos y lactosa si había sospecha clínica de intolerancia a lácteos o lactosa, y se recomendó añadir suplementos de vitaminas y minerales, consejos que son frecuentes en los pacientes celíacos. También se minimizó el uso de antiinflamatorios, inhibidores de la bomba de protones y psicofármacos, por su perfil de efectos secundarios tanto sobre el intestino delgado, como sobre el sistema nervioso central.
Las primeras observaciones clínicas fueron sorprendentemente favorables, superando las expectativas. Una selección de 20 de los primeros pacientes con clara respuesta clínica y con enteropatía tipo 1 de Marsh ha sido publicada22. La mejoría clínica relevante se definió como conseguir al menos uno de los siguientes objetivos: remisión de la FM, poder volver a trabajar o a hacer vida normal, o discontinuación de tratamiento con opioides. El tiempo medio de seguimiento fue de 16 meses (5-31). Solo 11 pacientes tenían susceptibilidad DQ2.5 o DQ8. Se dispone de seguimiento clínico con esta estrategia basada en DSG en 246 pacientes con FM, de los que se ha observado mejoría clínica relevante en 90 pacientes (36%). Pensamos que si el paciente es HLA DQ2 o DQ8, y tiene linfocitosis intraepitelial en la biopsia duodenal, es bastante probable que responda a la DSG, aunque su negatividad no lo excluye. De los datos clínicos, los que consideramos más orientativos para detectar la SGNC son: tener una familiar celíaco, aftosis oral reiterada, intestino irritable con predominio diarrea y anemia ferropénica.
Sensibilidad al gluten no celíaca y espondiloartritisEl siguiente grupo de pacientes en que se plantea la SGNC es en la espondiloartritis. Está bien descrito el solapamiento sintomático entre la espondiloartritis y la FM debido a que el dolor lumbar crónico y polientesítico de la espondiloartritis puede ser similar al cuadro fibromiálgico. No existe la prueba analítica que confirme o descarte ninguna de las 2 enfermedades, y no es raro en nuestra experiencia que a los pacientes con FM se les busque la espondiloartritis prerradiológica e incluso se les ponga tratamiento de prueba. En un estudio de 30 pacientes con espondilitis anquilosante, 11 de ellos tuvieron anticuerpos antigliadina positivos y ninguno en el grupo control. Sin embargo, en solo un paciente se confirmó la EC23. Como es importante la etiopatogenia intestinal en las espondiloartritis, y se ha descrito la sacroilitis asociada a la EC24,25, parece razonable postular la SGNC como causa de espondiloartritis enteropática.
A continuación, se exponen observaciones clínicas que argumentan a favor de la espondiloartritis enteropática por SGNC. Se trata de 4 pacientes con espondiloartritis axial, 2 de ellos con espondilitis anquilosante y uno de ellos con espondiloartritis psoriásica. En los 4 pacientes se descartó la EC y se observó una clara respuesta a la DSG, con resolución del dolor lumbar crónico inflamatorio, con recidiva tras ingesta de gluten. En 3 pacientes se realizó biopsia duodenal y se observó linfocitosis intraepitelial.
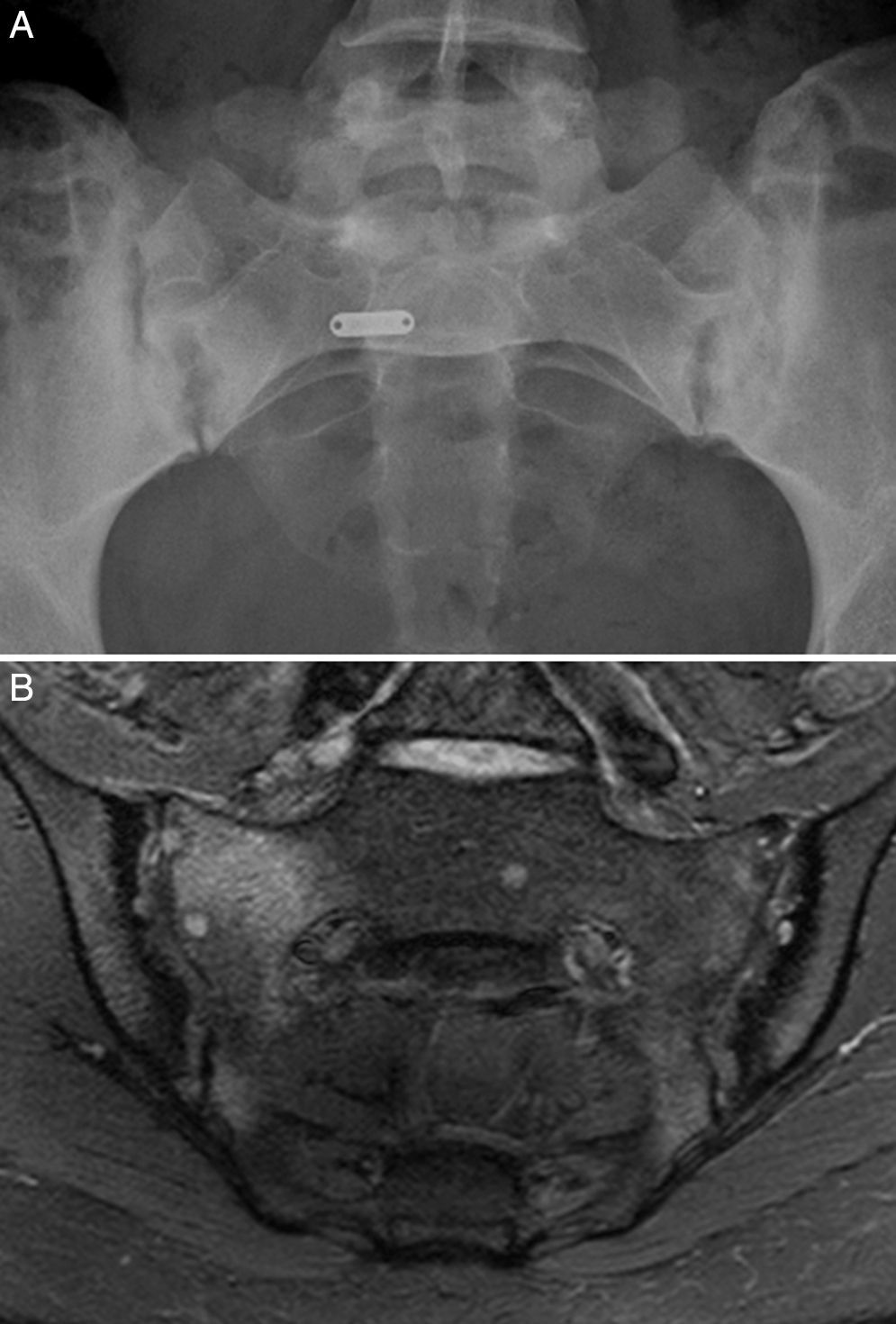
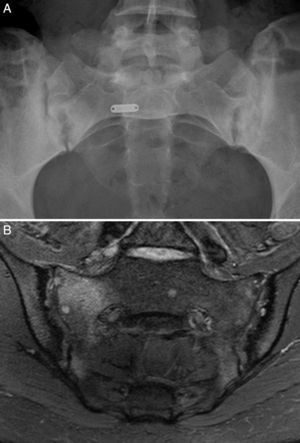
Caso 1: mujer de 28 años, con dolor lumbar crónico inflamatorio y astenia de 10 años de evolución. La radiografía simple mostró evidente sacroilitis bilateral. En la RM de sacroiliacas se objetivaron los siguientes signos de sacroilitis: esclerosis, erosiones y marcado edema óseo periarticular y bilateral (fig. 1). El HLA B27 fue positivo, de modo que el diagnóstico de espondilitis anquilosante quedó establecido. Tenía una hermana con EC. No tenía cuadro digestivo asociado. La serología de EC mediante el test de cribado de anticuerpos antitransglutaminasa y antipéptido deaminado de gliadina, tanto IgG como IgA, fue negativa. La tipificación HLA mostró DQ7 homocigoto, con ausencia de DQ2 y de DQ8. La biopsia duodenal mostró un infiltrado intraepitelial de 37 linfocitos CD3 por 100 enterocitos, sin atrofia de vellosidades. La mejoría del dolor lumbar y la astenia fue clara a los 3 meses de iniciar la DSG. A los 10 meses, había resolución del dolor lumbar crónico, con recidiva tras la toma inadvertida de gluten.
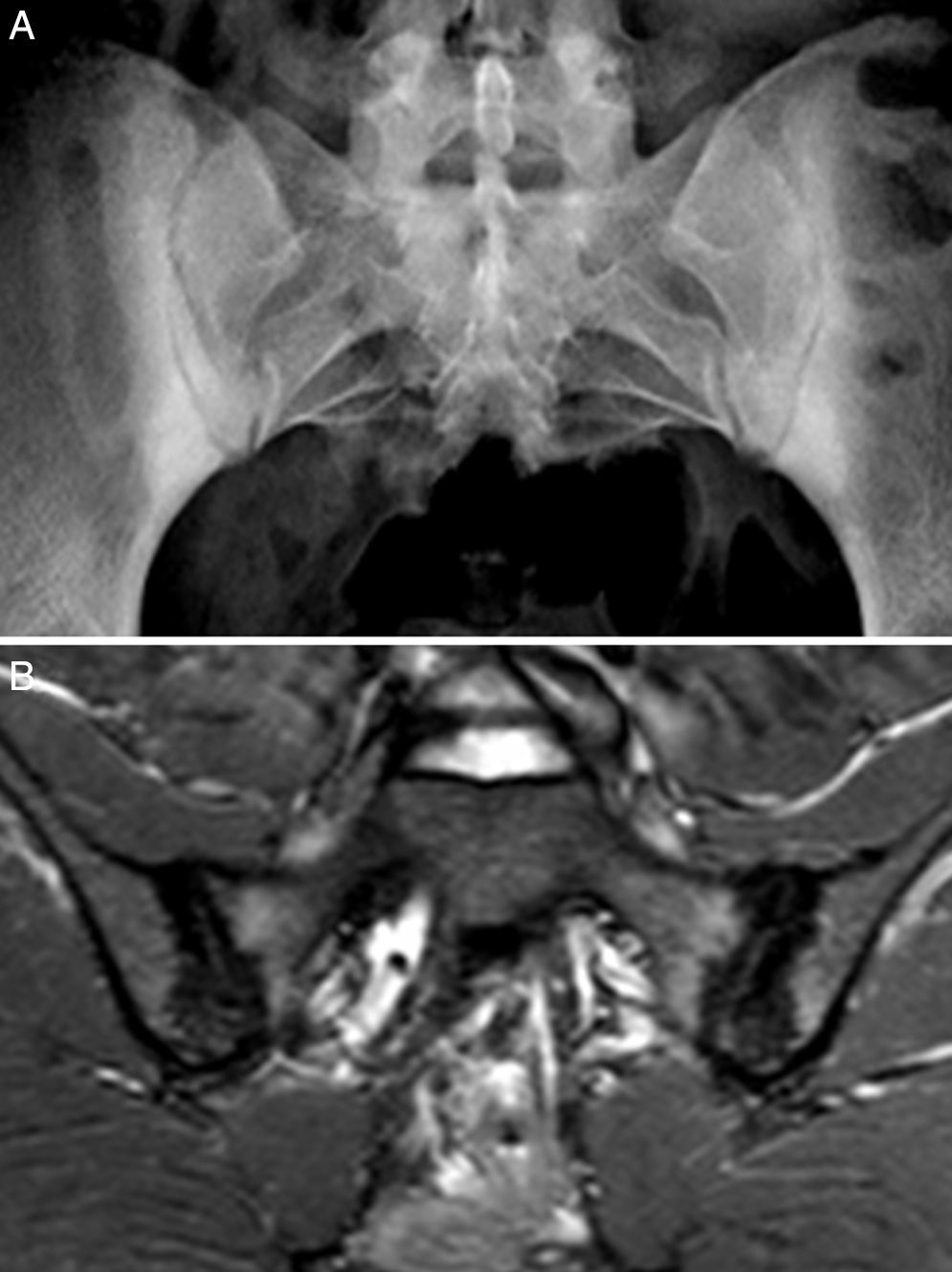
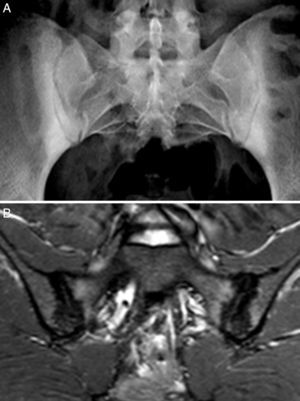
Caso 2: mujer de 28 años, con dolor lumbar crónico de características inflamatorias y dolor generalizado con criterios de FM, de un año de evolución. El HLA B27 fue negativo y los ANA positivos a título bajo 1/80 sin especificidad. La radiografía simple mostró esclerosis de ambas sacroiliacas con un diagnóstico diferencial difícil entre osteítis condensante del iliaco y sacroilitis. La RM mostró esclerosis, erosiones y edema óseo demostrativo de sacroilitis (fig. 2). La paciente reunía, por lo tanto, criterios ASAS de espondiloartritis axial. Además, presentaba un cuadro digestivo asociado con dispepsia, náuseas y vómitos. La serología de cribado de EC fue negativa. La tipificación HLA mostró DQ7 y DQ6, con ausencia de DQ2 y de DQ8. La biopsia duodenal mostró un infiltrado intraepitelial de 44 linfocitos CD3 por 100 enterocitos, sin atrofia de vellosidades. El cuadro clínico remitió tras 7 meses de DSG, tanto el dolor lumbar como el dolor generalizado, y el cuadro digestivo. A los 20 meses de seguimiento, se mantenía la remisión clínica y refería recidiva de dolor y digestiva cuando había tomado gluten.
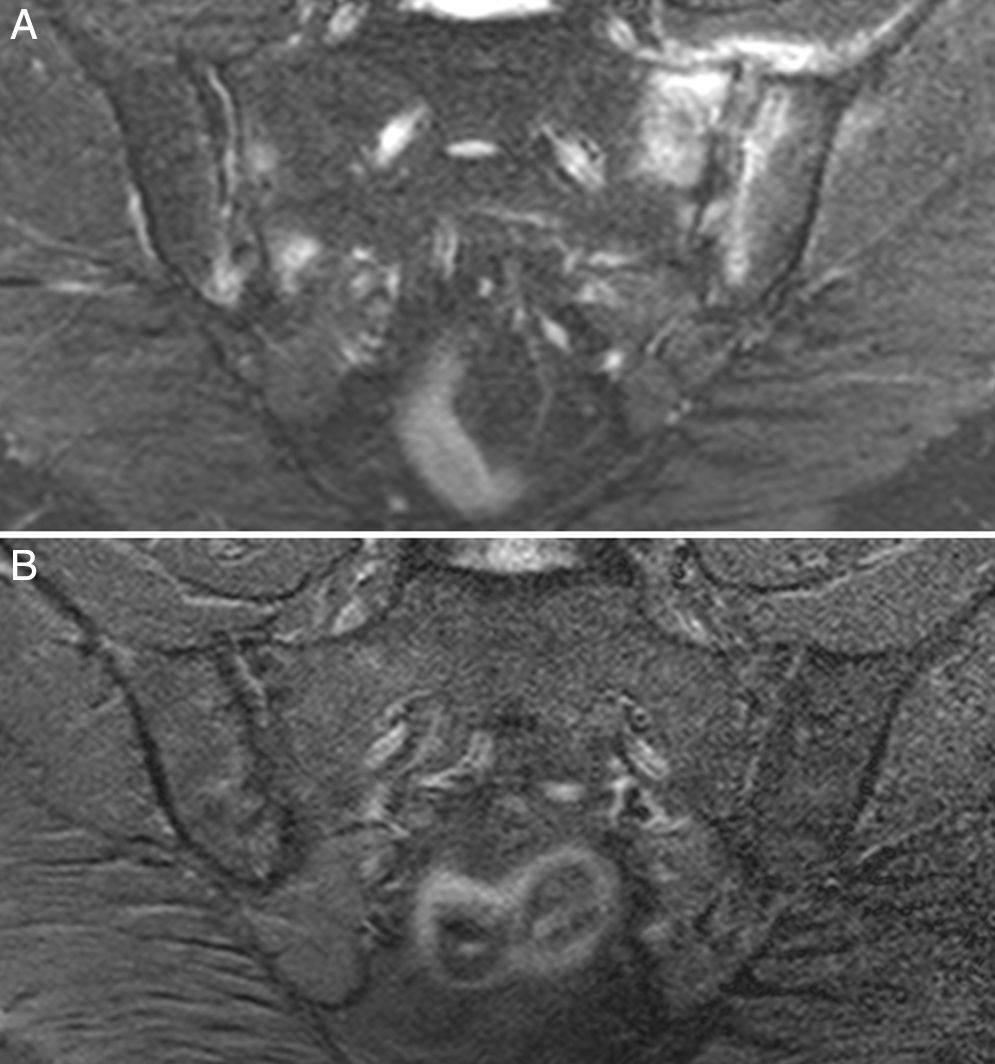
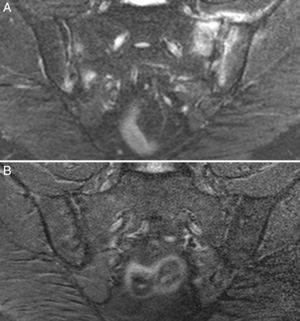
Caso 3: mujer de 50 años, diagnosticada de espondilitis anquilosante hacía 3 años, con sacroilitis bilateral en radiografía simple y HLA B27 positivo. Tenía dolor lumbar inflamatorio severo invalidante y refractario, con insuficiente respuesta a antiinflamatorios no esteroideos, y con difícil manejo debido a la coexistencia de obesidad, espondiloartrosis, hipertensión arterial, alteración crónica de transaminasas, diabetes mellitus, hipotiroidismo autoinmune y diarrea. El dolor condicionaba una vida limitada a uso de muletas y silla de ruedas, con dependencia de otros para su cuidado personal. La ileocolonoscopia con biopsias de íleon y colon fue normal. La RM de sacroiliacas mostraba marcado edema óseo demostrativo de sacroilitis. La serología de cribado de EC fue negativa; el HLA mostró DQ5 homocigoto con ausencia de DQ2 y DQ8. Se ofreció la posibilidad de hacer biopsia duodenal, pero la paciente optó por intentar la DSG sin hacer biopsia duodenal. La evolución con DSG y suplementos de vitamina D fue muy favorable, con remisión del dolor lumbar invalidante y de la diarrea a los 7 meses. Persistía lumbalgia mecánica y astenia. Se añadió dieta sin lácteos con mejoría de la astenia. En la RM de sacroiliacas realizada a los 17 meses de seguimiento se observó remisión del edema óseo (fig. 3). Había recuperado vida activa normal y vuelto a trabajar. No volvió a tomar gluten.
Caso 4: varón de 39 años, con dolor lumbar crónico de más de 15 años de evolución, diagnosticado de espondiloartritis psoriásica sobre la base de sacroilitis con edema óseo en la RM de sacroiliacas y psoriasis personal. La situación del paciente era refractaria y se había propuesto tratamiento con fármacos biológicos antagonistas del factor de necrosis tumoral. Tenía un hijo celíaco, no tenía cuadro digestivo asociado. La serología de EC fue negativa y el HLA mostró DQ2.2 (DQA1*02 DQB1*02). La biopsia duodenal mostró un infiltrado intraepitelial de 60 linfocitos CD3 por 100 enterocitos, sin atrofia de vellosidades. El dolor lumbar mejoró llamativamente en alrededor de un mes con DSG. Al año de seguimiento, se mantenía en remisión del dolor lumbar y tenía recidiva si tomaba gluten. No hubo mejoría de la psoriasis cutánea.
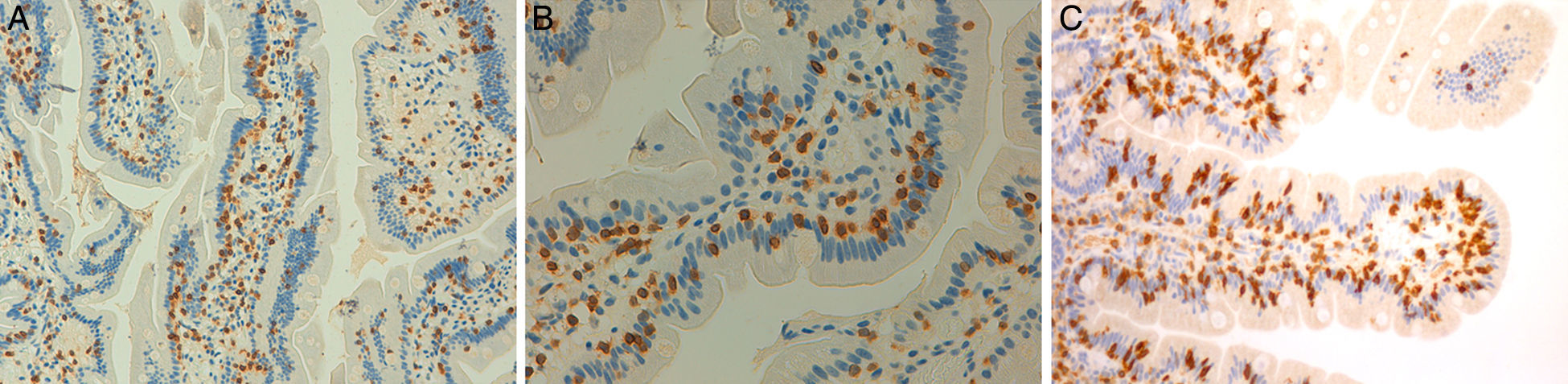
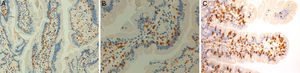
Estos 4 pacientes tienen espondiloartritis axial, 2 de ellos con espondilitis anquilosante y uno con espondiloartritis psoriásica. Son sensibles al gluten, con clara respuesta clínica a la DSG a pesar de haberse descartado la EC. En 2 casos hay un familiar celíaco. La mejoría del dolor lumbar crónico ha sido muy relevante, hasta el punto de la resolución del cuadro clínico, y en un caso se observa remisión del edema en la RM de sacroiliacas tras un largo tiempo de seguimiento. Además, en los 3 pacientes en que ha habido exposición al gluten, esta ha ido seguida de recidiva clínica. Es improbable que una mejoría clínica como la descrita sea debida a casualidad o a efecto placebo. La observación de la linfocitosis intraepitelial junto con la evolución clínica apoya el concepto de espondiloartritis enteropática por SGNC. La figura 4 muestra las biopsias duodenales de los casos 1, 2 y 4, en las que se observa un aumento de los linfocitos dentro del epitelio intestinal.
Biopsias duodenales tras tinción inmunohistoquímica para CD3 en las que se evidencia un aumento del número de linfocitos intraepiteliales, sin acortamiento vellositario ni hiperplasia de criptas. A) Aumento del número linfocitos intraepiteliales a lo largo de la vellosidad intestinal (20×), caso 1. B) Detalle del incremento de linfocitos intraepiteliales (40×), caso 2. C) Detalle del cúmulo de linfocitos intraepiteliales en el ápice de la vellosidad intestinal (40×), caso 4, cortesía del Dr. Fernando Casco, Histocitomed.
La tercera situación clínica en la que se ha buscado la SGNC es en las enfermedades autoinmunes. Es frecuente la persistencia de astenia severa y artralgias sin artritis en los pacientes con enfermedades autoinmunes, a pesar de que se consiga un buen control de los marcadores de inflamación con tratamiento corticoideo e inmunosupresor. Parece razonable pensar que, al igual que la EC se asocia con autoinmunidad, también lo pueda hacer la SGNC. En la FM hemos publicado un caso en el que el familiar celíaco se descubre a partir del paciente sensible al gluten no celíaco26 y esto mismo lo hemos observado en una paciente con SGNC y una poliartritis con características diagnósticas de artritis psoriásica y con anticuerpos anti-PCC y anti-Ro positivos27. A continuación, se exponen casos clínicos que apoyan la existencia de SGNC asociada a enfermedades autoinmunes.
Caso 5: mujer de 51 años, seguida en otro centro por artritis reumatoide erosiva, anti-PCC positivo. Su situación clínica había sido de mal control pese a tratamientos químicos y biológicos. Era refractaria a tratamiento anti-TNF y había sido incluida en ensayos clínicos de nuevos biológicos, como ocrelizumab. Estaba en tratamiento con metotrexato, rituximab, corticoides, indometacina, inhibidores de la bomba de protones y sertralina. A pesar de que la inflamación articular estaba razonablemente controlada con tratamiento inmunosupresor, tenía dolor y astenia severa, diarrea, distensión abdominal y aftas orales. El dolor y la astenia severa condicionaban una vida dependiente. La serología de EC fue negativa. Se decidió intentar DSG sin hacer ni tipificación HLA ni biopsia duodenal. La DSG fue seguida de clara mejoría de todo su cuadro clínico en 6 meses. A los 4 años de mantener DSG, se mantenía en excelente situación clínica, hacía vida independiente, excursiones por el campo y bailaba zumba. Mantenía tratamiento con metotrexato 15mg por vía oral semanal y prednisona 2,5mg diarios. Si tomaba gluten tenía recidiva de la diarrea, la astenia y la artritis, corroborando así la sensibilidad al gluten.
Caso 6: mujer de 39 años, remitida por poliartritis simétrica, incluyendo afectación de MCF e IFP, de 6 años de evolución. El FR, anti-CCP, ANA y HLA B27 eran negativos. Había recibido tratamiento con salazopirina y corticoides, con mejoría parcial. Asociaba importante astenia, aftas orales e historia de anemia ferropénica. Había sido diagnosticada previamente de intestino irritable. La serología de enfermedad celíaca fue negativa. LA tipificación HLA mostró la presencia de HLA DQ8 y la biopsia duodenal mostró 34 CD3 por 100 enterocitos. A los 9 meses de iniciar DSG, había resolución de todo el cuadro clínico. Estaba asintomática, manteniendo solo salazopirina 1,5 g diarios, y se había resuelto la anemia previa. A los 2 años de iniciar DSG, se mantenía asintomática sin mediación. Se desestimó hacer provocación con gluten.
Caso 7: mujer de 49 años, diagnosticada de esclerosis sistémica, forma limitada. Tenía Raynaud severo, con anticuerpos anticentrómero 1/2.560. El resto de la analítica era normal, salvo Hb 11,5g/dl. La gastroscopia mostraba gastropatía hipertensiva con angiodisplasia gástrica (water melon). El estudio de afectación cardiopulmonar era negativo. El cuadro clínico era de 4 años de evolución. Tenía astenia severa, problemas de concentración y de memoria, distensión abdominal, diarrea intermitente, reflujo gastroesofágico y aftas orales. No había tolerado tratamiento corticoideo. La tinción con inmunohistoquímica de la biopsia duodenal previamente considerada normal mostró 25 CD3 por 100 enterocitos. Tenía el haplotipo HLA DQ2.5. A los 6 meses de iniciar DSG, habían mejorado el cuadro digestivo, el cansancio y el Raynaud. Había retirado el nifedipino que tomaba previamente. Se añadieron suplementos polivitamínicos con minerales, coenzima Q10 y omega 3. A los 18 meses de DSG, estaba asintomática, con resolución del cuadro digestivo, la astenia y la fatiga mental. Tenía Raynaud ocasional. Los anticuerpos anticentrómero eran positivos 1/160. La toma de gluten ocasional había ido seguida de forma inmediata de astenia, aftas orales y recidiva de la clínica digestiva.
Caso 8: mujer de 46 años, con un cuadro de más de 10 años de evolución con poliartritis y síndrome seco al, que posteriormente se añade fenómeno de Raynaud, teleangiectasias y úlceras digitales. Los datos analíticos mostraban FR 556 U, anti-ENA SS-A/Ro > 600, anti-ENA U1 RNP 140 y anti-ENA RNP-70 114. La capilaroscopia era concordante con esclerosis sistémica. La biopsia de glándula salival era concordante con enfermedad de Sjögren. Se le había prescrito tratamiento con corticoides, metotrexato, antipalúdicos, azatioprina, leflunomida, estatinas, antiagregación, antiiniflamatorios no esteroideos, inhibidores de la bomba de protones y antidepresivos. Había tenido efectos secundarios de la medicación y mal cumplimiento del tratamiento. Asociaba astenia severa, diarrea y aftas orales. La serología de enfermedad celíaca fue negativa y la biopsia duodenal, normal. La tipificación HLA mostró DQ2.2 (DQA1*02 DQB1*02) y DQ8. A los 4 meses de iniciar DSG tuvo clara mejoría de síntomas digestivos, astenia y aftas orales, así como mejoría de la tumefacción en manos y lesiones digitales. Si tomaba gluten, tenía recidiva de diarrea. Dos años después, la paciente se encuentra bien, en tratamiento con DSG, leflunomida 10mg diarios, Dacortín® 2,5mg diarios y suplementos con vitaminas y minerales. Los marcadores de autoinmunidad seguían siendo positivos a títulos similares.
Caso 9: mujer de 44 años, remitida de otro centro por artritis de repetición. Había tenido ANA positivo fluctuante y anticardiolipina IgG e IgM positivo a título bajo. Asociaba diarrea e importante astenia; había sido diagnosticada de síndrome de intestino irritable, y tenía una hija celíaca. Se había descartado la EC mediante serología negativa y biopsia duodenal, a pesar de lo cual la paciente desde hacía 3 años hacía DSG no estricta, con clara mejoría de su sintomatología, y empeoraba si tomaba gluten. No quería hacer provocación. Los ANA eran positivos 1/160 y los anticuerpos anticardiolipina eran negativos. Portaba el haplotipo HLA DQ2.5 y la revisión de la biopsia duodenal previa mostró enteropatía tipo 1 de Marsh 1, con 33 linfocitos CD3 por cada 100 enterocitos. Se recomendó dieta estricta sin gluten y retirar lácteos, y se añadieron suplementos de vitaminas y minerales, y omega 3. En el seguimiento a los 2 años estaba en remisión del cuadro digestivo, de astenia y del cuadro articular. Los ANA eran positivos a título 1/80 y los anticardiolipina seguían siendo negativos.
Recientemente, se ha descrito que un 14% de los pacientes con SGNC tiene enfermedad autoinmune asociada, fundamentalmente enfermedad tiroidea autoinmune y psoriasis14. Estos casos clínicos incluyen poliartritis no filiada, poliartritis asociada con ANA y con anticardiolipina, artritis reumatoide refractaria, esclerosis sistémica y enfermedad mixta del tejido conectivo. Ilustran que la SGNC se puede asociar con una variedad de enfermedades autoinmunes. Resulta llamativa la evolución favorable con DSG de estos pacientes que tenían muy mala situación clínica, a pesar de la escalada de tratamiento inmunosupresor. De la misma forma que con la FM y la espondiloartritis, es improbable que la buena evolución haya sido debida a casualidad o efecto placebo y, por lo tanto, plantea hasta qué punto la DSG puede tener un papel importante en el tratamiento de estos pacientes. Es importante destacar que la mejoría clínica permitió el descenso o la retirada del tratamiento inmunosupresor. La evolución clínica favorable se produjo a pesar de la persistencia de marcadores de autoinmunidad positivos, aunque en algún caso se ha observado también su evolución favorable. Como en la FM y en las espondiloartritis, los datos que orientan a la presencia de SGNC son la astenia severa, las aftas orales, el cuadro digestivo asociado y tener un familiar celíaco. Estas observaciones clínicas contrastan con el estudio de Vives et al., en el que apenas encuentran enteropatía por gluten en las enfermedades sistémicas28. Esto puede ser debido a que nosotros describimos la SGNC sobre la base de la respuesta clínica, incluyendo tanto las formas más próximas a la EC con HLA de susceptibilidad y enteropatía Marsh 1, como también las formas más alejadas de la EC, incluso sin necesidad de demostrar enteropatía. El estudio de Vives et al. busca la enteropatía por gluten realizando biopsia duodenal en pacientes con serología de EC positiva, o HLA de susceptibilidad, o con síntomas indicativos de EC; y para el diagnóstico de enteropatía por gluten requiere la demostración de enteropatía y, además de la respuesta clínica, la respuesta analítica o histológica.
Estas observaciones clínicas de SGNC asociada a enfermedades sistémicas en las que el beneficio de la dieta puede tardar meses en apreciarse contrastan con las ideas aceptadas sobre la SGNC que la consideran un problema no autoinmune, y en la que la respuesta clínica a la DSG es fácil de apreciar en pocos días o semanas.
ConclusionesLa EC es una enfermedad autoinmune con un amplio abanico de manifestaciones reumatológicas, que debe ser tenida en cuenta por el reumatólogo. La SGNCes un problema probablemente más frecuente que la EC, con síntomas similares, pero de difícil diagnóstico debido a la ausencia de pruebas diagnósticas específicas. En este artículo postulamos la hipótesis, sobre la base de argumentos razonables y observaciones clínicas, de que la SGNC se asocia a una amplia gama de manifestaciones reumatológicas que incluyen la FM, las espondiloartritis y las enfermedades autoinmunes sistémicas. En nuestra experiencia, los datos clínicos más importantes que indican la presencia de SGNC son la astenia severa no explicada, las aftas orales, el cuadro digestivo asociado, la anemia ferropénica y tener un familiar celíaco. Estos datos clínicos parecen particularmente a tener en cuenta cuando el paciente con una enfermedad sistémica tiene un cuadro fibromiálgico asociado. La buena evolución tras la DSG, tanto de las manifestaciones de tipo fibromiálgico, como también de la artritis y la sacroilitis, nos hacen pensar que la sensibilidad al gluten puede tener un papel etiopatogénico que contribuye de forma desencadenante en algunos pacientes con enfermedades autoinmunes sistémicas. Por supuesto, son necesarios estudios prospectivos y ensayos clínicos con provocación doble ciego para aclarar hasta qué punto la SGNC es frecuente, y su tratamiento relevante, en las enfermedades reumatológicas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónMSD Inmunología contribuyó de forma decisiva en las primeras fases de este trabajo proporcionando recursos económicos para hacer la inmunohistoquímica de las biopsias duodenales. Genyca Innova ha contribuido en la realización de la tipificación HLA de estos pacientes.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.
A los autores de este trabajo que no están incluidos entre los firmantes debido a la limitación del número de autores de las normas editoriales: Natalia Fernández Puga, especialista de Digestivo del Hospital Puerta de Hierro; Isabel Colmenero y Fernando Casco, patólogos del Birmingham Children's Hospital y de Labco; María José Castro Panete, inmunóloga del Hospital Doce de Octubre, y a la Asociación de Celíacos y Sensibles al Gluten de Madrid.