Describir el manejo terapéutico de la artritis reumatoide (AR), la artritis psoriásica (Aps) y la espondilitis anquilosante (EA) en pacientes que inician tratamiento con agentes biológicos.
Materiales y métodosEstudio observacional, retrospectivo, longitudinal en 33 hospitales españoles. Se incluyeron pacientes con AR, Aps y EA que iniciaron tratamiento con agentes biológicos entre septiembre de 2009 y agosto de 2010, con un seguimiento de más de 3 años. Se analizaron las características clínico-demográficas, los fármacos, la supervivencia de la terapia biológica y las causas de cambio o interrupción.
ResultadosSe incluyeron 463 pacientes (183 AR, 119 Aps y 161 EA) con un seguimiento medio de 3,8 años. Al final del seguimiento una elevada proporción continuaba con el primer biológico prescrito (41,0% de AR, 59,7% de Aps y 51,6% de EA), precisando ajustes de dosis el 31,1%, 47,9% y 42,9% de pacientes con AR, Aps y EA, respectivamente. Hubo interrupción temporal en el 8,2%, 8,4% y 15,5% de los pacientes y se precisó cambio de biológico en el 37,7%, 26,1% y 24,2%. La interrupción definitiva ocurrió en el 13,1%, 5,9% y 8,7% de pacientes con AR, Aps y EA, respectivamente. El tiempo medio de cambio o interrupción fue de 30,1 meses para la AR y de 35,7 meses para la Aps y la EA.
ConclusionesNuestros resultados sugieren que, en la práctica, la mitad de los pacientes con AR y 2/3 con Aps o EA continúan con el primer biológico, pero con frecuentes ajustes de tratamiento.
To describe the therapeutic management of Rheumatoid Arthritis (RA), Psoriatic Arthritis (PsA) and Ankylosing Spondylitis (AS) in patients initiating treatment with biological agents.
Materials and methodsObservational, retrospective, longitudinal study in 33 Spanish hospitals. Patients with RA, PsA and AS starting treatment with biological agents between September 2009 and August 2010 and a follow-up longer than 3 years were included. Clinical-demographic characteristics, drugs, biological therapy survival, and reasons for discontinuation or switching were analyzed.
ResultsFour hundred and sixty-three patients were included (183 RA, 119 PsA and 161 AS), with a mean follow-up of 3.8 years. At the end of follow-up, a high proportion continued with the first biological prescribed (41.0% of RA, 59.7% of PsA and 51.6% of AS), 31.1%, 47.9% and 42.9% of RA, PsA and AS patients requiring dosage adjustments, respectively. There was temporary discontinuation in 8.2%, 8.4% and 15.5% of patients, and a switch of biologic agent was required in 37.7%, 26.1% and 24.2%. Definitive discontinuation occurred in 13.1%, 5.9% and 8.7% of RA, PsA and AS patients, respectively. Mean time to discontinuation or switching was 30.1 months for RA and 35.7 months for PsA and AS.
ConclusionsOur results suggest that, in practice, half of patients with RA and two thirds with PsA or AS maintained the first biological, but with frequent dose adjustments.
Artritis reumatoide (AR), artritis psoriásica (Aps) y espondilitis anquilosante (EA) constituyen la causa más frecuente de artropatías inflamatorias y cursan con inflamación, dolor y daño en las articulaciones y otros órganos, lo que reduce la funcionalidad de los pacientes, la calidad de vida y aumenta la mortalidad1. AR, Aps y EA, en conjunto, afectan al 1% de la población general2,3. Estas enfermedades son una carga económica para la sociedad, más aún teniendo en cuenta el aumento de la esperanza de vida. La existencia de mejores opciones terapéuticas podría repercutir en la calidad de vida de los pacientes y ahorraría recursos y costes al servicio sanitario4-6.
El desarrollo de fármacos biológicos ha mejorado el tratamiento y pronóstico de los pacientes reumáticos, reduciendo la pérdida de la función articular y el dolor7,8.
El registro BIOBADASER 2.0 mostró que el 50% de pacientes había suspendido el tratamiento biológico a los 4 años9,10. Los pacientes con Aps o EA siguen el tratamiento durante más tiempo que los pacientes con AR, con tasas de supervivencia de la primera terapia biológica a los 3 años de 0,73, 0,76 y 0,65, respectivamente11. Otros estudios, incluyendo el registro DANBIO, describen la falta de eficacia, efectos secundarios, edad, sexo y preferencias del paciente, entre otros, como factores asociados a la supervivencia de fármacos biológicos en enfermedades reumáticas10,12-14. Así, en pacientes más jóvenes la causa más frecuente de suspensión es la falta de eficacia, mientras que en los de mayor edad son los acontecimientos adversos (AA), especialmente en AR. Las cuestiones relacionadas con la supervivencia farmacológica y los patrones posológicos de los fármacos biológicos en España se habían analizado previamente en pacientes reumáticos tratados con etanercept10,14. No obstante, no se dispone de datos sobre manejo terapéutico global de pacientes con enfermedades reumáticas tratados con fármacos biológicos en España, especialmente en lo que respecta a la optimización de dosis y cambios entre diferentes fármacos biológicos. El presente estudio tiene como objetivo analizar el manejo terapéutico de la AR, la Aps y la EA en pacientes en los que se instauró tratamiento biológico. Esto incluye la descripción de los patrones de tratamiento iniciales y posteriores, los motivos para el cambio y la supervivencia de los biológicos.
Materiales y métodosDiseño del estudioEstudio observacional, retrospectivo, longitudinal, realizado en 33 hospitales públicos de 14 comunidades autónomas españolas. La lista de centros e investigadores se incluye en los archivos suplementarios. Se revisaron las historias clínicas de los pacientes con AR, Aps o EA que comenzaron el tratamiento con fármacos biológicos entre el 1 de septiembre de 2009 y el 31 de agosto de 2010. La fecha de inicio del primer biológico se definió como la primera prescripción para la AR, Aps o EA. Se extrajeron los datos longitudinales que cubrían entre 36 y 48 meses después de la fecha de inicio del primer biológico. Los investigadores incluyeron 5 pacientes con AR, Aps y EA de su base de datos, seleccionados de forma consecutiva en función de la fecha de inicio del fármaco biológico a partir de septiembre de 2009. Debido a las dificultades para incluir pacientes en algunos centros se pasó a una inclusión competitiva 6 semanas después del cierre del periodo de reclutamiento en el último centro incluido. La extracción de datos se realizó entre agosto de 2013 y mayo de 2014.
El protocolo del estudio fue aprobado por el Comité Ético del Hospital Clínic i Provincial de Barcelona, y clasificado por la Agencia Española de Medicamentos y Productos Sanitarios como estudio postautorización con otros diseños diferentes al de seguimiento prospectivo (EPA-OD). El estudio se llevó a cabo de conformidad con los principios de la Declaración de Helsinki.
Para minimizar el sesgo de selección se registraron todos los pacientes que habían iniciado tratamiento con fármacos biológicos en el período de estudio y posteriormente se aplicaron los criterios de inclusión y exclusión.
Los pacientes debían cumplir todos los criterios de inclusión:
- 1)
Al menos tener 18 años de edad en la fecha de inicio del primer biológico.
- 2)
Diagnóstico de AR, Aps o EA en la fecha de inicio del primer biológico según los criterios de clasificación del Colegio Americano de Reumatología de 1987 o los del Colegio Americano de Reumatología de 2010/de la Liga Europea contra los Reumatismos10,13 para la AR. La Aps se clasificó de acuerdo con los criterios CASPAR14 y se definió mediante presencia de al menos 3 articulaciones inflamadas y 3 dolorosas, factor reumatoide negativo y presencia de psoriasis en placas con una lesión confirmada de al menos 2cm de diámetro. Para la EA se emplearon los criterios modificados de Nueva York de 198415.
- 3)
Inicio del tratamiento con biológicos entre 36-48 meses antes de la inclusión, independientemente de si el tratamiento se interrumpió o modificó después de dicha fecha.
- 4)
Disponibilidad de historias clínicas con al menos la información mínima obligatoria para el estudio (desde la visita o la fecha de inicio del primer biológico hasta la fecha de inclusión o muerte).
- 5)
Consentimiento informado firmado por el paciente, excepto en aquellos hospitales en los que no se consideró necesario.
Los criterios de exclusión del estudio fueron:
- 1)
Trastornos médicos o psicológicos que comprometieran la capacidad del paciente para otorgar el consentimiento informado, según criterio del investigador.
- 2)
Participación en cualquier ensayo clínico durante el periodo de estudio.
- 3)
Tratamiento biológico para una indicación diferente de AR, Aps o EA.
Se recogieron los datos demográficos incluyendo la edad, el sexo, la raza, la residencia y el estado civil. La presencia de enfermedades concomitantes se recopiló según criterio médico a partir de una lista predefinida (osteoporosis, asma, enfermedad pulmonar obstructiva crónica, angina de pecho, insuficiencia cardíaca congestiva, infarto agudo de miocardio, enfermedad neurológica, accidente cerebrovascular, enfermedad vascular periférica, diabetes tipo 1, diabetes tipo 2, enfermedad gastrointestinal, ansiedad, depresión, otras enfermedades psicológicas, deficiencia visual, deficiencia auditiva, obesidad o índice de masa corporal>30, hipertensión, dislipidemia, neoplasia y otras enfermedades). Las características de la enfermedad incluyeron el uso de tratamientos concomitantes (antinflamatorios no esteroideos [AINE], glucocorticoides y fármacos antirreumáticos modificadores de la enfermedad [FAME]), duración de la enfermedad, número de articulaciones dolorosas e inflamadas, valoración general por el paciente, velocidad de sedimentación globular (VSG) e índice de actividad de la enfermedad de 28 articulaciones (DAS28). Los datos del tratamiento biológico incluyeron fármaco activo, dosis y frecuencia prescrita inicialmente, así como cualquier modificación de la prescripción durante el periodo del estudio. Se definió la información mínima necesaria disponible para cada enfermedad en la fecha de inicio del primer biológico y al menos en las visitas de seguimiento con modificación del tratamiento. La información mínima necesaria obtenida en los 30 días previos para pacientes con AR o Aps incluía el número de articulaciones dolorosas e inflamadas (recuentos de 28 articulaciones), un reactante de fase aguda (VSG y proteína C reactiva). En pacientes con EA se empleó el índice BASDAI y un reactante de fase aguda, mientras que en Aps se obtuvieron, además de los recuentos articulares, los índices de lesión cutánea PASI y BSA y BASDAI cuando procedía.
Tamaño del estudio y métodos estadísticosDebido a la variabilidad en los resultados notificados previamente4,10,14 el tamaño muestral para cada enfermedad se estimó suponiendo una proporción de modificación del tratamiento del 50%, que maximiza el tamaño de muestra necesario. El tamaño de muestra objetivo era de 228 pacientes para cada enfermedad, teniendo en cuenta una precisión del 6,5% y un nivel de significación del 0,05.
Los pacientes fueron incluidos independientemente de la duración de su seguimiento. El tiempo de seguimiento se calculó como el número de años entre la fecha de inicio del primer biológico y la última visita de seguimiento.
En la fecha de inicio del primer biológico la dosis inicial del fármaco biológico se describió en comparación con las recomendaciones incluidas en la ficha técnica del producto definiendo 2 desviaciones: a) reducción progresiva de dosis, tanto disminución como intervalos posológicos más amplios; y b) aumento progresivo de dosis, incluyendo tanto aumento como intervalos posológicos más reducidos. Además, los cambios obtenidos durante el periodo de seguimiento se clasificaron en las siguientes categorías: a) cambio de tratamiento, pacientes que discontinuaron el tratamiento con el primer fármaco biológico prescrito e iniciaron tratamiento con un fármaco biológico diferente; b) interrupción, durante menos de 12meses, y reinicio del tratamiento con el mismo fármaco biológico; y c) discontinuación, pacientes que discontinuaron el tratamiento con un fármaco biológico y no iniciaron tratamiento con ningún otro tratamiento biológico durante los 12 meses posteriores.
De acuerdo con el objetivo del estudio no se emplearon técnicas de imputación para el tratamiento de datos desconocidos. Se analizó el porcentaje de pacientes que requirieron modificación del tratamiento, el tiempo transcurrido hasta la primera modificación, el motivo de la modificación, el número de modificaciones ajustado por la duración del seguimiento y el tiempo medio entre modificaciones consecutivas. Se utilizaron curvas de supervivencia de Kaplan-Meier para describir el tiempo transcurrido hasta el abandono del tratamiento biológico (discontinuación o cambio de biológico). Los pacientes sin discontinuación o con cambio de tratamiento se consideraron datos censurados. Se utilizaron análisis de regresión de Cox para identificar factores pronósticos independientes de abandono del tratamiento biológico.
Todos los análisis se llevaron a cabo utilizando SAS v9.2.
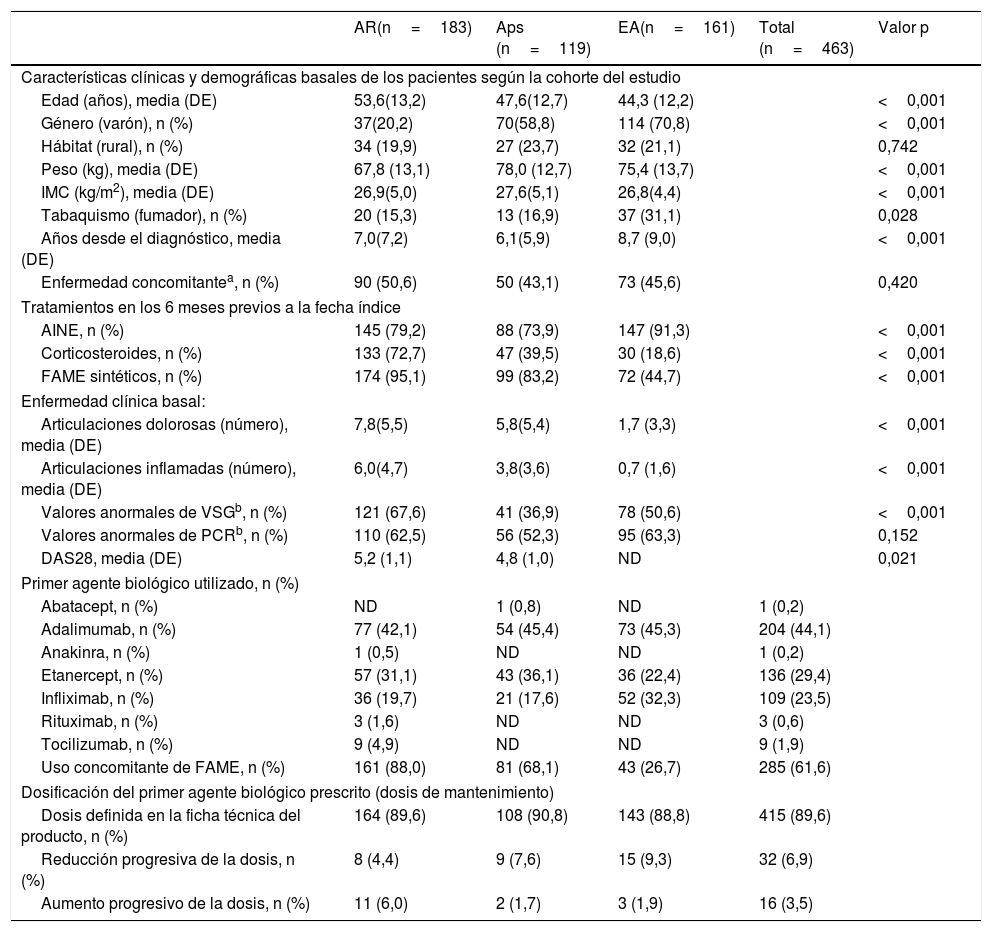
ResultadosSe reclutaron 492 pacientes: 183 (39,5%) con AR, 119 (25,7%) con Aps y 161 (34,8%) con EA; se excluyeron 29 (5,9%) pacientes debido a la pérdida de información de seguimiento o a la ausencia de uso de fármaco biológico. En el momento de inicio el tiempo transcurrido desde el diagnóstico fue mayor en pacientes con EA que con AR y Aps. Tal y como se esperaba, el uso previo de FAME sintéticos en el periodo basal fue menor en pacientes con EA que con AR y Aps. El DAS28 medio fue menor en pacientes con Aps que con AR (tabla 1). En la muestra de AR, el 78,9% de pacientes fueron positivos para el factor reumatoide, el 75,8% positivos para anticuerpos antipéptidos citrulinados y el 55,9% presentaron erosiones óseas. En Aps el 68,1% presentaron enfermedad principalmente localizada en articulaciones periféricas, el 10,9% enfermedad axial y el 23,5% enfermedad mixta. En EA el 84,4% fueron HLA-B27 positivo.
Características basales de los pacientes según la cohorte del estudio
| AR(n=183) | Aps (n=119) | EA(n=161) | Total (n=463) | Valor p | |
|---|---|---|---|---|---|
| Características clínicas y demográficas basales de los pacientes según la cohorte del estudio | |||||
| Edad (años), media (DE) | 53,6(13,2) | 47,6(12,7) | 44,3 (12,2) | <0,001 | |
| Género (varón), n (%) | 37(20,2) | 70(58,8) | 114 (70,8) | <0,001 | |
| Hábitat (rural), n (%) | 34 (19,9) | 27 (23,7) | 32 (21,1) | 0,742 | |
| Peso (kg), media (DE) | 67,8 (13,1) | 78,0 (12,7) | 75,4 (13,7) | <0,001 | |
| IMC (kg/m2), media (DE) | 26,9(5,0) | 27,6(5,1) | 26,8(4,4) | <0,001 | |
| Tabaquismo (fumador), n (%) | 20 (15,3) | 13 (16,9) | 37 (31,1) | 0,028 | |
| Años desde el diagnóstico, media (DE) | 7,0(7,2) | 6,1(5,9) | 8,7 (9,0) | <0,001 | |
| Enfermedad concomitantea, n (%) | 90 (50,6) | 50 (43,1) | 73 (45,6) | 0,420 | |
| Tratamientos en los 6 meses previos a la fecha índice | |||||
| AINE, n (%) | 145 (79,2) | 88 (73,9) | 147 (91,3) | <0,001 | |
| Corticosteroides, n (%) | 133 (72,7) | 47 (39,5) | 30 (18,6) | <0,001 | |
| FAME sintéticos, n (%) | 174 (95,1) | 99 (83,2) | 72 (44,7) | <0,001 | |
| Enfermedad clínica basal: | |||||
| Articulaciones dolorosas (número), media (DE) | 7,8(5,5) | 5,8(5,4) | 1,7 (3,3) | <0,001 | |
| Articulaciones inflamadas (número), media (DE) | 6,0(4,7) | 3,8(3,6) | 0,7 (1,6) | <0,001 | |
| Valores anormales de VSGb, n (%) | 121 (67,6) | 41 (36,9) | 78 (50,6) | <0,001 | |
| Valores anormales de PCRb, n (%) | 110 (62,5) | 56 (52,3) | 95 (63,3) | 0,152 | |
| DAS28, media (DE) | 5,2 (1,1) | 4,8 (1,0) | ND | 0,021 | |
| Primer agente biológico utilizado, n (%) | |||||
| Abatacept, n (%) | ND | 1 (0,8) | ND | 1 (0,2) | |
| Adalimumab, n (%) | 77 (42,1) | 54 (45,4) | 73 (45,3) | 204 (44,1) | |
| Anakinra, n (%) | 1 (0,5) | ND | ND | 1 (0,2) | |
| Etanercept, n (%) | 57 (31,1) | 43 (36,1) | 36 (22,4) | 136 (29,4) | |
| Infliximab, n (%) | 36 (19,7) | 21 (17,6) | 52 (32,3) | 109 (23,5) | |
| Rituximab, n (%) | 3 (1,6) | ND | ND | 3 (0,6) | |
| Tocilizumab, n (%) | 9 (4,9) | ND | ND | 9 (1,9) | |
| Uso concomitante de FAME, n (%) | 161 (88,0) | 81 (68,1) | 43 (26,7) | 285 (61,6) | |
| Dosificación del primer agente biológico prescrito (dosis de mantenimiento) | |||||
| Dosis definida en la ficha técnica del producto, n (%) | 164 (89,6) | 108 (90,8) | 143 (88,8) | 415 (89,6) | |
| Reducción progresiva de la dosis, n (%) | 8 (4,4) | 9 (7,6) | 15 (9,3) | 32 (6,9) | |
| Aumento progresivo de la dosis, n (%) | 11 (6,0) | 2 (1,7) | 3 (1,9) | 16 (3,5) | |
a La presencia de enfermedades concomitantes se evaluó utilizando una lista predefinida (osteoporosis, asma, EPOC, angina, insuficiencia cardíaca congestiva, infarto agudo de miocardio, enfermedad neurológica, accidente cerebrovascular, enfermedad vascular periférica, diabetes tipo 1, diabetes tipo 2, enfermedad gastrointestinal, ansiedad, depresión, otras enfermedades psicológicas, discapacidad visual, impedimentos auditivos, obesidad o IMC>30, hipertensión, dislipidemia, neoplasia y otras enfermedades).
b De acuerdo con los valores de referencia utilizados en los laboratorios de los centros participantes.
AINE: antinflamatorios no esteroideos; Aps: artritis psoriásica; AR: artritis reumatoide; DAS28: índice de actividad de la enfermedad de 28 articulaciones; DE: desviación estándar; EA: espondilitis anquilosante; FAME: fármaco antirreumático modificador de la enfermedad; IMC: índice de masa corporal; ND: no definido; PCR: proteína C reactiva; VSG: velocidad de sedimentación globular.
El principal motivo para el inicio del tratamiento biológico fue la falta de respuesta al tratamiento previo (96,7% de pacientes con AR, 95,8% con Aps y 95,7% con EA). Adalimumab, etanercept e infliximab fueron los fármacos usados con mayor frecuencia, en 204 (44,1%), 136 (29,4%) y 109 (23,5%) pacientes, respectivamente (tabla 1). La mayoría de pacientes iniciaron la fase de mantenimiento del tratamiento biológico utilizando la posología definida en la ficha técnica y, posteriormente, el 6,9% redujo progresivamente la dosis y el 3,5% la aumentó.
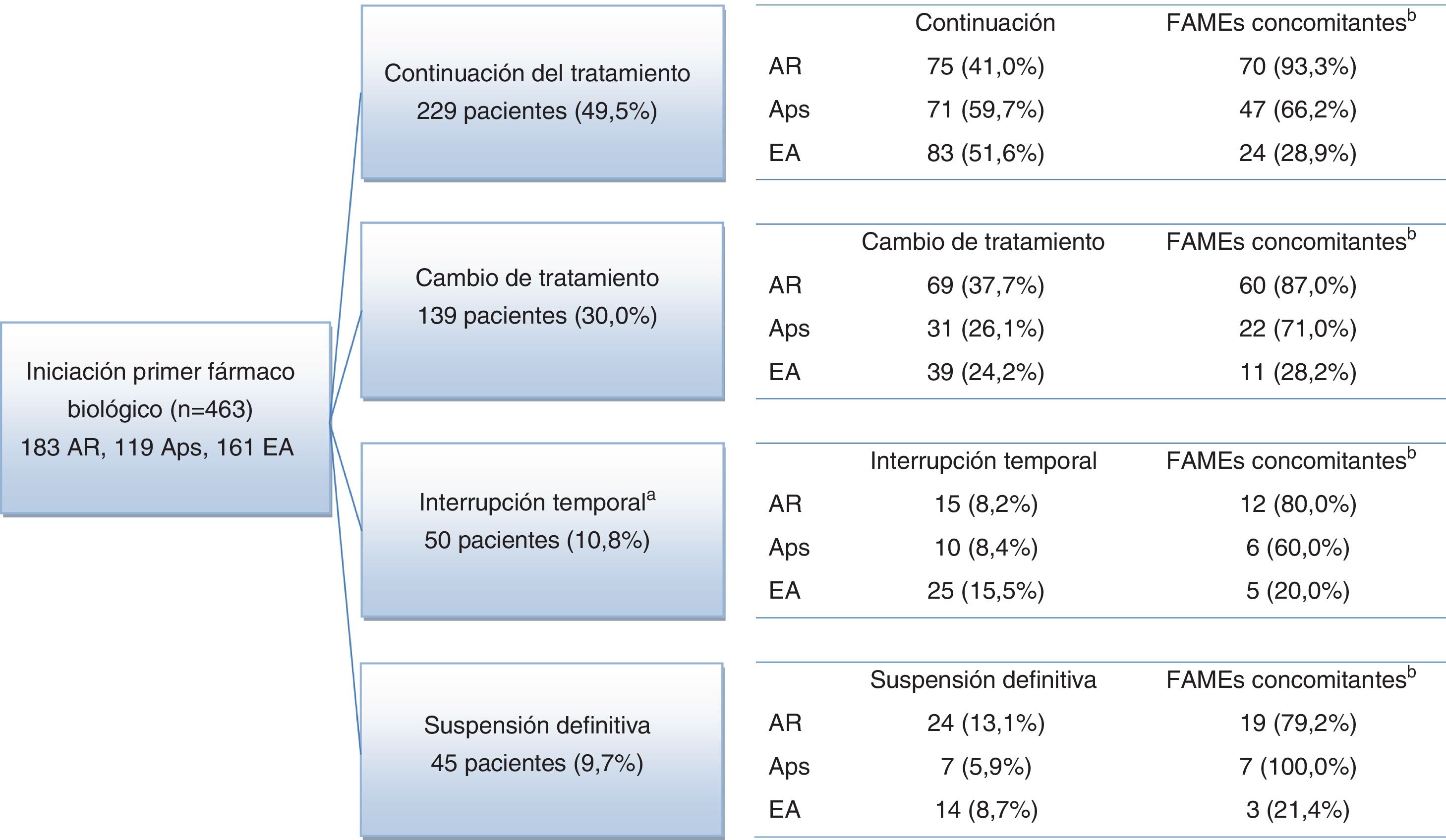
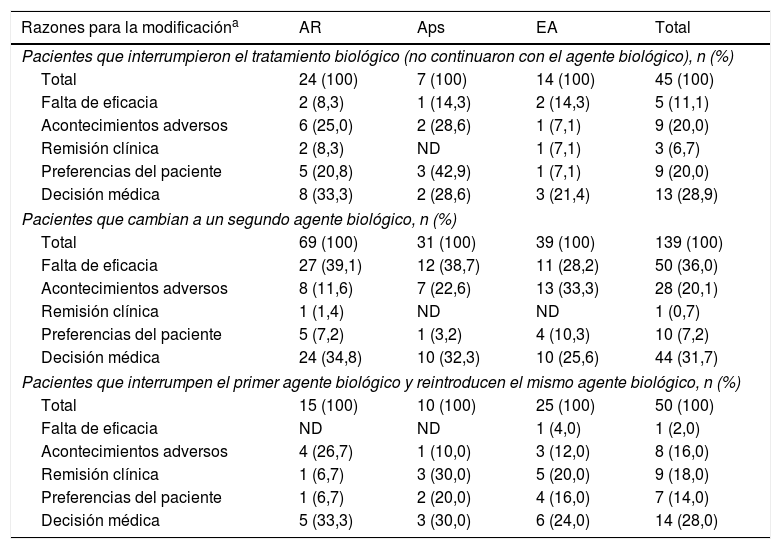
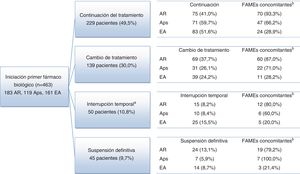
El seguimiento medio fue de 3,8 años, siendo >3 años en el 94,8% de pacientes. Al final del periodo de seguimiento una elevada proporción de pacientes seguía con el primer fármaco biológico prescrito sin interrupciones: 75 (41,0%) pacientes con AR, 71 (59,7%) con Aps y 83 (51,6%) con EA (fig. 1). También se cambió el fármaco biológico prescrito inicialmente en un elevado porcentaje de pacientes: 69 (37,7%) con AR, 31 (26,1%) con Aps y 39 (24,2%) con EA. Treinta y nueve (21,3%) pacientes con AR, 17 (14,3%) con Aps y 39 (24,2%) pacientes con EA discontinuaron sus tratamientos de forma temporal o definitiva (fig. 1). Las causas notificadas con mayor frecuencia para discontinuar o modificar el tratamiento inicial fueron: decisión del médico (30,3%), ausencia de respuesta (23,9%) y AA (19,2%) (tabla 2).
Diagrama de flujo de pacientes por enfermedad reumática.
a La interrupción temporal fue de hasta 12 meses en 38 pacientes (8,2%) y más de 12 meses en 12 pacientes (2,6%).
b Concomitante: número y porcentaje de pacientes que reciben al menos un tratamiento concomitante para las enfermedades del estudio (AINE, glucocorticoides y FAME).
AINE: antiinflamatorio no esteroideo; Aps: artritis psoriásica; AR: artritis reumatoide; EA: espondilitis anquilosante; FAME: fármaco antirreumático modificador de la enfermedad.
Razones para la modificación de la terapia inicial
| Razones para la modificacióna | AR | Aps | EA | Total |
|---|---|---|---|---|
| Pacientes que interrumpieron el tratamiento biológico (no continuaron con el agente biológico), n (%) | ||||
| Total | 24 (100) | 7 (100) | 14 (100) | 45 (100) |
| Falta de eficacia | 2 (8,3) | 1 (14,3) | 2 (14,3) | 5 (11,1) |
| Acontecimientos adversos | 6 (25,0) | 2 (28,6) | 1 (7,1) | 9 (20,0) |
| Remisión clínica | 2 (8,3) | ND | 1 (7,1) | 3 (6,7) |
| Preferencias del paciente | 5 (20,8) | 3 (42,9) | 1 (7,1) | 9 (20,0) |
| Decisión médica | 8 (33,3) | 2 (28,6) | 3 (21,4) | 13 (28,9) |
| Pacientes que cambian a un segundo agente biológico, n (%) | ||||
| Total | 69 (100) | 31 (100) | 39 (100) | 139 (100) |
| Falta de eficacia | 27 (39,1) | 12 (38,7) | 11 (28,2) | 50 (36,0) |
| Acontecimientos adversos | 8 (11,6) | 7 (22,6) | 13 (33,3) | 28 (20,1) |
| Remisión clínica | 1 (1,4) | ND | ND | 1 (0,7) |
| Preferencias del paciente | 5 (7,2) | 1 (3,2) | 4 (10,3) | 10 (7,2) |
| Decisión médica | 24 (34,8) | 10 (32,3) | 10 (25,6) | 44 (31,7) |
| Pacientes que interrumpen el primer agente biológico y reintroducen el mismo agente biológico, n (%) | ||||
| Total | 15 (100) | 10 (100) | 25 (100) | 50 (100) |
| Falta de eficacia | ND | ND | 1 (4,0) | 1 (2,0) |
| Acontecimientos adversos | 4 (26,7) | 1 (10,0) | 3 (12,0) | 8 (16,0) |
| Remisión clínica | 1 (6,7) | 3 (30,0) | 5 (20,0) | 9 (18,0) |
| Preferencias del paciente | 1 (6,7) | 2 (20,0) | 4 (16,0) | 7 (14,0) |
| Decisión médica | 5 (33,3) | 3 (30,0) | 6 (24,0) | 14 (28,0) |
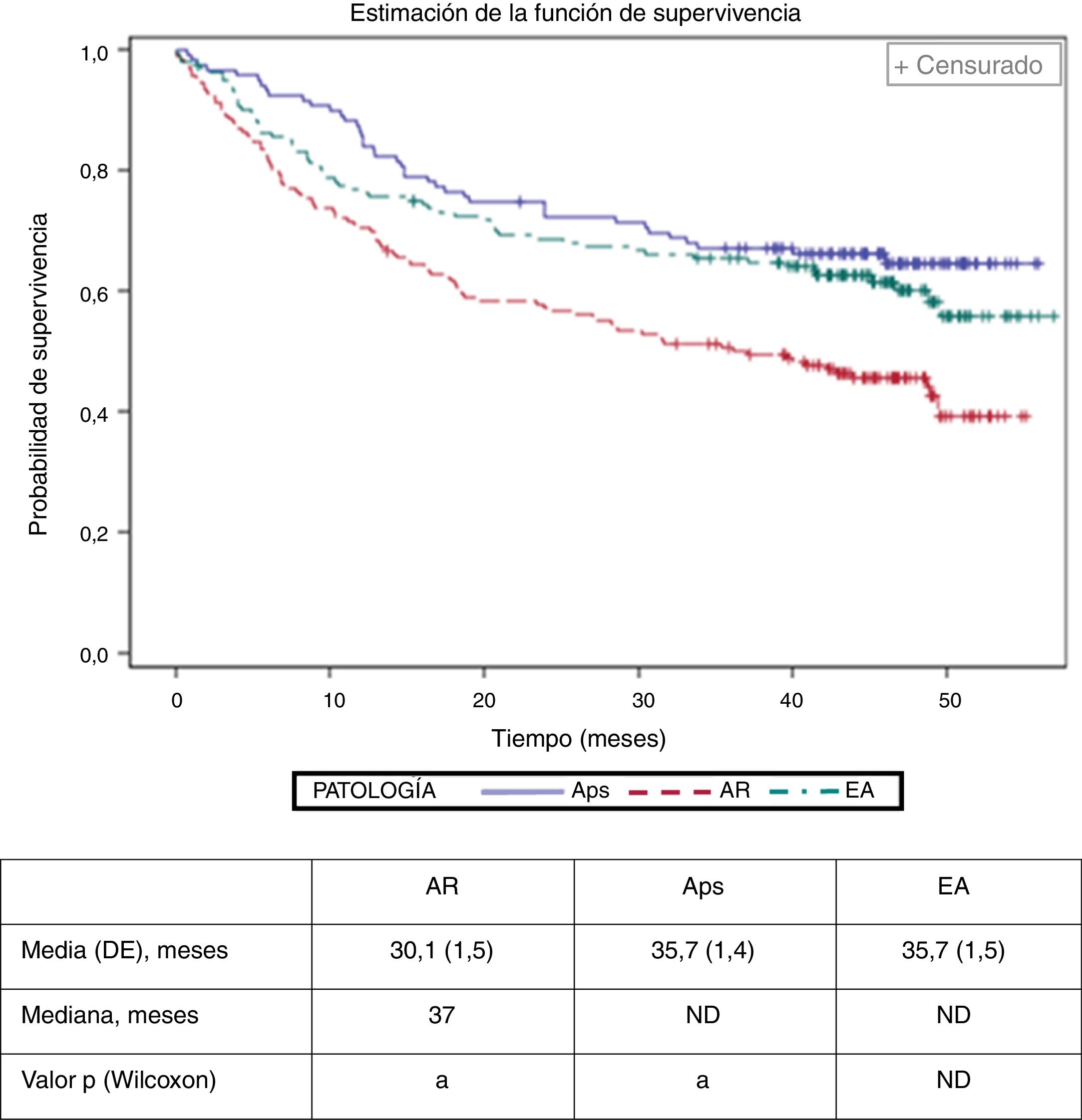
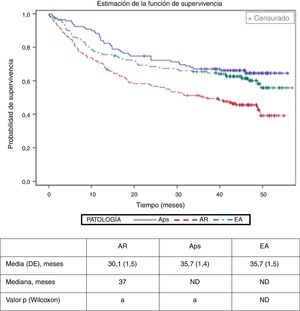
Se estimó el tiempo medio (desviación estándar, DE) hasta el abandono del tratamiento biológico (discontinuación o cambio de fármaco biológico) en 30,1 (1,5) meses en AR, 35,7 (1,4) meses en Aps y 35,7 (1,5) meses en EA (fig. 2), siendo menor en pacientes con AR (valor de p de Bonferroni<0,01). El modelo de regresión de Cox identificó la AR (hazard ratio: 1,77; IC del 95%: 1,22 a 2,55), edad>40 (1,42; 1,01 a 1,99) y la escala visual analógica de evaluación global del médico>6 (1,80; 1,17 a 2,76) como factores basales relacionados con el incremento del riesgo de abandono del primer fármaco biológico.
Tiempo de retirada (cambio de agente biológico o interrupción) del primer tratamiento biológico por enfermedad.
a Las cohortes de estudio con la misma letra muestran diferencias estadísticamente significativas (p<0,01). Los valores medios para Aps y EA no se calcularon debido al limitado período de seguimiento.
Aps: artritis psoriásica; AR: artritis reumatoide; DE: desviación estándar; EA: espondilitis anquilosante; ND: no definido.
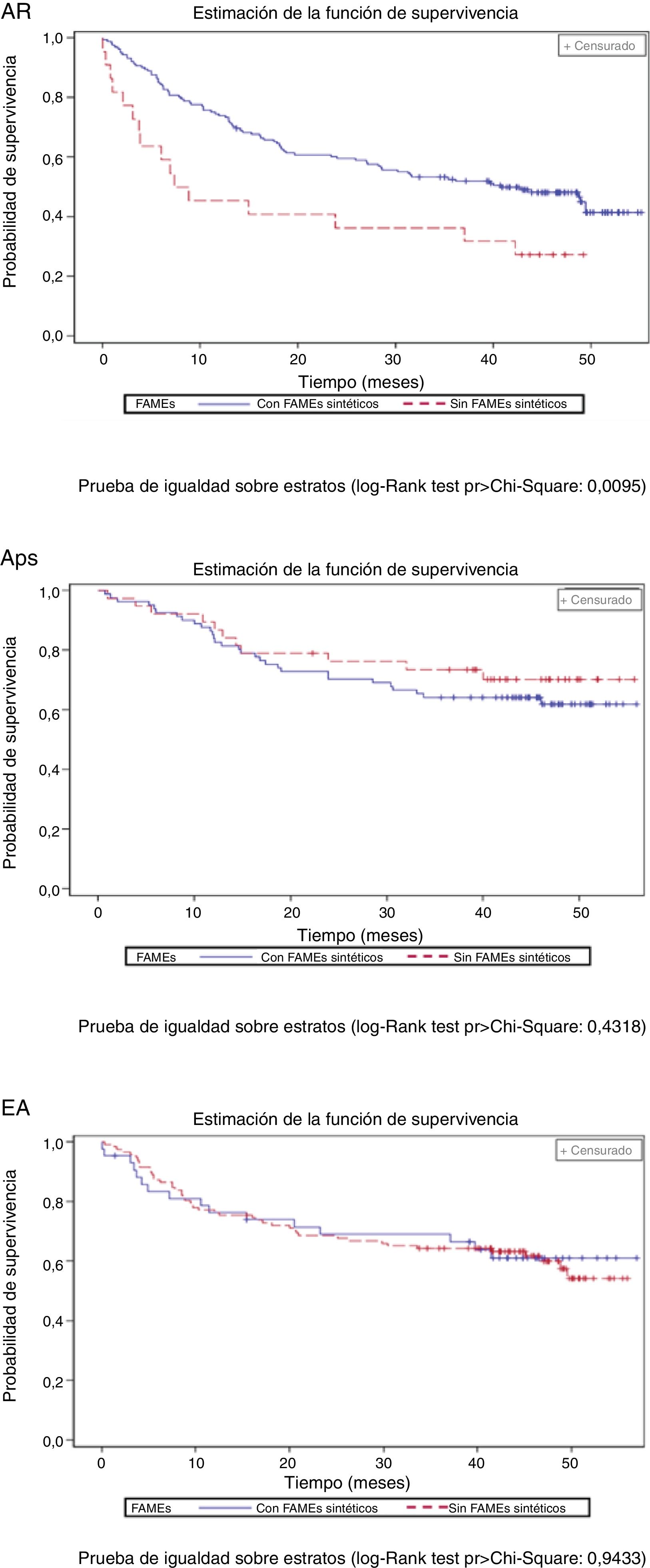
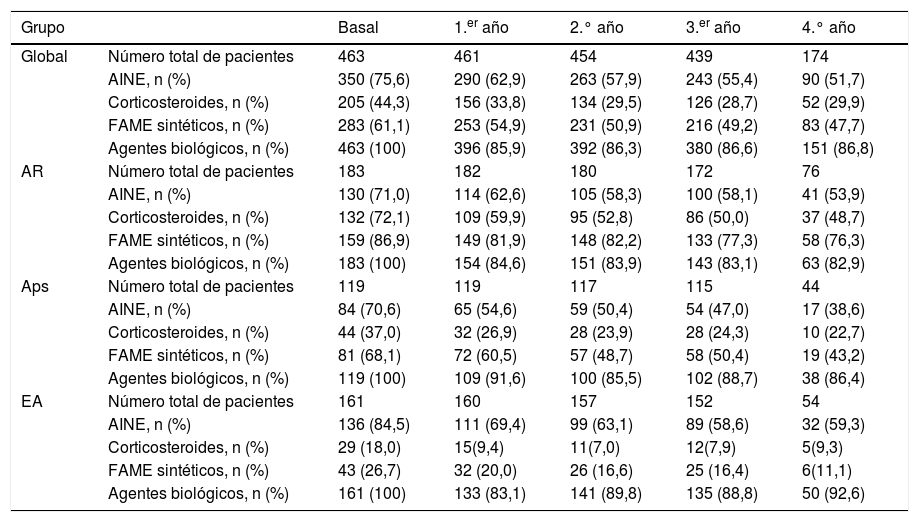
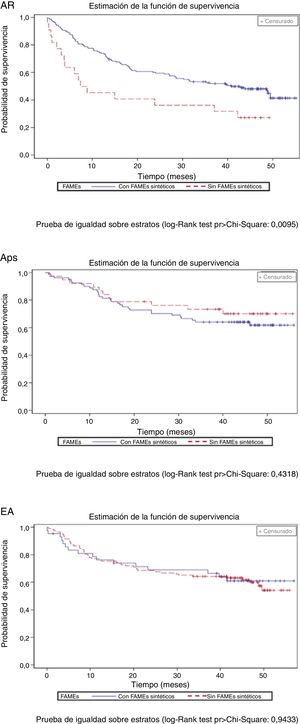
El porcentaje de pacientes con tratamientos concomitantes se redujo durante el periodo de seguimiento: 23,9% de pacientes con AINE, 14,4% con glucocorticoides y 13,4% con FAME sintéticos (tabla 3). La figura 3 muestra la supervivencia del primer fármaco biológico de acuerdo con el uso concomitante de FAME sintéticos. Los pacientes con AR con tratamiento concomitante de FAME sintéticos y un fármaco biológico mostraron una tasa de retención superior del primer fármaco biológico que los que no habían recibido FAME sintéticos.
Porcentaje de pacientes que reciben tratamiento concomitante durante el período de seguimiento por enfermedad
| Grupo | Basal | 1.er año | 2.° año | 3.er año | 4.° año | |
|---|---|---|---|---|---|---|
| Global | Número total de pacientes | 463 | 461 | 454 | 439 | 174 |
| AINE, n (%) | 350 (75,6) | 290 (62,9) | 263 (57,9) | 243 (55,4) | 90 (51,7) | |
| Corticosteroides, n (%) | 205 (44,3) | 156 (33,8) | 134 (29,5) | 126 (28,7) | 52 (29,9) | |
| FAME sintéticos, n (%) | 283 (61,1) | 253 (54,9) | 231 (50,9) | 216 (49,2) | 83 (47,7) | |
| Agentes biológicos, n (%) | 463 (100) | 396 (85,9) | 392 (86,3) | 380 (86,6) | 151 (86,8) | |
| AR | Número total de pacientes | 183 | 182 | 180 | 172 | 76 |
| AINE, n (%) | 130 (71,0) | 114 (62,6) | 105 (58,3) | 100 (58,1) | 41 (53,9) | |
| Corticosteroides, n (%) | 132 (72,1) | 109 (59,9) | 95 (52,8) | 86 (50,0) | 37 (48,7) | |
| FAME sintéticos, n (%) | 159 (86,9) | 149 (81,9) | 148 (82,2) | 133 (77,3) | 58 (76,3) | |
| Agentes biológicos, n (%) | 183 (100) | 154 (84,6) | 151 (83,9) | 143 (83,1) | 63 (82,9) | |
| Aps | Número total de pacientes | 119 | 119 | 117 | 115 | 44 |
| AINE, n (%) | 84 (70,6) | 65 (54,6) | 59 (50,4) | 54 (47,0) | 17 (38,6) | |
| Corticosteroides, n (%) | 44 (37,0) | 32 (26,9) | 28 (23,9) | 28 (24,3) | 10 (22,7) | |
| FAME sintéticos, n (%) | 81 (68,1) | 72 (60,5) | 57 (48,7) | 58 (50,4) | 19 (43,2) | |
| Agentes biológicos, n (%) | 119 (100) | 109 (91,6) | 100 (85,5) | 102 (88,7) | 38 (86,4) | |
| EA | Número total de pacientes | 161 | 160 | 157 | 152 | 54 |
| AINE, n (%) | 136 (84,5) | 111 (69,4) | 99 (63,1) | 89 (58,6) | 32 (59,3) | |
| Corticosteroides, n (%) | 29 (18,0) | 15(9,4) | 11(7,0) | 12(7,9) | 5(9,3) | |
| FAME sintéticos, n (%) | 43 (26,7) | 32 (20,0) | 26 (16,6) | 25 (16,4) | 6(11,1) | |
| Agentes biológicos, n (%) | 161 (100) | 133 (83,1) | 141 (89,8) | 135 (88,8) | 50 (92,6) |
AINE: antinflamatorio no esteroideo; Aps: artritis psoriásica; AR: artritis reumatoide; EA: espondilitis anquilosante; FAME: fármaco antirreumático modificador de la enfermedad.
Durante el periodo de seguimiento los pacientes iniciaron una media de 0,7 fármacos biológicos/año. Se registraron un total de 5.213 visitas médicas, con 3,0 visitas/paciente/año de media, el 96,9% de las cuales fueron visitas programadas. Tres (0,6%) pacientes fallecieron durante el periodo de seguimiento, pero ninguna muerte estuvo relacionada con tratamientos biológicos.
Considerando únicamente los pacientes que abandonaron, el tiempo medio (DE) de tratamiento con el primer fármaco biológico fue de 15,0 (13,6) meses en pacientes con AR, 16,1 (11,0) meses con Aps y 14,8 (13,7) meses con EA. Durante el periodo de seguimiento 159 pacientes iniciaron tratamiento con un segundo fármaco biológico, 91 (57,2%) continuaban con ese tratamiento al final del seguimiento y 68 (42,8%) abandonaron (discontinuación o cambio de fármaco biológico). El abandono del segundo fármaco biológico varió según la enfermedad: 38 (48,7%) de 78 pacientes con AR, 20 (58,8%) de 34 con Aps y 10 (21,3%) de 47 con EA.
DiscusiónEste estudio describe el patrón de tratamiento de 3 enfermedades articulares inflamatorias crónicas con fármacos biológicos en una gran cohorte de pacientes. La muestra del estudio es representativa de la práctica clínica en España, al incluir pacientes de 33 centros y 14 comunidades autónomas.
Nuestra cohorte de pacientes con AR, Aps y EA fue objeto de seguimiento a lo largo de 4 años para describir el patrón de tratamiento con fármacos biológicos. Al final del seguimiento, el 41% de pacientes con AR, el 59% con Aps y el 51% con EA continuaban con el primer fármaco biológico prescrito, aunque el 49%, el 69% y el 67% de estos pacientes, respectivamente, presentaron discontinuaciones temporales (de hasta 12 meses en el 8,2% de pacientes y más de 12 meses en el 2,6% de pacientes). Estos resultados concuerdan con los notificados por el registro BIOBADASER 2.0, donde aproximadamente el 50% de pacientes con AR, Aps y EA continúan con el tratamiento inicial tras 4 años de seguimiento9,10.
Existen muy pocos datos respecto al ajuste de dosis de fármacos biológicos en la práctica clínica. Nuestro estudio muestra que se llevó a cabo un ajuste en un porcentaje inesperadamente elevado de pacientes: 31%, 48% y 43% con AR, Aps y EA, respectivamente. Este ajuste se basó principalmente en una reducción progresiva de la dosis con porcentajes significativamente superiores en Aps (43%) y EA (33%), en comparación con AR (24%), probablemente debido a que los fármacos biológicos consiguen un mejor control de la actividad de la enfermedad en las espondiloartritis16.
La duración media del primer fármaco biológico prescrito osciló entre 30 y 36 meses, dependiendo de la enfermedad, siendo ligeramente inferior a los 43-53 meses notificados en un estudio de pacientes tratados con etanercept14.
En nuestro estudio, la supervivencia del tratamiento fue superior en pacientes con Aps o EA que con AR, en concordancia con los resultados publicados9-11, sugiriendo la diferente fisiopatología entre AR (más relacionada con células T y B) y Aps (más relacionada con citocinas proinflamatorias). Por el contrario, Senabre-Gallego et al.14 no hallaron diferencias en la supervivencia del tratamiento en función de la enfermedad.
Los principales motivos por los que los pacientes cambiaron a un segundo fármaco biológico fueron la falta de respuesta (67%) y los AA (23%). Estos son también los principales motivos para la discontinuación del tratamiento biológico notificados por 2 grupos españoles11,12, en los que la discontinuación debida a la falta de eficacia fue más frecuente en pacientes más jóvenes, y la debida a AA en pacientes de mayor edad10. En nuestro estudio la remisión clínica se identificó como uno de los principales motivos asociados a la discontinuación temporal, pero el número de pacientes con discontinuación temporal del tratamiento fue demasiado pequeño para extrapolar los resultados.
Nuestro estudio presenta diversas limitaciones: 1) el uso de datos retrospectivos, lo que impide establecer definiciones y criterios homogéneos entre los centros participantes; 2) la disponibilidad del uso de fármacos biológicos en la fecha de inicio del primer biológico, ya que golimumab y certolizumab no estaban disponibles y la experiencia con rituximab en España era limitada; y 3) el objetivo descriptivo del estudio y el elevado porcentaje de pacientes con datos censurados, lo que no permite establecer los factores asociados a la discontinuación del tratamiento biológico.
No obstante, nuestro estudio cuenta con la ventaja de su viabilidad, inmediatez y del menor riesgo de introducir sesgos en la práctica clínica, pudiendo ayudar a generar hipótesis para futuras investigaciones. A pesar de las limitaciones descritas, el presente estudio permitió obtener datos recogidos en práctica clínica correspondientes a una mayor muestra de pacientes con 3 enfermedades diferentes y durante un periodo de estudio más prolongado.
ConclusiónEn resumen, este estudio observacional muestra que la mayoría de pacientes con Aps, EA y, en menor proporción, con AR, continúan con el primer fármaco biológico prescrito después de un largo periodo de tiempo. Los datos reflejan la práctica clínica en 33 hospitales distribuidos por todo el territorio español. Los ajustes de dosis, principalmente en forma de reducción progresiva de la dosis, y los cambios de tratamiento se realizan en un porcentaje significativo de pacientes por diversos motivos, principalmente relacionados con la decisión del médico, la eficacia y la seguridad. Estos datos del mundo real podrían ser interesantes para comprender la supervivencia de los fármacos biológicos en el tratamiento de la AR y las espondiloartroartritis en práctica clínica.
Conflicto de interesesJuan D. Cañete fue asesor y/o participó como ponente para Abbvie, Boehringer, BMS, Celgene, Janssen, Lilly, MSD, Novartis, Novo-Nordisk, Pfizer y UCB.
Antonio Naranjo fue consejero y/o participó como ponente para Abbvie, Amgen, Gebro, Janssen, Pfizer y Roche, y participó en proyectos financiados por MSD.
Javier Calvo participó en reuniones y estudios/ensayos clínicos promovidos por Abbvie, Celgene, Lilly, MSD, Novartis, Pfizer y Roche.
Carmen Ordás participó en reuniones y estudios/ensayos clínicos promovidos por Abbvie, BMS, Celgene, Janssen, MSD, Pfizer y Roche.
Belén Aragón y Gonzalo Nocea son empleados de MSD.
Montse Roset es empleada de IQVIA, que ha recibido honorarios de MSD para la elaboración del manuscrito y del análisis estadístico.
Antonio Fernández-Nebro ha recibido honorarios de consultoría de empresas cuyos productos se describen en este manuscrito o que tienen productos comercializados para la misma indicación (MSD, Abbvie, UCB, Pfizer, Roche y BMS).
FinanciaciónEl presente trabajo ha sido financiado por Merck Sharp & Dohme (MSD), España. MSD ha participado en el diseño y ejecución del estudio.
Los autores agradecen a los investigadores participantes la recopilación de datos. Ver en el anexo (material adicional) la lista completa de investigadores y centros participantes en el estudio.