Determinar el valor diagnóstico de los anticuerpos contra un péptido del fibrinógeno citrulinado, en pacientes cubanos con artritis reumatoide (AR), mediante un inmunoanálisis enzimático.
Materiales y métodosSe sintetizó un péptido del fibrinógeno citrulinado diseñado por predicción informática y se utilizó en un inmunoanálisis enzimático. Participaron 81 pacientes con AR temprana, 81 pacientes con AR establecida, 58 pacientes con otras enfermedades reumáticas e inflamatorias y 43 individuos sanos. Se determinaron los anticuerpos contra el péptido citrulinado del fibrinógeno, antivimentina citrulinada mutada, antipéptidos citrulinados de segunda generación y factor reumatoide mediante el ensayo de inmunoabsorción ligaado a enzimas (ELISA).
ResultadosLa determinación de anticuerpos contra el péptido citrulinado del fibrinógeno mediante el inmunoanálisis enzimático diseñado mostró el mejor desempeño diagnóstico en pacientes con enfermedad temprana, con el valor más elevado de sensibilidad (84%), valor predictivo negativo (85%), índice de Youden (0,73%) y área bajo la curva operativa del receptor (0,9192). La especificidad (89%) y el valor predictivo positivo (88%) fueron superiores al factor reumatoide, similar al ensayo antivimentina citrulinada mutada, pero inferiores al ensayo antipéptidos citrulinados de segunda generación. La positividad de proteína C reactiva se asoció a la presencia de anticuerpos contra el péptido citrulinado del fibrinógeno y los títulos de estos anticuerpos tuvieron correlación con la actividad clínica en la enfermedad temprana.
ConclusionesEl inmunoanálisis diseñado con un péptido citrulinado del fibrinógeno tiene un alto valor diagnóstico y permite la identificación de pacientes con mayor actividad clínica en la AR temprana.
To determinate the diagnostic value of an antibody against a citrullinated fibrinogen peptide in Cuban patients with rheumatoid arthritis, using an enzyme immunasay.
Materials and methodsA citrullinated peptide of fibrinogen designed by informatics prediction was synthesized and used in an enzyme immunoassay. The participants were 81 patients with early disease, 81 patients with established disease, 58 patients with other rheumatic and inflammatory diseases, and 43 healthy individuals. Anti- citrullinated fibrinogen peptide, anti-mutated citrullinated vimentin, anti second generation citrullinated peptides and rheumatoid factor antibodies were determined by enzyme-linked immunosorbent assay.
ResultsDetermination of anti-citrullinated peptide of fibrinogen antibodies by the designed enzyme immunoassay showed the best diagnostic value in early rheumatoid arthritis patients, with the highest value sensitivity (84%), negative predictive value (85%), Youden index (0.73%) and area under the receiver operating curve (0.9192). Specificity (89%) and positive predictive value (88%) were higher than rheumatoid factor, similar to anti- mutated citrullinated vimentin, but lower than second generation anti-citrullinated peptides assay. The positivity of C-reactive protein was associated with the presence of anti- citrullinated fibrinogen peptide antibodies and the titres of these antibodies correlated with clinical activity in early disease.
ConclusionsThe immunoassay designed with a citrullinated fibrinogen peptide has a high diagnostic value and can identify patients with greater clinical activity in early rheumatoid arthritis.
La artritis reumatoide (AR) es una enfermedad caracterizada por inflamación crónica y presencia de autoanticuerpos, que afecta las pequeñas articulaciones periféricas con una alta morbilidad y discapacidad1,2.
Aunque no se ha dilucidado completamente la etiopatogenia de la AR, existen evidencias que indican que bajo la influencia de complejas interacciones medioambientales y genéticas los antígenos propios con modificaciones postraduccionales como la citrulinación son presentados al sistema inmunitario, lo cual conlleva a la rotura de los procesos de tolerancia inmunológica3-6.
El diagnóstico de la enfermedad se realizaba mediante los criterios del Colegio Americano de Reumatología de 1987, que establecen 6criterios clínicos y el factor reumatoide (FR) como único criterio serológico7. Como la citrulinación de las proteínas ha sido involucrada en los mecanismos patogénicos de la AR, los anticuerpos contra péptidos citrulinados se han incluido en los nuevos criterios del Colegio Americano de Reumatología y la Liga Europea contra el Reumatismo para el diagnóstico de la enfermedad8.
Los primeros anticuerpos contra péptidos citrulinados descritos fueron el factor perinuclear y los anticuerpos antiqueratina, que reaccionan con epítopos de la proteína profilagrina, identificados por inmunofluorescencia indirecta9. La introducción de cambios cíclicos a péptidos lineales de filagrina dio origen a la primera generación de ensayos de determinación de anticuerpos contra péptidos citrulinados, con mayor sensibilidad para el diagnóstico9.
Uno de los ensayos más utilizados es la determinación de anticuerpos contra péptidos citrulinados de segunda generación (anti-CCP2), que además de su alta especificidad, se presentan en etapas tempranas de la enfermedad y son predictivos de la erosión articular en los pacientes con AR8,10,11.
La tercera generación de inmunoanálisis (anti-CCP3) se designó mediante ingeniería de péptidos y diversos autores han demostrado que no existe gran diferencia entre estos y el ensayo anti-CCP211,12. Otros autores refieren que tienen valor diagnóstico superior a los anti-CCP213.
Por otra parte, en el tejido sinovial de las articulaciones inflamadas de pacientes con AR se han detectado proteínas citrulinadas con alta especificidad para el diagnóstico (fibrinógeno, vimentina, enolasa, fibronectina y colágeno tipo ii). Estas proteínas son consideradas candidatos relevantes para el desencadenamiento de la autoinmunidad en individuos genéticamente susceptibles14,15.
En este trabajo nos propusimos determinar el valor diagnóstico de los anticuerpos contra un péptido citrulinado del fibrinógeno en pacientes cubanos con AR temprana y establecida, mediante un inmunoanálisis enzimático.
Material y métodosSe realizó un estudio de tipo transversal.
PacientesLa muestra estuvo constituida por 162 pacientes incorporados de manera consecutiva al estudio (81 pacientes con AR temprana con menos de un año de diagnóstico y 81 pacientes con AR establecida), de uno y otro sexo, mayores de 18 años, que fueron atendidos en el Centro Nacional de Reumatología de Cuba y que cumplieron los criterios del Colegio Americano de Reumatología y la Liga Europea contra el Reumatismo8. Se excluyó a pacientes con neoplasias y gestantes. Participaron además 25 individuos sanos del banco provincial de sangre de La Habana y 56 individuos con otras enfermedades autoinmunes, autoinflamatorias o infecciosas crónicas (13 pacientes con sintomatología pero sin diagnóstico definitivo de AR, 10 con enfermedad mixta del tejido conectivo, 10 con hepatitis virales crónicas, 9 con lupus eritematoso sistémico, 4 con esclerodermia, 3 con artritis psoriásica, 3 con espondiloartropatías, 3 con miositis autoinmune y uno con síndrome de Sjögren) del Centro Nacional de Genética Médica de Cuba. La investigación fue aprobada por el comité de ética del Centro Nacional de Genética Médica y se obtuvo el consentimiento informado de todos los participantes.
Determinación de los indicadores de actividad de la enfermedadSe determinó la velocidad de sedimentación globular (VSG) en 2ml de sangre anticoagulada con 0,5ml de citrato de sodio (3,8%), en 1 h16. La proteína C reactiva se determinó mediante la técnica cualitativa de aglutinación en látex (Diagnostic Automation/Cortez Diagnostics, EE. UU.), para lo cual se adicionó una gota de suero del paciente en las láminas de látex y se observó la presencia de turbidez en 2 minutos de reacción. Se realizó el cuestionario de evaluación de la salud (HAQ) y se calculó el indicador clínico de actividad de la enfermedad (DAS 28) basado en la VSG. Se consideró DAS 28 en remisión (DAS 28 <2,6), DAS 28 baja actividad (DAS 28 ≥ 2,6 y ≤ 3,2), moderado (DAS 28> 3,2 y ≤ 5,1) y elevado (DAS 28> 5,1)8,17.
Diseño y obtención del péptido citrulinado del fibrinógenoSe realizó la predicción de determinantes antigénicos de las cadenas α y β del fibrinógeno, en la estructura tridimensional de la proteína obtenida del Banco de datos RSCB-PDB-101, utilizando los programas informáticos BepiPred 1.0 (DTU Bioinformatics, Universidad Técnica de Dinamarca, Lyngby, Dinamarca)18 y Discotope 1.2 (DTU Bioinformatics)19. Se seleccionaron 2 péptidos del fibrinógeno. Se realizó la unión covalente de ambos péptidos con un aminoácido cisteína intermedio entre una cadena peptídica de α fibrinógeno y una cadena de β fibrinógeno, con la ubicación de una cisteína final y la sustitución de la terminación carboxílica terminal de la cisteína por carboxamida terminal. Las 2subunidades peptídicas fueron citrulinadas en 2residuos de arginina. Se realizó la síntesis en fase sólida mediante la metodología Fmoc/tBu (9-fluoerenilmetiloxicarbonilo/tert-butilo). La purificación se realizó por cromatografía líquida de alta resolución en fase reversa (HPLC-RP) preparativa en un equipo LabChrom (Merck LaChrom, Hitachi High-Technologies Corporation, Alemania). El grado de pureza se determinó mediante HPLC-RP analítica en el equipo AKTA 100 (GE Healthcare, Groton, CT, EE. UU.). La determinación de la masa molecular se realizó mediante espectrometría de masas mediante ionización por electronebulización, en un espectrómetro Q-Tof (Micromass, Ltd., Manchester, Reino Unido). Se realizó la síntesis del péptido en su forma nativa (no citrulinado) para comparar la reactividad con respecto al péptido citrulinado del fibrinógeno.
Determinación de autoanticuerposLa determinación de anticuerpos antipéptido citrulinado del fibrinógeno diseñado (anti-PCF) de tipo IgG se realizó mediante un ensayo de inmunoabsorción ligado a enzimas (ELISA) de tipo indirecto. Se sensibilizaron las placas de máxima absorción de 96 pocillos (Thermo Ficher Scientific, NUNC, Roskilde, Dinamarca) con el péptido del fibrinógeno a la concentración de 10μg/ml en solución amortiguadora fosfato salina 0,15M, pH=7,2 (PBS). Se incubó 16h en cámara húmeda de 20 a 25°C. Se lavó 3 veces con PBS y Tween 20 al 0,05% en un lavador de micro ELISA (SUMA, MW-2001 Centro de Inmunoensayos, La Habana, Cuba), añadiendo 200μL en cada pocillo. Se adicionó albúmina de suero bovino (BSA) (SIGMA, Aldrich, St Louis MO, EE. UU.) diluida al 2% en PBS, se incubó 1h en cámara húmeda de 20 a 25°C y se realizó el lavado nuevamente. Los controles positivo y negativo se prepararon a partir de pacientes con AR e individuos sanos, respectivamente, y se añadieron al igual que las muestras diluidas 1/100 en PBS, BSA 2% y Tween 20 al 0,05%. Se adicionó el suero estándar desde 120 U/ml hasta 6,2 U/ml, preparado a partir del suero de pacientes con AR, cuya concentración fue evaluada con respecto al suero estándar del ensayo anti-CCP2 (IBL, International GmbH, Hamburgo, Alemania). Se incubó de 20 a 25°C durante 1h en cámara húmeda. Luego de otro paso de lavado se añadió el conjugado anti-IgG con peroxidasa (Dako cytomation, Dako, Glostrup, Dinamarca) 100μl en cada pocillo a la dilución sugerida para el reactivo (1/6.000), en PBS, Tween 20 al 0,05%. Se incubó 1h de 20 a 25°C y se lavó la placa. Se añadió el sustrato dihidrocloruro de orto fenilendiamina (SIGMA, EE. UU.) 1mg/ml diluido en la disolución amortiguadora citrato de sodio 0,1mol/l, pH 5,5 con peróxido de hidrogeno 1mg/ml (Merck, Alemania). Se incubó 30min a una temperatura de 20±5°C. La reacción se detuvo por la adición de 50μl de ácido sulfúrico 3mol/l (Merck, Alemania) en agua y se midió la absorbancia a 492nm en un lector de ELISA PR-521 (SUMA, Cuba). Se utilizó un ajuste logarítmico para la curva de calibración. La determinación de anticuerpos anti-CCP2 de tipo IgG se realizó mediante un ELISA (IBL International, Alemania), con un valor de corte sugerido de 30 U/ml. La determinación de anticuerpos antivimentina citrulinada mutada (anti-MCV) y FR de tipo IgM se realizaron mediante ELISA (Orgentec, Diagnostika GmbH, Mainz, Alemania), con un valor de corte sugerido de 20 U/ml para cada ensayo.
Análisis estadísticoSe utilizaron los programas Statistica 7.0 (StatSoft, Inc, Tulsa Ok, EE. UU.) y EPIDAT 3.1 (Dirección General de Salud Pública, Junta de Galicia, Organización Panamericana de la Salud OPS/OMS). Las variables cualitativas se expresaron como frecuencia y porcentajes. Se calculó el estadígrafo χ2, con prueba exacta de Fisher, para valores esperados inferiores a 5 y se estimó la odds ratio (OR) como magnitud de asociación. Se determinaron las diferencias entre las densidades ópticas de los controles mediante el estadígrafo t de Student. Las variables cuantitativas con distribución diferente a la normal se expresaron como mediana y recorridos intercuartiles. Se realizó la comparación de las variables cuantitativas entre grupos con U de Mann-Whitney. Para la correlación se determinó el coeficiente de Spearman. Para determinar el valor diagnóstico se realizaron las tablas de contingencia para el total de pacientes con AR, con respecto a los individuos sanos y a pacientes con otras enfermedades autoinmunes, autoinflamatorias e infecciosas crónicas. De igual manera, se realizó por separado para el grupo de pacientes con AR temprana y para el grupo de pacientes con AR establecida. Se calcularon la sensibilidad y la especificidad diagnósticas, así como los valores predictivos positivo y negativo. Se determinaron el índice de Youden (IY) y el área bajo la curva operativa del receptor (ROC). El nivel de significación estadística empleado fue 0,05.
ResultadosLos pacientes incluidos en el grupo de AR temprana tuvieron una mediana de edad de 48 años (39-53), de los cuales 60 pacientes fueron recién diagnosticados y 21 pacientes tuvieron una mediana de duración de la enfermedad de 7 meses (5 a 12) a partir del diagnóstico. La mediana de edad en los pacientes con AR establecida fue de 51 años (44-61), con una mediana de duración de la enfermedad de 5 años (2-10). La frecuencia del sexo femenino fue elevada en la AR temprana (76,5%) y establecida (82,7%).
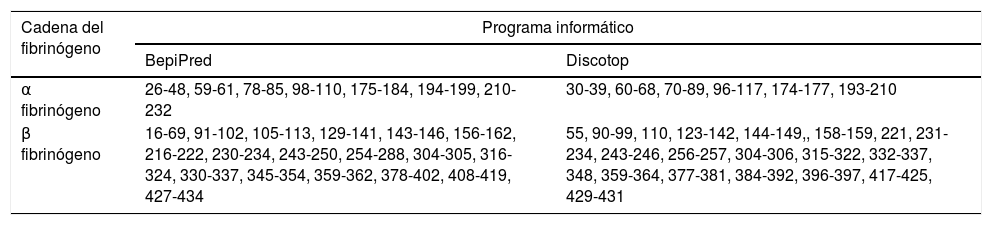
La predicción de determinantes antigénicos realizada a las cadenas α y β de la proteína fibrinógeno permitió obtener diferentes epítopos con antigenicidad probable para reaccionar con ACPC en pacientes con AR. Las regiones con mayor cantidad de aminoácidos obtenidas en las predicciones realizadas al fibrinógeno, fueron las regiones de aminoácidos de 210 a 232 de la cadena α y de 16 a 69 de la cadena β (tabla 1).
Regiones de aminoácidos de los epítopos obtenidos en la predicción de las cadenas α y β del fibrinógeno, coincidentes por ambos programas informáticos
| Cadena del fibrinógeno | Programa informático | |
|---|---|---|
| BepiPred | Discotop | |
| α fibrinógeno | 26-48, 59-61, 78-85, 98-110, 175-184, 194-199, 210-232 | 30-39, 60-68, 70-89, 96-117, 174-177, 193-210 |
| β fibrinógeno | 16-69, 91-102, 105-113, 129-141, 143-146, 156-162, 216-222, 230-234, 243-250, 254-288, 304-305, 316-324, 330-337, 345-354, 359-362, 378-402, 408-419, 427-434 | 55, 90-99, 110, 123-142, 144-149,, 158-159, 221, 231-234, 243-246, 256-257, 304-306, 315-322, 332-337, 348, 359-364, 377-381, 384-392, 396-397, 417-425, 429-431 |
La secuencia de aminoácidos seleccionada fue Lys Asp Ile Ile Pro Ser citrulina Asp Arg Gln His citrulina Pro Leu Asp Lys Lys Arg Glu Glu Cys (KDLLPS citrulina DRQHCGH citrulina PLDKKREEC), cubriendo el 1,9% de la cadena α del fibrinógeno (11/560 aminoácidos) y el 2,4% de la cadena β del fibrinógeno (11/461). El péptido diseñado tuvo una carga neta positiva (2+), un balance arginina/citrulina de 1, una masa molecular de 2.916,46±0,02 Da, que coincidió con la masa molecular teórica 2.916,46Da, y una pureza de 98,3.
Al realizar el ELISA con el péptido del fibrinógeno citrulinado diseñado y el péptido no citrulinado, no se demostraron diferencias entre los controles positivo y negativo (p=0,6644).
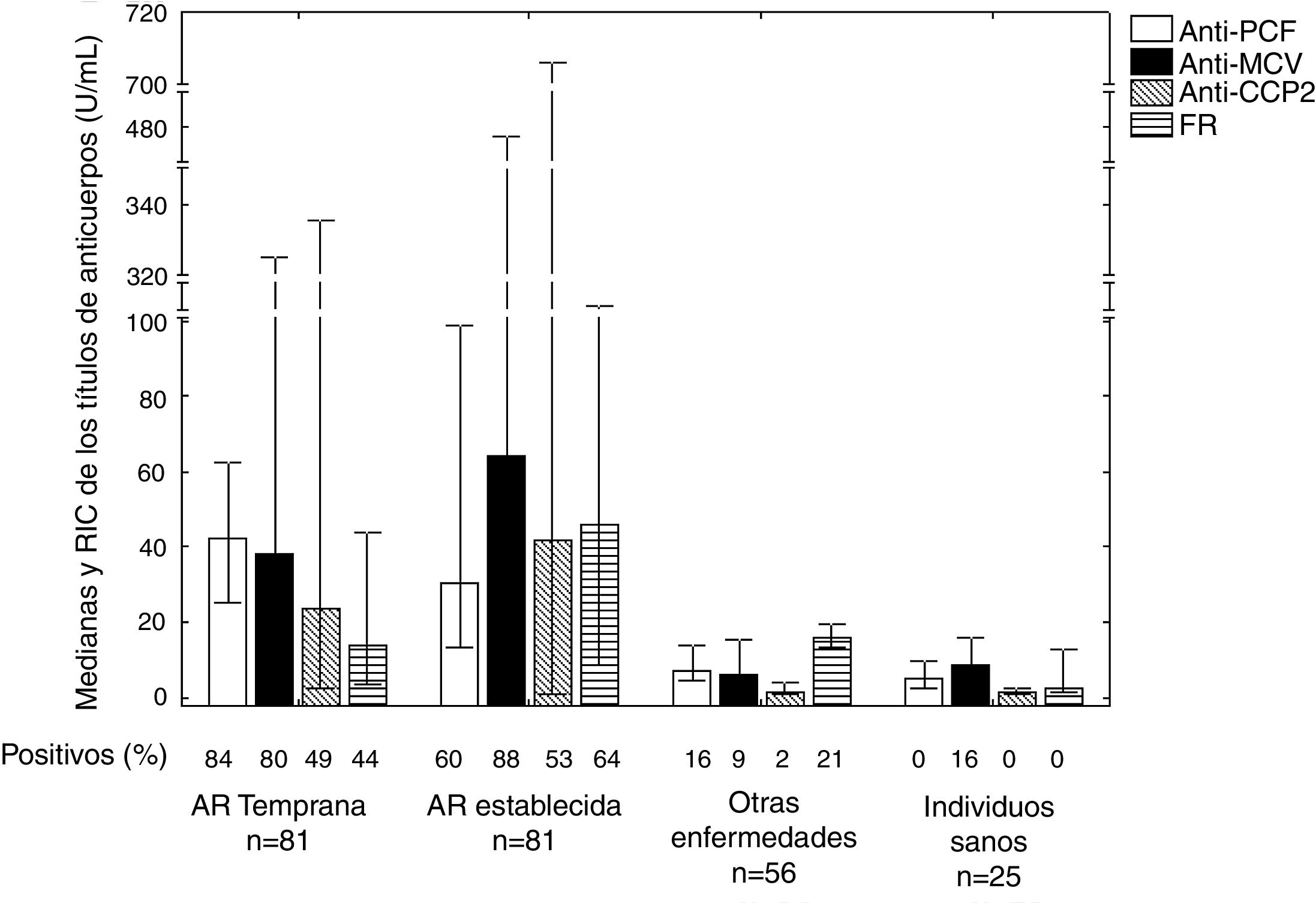
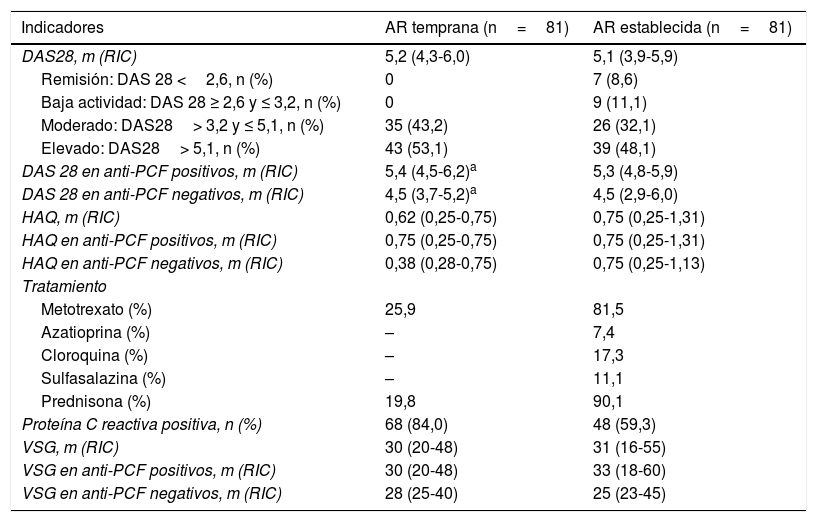
En los pacientes con AR temprana los anticuerpos que más se detectaron fueron los anticuerpos anti-PCF (84,0%) (fig. 1). La frecuencia de positividad de todos los anticuerpos estudiados fue mayor en los pacientes con AR que en los controles. En el total de pacientes con AR, los títulos fueron superiores para los anticuerpos anti-PCF (p=0,0000), anti-MCV (p=0,0000), anti-CCP2 (p=0,0000) y FR (p=0,0027), con respecto al total de pacientes con otras enfermedades e individuos sanos. Se observaron diferencias entre los títulos de anticuerpos de FR de los pacientes con AR temprana y establecida (p=0,0121).
Frecuencia de positividad de los anticuerpos en los pacientes con AR temprana y establecida, en los controles sanos y en los controles enfermos.
Se observaron diferencias entre los títulos de anticuerpos de todos los pacientes con AR, con respecto al total de pacientes con otras enfermedades e individuos sanos, para los anticuerpos anti-PCF (p=0,0000), anti-MCV (p=0,0000), anti-CCP2 (p=0,0000) y FR (p=0,0027). Se observaron diferencias en los títulos de anticuerpos de FR de los pacientes con AR temprana y establecida (p=0,0121).
AR: artritis reumatoide; CCP 2: péptidos citrulinados de segunda generación, FR: factor reumatoide; MCV: vimentina citrulinada mutada; n: total de pacientes; PCF: péptido citrulinado del fibrinógeno; RIC: recorridos intercuartiles.
Los anticuerpos más frecuentes en los pacientes que no tuvieron anticuerpos anti-PCF fueron los anticuerpos anti-MCV en la AR temprana (84,6%) y los anticuerpos anti-CCP2 la AR establecida (68,8%).
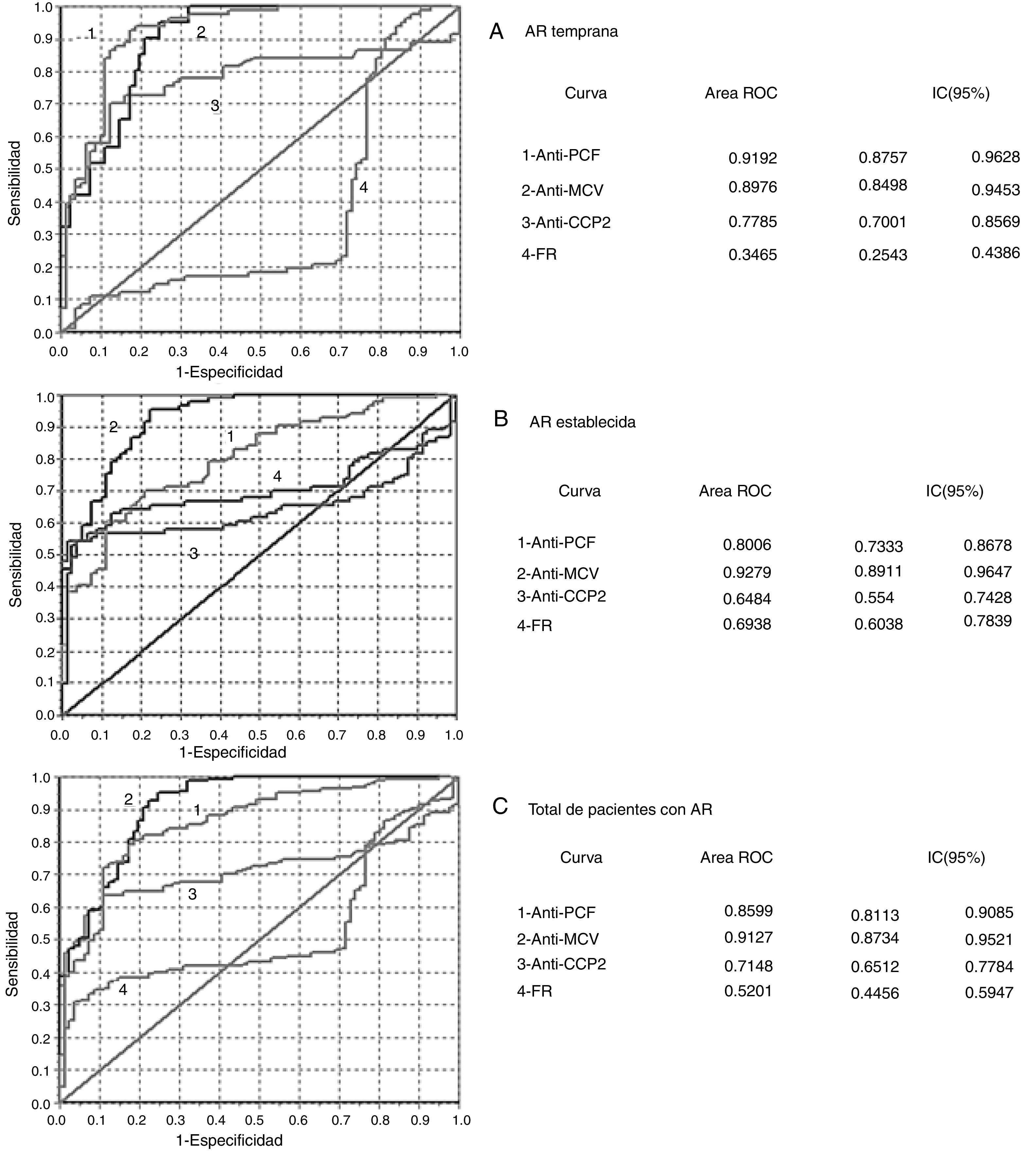
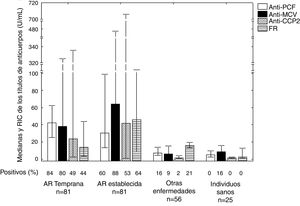
Mediante el análisis del IY (tabla 2) y de las curvas ROC (fig. 2), los anticuerpos anti-PCF tuvieron el mejor desempeño diagnóstico en la AR temprana.
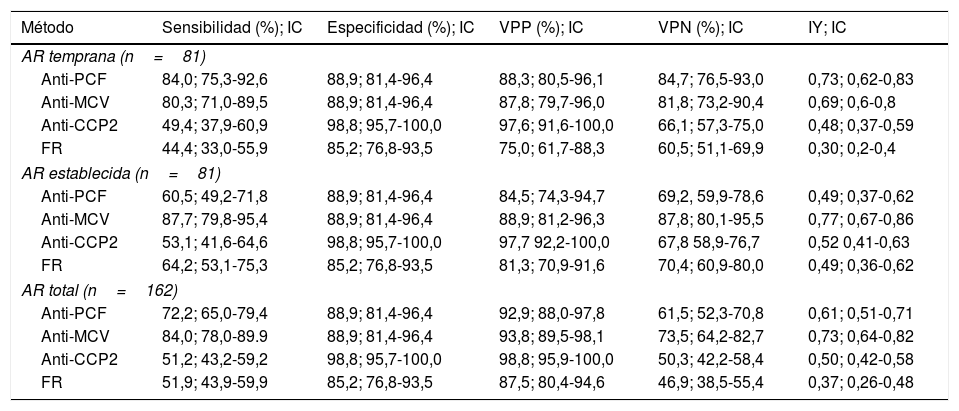
Desempeño diagnóstico de los métodos de determinación de autoanticuerpos en los pacientes con AR al valor de corte seleccionado para cada método
| Método | Sensibilidad (%); IC | Especificidad (%); IC | VPP (%); IC | VPN (%); IC | IY; IC |
|---|---|---|---|---|---|
| AR temprana (n=81) | |||||
| Anti-PCF | 84,0; 75,3-92,6 | 88,9; 81,4-96,4 | 88,3; 80,5-96,1 | 84,7; 76,5-93,0 | 0,73; 0,62-0,83 |
| Anti-MCV | 80,3; 71,0-89,5 | 88,9; 81,4-96,4 | 87,8; 79,7-96,0 | 81,8; 73,2-90,4 | 0,69; 0,6-0,8 |
| Anti-CCP2 | 49,4; 37,9-60,9 | 98,8; 95,7-100,0 | 97,6; 91,6-100,0 | 66,1; 57,3-75,0 | 0,48; 0,37-0,59 |
| FR | 44,4; 33,0-55,9 | 85,2; 76,8-93,5 | 75,0; 61,7-88,3 | 60,5; 51,1-69,9 | 0,30; 0,2-0,4 |
| AR establecida (n=81) | |||||
| Anti-PCF | 60,5; 49,2-71,8 | 88,9; 81,4-96,4 | 84,5; 74,3-94,7 | 69,2, 59,9-78,6 | 0,49; 0,37-0,62 |
| Anti-MCV | 87,7; 79,8-95,4 | 88,9; 81,4-96,4 | 88,9; 81,2-96,3 | 87,8; 80,1-95,5 | 0,77; 0,67-0,86 |
| Anti-CCP2 | 53,1; 41,6-64,6 | 98,8; 95,7-100,0 | 97,7 92,2-100,0 | 67,8 58,9-76,7 | 0,52 0,41-0,63 |
| FR | 64,2; 53,1-75,3 | 85,2; 76,8-93,5 | 81,3; 70,9-91,6 | 70,4; 60,9-80,0 | 0,49; 0,36-0,62 |
| AR total (n=162) | |||||
| Anti-PCF | 72,2; 65,0-79,4 | 88,9; 81,4-96,4 | 92,9; 88,0-97,8 | 61,5; 52,3-70,8 | 0,61; 0,51-0,71 |
| Anti-MCV | 84,0; 78,0-89.9 | 88,9; 81,4-96,4 | 93,8; 89,5-98,1 | 73,5; 64,2-82,7 | 0,73; 0,64-0,82 |
| Anti-CCP2 | 51,2; 43,2-59,2 | 98,8; 95,7-100,0 | 98,8; 95,9-100,0 | 50,3; 42,2-58,4 | 0,50; 0,42-0,58 |
| FR | 51,9; 43,9-59,9 | 85,2; 76,8-93,5 | 87,5; 80,4-94,6 | 46,9; 38,5-55,4 | 0,37; 0,26-0,48 |
AR: artritis reumatoide; CCP2: péptidos citrulinados de segunda generación; FR: factor reumatoide; IC: intervalo de confianza; IY: índice de Youden; MCV: vimentina citrulinada mutada; n: cantidad de pacientes;; PCF: péptido citrulinado del fibrinógeno; VC: valor de corte; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Análisis de las curvas ROC obtenidas en la evaluación del desempeño diagnóstico de los inmunoanálisis. A) AR temprana. B) AR establecida. C) Total de pacientes con AR.
La prueba de homogeneidad de áreas mostró diferencias entre todas las curvas (p=0,000).
AR: artritis reumatoide; CCP 2: péptidos citrulinados de segunda generación; FR: factor reumatoide; IC: intervalo de confianza; MCV: vimentina citrulinada mutada; PCF: péptido citrulinado del fibrinógeno; ROC: curva operativa del receptor.
Todos los pacientes con AR temprana tuvieron DAS 28 moderado o elevado, al igual que el 80,2% de los pacientes con AR establecida (tabla 3), con una mediana mayor de 5,1. La mayor positividad de proteína C reactiva fue observada en los pacientes con AR temprana. Se demostró que la positividad de proteína C reactiva está asociada a la presencia de anticuerpos anti-PCF (χ2=5,8; OR=4,7; IC=1,2-17,9; p=0,0163) en la AR temprana y en la AR establecida (χ2=5,3; OR=2,9; IC=1,2-7,4; p=0,0217). Además, en la AR temprana se observó correlación positiva de los anticuerpos anti-PCF con el DAS 28, así como valores superiores del DAS 28 en los pacientes positivos de anticuerpos anti-PCF al compararlos con los pacientes seronegativos (U=244,0; p=0,0108).
Indicadores clínicos y serológicos de actividad de la enfermedad en los pacientes con AR y relación con la positividad de anticuerpos anti-PCF
| Indicadores | AR temprana (n=81) | AR establecida (n=81) |
|---|---|---|
| DAS28, m (RIC) | 5,2 (4,3-6,0) | 5,1 (3,9-5,9) |
| Remisión: DAS 28 <2,6, n (%) | 0 | 7 (8,6) |
| Baja actividad: DAS 28 ≥ 2,6 y ≤ 3,2, n (%) | 0 | 9 (11,1) |
| Moderado: DAS28> 3,2 y ≤ 5,1, n (%) | 35 (43,2) | 26 (32,1) |
| Elevado: DAS28> 5,1, n (%) | 43 (53,1) | 39 (48,1) |
| DAS 28 en anti-PCF positivos, m (RIC) | 5,4 (4,5-6,2)a | 5,3 (4,8-5,9) |
| DAS 28 en anti-PCF negativos, m (RIC) | 4,5 (3,7-5,2)a | 4,5 (2,9-6,0) |
| HAQ, m (RIC) | 0,62 (0,25-0,75) | 0,75 (0,25-1,31) |
| HAQ en anti-PCF positivos, m (RIC) | 0,75 (0,25-0,75) | 0,75 (0,25-1,31) |
| HAQ en anti-PCF negativos, m (RIC) | 0,38 (0,28-0,75) | 0,75 (0,25-1,13) |
| Tratamiento | ||
| Metotrexato (%) | 25,9 | 81,5 |
| Azatioprina (%) | – | 7,4 |
| Cloroquina (%) | – | 17,3 |
| Sulfasalazina (%) | – | 11,1 |
| Prednisona (%) | 19,8 | 90,1 |
| Proteína C reactiva positiva, n (%) | 68 (84,0) | 48 (59,3) |
| VSG, m (RIC) | 30 (20-48) | 31 (16-55) |
| VSG en anti-PCF positivos, m (RIC) | 30 (20-48) | 33 (18-60) |
| VSG en anti-PCF negativos, m (RIC) | 28 (25-40) | 25 (23-45) |
AR: artritis reumatoide; DAS 28: índice de actividad de la enfermedad basado en el conteo de 28 articulaciones; HAQ: cuestionario de evaluación de la salud; m: mediana; n: cantidad de pacientes; PCF: péptido citrulinado de fibrinógeno; RIC: recorrido intercuartil; VSG: velocidad de sedimentación globular.
El hallazgo más importante de esta investigación fue la capacidad del péptido citrulinado del fibrinógeno diseñado para reconocer con una elevada frecuencia los anticuerpos presentes en pacientes cubanos con AR.
Diversos estudios han analizado la utilidad de péptidos derivados de la fibrina en el diagnóstico de esta enfermedad. El péptido diseñado tuvo similitudes con los péptidos evaluados anteriormente en estos pacientes, en cuanto a coincidencia con algunas regiones de aminoácidos, carga neta positiva y balance arginina/citrulina20-22. De acuerdo con estos investigadores, una carga neta positiva y un adecuado balance de residuos arginina/citrulina en los péptidos puede favorecer una conformación con mayor capacidad de unión a los autoanticuerpos22.
Investigaciones previas han demostrado que no todos los péptidos citrulinados tienen igual reactividad, lo que demuestra la importancia de los residuos de aminoácidos no citrulinados circundantes en la formación de epítopos y en la accesibilidad de los residuos de citrulina para potenciar la antigenicidad22. Se ha observado que los residuos de aminoácidos que rodean a la citrulina intervienen en la afinidad del péptido por los anticuerpos, donde los aminoácidos más encontrados son glicina, serina, histidina, treonina y glutamina22-24. En el péptido diseñado los aminoácidos serina e histidina se encuentran circundantes a la citrulina.
El valor diagnóstico de los anticuerpos anti-PCF fue superior a los inmunoanálisis comerciales utilizados habitualmente (anti-MCV, anti-CCP2 y FR) en los pacientes cubanos con AR temprana, mientras que en los pacientes con AR establecida fue solamente superior a los ensayos anti-CCP2 y FR. En este sentido, es importante la capacidad que han demostrado los antígenos modificados presentes en las articulaciones como el fibrinógeno para iniciar la producción de autoanticuerpos en las etapas tempranas de la enfermedad14,15. En investigaciones anteriores en pacientes cubanos con AR, se ha demostrado que los anticuerpos contra antígenos modificados de la vimentina tienen un valor diagnóstico superior a los anticuerpos anti-CCP225.
El inmunoanálisis para la determinación de anticuerpos anti-PCF evaluado mostró valores superiores de sensibilidad y valores inferiores de especificidad para el diagnóstico de la AR temprana a los obtenidos por otros autores, que evaluaron péptidos citrulinados contra otros epítopos de las proteínas fibrina y fibrinógeno21,22,26, En el 2009, Sanmarti et al. observaron una sensibilidad del 72,1% y una especificidad del 98% de un péptido de la cadena α de la fibrina citrulinada (617-631, citrulinación 630) unido a la filagrina y una sensibilidad de 73,9% para la determinación de anticuerpos anti-CCP221. En el 2014, Cornillet et al. evaluaron un péptido de la cadena β de la fibrina citrulinada (60-74, citrulinación 60, 72, 74) ya reportado en la década pasada, obteniendo una sensibilidad (71%) y una especificidad (95%) similares a las que obtuvieron con la determinación de anti-CCP2 (74% sensibilidad y 95% de especificidad)26. >Demostraron que estos epítopos de la fibrina son reconocidos por anticuerpos contra el fibrinógeno citrulinado y estudiaron además la reactividad de un péptido citrulinado de la cadena α de la fibrina (36-50) combinado con un péptido de la cadena β (60-74), observando una sensibilidad de 47%, al fijar la especificidad al 98% (26). Cabrera-Villalba et al., en el 2017, observaron una frecuencia del 68,5% de un péptido citrulinado del fibrinógeno α (617-631, citrulinación 630) en pacientes con AR27, inferior a la frecuencia de aparición de los anticuerpos que reconocen el péptido diseñado en la AR temprana.
En la población cubana pudieran existir diferentes especificidades antigénicas reconocidas por otros anticuerpos frente a péptidos citrulinados no detectados por los anticuerpos anti-CCP2. Las variaciones en diferentes poblaciones de la frecuencia de anticuerpos que reconocen proteínas citrulinadas pueden ser debidas a factores genéticos y medioambientales, además de a las características demográficas, la selección de los pacientes y la clasificación de la enfermedad4,11.
La presencia de los anticuerpos anti-PCF estuvo vinculada a mayor severidad de la enfermedad y, por tanto, son una herramienta útil para la evaluación clínica de los pacientes cubanos con AR. Estos anticuerpos permiten diferenciar 2poblaciones de pacientes bien definidas, con diferentes características clínicas. En la AR temprana, el grupo de pacientes seropositivos se caracteriza por una mayor actividad de la enfermedad, con un valor mayor de DAS 28, que los pacientes seronegativos. En este sentido, los objetivos y las estrategias de tratamiento en la AR pueden ser diferentes en pacientes seropositivos de anticuerpos anti-PCF.
Una limitación de este trabajo fue que no se estudió la vinculación de los anticuerpos anti-PCF con estudios radiológicos, lo cual puede formar parte de futuras investigaciones clínicas en pacientes cubanos con AR.
ConclusionesEl inmunoanálisis diseñado con un nuevo péptido citrulinado del fibrinógeno es capaz de detectar anticuerpos específicos en pacientes cubanos con AR temprana y establecida con un alto valor diagnóstico y puede ser utilizado para identificar a los pacientes con mayor severidad de la enfermedad.
FinanciaciónEsta investigación fue financiada por el Ministerio de Salud Pública, La Habana, Cuba.
Conflicto de interesesLos autores plantean que no existen conflictos de intereses con respecto al artículo publicado.