Estimar la frecuencia de aparición de las reacciones relacionadas con la administración (RRA), los síntomas asociados a las graves o tardías, la ventana de exposición desde inicio de la terapia biológica y si hay diferencias entre infliximab, etanercept y adalimumab.
Pacientes y métodoBIOBADASER es un registro de acontecimientos adversos establecido en 2001 para determinar la seguridad de las terapias biológicas en enfermedades reumáticas. Contiene datos de los pacientes, tratamiento y acontecimientos adversos relevantes.
ResultadosSe registró un total de 496 RRA relevantes en 442 pacientes, lo que representa un 19,6% (496/2.531) de todos los acontecimientos adversos comunicados y un 6,3% de los pacientes registrados (442/6.969). La tasa de incidencia de RRA por 1.000 años-paciente con infliximab es de 28 casos (intervalo de confianza [IC] del 95%, 25-31), con etanercept 0,2 (IC del 95%, 0,1-0,4) y con adalimumab 0,2 (IC del 95%, 0,07-0,7). En más de la mitad de las RRA, el acontecimiento adverso da lugar a la interrupción del fármaco relacionado y en el 5% de los casos el paciente requiere ser hospitalizado. Más del 20% de las RRA ocurren después de 15 meses de tratamiento, incluso aparecen después de 5 años. En las reacciones adversas tardías los síntomas comunicados con más frecuencia son erupciones, fiebre, malestar general y mialgias.
ConclusionesLas RRA pueden aparecer en cualquier momento de la enfermedad, son una de las causas más frecuentes de interrupción de tratamiento con infliximab. Aunque con menor frecuencia, también se relacionan con etanercept y adalimumab en síntomas que pueden no identificarse como tales.
To estimate the frequency of administration related reactions (ARR), the risk window from the starting date, and finally if there are any differences between infliximab, etanercept and adalimumab.
Patients and methodBIOBADASER is an adverse events registry established in 2001 for active long-term follow-up of safety of biological therapies in rheumatic patients. Data from patients, diagnosis, treatment, and adverse events are recorded.
ResultsFour-hundred ninety six relevant ARR were registered, 19.6% (496/2531) of all the adverse events communicated and 6.3% (496/2531) of all the patients registered. The incidence rate per 1000 patients-year with infliximab is 28 cases (95% CI, 25-31), with etanercept 0.2 (95% CI, 0.1-0.4) and with adalimumab 0.2 (95% CI, 0.07-0.7). Treatment was interrupted in more than 50%
of all the ARR and 5% of all patients were hospitalized. More than 20% ARR happened after 15 months of treatment; in addition 2 appeared after 5 years of treatment. In delayed reactions the symptoms that most frequently were recorded were rash, fever, malaise, and myalgia.
ConclusionsARR can appear in any moment of the treatment; they are among the most frequent causes of treatment interruption. Although with less frequency, ARR are also associated with etanercept and adalimumab with symptoms that cannot be identified as such.
La inhibición farmacológica del factor de necrosis tumoral (TNF), ya sea con infliximab, etanercept o adalimumab, ha demostrado ser eficaz en varias enfermedades inflamatorias. Entre los efectos adversos esperados de toda terapia de origen biotecnológico, como es el caso de estos medicamentos, se encuentran las reacciones adversas relacionadas con su administración (RRA). Las RRA de los inhibidores del TNF se pueden clasificar en agudas o tardías1–4.
Las RRA agudas se presentan en el momento de la administración o en las siguientes 24 horas y se suelen caracterizar por síntomas tales como prurito, edema, urticaria, hipotensión, hipertensión, bradicardia, taquicardia, cefaleas, fiebre o shock anafiláctico, entre otros. Las RRA tardías se presentan desde 24 horas hasta 14 días después de la administración del medicamento y suelen asociarse a síntomas tales como artralgias, mialgias, urticaria, erupciones, fiebre o cefaleas.
Un síntoma aislado de una RRA puede interpretarse como un acontecimiento adverso de otro tipo, ya que, salvo las cutáneas, tipo prurito y urticaria, todos los síntomas que se describen habitualmente son muy inespecíficos. Un mejor conocimiento del tipo y el momento de aparición de las reacciones adversas puede ayudarnos a la hora de establecer un diagnóstico diferencial ante un acontecimiento adverso en un paciente en tratamiento con inhibidores del TNF. Es por ello que decidimos realizar un análisis en BIOBADASER, el Registro Español de Acontecimientos Adversos de Terapias Biológicas en Enfermedades Reumáticas, con el objeto de estimar la frecuencia de aparición de las RRA, así como los síntomas concomitantes de las RRA graves o tardías, conocer la ventana de exposición desde el inicio de la terapia biológica y, por último, determinar las diferencias en RRA que puedan existir entre infliximab, etanercept y adalimumab.
Pacientes y métodoBIOBADASER ha sido descrito en detalle en publicaciones anteriores5,6. Se trata de un registro de acontecimientos adversos, creado en el año 2001, para determinar la seguridad de las terapias biológicas en enfermedades reumáticas. En él se registran datos de los pacientes (sexo, edad, diagnóstico, fecha de diagnóstico), de los tratamientos (tipo, fecha de inicio y fin) y de los acontecimientos adversos. Los pacientes incluidos en BIOBADASER pueden tener cualquier enfermedad tratada por reumatólogos para la que se haya utilizado un tratamiento de origen biotecnológico.
Los acontecimientos adversos que se recogen en BIOBADASER son sólo los relevantes. Se considera acontecimiento adverso relevante todo suceso desfavorable que, independientemente de la dosis, produzca la muerte, ponga en peligro la vida, precise de ingreso hospitalario o lo prolongue, produzca una discapacidad persistente o importante o produzca malformaciones congénitas. Acontecimientos médicos importantes que no pongan en peligro inmediato la vida ni produzcan la muerte, pero que comprometan al paciente o requieran intervención para prevenir alguno de los resultados enumerados en la definición anterior, también se considerarán acontecimientos adversos relevantes.
Se definen como RRA las manifestaciones aisladas o en síndrome que sobrevienen en relación temporal con la administración de un fármaco o que por sus características (racimos típicos de síntomas) se consideran relacionadas con la administración aunque su aparición sea tardía. Los propios médicos participantes de BIOBADASER son los que definían si se trataba o no de una RRA. Todas las RRA registradas son relevantes por definición, pero además se han considerado RRA graves las que han requerido ingreso hospitalario del paciente o que éste se prolongara. Se han considerado reacciones agudas las que se presentan hasta 24 horas después de la administración y tardías las que se presentan desde 24 horas hasta 14 días después.
De todas las RRA, se recogió de forma sistemática, mediante un listado de comprobación, todos los posibles síntomas que podían estar asociados, tales como erupción, disnea, prurito, dolor torácico, malestar general, mareo, hipotensión, náuseas, hipertensión, fiebre, cefalea, edema facial, broncospasmo, dolor lumbar, tos, edema bucal, mialgia, parestesias, dolor abdominal, astenia, taquicardia supraventricular, síncope, conjuntivitis, cianosis, dispepsia, edema periférico, edema generalizado, insuficiencia cardíaca, acidosis respiratoria y diplopía, además se incluyó un campo de texto libre en el que se podía incluir cualquier otro síntoma relacionado.
Los centros participantes son monitorizados tanto online, diariamente, como in situ, anualmente, justo antes de descargar la base de datos para obtener el informe anual. Las monitorizaciones se realizan en una muestra aleatoria de 20 pacientes por centro, cuyas historias clínicas se comparan con los datos introducidos en BIOBADASER. Los datos incompletos y los errores son corregidos según las instrucciones del monitor.
Se realizó un análisis descriptivo de las RRA desde el inicio del registro hasta junio de 2006. Se estimó la tasa de incidencia de RRA con intervalos de confianza (IC) del 95%. Se comparó las características clínicas de los pacientes de BIOBADASER con y sin RRA mediante los tests apropiados a la distribución de las variables (la prueba de la χ2 para las dicotómicas o categóricas y la de la t de Student para las continuas).
ResultadosDesde su inicio en febrero de 2000 hasta enero de 2006 se registró en BIOBADASER a 6.969 pacientes, procedentes de 100 centros españoles. Estos pacientes han recibido hasta 8.321 tratamientos con agentes biológicos, de los cuales 4.525 (54%) han sido con infliximab, 2.595 (31%) con etanercept, 1.081 (13%) con adalimumab, 107 (1%) con anakinra y 13 (0,2%) con rituximab. Hasta 1.125 pacientes han estado en tratamiento con más de un agente biológico en momentos distintos de su evolución. Dado el bajo número de pacientes con anakinra o rituximab se excluyeron del análisis.
Se registró un total de 496 RRA relevantes en 442 pacientes, lo que representa un 19,6% (496/2.531) de todos los acontecimientos adversos comunicados y un 6,3% de los pacientes registrados (442/6.969). En 42 pacientes se comunicaron 2 RRA; en 9 pacientes, 3 RRA, y 3 pacientes presentaron respectivamente 4, 5 y 6 RRA.
Al comparar a los pacientes que han presentado RRA con el resto de los pacientes incluidos en el registro que no han presentado ninguna RRA, se puede observar que el porcentaje de pacientes con artritis reumatoide es mayor entre los que no presentaron RRA, mientras que la espondilitis anquilosante y la artritis psoriásica son menos frecuentes como diagnóstico indicativo del tratamiento biológico en los pacientes con RRA. No se observan diferencias significativas en cuanto a la edad y la duración de la enfermedad, pero sí en el porcentaje de mujeres, que es superior en los pacientes que presentaron RRA (tabla 1).
Características de los pacientes en BIOBADASER que presentaron RRA en algún momento del seguimiento frente a las de los pacientes que no las presentaron
| Sin RRA (n = 6.527) | Con RRA (n = 442) | p | |
| Edad (media ± DE) | 54 ± 15 | 52 ± 14 | 0,058 |
| Mujeres, n (%) | 4.206 (64) | 310 (70) | 0,015 |
| Duración media de la enfermedad (años), media ± DE | 10 ± 8 | 10 ± 7 | 0,180 |
| Diagnósticos más frecuentes, n (%) | 0,001 | ||
| Artritis reumatoide | 4.142 (66) | 317 (76) | |
| Espondilitis anquilosante | 853 (14) | 43 (10) | |
| Artritis psoriásica | 787 (13) | 35 (9) | |
| Otras espondiloartritis | 236 (4) | 9 (2) | |
| Artritis idiopática juvenil | 223 (3) | 11 (3) |
DE: desviación estándar; RRA: reacciones relacionadas con la administración.
La tasa de aparición de RRA con inhibidores del TNF es de 18 casos por 1.000 años-paciente (IC del 95%, 16-20). En cuanto a la frecuencia de aparición respecto del tipo de biológico empleado, es mayor con infliximab que con los otros inhibidores del TNF (tabla 2). En el 10,4% (472/4.525) del total de tratamientos con infliximab aparece al menos una RRA, en el 0,5% (14/2.595) con etanercept y en el 0,7% (8/1.081) con adalimumab. Las RRA tardías son más frecuentes con etanercept y adalimumab que con infliximab, aunque no de forma estadísticamente significativa. En más de la mitad de las RRA, el acontecimiento adverso da lugar a la interrupción del fármaco relacionado (tabla 2). Los síntomas registrados con etanercept son prurito (n = 5), erupción (n = 3), broncospasmo (n = 2) y dolor torácico (n = 2); además, se han comunicado cefalea, cianosis, diplopía, disnea, edema bucal, edema facial, fiebre, malestar general, mareo y parestesias (en todas, n = 1). Los síntomas asociados a adalimumab son erupción (n = 4), fiebre (n = 2), malestar general (n = 2), prurito (n = 2) y, además, poliartralgias, parestesias, broncospasmo, dolor torácico y edema bucal (todas, n = 1).
Diferencias entre las RRA producidas por infliximab, etanercept o adalimumab
| Reacciones | Infliximab (n = 472) | Etanercept (n = 16) | Adalimumab (n = 8) | p |
| Tasa de RRA por 1.000 años-paciente (IC del 95%) | 28(25-31) | 0,2(0,1-0,4) | 0,2(0,07-0,7) | |
| Graves, n (%) | 24 (5,1) | 1 (6,2) | 0 | 0,788 |
| Tardías, n (%) | 31 (6,6) | 2 (12,5) | 3 (37,5) | 0,484 |
| La RRA dio lugar a la interrupción del tratamiento, n (%) | 304(64,4) | 8(50,0) | 6(75,0) | 0,471 |
IC: intervalo de confianza; RRA: reacciones relacionadas con la administración.
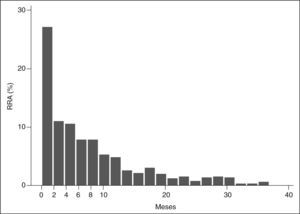
Si observamos el tiempo que transcurre desde el inicio del tratamiento con un biológico concreto hasta el momento en que aparece la primera RRA, se puede observar que más del 20% de las RRA ocurren después de 15 meses de tratamiento, incluso han aparecido 2 RRA después de 5 años (fig. 1).
Al estudiar la sintomatología de los pacientes que presentan alguna RRA, hay que tener en cuenta que normalmente en una RRA se presentan varios síntomas asociados. Los síntomas que con mayor frecuencia se han comunicado son: erupciones (n = 195), disnea (n = 115), prurito (n = 109), dolor torácico (n = 65), malestar general (n = 64), mareo (n = 57), hipotensión (n = 57) y náuseas (n = 50). La mediana (P25-75) de síntomas que aparecieron por reacción fue de 2 (1-3).
La tabla 3 muestra también los síntomas comunicados en las RRA tardías; los más frecuentes fueron las erupciones, la fiebre, el malestar general y las mialgias. De las 33 RRA tardías comunicadas, 5 requirieron la hospitalización del paciente y en 15 casos se interrumpió el tratamiento.
Síntomas de todas las reacciones adversas relacionadas con los medicamentos y de las tardías por orden de frecuencia
| Síntomas totales | n (%) | Síntomas tardíos | n (%) |
| Erupción | 195 (19,5) | Erupción | 15 (25,4) |
| Disnea | 115 (11,5) | Fiebre | 9 (15,3) |
| Prurito | 109 (10,9) | Malestar general | 5 (8,5) |
| Dolor torácico | 65 (6,5) | Mialgia | 4 (6,8) |
| Malestar general | 64 (6,4) | Prurito | 4 (6,8) |
| Mareo | 57 (5,7) | Cefalea | 3 (5,1) |
| Hipotensión | 57 (5,7) | Tos | 3 (5,1) |
| Náuseas | 50 (5,0) | Broncospasmo | 2 (3,4) |
| Hipertensión | 39 (3,9) | Edema bucal | 2 (3,4) |
| Fiebre | 37 (3,7) | Edema facial | 2 (3,4) |
| Cefalea | 34 (3,4) | Parestesias | 2 (3,4) |
| Edema facial | 31 (3,1) | Astenia | 1 (1,7) |
| Broncospasmo | 19 (1,9) | Conjuntivitis | 1 (1,7) |
| Dolor lumbar | 18 (1,8) | Diplopía | 1 (1,7) |
| Tos | 17 (1,7) | Dolor abdominal | 1 (1,7) |
| Edema bucal | 16 (1,6) | Dolor lumbar | 1 (1,7) |
| Mialgia | 11 (1,1) | Dolor torácico | 1 (1,7) |
| Parestesias | 11 (1,1) | Náuseas | 1 (1,7) |
| Dolor abdominal | 9 (0,9) | Taquicardia | 1 (1,7) |
| Astenia | 7 (0,7) | Total | 59 (100) |
| Taquicardia | 7 (0,7) | ||
| Síncope | 6 (0,6) | ||
| Conjuntivitis | 5 (0,5) | ||
| Cianosis | 5 (0,5) | ||
| Dispepsia | 5 (0,5) | ||
| Edema periférico | 4 (0,4) | ||
| Edema generalizado | 3 (0,3) | ||
| Insuficiencia cardíaca | 2 (0,2) | ||
| Acidosis respiratoria | 1 (0,1) | ||
| Diplopía | 1 (0,1) | ||
| Total | 1.000 (100) |
Los síntomas más comúnmente registrados en las 25 RRA graves han sido: erupción (n = 11), disnea (n = 7), opresión torácica (n = 7), fiebre (n = 5), broncospasmo (n = 4), cefalea (n = 4) e hipotensión (n = 4). De las 25 comunicadas 6 eran tardías y en 12 se interrumpió el tratamiento a raíz de la RRA.
DiscusiónA pesar de que las RRA son un tipo de reacción adversa conocida por todos los que utilizan fármacos de origen biotecnológico, hasta ahora no se había estudiado en su conjunto las RRA asociadas a todos los anti-TNF. Todos los artículos publicados hasta el momento se centran únicamente en reacciones infusionales relacionadas con infliximab1–4,7–10 y en series de casos o cohortes de pequeño tamaño muestral.
Con respecto a los factores que pueden predecir la aparición de RRA, únicamente un artículo publicado por Kapenatovic et al1, acorde con nuestros resultados, menciona que los pacientes con artritis reumatoide presentan reacciones infusionales con más frecuencia que los que utilizan infliximab por espondilitis anquilosante (el 21 frente al 13%), si bien debido al escaso número de pacientes (213 con artritis y 76 con espondilitis) la diferencia que detectan no logra la significación estadística.
En relación con el porcentaje sobre el total de pacientes que presentan al menos una RRA existen discrepancias, ya que en algunos estudios es aproximadamente un 20%1,4,7, incluso uno de ellos menciona que en el 53% de los pacientes aparecen RRA8. Aunque nuestros resultados con infliximab coinciden con los de Cheifetz et al3 (10%), es difícil comparar estos resultados, ya que en todos ellos la población estudiada es diferente, unos estudian a pacientes sólo con artritis reumatoide, otros con artritis y espondilitis, e incluso a pacientes con enfermedad de Crohn3. Sobre este dato es importante destacar que en BIOBADASER únicamente se notifican acontecimientos adversos “relevantes”, es decir que la frecuencia total de RRA es harto probable que sea mucho mayor.
Uno de los datos más importantes del presente análisis es el porcentaje de RRA en los anti-TNF distintos de infliximab. Es muy común pensar que con etanercept o adalimumab, ambos de administración subcutánea, únicamente se producen reacciones en el sitio de inyección, pero nuestros resultados demuestran que también aparecen síntomas tales como fiebre, opresión torácica, broncospasmo, náuseas, diplopías, parestesias y otros síntomas comúnmente relacionados con las reacciones infusionales. A este respecto, convendría señalar además que el elevado número de RRA de infliximab frente a etanercept o adalimumab puede estar aumentado, ya que cuando éstas ocurren durante la infusión de infliximab, excepto en las tardías, el médico siempre está presente, circunstancia que no se da habitualmente en el caso de etanercept o adalimumab.
A pesar de que este tipo de reacciones no suelen ser graves, y que se controlan con medicación que reduzca la sensibilización, como antihistamínicos o corticoides, o disminuyendo el ritmo de infusión en el caso de administración intravenosa, hasta un 5% de los pacientes requieren ser hospitalizados. En la mayoría de los artículos publicados el porcentaje de RRA graves es muy bajo, excepto en un artículo de Kugathasan et al9, que presentan el 14% de RRA graves. Además, las RRA asociadas a infliximab son la causa más común de interrupción de tratamiento, este dato nos lleva a pensar que, aunque no son graves como para hospitalizar al paciente, el 64% de ellas son lo suficientemente relevantes como para interrumpir el tratamiento. Estos datos discrepan con los resultados de Wasserman, Cheifetz o Maini, en que la interrupción del tratamiento se produjo en aproximadamente el 2% de los casos y en ninguno se requirió la hospitalización del paciente.
Con respecto a las reacciones tardías, aunque no son demasiado frecuentes (7%), llama la atención que se produzcan síntomas propios de las RRA agudas, tales como broncospasmo, edema, dolor torácico, náuseas o taquicardia. Además se produce cierto tipo de síntomas, como mialgias, dolor lumbar, fiebre, parestesias o diplopía, que por sus características pueden no ser identificados con una RRA tardía y llegar a confundirse con otras enfermedades concomitantes, por lo que es importante tener presente en todo momento este tipo de RRA tardías.
Coincidiendo con estudios previos, en tan sólo el 50% de los casos la RRA se produce en las primeras 3 infusiones de infliximab, con mayor frecuencia en la tercera infusión3,10. Es importante destacar que han aparecido RRA hasta 5 años después de iniciar el tratamiento y que más del 20% aparecen después de 15 meses de tratamiento.
Para concluir, resaltar que aunque este tipo de reacciones se asocian a infliximab con una mayor frecuencia, no se debe descartar que aparezcan con etanercept y adalimumab, con síntomas tales como fiebre, opresión torácica, broncospasmo o náuseas. Además, las RRA son una de las causas más frecuentes de interrupción de tratamiento con infliximab. Destacar que es importante estar alerta a los síntomas que pueden aparecer en la RRA tardías, ya que muchas veces no se piensa en su relación con la administración del fármaco. Y tener en cuenta que este tipo de reacciones pueden aparecer en cualquier momento de la enfermedad, no sólo en las primeras administraciones.
Integrantes del Grupo de Estudio BIOBADASERAgustí Sellas, Basilio Rodríguez, Mireia Barceló (Ciudad Sanitaria Vall d’Hebron); Laura Cebrián, María Montoro (Hospital Gregorio Marañón); Dolores Montesinos (Hospital Universitario Virgen Macarena); Eva Pérez-Pampín (Hospital Clínico Universitario de Santiago); Paloma Vela (Hospital General Universitario de Alicante); Olga Maiz (Hospital Donostia-Edif. Guipúzcoa); Ana M. Ortiz (Hospital Universitario de La Princesa); Paloma Abreu, Isabel Granados (Hospital Ramón y Cajal); Francisco Javier Manero Ruiz, Chesús Beltrán, Eugenio Gimenez Úbeda, Fernando Jiménez Zorzo, Jesús Marzo, Marta Medrano, Ángela Pecondó (Hospital Universitario Miguel Servet); M. Victoria Hernández, Raimon Sanmartí, Juan D. Cañete (Hospital Clínic i Provincial); Carlos Rodríguez Lozano, Antonio Naranjo, Soledad Ojeda, Félix Francisco Hernández, Celia Erausquin, Íñigo Rúa (Hospital de Gran Canaria Dr. Negrin); Inmaculada Ureña, Maria Victoria Irigoyen, Laura Cano (Hospital General Carlos Haya); Ana Cruz Valenciano, Manuel Crespo Echeverria, Félix Cabero Del Pozo (Hospital Severo Ochoa); Luis Francisco Linares (Hospital Virgen de la Arrixaca); Rosa Roselló Pardo, Carlos Vázquez Galeano (Hospital General San Jorge); Juan Carlos Vesga, Eduardo Cuende (Hospital Txagorritxu); Carmen Idalgo Tenorio (Hospital Virgen de Las Nieves); Alexia de Juanes, Beatriz Joven, Javier García (Hospital 12 de Octubre); Delia Reina (Hospital de Bellvitge Princeps D'espanya); Manuel Fernández Prada (Hospital General Universitario de Guadalajara); Joan Maymo Guarch (Imas. Hospital de L'Esperanfa y Hospital del Mar); Javier Calvo, Cristina Campos (Hospital General Universitario de Valencia); Isabel Ibero Díaz, Vega Jovani Casado (Hospital General de Elda); Trinidad Pérez Sandoval (Hospital Virgen Blanca); Jose Raúl Noguera Pons (Hospital General Universitario de Elche); Eduardo Rejón (Hospital Universitario de Valme); Raquel Almodóvar (Hospital Fundación Alcorcón); Manuel Rodríguez Gómez (Complejo Hospitalario de Ourense); Eduardo Collantes Estevez, M. Carmen Castro Villegas (Hospital Universitario Reina Sofía); Jose Ángel Cabezas Lefler (Complejo Hospitalario San Millan-San Pedro); Marta Larrosa Padro, Jordi Gratacos Masmitja, Enrique Casado (Consorci Hospitalari del Parc Tauli); M. Teresa Ruiz Jimeno, Jaime Calvo Alen (Hospital Comarcal Sierrallana); M. Ángeles Mora (Hospital Universitario de Canarias); Jesús Ibáñez Ruan (Policlínico Vigo, S.A. Povisa); Juan Jose García Borras, Rosa Negueroles, Luisa Muñoz, J.L. Valero, D. Ybáñez (Hospital La Fe); Eva Tomero Muriel (Hospital General de Segovia); Amalia Sánchez-Andrade Fernández (Hospital Xeral-Calde); Encarnación Saiz Cuenca (Hospital General Morales Meseguer); Montserrat Centellas (Hospital de Mataró); Jordi Fiter Aresté, Luis Espadaler Poch (Hospital Son Dureta); Lucia Pantoja, M. Valvanera Pinillos (Hospital del Bierzo); Julia García Consuegra, Rosa Merino (Hospital Infantil La Paz); Javier Rivera, Teresa González Hernández (Instituto Provincial de Rehabilitación); Vera Ortiz (Hospital Universitari Germans Trias i Pujol); Carmen Torres, Montserrat Corteguera (Hospital Nuestra Señora de Sonsoles); Javier Alegre (Hospital General Yagüe); Xavier Arasa (Hospital de Tortosa); Jordi del Blanco Barnusell (Hospital Sant Jaume de Calella); Anna Martínez Cristóbal (Hospital de La Ribera); Inmaculada Bañegil (Hospital de Mendaro); Ángel García Aparicio (Hospital Virgen de La Salud); Emilia Aznar (Hospital Reina Sofía); Maria Francisca Pina (Hospital Rafael Méndez); Miquel Ángel Belmonte, Juan Beltrán Fabregat (Hospital General de Castellón); Alberto Alonso Ruiz, Esther Uriarte Itzazelaia (Hospital de Cruces); Mauricio Minguez Vega, Gaspar Panadero Tendero (Hospital San Juan de Alicante); Miguel Ángel Abad Hernández, María Torresano (Hospital Virgen del Puerto); Ana Urruticoechea (Hospital Can Misses de Ibiza); Jose Ivorra (Hospital General de Onteniente y Lluís Alcanyís de Xátiva); Antonio Juan Mas, Jenaro Graña (Hospital Santa Teresa); Saúl Mario Gelman Aizen (Centre Hospitalari Manresa); Jose Carlos Rosas, Gregorio Santos, Raquel Martín (Hospital del S.V.S. de Villajoyosa); Cristina Hidalgo (Hospital de La Santísima Trinidad); Jaime Fernández Campillo, Víctor Eliseo Quevedo (Hospital Comarcal de Monforte); Isabel Rotes, Estefanía Moreno (Hospital de San Rafael).
Queremos agradecer el esfuerzo que han realizado y que realizan todos los centros que componen BIOBADASER.