Comunicamos el caso de un varón portador crónico de virus de hepatitis B (VHB) con espondiloartritis B27 positivo que desarrolló una hepatitis fulminante tras la suspensión del tratamiento con metotrexato (MTX). Una total recuperación tras terapia con lamivudina y adefovir permitió un tratamiento con adalimumab sin otras complicaciones y buena tolerancia.
La reactivación de hepatitis B tras suspensión de MTX es una complicación muy poco frecuente, que también puede ocurrir con los anti-TNF. En pacientes con serología positiva de VHB se recomienda tratamiento profiláctico con antivirales.
We report the case of a male chronic hepatitis B virus (HBV) carrier with HLA-B27 spondyloarthrititis who developed fulminant hepatitis after discontinuation of methotrexate (MTX). Full recovery after therapy with lamivudine and adefovir allowed treatment with adalimumab which was well tolerated.
Reactivation of hepatitis B after MTX withdrawal is a very rare complication, which can also occur in association with anti-TNF agents. In patients with positive serology for HBV prophylactic antiviral therapy is recommended.
La infección por virus de la hepatitis B (VHB) es un problema de salud mundial a pesar de la implantación de los programas de vacunación y postexposición. Se estima que existen más de 350 millones de portadores del VHB de distribución universal, con una prevalencia en los países mediterráneos entre el 1 y el 8%1.
La reactivación de la hepatitis B es un hecho bien conocido en pacientes con infección VHB crónica que son sometidos a tratamiento quimioterápico, inmunosupresor, con anticuerpos monoclonales y en receptores de trasplante hematopoyético. Puede cursar desde una forma asintomática hasta una hepatitis fulminante con elevada morbimortalidad1.
El metotrexato (MTX) es un inmunomodulador ampliamente utilizado en Reumatología y representa en la actualidad el tratamiento de primera elección en numerosas enfermedades. A pesar de su uso tan extendido, de su acción inmunosupresora y de la alta prevalencia de infección por VHB, son muy pocos los casos publicados de reactivación de hepatitis B en pacientes que han recibido tratamiento con dosis bajas semanales de MTX2-9.
La reactivación de hepatitis B también se ha comunicado en pacientes con enfermedades reumáticas tratados con terapia biológica anti-TNF, fundamentalmente infliximab10,11.
La lamivudina se ha mostrado eficaz en el tratamiento y profilaxis de la reactivación de hepatitis B en pacientes tratados con quimioterapia, inmunosupresión o terapia biológica1,10-13. Sin embargo, debido a las altas tasas de resistencia en tratamientos de larga duración, las últimas guías clínicas recomiendan el uso de los nuevos antivirales14.
Presentamos el caso de un varón portador crónico de VHB con espondiloartritis B27 positivo, con afectación axial y periférica que presentó una hepatitis fulminante tras suspensión de tratamiento semanal con MTX. Se recuperó completamente con lamivudina y posteriormente en asociación con adefovir, lo que permitió iniciar tratamiento con adalimumab sin presentar ninguna nueva complicación al año de seguimiento.
Observación clínicaSe trata de un varón de 41 años, fontanero, con antecedentes de HTA desde los 21 años, probable alergia a sulfamidas, episodio de hepatitis B aguda 8 años antes y cirugía de 2.° dedo en martillo del pie izquierdo. Entre sus antecedentes familiares destacan HTA paterna y materna y madre portadora de VHB.
En julio de 2005 tras un episodio de uretritis con secreción uretral estéril que recibió tratamiento con ciprofloxacino, presentó un mes después artritis en tobillo y muñeca izquierda con febrícula. En la anamnesis refería desde hace unos 7 años brotes de lumbalgia inflamatoria y ocasional talalgia. Negaba exantemas y afectación ocular o intestinal ni antecedentes familiares de espondiloartritis. Tras ingreso hospitalario en la exploración se confirmó la oligoartritis, así como dolor en 2.ª MTF del pie izquierdo y en sacroilíacas. Los cultivos de exudado uretral, heces, orina y hemocultivos fueron negativos. El hemograma fue normal. Presentaba una marcada elevación de VSG (98) y PCR (74 mg/l). La bioquímica fue normal a excepción de GGT: 117 UI/l e IgA de 610. Las serologías de lúes, VIH, VHC, Salmonella, Yersinia y Chlamydia fueron negativas. La serología de VHB fue la siguiente: HbsAg (+), HbeAg (–), antiHBc (+), antiHBc IgM (–), antiHBe (+), compatible con estado de portador crónico de VHB. No se determinó la carga viral. El tipaje HLA fue: A1 A24 B27 B8 Bw4 Bw6 Cw2. Los estudios de imagen demostraron sacroileítis bilateral grado 3 y pinzamiento de la 2.ª MTF izquierda, posiblemente posquirúrgico. Se instauró tratamiento con naproxeno 500 mg/12 h y 15 mg/día de prednisona con mejoría articular y se procedió al alta hospitalaria.
En su seguimiento, cada intento de reducir la dosis de prednisona por debajo de 10 mg/día se acompañaba de nuevos brotes de artritis en tobillos, por lo que ante su antecedente de alergia a sulfamidas que contraindicaba la sulfasalacina, iniciamos a los 6 meses tratamiento con 10 mg semanales de MTX subcutáneo que subimos a 15 mg un mes más tarde. La biología hepática se mantuvo normal hasta 3 meses más tarde, momento en que presentó en un control analítico GOT: 144 UI/l, GPT: 215 UI/l, GGT: 144 UI/l, por lo que suspendimos MTX. Quince días después ingresa de Urgencias por cuadro de ictericia, náuseas y diarrea. Se le diagnostica una hepatitis fulminante con citólisis (GOT: 1.039; GPT: 1.085; GGT: 1.510) y colestasis (bilirrubina total de 26,4 mg/l), hepatomegalia homogénea detectada mediante ecografía, trastorno de coagulación (actividad de protrombina del 39%) e insuficiencia renal leve con creatinina de 1,6 mg/l. La serología de VHB fue: HbsAg (+), antiHBc (+), antiHBe (+), DNA VHB 110.000.000 de copias/ml. Se descartaron otras causas de hepatitis viral o autoinmune. Fue tratado con lamivudina 100 mg/día y se mantuvieron 12,5 mg/día de prednisona con mejoría clínica y analítica progresiva hasta la completa normalización de la función hepática y renal a los 5 meses con DNA HVB de 671 copias.
Tras un estudio alergológico se comprobó tolerancia a sulfasalacina, por lo que comenzó tratamiento con 2 g/día y reducción progresiva de prednisona por persistir con artritis de tobillos y tendinitis aquilea. A los 4 meses se constató un nuevo aumento de la carga viral que se controló tras añadir 10 mg/día de adefovir. Un año más tarde persistía con artritis de tobillos y tendinitis aquilea bilateral con afectación radiológica tarsiana izquierda, sacroileítis bilateral grado 4 y entesofitos aquileos, BASDAI de 6,9, BASFI de 4,5, la función hepática era normal y la carga viral negativa. Suspendimos la sulfasalacina y comenzó tratamiento con adalimumab cada 2 semanas. Tras un año de seguimiento no ha vuelto a tener ningún brote articular, continúa en tratamiento con adalimumab, lamivudina y adefovir, la función hepática sigue normal y la carga viral es negativa.
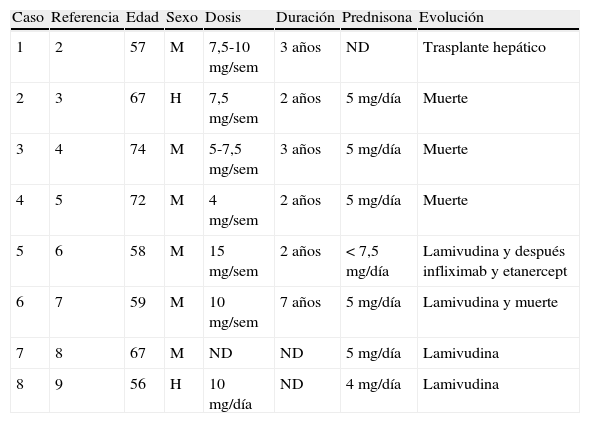
DiscusiónLa hepatitis fulminante por reactivación de hepatitis B tras la suspensión de tratamiento con dosis bajas semanales de MTX se describió por primera vez en 19902. Desde entonces, y a pesar del uso cada vez más extendido del MTX en Reumatología, se han comunicado muy pocos casos de esta complicación y con una elevada mortalidad (tabla 1). En algunos casos la reactivación se ha atribuido a una mutación en la región precore o del promotor del core2-4. En otros dos casos de espondiloartritis B27 se especuló sobre la contribución del MTX en la reactivación de VHB13.
Recopilación de casos de reactivación de VHB tras suspensión de MTX.
| Caso | Referencia | Edad | Sexo | Dosis | Duración | Prednisona | Evolución |
| 1 | 2 | 57 | M | 7,5-10 mg/sem | 3 años | ND | Trasplante hepático |
| 2 | 3 | 67 | H | 7,5 mg/sem | 2 años | 5 mg/día | Muerte |
| 3 | 4 | 74 | M | 5-7,5 mg/sem | 3 años | 5 mg/día | Muerte |
| 4 | 5 | 72 | M | 4 mg/sem | 2 años | 5 mg/día | Muerte |
| 5 | 6 | 58 | M | 15 mg/sem | 2 años | < 7,5 mg/día | Lamivudina y después infliximab y etanercept |
| 6 | 7 | 59 | M | 10 mg/sem | 7 años | 5 mg/día | Lamivudina y muerte |
| 7 | 8 | 67 | M | ND | ND | 5 mg/día | Lamivudina |
| 8 | 9 | 56 | H | 10 mg/día | ND | 4 mg/día | Lamivudina |
H: hombre; M: mujer; ND: no determinado.
La reactivación de la hepatitis B es un hecho ampliamente conocido en pacientes oncohematológicos sometidos a tratamiento con diversos agentes quimioterápicos, inmunosupresión agresiva, glucocorticoides, anticuerpos monoclonales y trasplante hematopoyético de células madre1. Se conocen una serie de factores de riesgo favorecedores de esta complicación (tabla 2) que ocurre casi siempre tras la suspensión de la inmunosupresión cuando la respuesta inmune celular se restaura y se dirige contra los hepatocitos infectados1,10,12.
Factores de riesgo de reactivación de hepatitis B.
| Factores de riesgo de reactivación de hepatitis B |
| Sexo masculino |
| Edad joven |
| Altas dosis de quimioterapia o inmunosupresión |
| Quimioterapia con antraciclinas o glucocorticoides |
| Trasplante alogénico de células madre hematopoyéticas |
| Tratamiento con anticuerpos monoclonales: rituximab, alentuzumab, infliximab |
| Tratamiento con MTX o leflunomida |
| Perfil serológico del VHB: HBsAg (+), HBeAg (+), antiHBc (+) en ausencia de HbsAg y antiHBs, carga viral>3×105 copias/ml. |
La reactivación del VHB se ha comunicado también en pacientes tratados con terapias biológicas (infliximab, etanercept y rituximab) por patología reumatológica, inflamatoria intestinal o linfomas, por lo que se han publicado estrategias de cribaje, prevención y tratamiento de la reactivación del VHB en pacientes que van a recibir tratamiento con quimioterapia, inmunosupresores y terapia biológica1,10,12.
La profilaxis y el tratamiento de elección es con lamivudina, un análogo de los nucleósidos de la DNA polimerasa, por su rapidez de acción, seguridad y coste. Sin embargo, tras varios meses de tratamiento se puede producir resistencias por aparición de mutaciones, en cuyo caso se recomienda el adefovir o los nuevos antivirales (tenofovir o entecavir)1,10,12,14.
ConclusionesConsideramos que a todos los pacientes que van a recibir tratamiento con MTX, otros inmunosupresores o terapias biológicas se les debe realizar un cribaje de VHB y en caso de detectar HBsAg positivo se ha de determinar el DNA VHB e iniciar tratamiento con antivirales independientemente de si el virus replica o no. Los antivirales recomendados son tenofovir o entecavir y puesto que la duración de la terapia normalmente será mayor de 12 meses, se mantendrán durante todo el tiempo que dure el tratamiento y hasta 6-12 meses después de su suspensión dependiendo de la carga viral1,10,14.
Se obtuvo consentimiento informado por escrito del paciente para la administración de adalimumab junto al tratamiento antiviral.