El objetivo de la revisión sistemática fue evaluar la eficacia y la seguridad del tratamiento con RTX en pacientes con AR para la elaboración del Documento de consenso de uso de rituximab en artritis reumatoide, un documento con recomendaciones basadas en la evidencia5 sobre el empleo del fármaco en situaciones clínicas difíciles en práctica clínica habitual.
MetodologíaSe realizaron búsquedas de los trabajos publicados desde enero de 2003 hasta septiembre de 2009 en Medline, EMBASE y la Cochrane Library y revisión manual de los resúmenes de los congresos de EULAR y ACR de 2003 a 2009 y de datos proporcionados por Roche Pharma. En la estrategia de búsqueda se emplearon los siguientes términos: «Rituximab», «Rheumatoid arthritis», «Anti-CD20», «Biologics». Dos autores (BHC y MGH) efectuaron la búsqueda bibliográfica por título y resumen. Después dos autores (BHC y RAA) calificaron los trabajos según la escala GRADE y los seleccionaron tras su revisión en extenso. La extracción de los datos para el análisis se realizó en formato en papel. Las medidas de desenlace evaluadas fueron para eficacia las propuestas por OMERACT13 (Outcome Measurements in Rheumatoid Arthritis Clinical Trials) y el grupo Cochrane de Estudio de Enfermedades Musculoesqueléticas, relevantes en práctica clínica. Para seguridad se evaluaron: mortalidad, presencia de infecciones graves, efectos adversos graves, retiradas del estudio por cualquier causa, retiradas del estudio por efectos adversos graves, retiradas del estudio por reacciones a la infusión y reacciones graves relacionadas con la infusión. El análisis estadístico se realizó con el cálculo del riesgo relativo y la odds ratio para variables dicotómicas (OR) y de la diferencia media entre el valor basal frente al final para variables continuas, se estimó la diferencia absoluta de riesgo con el programa RevMan 519 y el número de pacientes necesario que tratar con las fórmulas y la calculadora de Cates20.
ResultadosEl RTX es un medicamento eficaz en el tratamiento de tres grupos de pacientes con artritis reumatoide: en fallo a MTX, fallo a anti-TNF y en pacientes sin exposición previa a MTX. Es necesario tratar a 7 (5-10) pacientes con RTX frente a placebo para obtener una respuesta ACR70; 9 (6-15) para conseguir un DAS28<2,6 y 5 (4-8) para una mejoría en el HAQ>0,2. La seguridad del fármaco fue similar a la del placebo, excepto para reacciones a la primera infusión en donde se necesita tratar 12 (8-26) pacientes con RTX frente a placebo para observar alguna reacción a la primera infusión con premedicación con corticoides. Las reacciones graves a la infusión tuvieron una incidencia de 0,7% en los pacientes del grupo tratado con RTX. No fue posible identificar un mayor incremento en el número de infecciones graves posiblemente debido a problemas metodológicos, no obstante el riesgo de desarrollar infecciones graves en pacientes tratados con RTX parece ser comparable al de otros anti-TNF y biológicos.
The aim of the systematic review was to evaluate the safety and efficacy of rituximab for the treatment of rheumatoid arthritis patients, as part of the Consensus on the use of rituximab in rheumatoid arthritis. A document with evidence based recommendations5.
MethodsAll papers published from January 2003 to September 2009 were reviewed in a systematic way in Medline, EMBASE and Cochrane Library database. The Mesh terms used were: «Rituximab», «Rheumatoid arthritis», «and Anti-CD20», «Biologics». The abstracts of the EULAR and ACR congress of 2003 to 2009 were also reviewed, as well data of Roche Pharma. Two rheumatologists (BHC y MGH) made the bibliographic review by title and summary of each work. Two authors (BHC y RAA) selected them by quality according the GRADE SCALE after they review. The data were collected in paper. The outcomes evaluated were of efficacy in agreement with OMERACT13 (Outcome Measurements in Rheumatoid Arthritis Clinical Trials) and The Musculoskeletal Cochrane Study Group. The outcomes of safety evaluated were: mortality, severe infections, severe adverse events, withdraw for any cause, for severe adverse events, and for infusion related reactions. The review was conducted with Cochrane methodology. The odds ratio and relative risk for dichotomist variables; and mean difference between baseline and final measurements for continuous variables, and risk differences were calculated with RevMan 519. The number of patients needed to treat was calculated with Cates’ calculator20.
ResultsRTX is an effective drug in three groups of patients with RA: patients who fail to MTX, those who fail anti-TNF and in patients with no prior exposure to MTX. It is necessary to treat 7 (5-10) patients with RTX vs. placebo to obtain an ACR70 response; 9 (6-15) to achieve a DAS28 < 2.6; and 5 (4-8) to achieve a HAQ improvement >0.2. Safety of the drug was similar to that of placebo except for infusion reactions where 12 (8-26) patients need to be treated with RTX vs. placebo to see a reaction to the first infusion with steroid premedication. Severe adverse events to the infusion had an incidence of 0.7% in patients of the RTX treated group. It was impossible to identify a larger increase in the number of severe infections, probably due to methodological problems, however, the risk of developing infections in patients treated with RTX seems to be comparable to that of other anti-TNF and biologics.
El rituximab (RTX) fue aprobado en España para el tratamiento del linfoma en junio de 1998 y de la artritis reumatoide (AR) en junio de 20061. La investigación en AR se basó inicialmente en la evidencia de eficacia y seguridad del fármaco en pacientes con linfoma, lo que condicionó un desarrollo clínico peculiar. Los primeros datos clínicos detallados del uso de RTX en AR se publicaron en 20012 y el desarrollo del fármaco incluyó: pacientes sin exposición previa a metotrexato (MTX), pacientes con fallo a MTX y/o otros fármacos modificadores de la enfermedad (FAME) y pacientes con fallo a fármacos que bloquean el factor de necrosis tumoral alfa (anti-TNF-α). En la actualidad, hay más de 7 años de experiencia con el empleo de RTX en pacientes con AR3 y en España cada vez se trata un mayor número de pacientes con RTX, no solo enfermos con AR sino pacientes con manifestaciones graves y refractarias de lupus eritematoso, vasculitis, síndrome de Sjögren y otras indicaciones, con buenos resultados. Un metaanálisis reciente mostró que el número de pacientes necesarios a tratar (NNT) con RTX frente a placebo para obtener una mejoría ACR50 fue de 4,1 (2,02-8,33)4. Mientras que el número de pacientes necesarios que tratar para tener un efecto perjudicial (NNH) y para observar un abandono por evento adverso no fue significativo: 1,34 (0,65-2,76). Estos datos son similares a los de otros biológicos del grupo de los anti-TNF4. Como parte de la creación del «Consenso de rituximab. Un documento con recomendaciones basadas en la evidencia»5, se decidió realizar una revisión sistemática siguiendo metodología Cochrane6. El objetivo de la revisión fue evaluar la eficacia y la seguridad del tratamiento con RTX en pacientes con AR, utilizando medidas de desenlace del ámbito de práctica clínica y con la intención de ayudar al médico a tomar decisiones terapéuticas en casos difíciles en la consulta habitual.
Pacientes y métodosSelección de trabajos: se realizaron búsquedas sensibles de trabajos publicados del 1 de enero de 2003 al 30 de septiembre de 2009 en las siguientes bases de datos electrónicas: Medline a través de la página web de Pubmed7, EMBASE8 y la Cochrane Library9. Además, se realizó una búsqueda manual de los resúmenes de los congresos de EULAR y ACR de 2003 a 2009, y la solicitud de datos a Roche Pharma10, así como la revisión de la Ficha técnica de Mabthera 20091. La estrategia de búsqueda fue similar para todas las bases: se utilizaron términos MESH y texto libre para los siguientes términos: rituximab, rheumatoid arthritis, anti-CD20, biologics, y no se seleccionó ningún tipo de filtro para idioma de publicación o tipo de estudio. En una primera etapa, dos autores (BHC y MGH) realizaron la búsqueda bibliográfica de modo independiente revisando título y resumen. En una segunda etapa dos revisores de modo independiente (BHC y RAA) seleccionaron los trabajos tras su revisión en extenso. La selección final de los artículos se realizó consensuando los casos de falta de acuerdo, considerando los siguientes criterios:
- –
Inclusión de pacientes mayores de 18 años de edad.
- –
Con AR según criterios del Colegio Americano de Reumatología11, 1987.
- –
Ensayos clínicos aleatorizados de tratamiento con RTX frente a placebo.
Se eliminaron subanálisis de estudios, estudios observacionales y estudios duplicados, eligiendo de éstos últimos el estudio más reciente.
Una vez seleccionados los artículos, la extracción de los datos para el análisis se realizó en formato en papel y de modo independiente por dos revisores (BHC y RAA) con la herramienta para la extracción de datos de la Colaboración Cochrane6, que incluye información sobre el tipo de ensayo clínico, características de los pacientes, número de centros, tipo de intervención, desenlaces de eficacia y seguridad, y características del análisis. Finalmente, se seleccionaron los trabajos cuyo puntaje de calidad asignado por cada evaluador según la escala GRADE y de modo independiente fue bueno o muy bueno12.
La estimación de la posibilidad de sesgos se realizó mediante la herramienta propuesta por la colaboración Cochrane6, que incluyó la valoración de: a) identificación de la generación de secuencia de aleatorización; b) calidad del enmascaramiento de dicha asignación; c) enmascaramiento por el paciente y evaluadores; d) similitud de los grupos de tratamiento; e) diferencias en seguimiento entre los grupos; f) diferencias en informe de desenlaces entre los grupos; g) diferencias en presencia de eventos adversos en los grupos, y h) evaluación de la calidad de los estudios.
Medidas de desenlace: se eligieron las propuestas por OMERACT13 (Outcome Measurements in Rheumatoid Arthritis Clinical Trials) y el grupo Cochrane de Estudio de enfermedades músculo-esqueléticas que a continuación se detallan:
- –
Eficacia clínica:
- 1.
Remisión según DAS28 (Disease Activity Score), considerando un DAS28 ≤ 2,614.
- 2.
Pacientes con buena respuesta clínica según criterios EULAR (European League Against Rheumatism), aquellos con cambio > 1,2 y DAS28 final ≤ 3,215.
- 3.
Respuesta ACR (American College of Rheumatology) del 50% (ACR50) y del 70% (ACR70)16.
- 4.
Función física medida con el HAQ (Health Assessment Questionnaire) considerando una mejoría en el HAQ ≥ 0,2 unidades17.
- 1.
- –
Desenlace radiográfico:
- 1.
Porcentaje de pacientes sin progresión radiográfica definida como un cambio en el índice Genant-Sharp ≤ 0.
- 2.
Cambio medio en el índice radiográfico Genant-Sharp18.
- 1.
- –
Seguridad:
- 1.
Mortalidad.
- 2.
Infecciones graves (infecciones que requirieron ingreso del paciente para tratamiento hospitalario y/o pusieron en peligro la vida del paciente).
- 3.
Efectos adversos graves (aquellos que requirieron hospitalización, causaron la muerte del enfermo, pusieron en peligro la vida del paciente o dejaron secuelas).
- 4.
Retiradas del estudio por cualquier causa.
- 5.
Retiradas del estudio por efectos adversos graves.
- 6.
Retiradas del estudio por reacciones a la infusión (cualquier reacción que ocurrió en las siguientes 24h a la infusión).
- 7.
Reacciones graves relacionadas con la infusión (aquellas que pusieron en peligro la vida del paciente, causaron su muerte, obligaron a su hospitalización o prolongación de la hospitalización).
- 1.
Para los desenlaces considerados se realizó el cálculo del riesgo relativo y la odds ratio (OR) para variables dicotómicas y de la diferencia media entre el valor basal frente al final para variables continuas. Para los eventos poco frecuentes el cálculo de la diferencia en el riesgo se realizó con la técnica de Mantel Haenszel, obteniendo intervalos de confianza al 95% (IC del 95%), con corrección por continuidad cuando fue necesario. El análisis se realizó empleando un modelo de efectos fijos y en el caso de heterogeneidad significativa entre los estudios incluidos también se realizó el análisis con un modelo de efectos aleatorios, con el programa RevMan 519. La heterogeneidad se evaluó considerando una I2 ≥ 50%.
La diferencia absoluta de riesgo se definió como la diferencia del riesgo del grupo tratado con RTX menos la diferencia del riesgo del grupo tratado con placebo. El NNT para los desenlaces de eficacia clínica y radiográficos anotados y el NNH para cada desenlace de seguridad se calcularon mediante el inverso de la diferencia del riesgo absoluto, con las fórmulas y la calculadora de Cates20.
A priori, se consideraron los siguientes análisis de subgrupos: a) tratamiento con/sin MTX; b) duración de la AR < 2 años; c) dosis de RTX de 2 ciclos de 500mg vs. 2 ciclos de 1.000mg, y d) resultados a la semana 52.
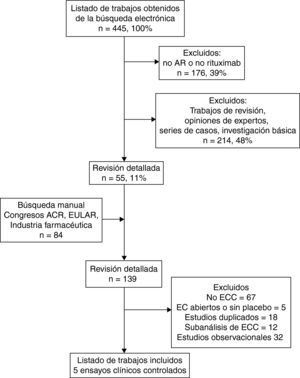
ResultadosLa búsqueda identificó 445 publicaciones, de las cuales, tras revisión inicial del título y el resumen, se descartaron 176 (40%) por no estar relacionadas con el tema y 234 (48%) por tratarse de estudios de investigación básica, trabajos de revisión o estudios observacionales. Se seleccionaron para una segunda revisión 55 (11%) trabajos, a los que se añadieron 84 artículos de tres fuentes: búsqueda manual, proporcionados por la industria farmacéutica y datos del Archivo del medicamento en Roche Pharma10. La revisión detallada se realizó de 139 trabajos y permitió la identificación de 10 ensayos clínicos controlados. Se excluyeron 67 trabajos por ser de investigación básica, series de casos o no estar relacionados con el tema; 18 informes duplicados, 12 subanálisis o extensiones de los ensayos clínicos seleccionados y 32 estudios observacionales. Finalmente, se seleccionaron 5 para la revisión sistemática21-25, eliminándose 5 por no tener grupo control o cuyo objetivo primario no fue la eficacia y/o seguridad26-38. El flujo de selección de los trabajos de la revisión se muestra en la figura 1.
Las características de los 5 ensayos clínicos incluidos y la valoración de calidad de acuerdo con criterios GRADE12 se presentan en la tabla 1. Los trabajos excluidos y sus causas se resumen en la tabla 226-38. La razón de la exclusión fueron problemas metodológicos en el caso de los ensayos clínicos (ausencia de grupo placebo, objetivo primario diferente a eficacia y seguridad y datos insuficientes para hacer la revisión). Los trabajos incluidos consideraron pacientes con AR de 51,4 años de edad, 80% mujeres, 84% FR+, y con 8,1 años de evolución de la AR. Todos los estudios excepto el trabajo de Tak et al.25 incluyeron pacientes con fallo a MTX. Dos trabajos permitieron la inclusión de enfermos con exposición previa a fármacos anti-TNF22,23. Los enfermos tenían un nivel elevado de actividad, con DAS28 basal de 6,7 y pobre función física (HAQ>1). Se midieron desenlaces de eficacia clínica según criterios ACR, EULAR y desenlaces de seguridad en todos los trabajos y en dos se realizó medición de desenlace radiográfico22,25. La calidad metodológica de los trabajos de acuerdo con la escala GRADE fue buena, considerando la calidad de la evidencia (diseño del estudio, calidad del estudio, consistencia de los resultados y dirección) y los datos agrupados dentro de los diferentes desenlaces.
Tabla de evidencia. Características de los trabajos incluidos en el metaanálisis
| Autor, año | Tipo | Población diana | Características AR | Desenlaces | Grupos de tratamiento | Basal | |||||||||
| Edad años | Mujeres % | FR+% | Duración AR, años | DAS28VSG | HAQ | VSG mmHra | PCR mg/dl | Radiográfico Genant-Sharp | Calidad de la evidencia (GRADE)* | ||||||
| Edwards et al.21, 2004n=161 | ECC | AR, fallo MTX | Activa: ≥ 8 NAD, ≥ 8 NAT y /o VSG ≥ 28 mmHra o PCR ≥ 1,5 mg/dl,FR+ | ACREULARSeguridad | Placebo + MTXRTX 2 x 1.000RTX 2 x 1.000+CFMRTX 2 x 1.000+MTX | 53,7±10,7 | 78 | 100 | 10,5±6,5 | 6,85±0,8 | ND | 51 | 3,1 | ND | Buena |
| Cohen et al.22, 2006n=517 | ECC | AR fallo Anti-TNF1=60%, 2=31%, 3=9% | Activa: ≥ 8 NAD, ≥ 8 NAT y/o VSG ≥ 28 mmHra o PCR ≥ 1,5 mg/dlAl menos una erosión | ACREULAR, radiográficoSeguridad | Placebo+MTXRTX 2 x 1.000+MTX | 52,5±12,4 | 81 | 79 | 11,9±8 | 6,85±1,0 | 1,9±0,5 | 48 | 3,7 | 48,1±35,4 | Buena |
| Emery et al.23, 2006n=465 | ECC | AR activaFallo a 2-5 FAME(≈30% anti-TNF) | Activa: ≥ 8 NAD, ≥ 8 NAT, y/o VSG ≥ 28 mmHra o PCR ≥ 1,5 mg/dl | ACREULARSeguridad | Placebo+MTXRTX 2 x 500+MTXRTX 2 x 1.000+MTX | 51,2 | 80 | 82 | 10,4 | 6,75 | 1,75 | 45 | 3,1 | ND | Buena |
| Emery et al.24, 2010n=512 | ECC | AR activa, fallo a MTX sin biológico previo | Activa: ≥ 8 NAD, ≥ 8 NAT y /o VSG ≥ 28 mmHra o PCR ≥ 0,6 mg/dl | EULARACRSeguridad | Placebo+MTXRTX 2 x 500+MTXRTX 2 x 1.000+MTX | 51,7±12,6 | 82 | 74 | 7,06±7,2 | 6,4±1,0 | ND | ND | ND | ND | Buena |
| Tak et al.25, 2009n=755 | ECC | AR activa, > 4 años, sin exposición previa a MTX | Activa: ≥ 8 NAD, ≥ 8 NAT y PCR ≥ 1,0 mg/dl | RadiográficoACREULARSeguridad | Placebo+MTXRTX+MTX 2 X 500RTX+MTX 2 X 1.000 | 47,9±13,1 | 81 | 86 | 0,9±1,1 | 7,1±1,0 | 1,8±0,6 | ND | 3,2 | 7,6±11,0 | Buena |
AR: artritis reumatoide; ACR: respuesta ACR; DAS28VSG: disease activity score calculado con la VSG; ECC: ensayo clínico controlado; EULAR: criterios EULAR de mejoría según DAS28; FAME: fármacos antirreumáticos modificadores de la enfermedad; FR+: factor reumatoide positivo; MTX: metotrexato; NAD: número de articulaciones dolorosas de un total de 68; NAT: número de articulaciones inflamadas de un total de 66; ND: no hay datos disponibles; PCR: proteína C reactiva en mg/dl; RTX: rituximab; VSG: velocidad de sedimentación globular, en mm/h; 2 × 1.000 dos ciclos de 1.000mg cada uno, administrados el día 0 y el día 15; 2 × 500: dos ciclos de 500mg cada uno administrados el día 0 y el día 15.
aEvaluación de calidad según metodología Cochrane.
Tabla de artículos excluidos del metaanálisis y motivo de exclusión
| Autor, año | Tipo | Población diana | Desenlace | Razón de exclusión |
| Rubber Roth et al.26, 2010) | EC | AR activa, fallo a MTX | Respuesta ACR, respuesta EULAR | No grupo placebo |
| Bingham III et al.27, 2009 | EC | AR activa | Respuesta a vacunación | EC abierto, el objetivo no fue eficacia |
| Loveless et al.28, 2009 | EC | AR activa, fallo a ≥ 1 FAME | Seguridad y eficacia | Ensayo abierto, ausencia de grupo placebo |
| Genwald et al.29, 2009 | EC | AR activa pese aMTX+etanercept o MTX+adalimumab | Seguridad (infecciones)Eficacia | Pacientes tratados con RTX en combinación con anti-TNF |
| Mease et al.30, 2008 | EC | AR+fallo a ≥ 1 anti-TNF | Eficacia y seguridad de un 2.° ciclo de RTX vs. placebo | No grupo placebo |
| Cohen et al.31, 2009 | EC22 | AR activa, fallo anti-TNF | ACR, EULAR, Rx, seguridad | Extensión |
| Issacs et al.32, 2009 | EC22,23 | En pacientes FR+ y/o CCP+ | Subanálisis | Subanálisis |
| Keystone et al.33, 2009 | EC22,23 | 1.000 mg × 2+MTX | Subanálisis, de fase abierta, pacientes con respuesta inicial | Subanálisis |
| Keystone et al.34, 2007 | EC22,24 | 1.000 mg × 2+MTX | Subanálisis de fase abierta, pacientes con respuesta inicial | Subanálisis |
| Mariette et al.35, 2009 | EC25 | 500 × 2+MTX1.000 × 2+MTXPlacebo+MTX | Subanálisis FR+y/o CCP+y mal pronóstico | Subanálisis |
| Emery et al.36, 2009 | EC23vs.22,24 | 1.000 × 2+MTX | Subanálisis fase II y III | Subanálisis |
| Kremer et al.37, 2006 | EC23 | RTX 1.000 × 2+MTX vs. Placebo+MTX | Subanálisis del REFLEX | Subanálisis |
| Vollenhoven et al.38, 2009 | EC22-27 | Al menos un ciclo de RTX | Seguridad | Subanálisis |
Los principales resultados de eficacia a las 24 semanas se resumen en la tabla 3. Los desenlaces de eficacia se presentan para el conjunto de pacientes y para dos de los subtipos de enfermos con AR incluidos en los artículos: pacientes con fallo a FAME y pacientes con fallo a anti-TNF. Analizando todos los enfermos, se encontró una respuesta ACR50 en 40% de los pacientes tratado con RTX vs. 19% en el grupo tratado con placebo, la diferencia del riesgo absoluta fue del 21% y el NNT con RTX frente a placebo para obtener una respuesta ACR50 fue de 5 (4-6). Hubo una respuesta ACR70 en 24% de los pacientes tratado con RTX vs. 10% en el grupo tratado con placebo, la diferencia del riesgo absoluta fue del 14% y el NNT con RTX frente a placebo para obtener una respuesta ACR70 fue de 7 (5-10).
Tabla de resultados agrupados de eficacia del tratamiento de dos ciclos de RTX frente a placebo para todos los pacientes y para los grupos de pacientes con AR y fallo a FAME y fallo a anti-TNF)
| Desenlace (semana 24) | N.° de ECC | N | Frecuencia en grupo RTX | Frecuencia en grupo PBO | Odds ratio (IC del 95%) | NNT (IC del 95%) |
| N.° eventos/n.° total (%) | N.° eventos/n.° total (%) | |||||
| Todos los escenarios | ||||||
| ACR50 | 5 | 2.251 | 597/1.484 (40) | 144/762 (19) | 3,1 (2,5-4,0) | 5 (4-6) |
| ACR70 | 5 | 2.251 | 358/1.484 (24) | 78/767 (10) | 3,0 (2,3-4,0) | 7 (5-10) |
| DAS28 < 2,6 | 3 | 1.723 | 194/1.118 (17) | 33/605 (5) | 3,5 (2,4-5,2) | 9 (6-15) |
| Buena respuesta EULAR | 4 | 1.497 | 164/982 (17) | 18/515 (3) | 5,2 (3,2-8,7) | 8 (5-15) |
| Mejoría del HAQ > 0,2 | 2 | 876 | 789/1.065 (74) | 302/526 (57) | 2,3 (1,7-3,1) | 5 (4-8) |
| % de pacientes sin progresión radiográfica a la semana 52 | 2 | 1.179 | 460/761 (60) | 208/418 (50) | 1,5 (1,2-1,9) | 10 (7-22) |
| Fallo a FAME | ||||||
| ACR50 | 3 | 956 | 170/582 (29) | 32/294 (13) | 3,3 (2,2-5,11) | 5 (4-9) |
| ACR70 | 2 | 876 | 62/582 (11) | 15/294 (5) | 2,2 (1,2-3,9) | 19 (9-88) |
| DAS28<2,6 | 2 | 876 | 32/377 (8) | 4/172 (2) | 4,4 (1,5-12,6) | 18 (13-29) |
| Mejoría del HAQ > 0,2 | 2 | 876 | 366/582 (63) | 123/294 (42) | 2,3 (1,7-3,1) | 5 (4-8) |
| Fallo a anti-TNF | ||||||
| ACR50 | 1 | 499 | 80/298 (27) | 10/201 (5) | 7,01 (3,5-13,9) | 5 (3-10) |
| ACR70 | 1 | 499 | 36/298 (12) | 2/201 (0,9) | 13,6 (3,2-57,4) | 10 (3-47) |
| DAS28<2,6 | 1 | 499 | 27/298 (9) | 0/201 (0) | NE | NE |
| Respuesta EULAR | 1 | 499 | 149/298 (50) | 40/201 (20) | 4,0 (2,6-6,0) | 4 (3-6) |
NE: no evaluado. La frecuencia del evento en el grupo control es 0 lo que hace imposible el cálculo.
Considerando los desenlaces que se evalúan en práctica clínica habitual, se encontró un DAS28 < 2,6 a las 24 semanas del tratamiento en el 17% de los pacientes tratados con RTX vs. 5% en el grupo tratado con placebo, la diferencia del riesgo absoluta fue del 12% y el NNT con RTX frente a placebo para obtener una respuesta DAS28 < 2,6 fue de 9 (6-15). La frecuencia de pacientes con buena respuesta EULAR a las 24 semanas del tratamiento fue del 17% en los pacientes tratados con RTX vs. 3% en el grupo tratado con placebo, la diferencia del riesgo absoluta fue de 14% y el NNT con RTX frente a placebo para obtener una buena respuesta EULAR fue de 8 (5-15). La mejoría en la función física, uno de los dominios más relevantes de la calidad de vida, medida como el porcentaje de pacientes con mejoría en el HAQ>0,2 a las 24 semanas del primer ciclo de tratamiento con RTX fue del 74% frente al 57% en el grupo placebo, la diferencia del riesgo absoluta fue de 21% y el NNT con RTX frente a placebo para obtener una mejoría en el HAQ>0,2 fue de 6 (4-8).
El desenlace radiográfico se evaluó en dos de los cinco trabajos. El porcentaje de pacientes que no mostró progresión radiográfica a la semana 24 fue del 66% en el grupo tratado con RTX frente al 59% del grupo tratado con placebo, OR 1,34 (1,04-1,71). A la semana 52, el porcentaje de pacientes sin progresión radiográfica fue del 60% en el grupo tratado con RTX vs. 50% en el grupo tratado con placebo, la diferencia del riesgo absoluta fue de 10%, la OR 1,53 (1,20-1,95) y el NNT con RTX frente a placebo y no tener un caso de progresión radiográfica fue de 10 (7-22). La diferencia media del Índice de Genant-Sharp a la semana 24 fue de 0,57 para el grupo tratado con RTX frente a 0,95 para el grupo placebo; a la semana 52 de 0,563 vs. 1,05, respectivamente para una diferencia media de –0,6 (–1б14 a –0,06). Se encontraron problemas de heterogeneidad en las evaluaciones ACR50 y mejoría del HAQ ≥ 0,2 con I2=el 59% y el 56%, respectivamente. Para el resto de los desenlaces de eficacia, la I2 fue del 13-42%.
Cuando se analizaron los datos incluyendo solo los estudios con fallo a FAME21,23,24 la dirección y magnitud de la respuesta fue similar, pero con NNT mayores e intervalos de confianza más amplios, como se muestra en la tabla 3. La heterogeneidad también se incrementó con I2=62% para la respuesta DAS28 remisión e I2=82% para el cambio en el HAQ. Lo mismo sucedió cuando el análisis se realizó con los pacientes con AR y fallo a anti-TNF. En este análisis, la evaluación de la remisión según DAS28 no fue posible, pues 27 de 298 (9%) pacientes del grupo tratado con RTX y ninguno del grupo placebo (0/201) presentó remisión.
Los resultados de seguridad se resumen en la tabla 4. La evaluación de los desenlaces de seguridad solo fue posible en la semana 24, debido al diseño de los estudios. La frecuencia de cualquier reacción a la infusión fue mayor en el grupo tratado con RTX. El NNH con RTX frente a placebo para observar una reacción a la primera infusión, cuando el paciente recibe premedicación con corticoides fue de 12 (8-26). En el caso de reacciones graves a la infusión, éstas solo ocurrieron en el grupo tratado con RTX (0,74%), lo que hizo imposible las estimaciones de diferencia de riesgo absoluta, OR y NNH. No hubo diferencias significativas entre ambos grupos en: número de eventos adversos graves, mortalidad, infecciones graves y retiradas debido a efectos adversos graves. Hubo un mayor número de retiradas del estudio por eventos adversos en el grupo placebo, debido a actividad de la enfermedad. Esta estimación fue la de mayor heterogeneidad (I2=93%) y en el resto menor la I2 fue menor de 50%.
Tabla de resultados agrupados de seguridad del tratamiento de un ciclo de dos infusiones de RTX frente a placebo
| Desenlace (semana 24) | N.°. de ECC | N | Frecuencia en grupo RTX (%) | Frecuencia en grupo PBO (%) | Odds ratio (IC del 95%) | NNH (IC del 95%) |
| N.° eventos/n.° total (%) | N.° eventos/n.° total (%) | |||||
| Efectos adversos graves | 5 | 2.327 | 123/1.565 (8) | 66/762 (9) | 0,94 (0,68-1,30) | NS |
| Mortalidad | 5 | 2.367 | 2/1565 (0,13) | 3/80 (0,37) | 0,33 (0,08-1,37) | NS |
| Reacciones a la primera infusióna | ||||||
| Cualquiera | 4 | 1.652 | 272/1.082 (25) | 92/570 (16) | 1,70 (1,31-2,22) | 12 (8-26) |
| Graves | 4 | 1.652 | 18/1.082 (0,74) | 0/570 (0%) | NE | NE |
| Infecciones graves | 4 | 1.652 | 18/1.082 (1,7) | 10/570 (1,8) | 0,93 (0,45-2,05) | NS |
| Abandonos del estudio, cualquier causa | 4 | 1.652 | 99/1.083 (9) | 85/569 (15) | 0,6 (0,44-0,81) | 19 (13-41) |
| Abandonos debido a EAG | 4 | 1.652 | 23/1.084 (2) | 5/370 (0,9) | 2,23 (0,87-5,69) | NS |
EAG: efecto adverso grave; NE: no evaluado. La frecuencia de efectos adversos en el grupo control es 0, lo que hace imposible el cálculo; NNH: número de pacientes necesarios a tratar y obtener un efecto perjudicial; NS: no significativo.
Reacciones a la infusión (cualquier reacción que ocurrió en las siguientes 24 horas a la infusión.
Reacciones graves relacionadas con la infusión: aquellas que pusieron en peligro la vida del paciente, causaron su muerte, obligaron a su hospitalización o prolongación de la hospitalización.
Infecciones graves: infecciones que requirieron ingreso del paciente para tratamiento hospitalario y/o pusieron en peligro la vida del paciente.
Efectos adversos graves: los que requirieron hospitalización, causaron la muerte del enfermo, pusieron en peligro la vida del paciente o dejaron secuelas.
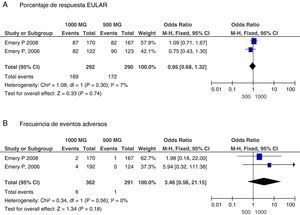
Un segundo objetivo del metaanálisis fue investigar la eficacia de ciclos con dosis diferentes de RTX: 500mg × 2 frente a 1.000mg × 2. Los pacientes con AR y fallo a anti-TNF recibieron ciclos de RTX con dosis de 1.000mg × 222. El análisis de dosis incluyó solo 2 ensayos23,24 de pacientes con fallo a MTX y no se encontraron diferencias significativas en las variables de eficacia ni seguridad entre las dos dosis empleadas, como se muestra en la figura 2.
La administración de RTX en monoterapia frente al tratamiento combinado RTX + MTX, solo fue evaluada en un ensayo clínico21 que incluyó a 40 pacientes por grupo; este trabajo fue el que tuvo mayor riesgo de sesgo por heterogeneidad y no fue posible realizar el análisis. De igual manera sucedió al tratar de evaluar tratamiento con RTX más FAME diferentes de MTX, ya que la única combinación fue la de RTX+CFM21. Un cuarto subanálisis realizado fue con datos clínicos de la semana 52; los resultados de eficacia fueron similares a los que se presentan a la semana 24 (datos no mostrados). Los datos de seguridad solo pudieron evaluarse en la semana 24.
DiscusiónEl objetivo de una revisión sistemática de una intervención terapéutica es encontrar la mejor evidencia disponible sobre la eficacia y la seguridad de un fármaco frente al tratamiento habitual. El metaanálisis se realizó incluyendo 5 ensayos clínicos controlados de adecuada calidad metodológica que aseguran su validez interna.
Los pacientes incluidos fueron predominantemente mujeres de más de 50 años de edad, con AR definida por los criterios ACR de larga evolución, con actividad elevada y pobre función física. La mayoría con fallo a FAME (al menos MTX) y/o un subgrupo con fallo a anti-TNF, similares a los que se atienden en práctica clínica habitual.
Los hallazgos del metaanálisis relacionados con las medidas de eficacia tienen un nivel de evidencia bueno. Se encontró que dos ciclos de RTX de 1.000mg cada uno administrados IV los días 0 y 15, fueron mejores que el placebo para alcanzar una respuesta a la semana 24 considerando: respuesta ACR50 con NNT de 5 (4-6); respuesta ACR70 con NNT de 7 (5-10), remisión según DAS28 ≤ 2,6 con NNT de 9 (6-15); buena respuesta EULAR con NNT de 8 (5-15); mejoría en el HAQ ≥ 0,2 con NNT de 5 (4-8); no progresión radiográfica 1,5 (1,2-1,9) y menor cambio en el índice Genant-Sharp 0,6 (–1.14 a –0,06). La calidad metodológica según la escala GRADE y las características de los modelos empleados para hacer las estimaciones fueron de moderadas a buenas, encontrándose problemas de heterogeneidad para los respuesta ACR50 y mejoría en el HAQ. Al realizar el correspondiente análisis de eficacia en dos subpoblaciones de enfermos con AR: con fallo a FAME y con fallo a anti-TNF, los resultados fueron similares, sin embargo, con menor solidez de los datos debido a un incremento en la heterogeneidad del modelo; con estimaciones de menor calidad.
La calidad de los resultados de la evaluación de los desenlaces de seguridad tuvo mayores problemas y fue moderada por las siguientes consideraciones:
- 1.
Posibilidad de sesgo de selección: los ensayos clínicos incluye a pacientes sin comorbilidad y excluyen a pacientes con comorbilidad significativa, que son quienes presentan peores desenlaces de seguridad, además en el proceso de selección se eligen pacientes con actividad elevada y la inclusión de pacientes de diversas zonas geográficas en donde el acceso al fármaco podría condicionar la entrada del paciente.
- 2.
El tamaño de muestra de los ensayos se calcula para los desenlaces de eficacia y no para seguridad; esto es importante en aquellos desenlaces de seguridad poco frecuentes (mortalidad e infecciones graves).
- 3.
Aspectos metodológicos: en los ensayos incluidos en el metaanálisis, la fase de placebo fue de 24 semanas, permitiéndose medicación de rescate, lo que reduce aun más el tamaño de muestra. El seguimiento de seguridad finaliza cuando termina el ensayo clínico, habitualmente a las 4 semanas de la última visita de seguimiento y no se realiza en el largo plazo, hecho de especial importancia cuando se habla de un fármaco que puede producir depleción sostenida de L-B.
- 4.
Se encontraron problemas de heterogeneidad significativa para retiradas del estudio por cualquier efecto adverso y por efectos adversos graves. Con todas estas consideraciones, la calidad de la evidencia para los desenlaces de seguridad fue moderada y esto debe tenerse en cuenta al interpretar los resultados. Se observaron más reacciones relacionadas con la infusión de cualquier tipo (NNH 12; 8-26) y sobre todo reacciones graves relacionadas con la infusión en el grupo tratado con RTX (0,7 vs. 0%, respectivamente), en este caso al no tener reacciones en el grupo placebo la estimación del NNT fue imposible. La posibilidad de reacciones durante la infusión del fármaco es conocida ocurre con mayor frecuencia cuando se administra la primera infusión y se reduce con la premedicación y la administración adecuada del fármaco y las reacciones graves a la infusión se ocurren aproximadamente en 0,5% de los pacientes tratados1,10. No se informaron casos de mortalidad relacionada con la infusión. La calidad metodológica para hacer esta aseveración fue moderada. Para otros desenlaces de seguridad: número de efectos adversos graves, mortalidad, infecciones graves y retiradas del estudio por eventos adversos graves no se encontraron diferencias entre el grupo de RTX y en el grupo placebo. Hubo mayor número de retiradas del ensayo por cualquier causa en el grupo placebo frente al grupo tratado con RTX, con un nivel de videncia bajo dado la heterogeneidad de la estimación.
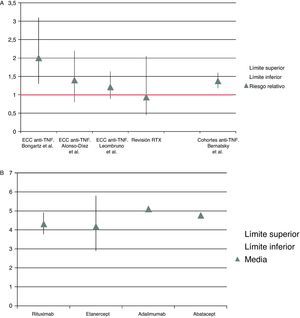
Al igual que en otro metaanálisis previo, no se observaron diferencias en infecciones graves en pacientes tratados con RTX vs. placebo39. Este hallazgo merece un comentario especial; la ausencia de diferencias en infecciones graves entre el grupo tratado y el placebo podría deberse a un error estadístico tipo II, es decir, asumir que no hay diferencias entre los grupos cuando sí las hay. Dificultades similares ocurren en metaanálisis de enfermos con AR y tratamiento anti-TNF40,41, como se muestra en la figura 3A, en donde los resultados son contradictorios. Un metaanálisis reciente de estudios observacionales ha demostrado un mayor riesgo de infecciones graves en enfermos con AR que reciben anti-TNF frente a FAME no biológicos42. Los pacientes de los estudios observacionales prospectivos son similares a los de práctica clínica habitual y podría eliminarse el sesgo de selección. Estos datos concuerdan con la impresión de los clínicos, que observamos que los fármacos anti-TNF incrementan el riesgo de infecciones graves43. Dado que la incidencia de infecciones graves por 100 pacientes-año en enfermos tratados con RTX es similar a la que se observa con otros biológicos (anti-TNF u otras dianas terapéuticas) (fig. 3B)31-34, pese a no encontrar diferencias en infecciones entre pacientes tratados con RTX frente a placebo en la revisión sistemática, consideramos que la frecuencia de infecciones graves relacionadas con RTX es similar a la observada con los anti-TNF y otros biológicos39-43.
Además de las limitaciones mencionadas, otras limitaciones fueron el horizonte temporal, ya que solo se realizaron estimaciones en la semana 24 para las variables de eficacia y seguridad, y en semana 52 para radiográficas. Otras preguntas interesantes como comparar eficacia con dosis de 500 × 2 vs. 1.000 × 2, monoterapia vs. tratamiento combinado con FAME, empleo concomitante con FAME diferentes de MTX o eficacia en enfermos con anticuerpos frente a péptidos citrulinados y/o factor reumatoide no pudieron responderse dado la falta de datos para realizar el análisis.
Las implicaciones de estos resultados en la práctica clínica son que el RTX es un tratamiento eficaz en enfermos con AR activa, considerando medidas de desenlace clínicas y radiográficas. Es necesario tratar 7 (5-10) pacientes con RTX frente a placebo para obtener una respuesta ACR70; 9 (6-15) para conseguir un DAS28 < 2,6 y 6 (4-8) para un HAQ < 0,2. La seguridad del fármaco fue similar a la del placebo, excepto para reacciones a la primera infusión. El NNH para reacciones a la primera infusión fue de 12 (8-26). No fue posible identificar un mayor incremento en otros desenlaces de seguridad, incluyendo el número de infecciones graves, posiblemente debido a problemas metodológicos. No obstante, el riesgo de desarrollar infecciones graves en pacientes tratados con RTX parece ser comparable al de otros anti-TNF y biológicos.
Conflictos de interesesEste documento fue financiado a través de una donación sin restricciones realizada al servicio de reumatología del Hospital Universitario La Paz (AREPAZ). La elección de los revisores fue responsabilidad exclusiva del coordinador del proyecto (EMM). Ningún empleado de Roche Farma participó en las reuniones científicas ni conoció el desarrollo de éstas, hasta que el proyecto estuvo finalizado. La organización de las reuniones y pago de honorarios a los expertos fue responsabilidad exclusiva del servicio de reumatología del Hospital Universitario La Paz (AREPAZ).