Describir las manifestaciones clínicas, antecedentes, comorbilidades y tratamientos asociados, hallazgos imagenológicos y seguimiento evolutivo de los pacientes con síndrome de leucoencefalopatía posterior reversible.
MétodosSe realizó un análisis retrospectivo y descriptivo de pacientes ingresados desde junio de 2009 hasta mayo de 2014, en un centro de tercer nivel de atención. Se evaluó edad, sexo, comorbilidades, sintomatología, valores de presión arterial al ingreso, función renal, medicación, tiempo transcurrido hasta la desaparición de síntomas.
ResultadosSe incluyeron 13 pacientes. El 77% estaba hipertenso al inicio del cuadro y el 85% presentó deterioro de la función renal. En 5 pacientes se objetivó el antecedente de trasplante renal. La manifestación clínica más común fueron convulsiones. Todos presentaron lesiones subcorticales y el compromiso más frecuente fue parietooccipital bilateral.
ConclusionesEste síndrome debe tenerse en cuenta entre los diagnósticos diferenciales de pacientes que se presenten con cuadros neurológicos agudos y los factores de riesgo mencionados.
To describe clinical manifestations, antecedents, comorbidities and associated treatments, imaging findings, and follow-up in patients with posterior reversible encephalopathy syndrome.
MethodsA retrospective, descriptive analysis of admitted patients was performed between June 2009 and May 2014 in a third-level care hospital. We evaluated age, sex, comorbidities, symptoms, values of blood pressure at admission, renal function, medication and time elapsed until the disappearance of symptoms.
ResultsThirteen patients were included. In all, 77% of them had a history of hypertension at baseline and 85% had impaired renal function. The most prevalent comorbidity was renal transplantation, and 85% had deterioration of renal function. Five of the patients had undergone renal transplantation. The most common clinical manifestation was seizures. All had subcortical lesions and bilateral parietooccipital involvement was the finding most frequently observed.
ConclusionThis syndrome should be taken into account in the differential diagnoses of patients presenting with acute neurological syndromes and the abovementioned risk factors.
El síndrome de leucoencefalopatía posterior reversible (PRES–posterior reversible encephalopathy syndrome) es una entidad clínico-radiológica potencialmente reversible, que se manifiesta con síntomas neurológicos agudos (alteraciones de la conciencia, convulsiones, cefalea, trastornos visuales, déficit neurológico focal)1.
Suele presentarse en el contexto de fluctuaciones de la presión arterial, insuficiencia renal (con o sin diálisis), fármacos citotóxicos, enfermedades autoinmunes sistémicas (EAS) y preeclampsia o eclampsia2.
Podría deberse a lesiones endoteliales relacionadas con cambios abruptos en la presión arterial o efectos directos de citocinas en el endotelio, con rotura de la barrera hematoencefálica y edema cerebral1–3.
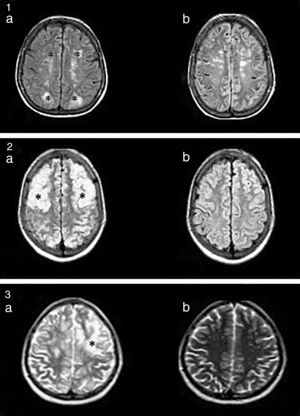
La resonancia magnética nuclear (RMN) (fig. 1) es el método de mayor valor diagnóstico, y permite diferenciar este síndrome de lesiones isquémicas agudas4.
1.a. Lesiones hiperintensas en FLAIR, córtico-subcorticales, simétricas, parieto-occipitales (*). b. Evidencia de mejoría luego de 3 meses. 2.a. Imágenes hiperintensas en FLAIR, bien definidas, bilaterales, que comprometen regiones córtico-subcorticales, fronto-parieto-temporo-occipitales bilaterales (*). b. Evidencia de mejoría a los 2 meses. 3. Lesión hiperintensa en T2 (*). No se evidencian alteraciones en la secuencia de difusión.
Constituye una entidad poco frecuente y se desconoce su verdadera prevalencia. Suele ser más común en mujeres y no existe predilección por un grupo etáreo específico5. Existen escasos reportes de PRES en nuestro medio6,7.
Presentamos 13 casos exponiendo la forma de presentación, antecedentes y tratamientos asociados, hallazgos radiológicos y evolución.
Pacientes y métodosSe realizó un análisis retrospectivo y descriptivo de 13 pacientes ingresados con diagnóstico de PRES desde junio de 2009 hasta mayo de 2014, en un centro de tercer nivel de atención.
Se consideró PRES a todos los pacientes con síntomas y hallazgos radiológicos compatibles1, evaluados por Neurología, excluyendo los diagnósticos diferenciales más frecuentes1.
Se evaluó edad, sexo, antecedentes, sintomatología, valores de presión arterial al ingreso, función renal, medicación, tiempo transcurrido hasta la desaparición de síntomas, métodos de imagen y características de las lesiones (tabla 1), obteniendo los datos de la historia clínica electrónica de nuestro hospital y de los registros de ingresos de los servicios de Reumatología y Neurología.
Hallazgos clínicos, analíticos y radiológicos
| Paciente n.o | Edad (años)/Sexo | Síntomas | PA al ingreso (mmHg) | Creatinina (mg/dL) | Localización de las lesiones | Antecedentes | Medicación | Tiempo de recuperación clínica (días) |
|---|---|---|---|---|---|---|---|---|
| 1 | 19/M | Convulsiones | 145/90 | 1,56 | BilateralesCórtico-subcorticalesFrontales, parietales y témporo-occipitalesVermis cerebeloso | Tx hepático, rechazo a los 7 añosEx-TBQ, enolista, cocaína | PDN 5mg/día | 13 |
| 2 | 57/F | Pérdida de la visión bilateral | 150/90 | 0,5 | BilateralesCórtico-subcorticalesParieto-occipitales | TAMO (SMD)Hipotiroidismo | PDN 5mg/día | 1 |
| 3 | 31/F | ConvulsionesAlteraciones visualesEncefalopatía | 160/100 | 14,1 | BilateralesCórtico-subcorticalesOccipitales parasagitales | Tx renal por GNF postestreptocócica. HTA. Marihuana, TBQ | PDN 5mg/día. MMFTacrolimus | 2 |
| 4 | 30/M | Convulsiones | 120/80 | 1,57 | BilateralesCórtico-subcorticalesFrontales, parietales y témporo-occipitalesSustancia blanca del centro oval y regiones periventriculares, núcleo caudado y lenticular, tálamo y protuberancia | SMPTAMO (2008)Esplenectomía | Pre Tx:PDN 5mg/díaAZACSPRTXPos Tx:PDN 5mg/díaTacrolimusMMF. | 10 |
| 5 | 26/F | EncefalopatíaAlucinaciones | 160/70 | 3,5 | BilateralesSubcorticalesFrontales, parietales y occipitales. Centro oval, tálamo, núcleos lenticularesProtuberancia anularHemisferios cerebelosos | Tx renal por GNF rápidamente progresiva. RechazoHemodiálisisHTADLP | ENL.Carvedilol | 10 |
| 6 | 31/M | ConvulsionesEncefalopatía | 135/95 | 16,4 | Unilateral derechaSubcorticalesOccipital paramediana | Tx renal por SUHRechazoHTADiálisis peritoneal | ValsartánCarvedilolAtorvastatinaEPO | 9 |
| 7 | 50/F | Convulsiones | 160/100 | 5,78 | BilateralesSubcorticalesFronto-temporales. Sustancia blanca del centro oval, periventriculares, radiaciones ópticasProtuberancia anular y unión bulbo protuberancial | Tx renal por poliquistosis.RechazoHemodiálisisHTA | PDN 5mg/día. AZACSPAciclovirAtorvastatinaENL | 7 |
| 8 | 57/F | Síntomas visualesEncefalopatía | 140/90 | 5 | BilateralesCórtico-subcorticalesOccipitales | Tx renal por poliquistosisHTAHemodiálisis | PDN 5mg/díaCSPMMF | 13 |
| 9 | 13/F | Convulsiones | 120/60 | 0,62 | Protuberancia con extensión a pedúnculos | Tx hepático por hepatitis viral | PDN 5mg/díaTacrolimusMMF | 30 |
| 10 | 31/M | Convulsiones | 150/90 | 2,6 | Unilateral izquierdaSubcorticalesOccipital paramediana | AKI por rabdomiólisisHD. | --- | Sin dato |
| 11 | 17/F | ConvulsionesAlteraciones visualesCefalea | 160/90 | 7,25 | BilateralesCórtico-subcorticalesFronto, parieto- occipitales | LES-Nefritis lúpica | PDN 7,5mg/díaHCQCFM | 7 |
| 12 | 25/F | ConvulsionesAlteraciones visualesCefaleaEncefalopatía | 220/110 | 2,02 | BilateralesCórtico-subcorticalesOccipitales | LES-Nefritis lúpicaHTA | PDN 5mg/díaHCQCFMENL | 10 |
| 13 | 22/F | ConvulsionesCefalea | 170/90 | 1,62 | Bilaterale.Córtico-subcorticalesOccipitales | LES | PDN 5mg/díaAZATacrolimusHCQGammaglobulina | 42 |
AKI: daño renal agudo; AZA: azatioprina; CFM: ciclofosfamida; CSP: ciclosporina; DLP: dislipidemia; ENL: enalapril; HCQ: hidroxicloroquina; HD: hemodiálisis; HTA: hipertensión arterial; LES: lupus eritematoso sistémico; MMF: micofenolato mofetil; PDN: prednisona; SMD: síndrome mielodisplásico; SMP: síndrome mieloproliferativo; TAMO: trasplante autólogo de médula ósea; TBQ: tabaquismo; Tx: trasplante.
Se identificaron 13 pacientes con PRES (9 mujeres y 4 varones). La edad promedio de presentación fue 31,46 años (rango, 13-57 años).
Las comorbilidades asociadas fueron hipertensión arterial (HTA) en 6 pacientes (46%), y lupus eritematoso sistémico (LES) en 3 (23%). Todas las pacientes con LES presentaron compromiso renal, hipocomplementemia y anti-ADN positivos. En 9 pacientes (69,2%) se evidenció el antecedente de trasplante: renal en 5 (39%) –3 de ellos en diálisis debido a rechazo–, hepático en 2 (15%) y médula ósea en 2 (15%).
Al ingreso, 10 pacientes (77%) presentaron HTA (por encima de 140/90mmHg). Además de los 4 pacientes en diálisis, otros 7 tuvieron insuficiencia renal, lo que hace un total de 11 pacientes (85%). La media de creatininemia fue de 4,8mg/dL (rango 0,5-16,4).
Con respecto al antecedente o uso actual de inmunosupresores, 10 (77%) pacientes recibieron esteroides orales, 4 (31%) tacrolimus, 4 (31%) micofenolato mofetilo, 3 (23%) azatioprina, 3 (23%) ciclosporina, 3 (23%) hidroxicloroquina, 2(15%) ciclofosfamida, y uno (8%) rituximab.
En cuanto a la presentación clínica, 10 pacientes tuvieron convulsiones como primera manifestación (77%). Otras manifestaciones fueron: alteraciones visuales (n=5; 39%), encefalopatía (n=5; 39%) y cefalea (n=3; 23%).
El tiempo promedio de recuperación clínica fue 13 días (rango 1-42 días). En un paciente no se encontraron datos precisos para estimar este período, pero presentó un cuadro reversible.
Se realizaron estudios de imagen en los 13 pacientes.
A 11 (85%) se les realizó tomografía axial computarizada como primer estudio; en 6 de ellos no se evidenciaron lesiones. Todos los pacientes de esta serie tuvieron RMN al ingreso y se evidenció la siguiente distribución de las lesiones: en 10 (77%) pacientes en ambos hemisferios cerebrales, en 2 (15%) lesiones unilaterales y uno (8%) presentó compromiso solo a nivel del tronco encefálico.
En los 12 que tuvieron lesiones hemisféricas, todas fueron a nivel subcortical (92%), con daño cortical en 8 de estos (62%).
Con respecto a la región comprometida, 11 tenían lesiones occipitales (84,6%), 5 parietales (39%), 5 frontales (39%) y 3 temporales (23%). Hubo 4 pacientes con lesiones en tronco cerebral (31%) y 2 en cerebelo (23%). Solo se realizó RMN con gadolinio para constatar extravasación de contraste al parénquima en 3 pacientes, debido a que la mayoría presentaban contraindicación por deterioro severo de la función renal.
En 11 pacientes se realizó RMN control, evidenciándose mejoría o desaparición de lesiones en 8 casos (62%). En 8 se llevó a cabo antes de los 30 días y con un intervalo mínimo de 5 días respecto a la RMN del ingreso. Los 3 pacientes en los que no se objetivaron cambios en las imágenes de control no presentaron empeoramiento clínico y la RMN de control fue realizada dentro de los 7 días posteriores a la primer RMN.
DiscusiónEl PRES se presenta con síntomas neurológicos agudos, entre los que se reportan encefalopatía (50-80%), convulsiones (60-75%), cefalea (50%), trastornos visuales (33%), déficit neurológico focal (10-15%) y estatus epiléptico (5-15%)1. Las principales manifestaciones clínicas en nuestra serie fueron similares: convulsiones, seguidas por encefalopatía y trastornos visuales.
Se postula que la instauración súbita de HTA o fluctuaciones en la misma serían los principales factores implicados, alterando la autorregulación del flujo sanguíneo cerebral y provocando disfunción endotelial con aumento de la perfusión y rotura de la barrera hematoencefálica1,3,8,9. Estos fenómenos provocarían extravasación de plasma y macromoléculas al intersticio9. En nuestra serie, el 77% de los pacientes se presentaron con HTA. Los pacientes con PRES pueden exhibir HTA moderada a severa, HTA acelerada y encefalopatía hipertensiva1. Sin embargo, hasta un 15-20% pueden encontrarse normo- o hipotensos, por lo que se cree que podrían existir otros factores implicados1.
La disfunción endotelial puede ocurrir también por efectos directos de citocinas circulantes (TNF alfa, interleucina 1, interferón gamma, incremento en la expresión del VEGF)3,8. Por este motivo también se ha asociado PRES con numerosas EAS como LES, Sjögren, artritis reumatoide, esclerodermia, vasculitis, púrpura trombótica trombocitopénica, entre otros6,10,11. En nuestro reporte solo encontramos pacientes con LES, y, al igual que en otras series, todos presentaron convulsiones, cefalea, HTA, y compromiso renal8. Además todos tenían hipocomplementemia y anti-ADN positivo. En estos pacientes debe realizarse diagnóstico diferencial con accidente cerebrovascular isquémico o hemorrágico, LES neuropsiquiátrico, e infecciones del sistema nervioso central8,10,11. Tanto en los pacientes con LES como en los restantes casos de esta serie, se realizó ecografía dúplex de troncos supraaórticos, ecocardiograma, electrocardiograma y monitorización cardiovascular durante las primeras 48h del ingreso. En 5 pacientes se realizó ECG-Holter. En ninguno de los pacientes incluidos se encontró fuente embolígena ni enfermedad cardiovascular que justifique el cuadro de ingreso. También se realizó electroencefalograma para descartar estatus epiléptico en los pacientes con convulsiones.
Existen inmunosupresores utilizados en el tratamiento de las EAS que se asocian con el desarrollo de PRES (corticoides orales, micofenolato, ciclosporina, ciclofosfamida)1,6,12. En nuestra serie la mayoría había recibido esteroides orales, y más de la mitad al menos otro inmunosupresor.
La insuficiencia renal es un trastorno que se presenta hasta en un 50% de los casos1 y se evidenció en 85% de nuestros pacientes.
Con respecto al diagnóstico por imágenes, la tomografía axial computarizada sin contraste puede visualizar edema vasogénico en algunos pacientes, pero su utilidad es muy limitada12–14. En el 54% de nuestros casos no se evidenciaron lesiones en la tomografía axial computarizada que sí se objetivaron en la RMN. Las alteraciones características en la RMN son: hipointensidad en T1, hiperintensidad en T2, aumento de sensibilidad en FLAIR, y falta de restricción en las secuencias ponderadas de difusión12–14. Estas secuencias permiten diferenciar edema vasogénico, que predomina en sustancia blanca y genera desplazamiento de las moléculas de agua a nivel tisular, del edema citotóxico, que se observa en sustancia gris y muestra restricción en la difusión12–15.
Se afecta característicamente la sustancia blanca subcortical, pero la corteza cerebral puede estar comprometida1–4,12–14 En todos los pacientes que presentamos con lesiones hemisféricas se observaron alteraciones a nivel subcortical y en el 62% daño cortical asociado.
Las regiones posteriores del cerebro son particularmente susceptibles al aumento de la perfusión y a la HTA por la escasa inervación simpática1.Esto explicaría por qué el edema cerebral suele afectar con mayor frecuencia las regiones parieto-occipitales1–6. Sin embargo, existen otros patrones de distribución frecuente: las zonas de irrigación limítrofe de ambos hemisferios y a nivel frontal superior1,11–14. La afectación del lóbulo frontal y temporal se ha reportado hasta en el 75%1. También se ha descrito el compromiso de ganglios basales, cerebelo y tronco encefálico, e incluso médula espinal1.
En un paciente observamos compromiso exclusivo de protuberancia y pedúnculos. Esta rara localización exige un minucioso diagnóstico diferencial con otros síndromes de afectación del tronco cerebral.
Los hallazgos radiológicos no se correlacionan necesariamente con la gravedad del cuadro clínico ni el pronóstico1,12.
No existen tratamientos específicos para esta entidad12–14. Se sugieren medidas de control de la HTA y medio interno, anticonvulsivantes, interrupción de medicamentos potencialmente implicados, y tratar los trastornos subyacentes (sepsis, EAS, eclampsia, preeclampsia)1–7,12–14.
En general el pronóstico es favorable, y la mayoría de los pacientes se recuperan clínica e imagenológicamente12–15. Sin embargo, se han publicado casos severos con lesiones irreversibles, hemorragia intracraneal o subaracnoidea, e hipertensión endocraneal. La mortalidad no supera el 6%1,2,12–15.
Los datos actuales provienen de estudios retrospectivos y series de casos. Sin embargo, han permitido encontrar presentaciones clínicas atípicas, hallazgos radiológicos en otras topografías, complicaciones infrecuentes, nuevos medicamentos posiblemente implicados y distintos patrones evolutivos. Se necesitan estudios experimentales para avanzar en el conocimiento de la fisiopatología, y ensayos aleatorizados, distribuidos al azar y multicéntricos que permitan diseñar guías y objetivos específicos de tratamiento.
A pesar de que esta entidad constituye una complicación infrecuente, aunque también probablemente subdiagnosticada en las EAS, consideramos de gran relevancia el conocimiento de las características clínicas, los factores de riesgo, los estudios diagnósticos y el manejo terapéutico por parte de los reumatólogos. Esto se fundamenta además en el hecho de que en la práctica diaria los pacientes con EAS pueden desarrollar esta complicación por la propia enfermedad, por los tratamientos inmunosupresores y por la insuficiencia y el trasplante renal.
ConclusionesEn nuestra serie de casos el PRES se presentó en pacientes con antecedente de HTA, LES y trasplante renal. Las convulsiones fueron el síntoma más frecuente. La mayoría de los pacientes presentaron HTA al momento del diagnóstico y se encontraban en tratamiento inmunosupresor. La RMN constituye el método de imagen de elección.
Incorporar esta entidad como diagnóstico diferencial de cuadros neurológicos agudos en pacientes con EAS puede contribuir al diagnóstico precoz y a un tratamiento oportuno para evitar secuelas.
FinanciaciónDeclaramos no haber recibido fuentes de financiación.
Conflicto de interesesDeclaramos no tener conflictos de intereses.