Comparar la supervivencia de los anti-TNF subcutáneos utilizados durante el periodo 2008-2012 según práctica clínica.
Material y métodosEstudio observacional retrospectivo de todos los pacientes diagnosticados de AR que habían iniciado tratamiento con un anti-TNF subcutáneo y mantenido durante al menos 6 meses. Los datos fueron analizados mediante SPSS V17,0.
ResultadosCuarenta y nueve pacientes con AR iniciaron tratamiento con anti-TNF subcutáneo (32 con etanercept y 17 con adalimumab). La media de edad fue de 45,94 años (75,5% mujeres). La media de duración de la enfermedad previa al inicio del anti-TNF fue de 2,67 años. La media de edad al inicio del tratamiento fue de 51,84 años, índice de actividad de la enfermedad en 28 articulaciones medio de 4,93. La supervivencia media del tratamiento anti-TNF fue de 8,40 años, mostrando una mayor supervivencia etanercept. La principal razón de discontinuación fue por fallo secundario (90,9%).
ConclusiónEn la práctica clínica habitual, la supervivencia a largo plazo de los tratamientos anti-TNF subcutáneos fue elevada e independiente de que tuvieran o no tratamiento inmunosupresor concomitante.
To compare the survival of subcutaneous anti-tumor necrosis factor (TNF) drugs used between 2008 and 2012 prescribed in accordance with clinical practice.
Material and methodsRetrospective, observational study of the patients in our center diagnosed with rheumatoid arthritis (RA). We included patients who had received a subcutaneous anti-TNF agent for at least 6 months. The data were analyzed using the SPSS V17.0 statistical package.
ResultsForty-nine RA patients started subcutaneous biological treatment with an anti-TNF agent (32 with etanercept and 17 with adalimumab). The mean age was 45.94 years (75.5% female). The mean disease duration prior to starting anti-TNF administration was 2.67 years. The mean age at the start of treatment was 51.84 years, and the average Disease Activity Score 28 was 4.93. The median survival of the anti-TNF treatment was 8.40 years; the survival of etanercept was the longer of the two. The main reason for discontinuation was secondary failure (90.9%).
ConclusionsIn routine clinical practice, the survival of subcutaneous anti-TNF treatment was extensive and was independent of whether or not the patients received concomitant immunosuppressive therapy.
La artritis reumatoide (AR) es una enfermedad inflamatoria crónica caracterizada por inflamación de la membrana sinovial, que puede conllevar destrucción del cartílago y daño a nivel articular, siendo una importante causa de discapacidad1. El pilar del tratamiento consiste en la introducción precoz de fármacos modificadores de la enfermedad (FAME) para el control de la actividad inflamatoria2,3.
En los últimos años, el tratamiento de la AR ha presentado un importante cambio con la introducción de los FAME biológicos. Los inhibidores del factor de necrosis tumoral α (TNF) son utilizados cuando los FAME sintéticos no consiguen el control de la enfermedad. Ensayos clínicos con diversos anti-TNF han demostrado mejoría a nivel de la actividad inflamatoria clínica, funcionalidad, valoración global del estado de salud y en la prevención de la progresión radiográfica4,5.
Los estudios de supervivencia son una forma indirecta de evaluar la efectividad y la seguridad de un fármaco en la práctica clínica diaria6. A diferencia de los ensayos clínicos, que incluyen una población seleccionada de pacientes y son de corta duración. La supervivencia del fármaco puede estar influida por diversos factores, siendo las principales causas de discontinuación los efectos adversos y la pérdida de eficacia7. Además, cada enfermedad reumática y los diferentes tratamientos biológicos presentan un perfil de supervivencia distinto8,9.
El objetivo de nuestro estudio fue elegir una cohorte de pacientes del Noroeste de España, con unas características bien definidas para evaluar y comparar la supervivencia y las principales causas de suspensión de los fármacos anti-TNF subcutáneos, durante el periodo 2008-2012. Dichos fármacos fueron prescritos en nuestro centro por el Servicio de Reumatología según práctica clínica habitual.
Material y métodosSe trata de un estudio observacional retrospectivo de todos los pacientes con diagnóstico previo de AR, atendidos de forma consecutiva en el Hospital Universitario Lucus Augusti entre los años 2008 y 2012. Los pacientes incluidos en el estudio habían sido diagnosticados por su reumatólogo habitual y cumplían los criterios de ACR de 198710. Todos los pacientes habían fracasado a un tratamiento previo con al menos un FAME, por lo que se había iniciado tratamiento con un anti-TNF subcutáneo siguiendo las recomendaciones del documento consenso de la SER. Para su inclusión en el estudio cada paciente que había iniciado tratamiento con un anti-TNF subcutáneo debía ser mantenido durante al menos 6 meses.
A tal efecto, se elaboró una base de datos que incluyó variables epidemiológicas (edad, sexo, raza, profesión, estado laboral y fecha de diagnóstico de la enfermedad), clínicas (índice de actividad de la enfermedad en 28 articulaciones (DAS28), factor reumatoide, velocidad de sedimentación globular y proteína C reactiva) y de tratamiento (fecha de inicio de tratamiento biológico, FAME concomitantes, dosis media de corticoide y toma de antiinflamatorios no esteroideos [AINE] concomitantes). Los motivos de suspensión del anti-TNF fueron analizados y clasificados en 3 categorías: ineficacia (no respuesta primaria o secundaria), efectos adversos y otros (remisión de la enfermedad, deseo de embarazo y preferencia del paciente).
El estudio fue aprobado por el Comité Ético del Hospital. Los datos se obtuvieron mediante la revisión de historias clínicas. Previamente a su inclusión, a todos los pacientes se les solicitó autorización mediante consentimiento informado.
Análisis estadísticoSe ha realizado un análisis descriptivo de todas las variables. Analizando las variables cualitativas mediante frecuencias absolutas y relativas, mientras que las variables cuantitativas se han representado mediante la media, desviación estándar e intervalos de confianza, si presentan una distribución normal, o a través de la mediana, mínimo, máximo y rango intercuartílico si no siguen la distribución gaussiana.
Para estudiar la existencia de diferencias estadísticamente significativas en variables cuantitativas paramétricas se ha utilizado el test t de Student y en las no paramétricas se empleó el test U de Mann-Whitney. En variables cualitativas, se utilizaron el test de la chi al cuadrado de Pearson o el test exacto de Fischer para tablas (2×2) y el test razón de verosimilitud para tablas (m×n).
Para estudiar la asociación de variables cuantitativas con datos pareados, se ha utilizado el test t de Student de datos apareados o el test de Wilcoxon en función de la distribución de la variable. Si se trata de variables cualitativas, se utilizó el test de Mc-Nemar para tablas (2×2).
A fin de describir la supervivencia del tratamiento anti-TNF se ha utilizado la función de supervivencia mediante el método de Kaplan-Meier. Para estudiar la existencia de diferencias estadísticamente significativas en las funciones de supervivencia, hemos empleado el test de Log Rank.
Las estimaciones se realizaron con un nivel de confianza del 95%. Se consideraron significativas con un valor p < 0,05.
Los datos fueron analizados utilizando el paquete estadístico SPSS V17,0.
ResultadosUn total de 49 pacientes con AR iniciaron tratamiento biológico subcutáneo con anti-TNF en el periodo 2008-2012.
La media de edad de la población fue de 45,94 años (SD 14,61), 75,5% fueron mujeres. La media de duración de la enfermedad previa al inicio del tratamiento anti-TNF fue de 2,67 años (SD 6,97). Del total de pacientes, 39 (79,6%) presentaban factor reumatoide positivo. Previamente al inicio del tratamiento con anti-TNF, todos los pacientes habían sido tratados con al menos un FAME, siendo el metotrexato utilizado en todos los casos (dosis media semanal 19,43mg). La leflunomida (dosis de 19,20mg/día) fue el segundo FAME más frecuentemente prescrito (53,1%), siempre en caso de fallo o intolerancia a metotrexato. Cuarenta y cuatro pacientes (89,8%) se encontraban en tratamiento con corticoides (dosis media 10mg/día) y 45 (91,8%) con AINE.
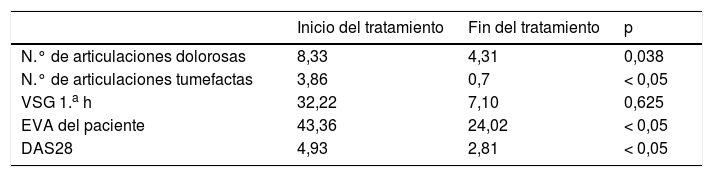
En la tabla 1 se presentan las características clínico-evolutivas de estos pacientes. Los fármacos anti-TNF subcutáneos disponibles fueron etanercept y adalimumab. Del total de pacientes, 32 (65,3%) recibieron etanercept y 17 (34,7%), adalimumab.
Características clínico-evolutivas de los pacientes con tratamiento anti-TNF
| Inicio del tratamiento | Fin del tratamiento | p | |
|---|---|---|---|
| N.° de articulaciones dolorosas | 8,33 | 4,31 | 0,038 |
| N.° de articulaciones tumefactas | 3,86 | 0,7 | < 0,05 |
| VSG 1.a h | 32,22 | 7,10 | 0,625 |
| EVA del paciente | 43,36 | 24,02 | < 0,05 |
| DAS28 | 4,93 | 2,81 | < 0,05 |
Al inicio del tratamiento con anti-TNF, los pacientes estudiados presentaban una media de edad de 51,84 años (SD 14,67), con un valor medio en del DAS28 de 4,93 puntos (SD 0,70); 4,79 en el grupo de etanercept (SD 0,60) y 5,19 en el grupo de adalimumab (0,82), sin observarse diferencias estadísticas significativas entre ambas subpoblaciones (p 0,110).
El 76,6% de los pacientes que iniciaron tratamiento con terapia biológica mantuvieron tratamiento con FAME. En estos casos, el metotrexato fue el más frecuentemente asociado (73%). La proporción de pacientes que mantuvieron tratamiento concomitante con metotrexato fue superior en aquellos que iniciaron tratamiento con adalimumab (76,5% vs. 43,8%, p = 0,038).
Una vez iniciado el tratamiento anti-TNF, los corticoides fueron retirados en 16 pacientes (36,4%) (p < 0,001), el 27% en el grupo de etanercept y el 59% en el grupo adalimumab (p<0,05).
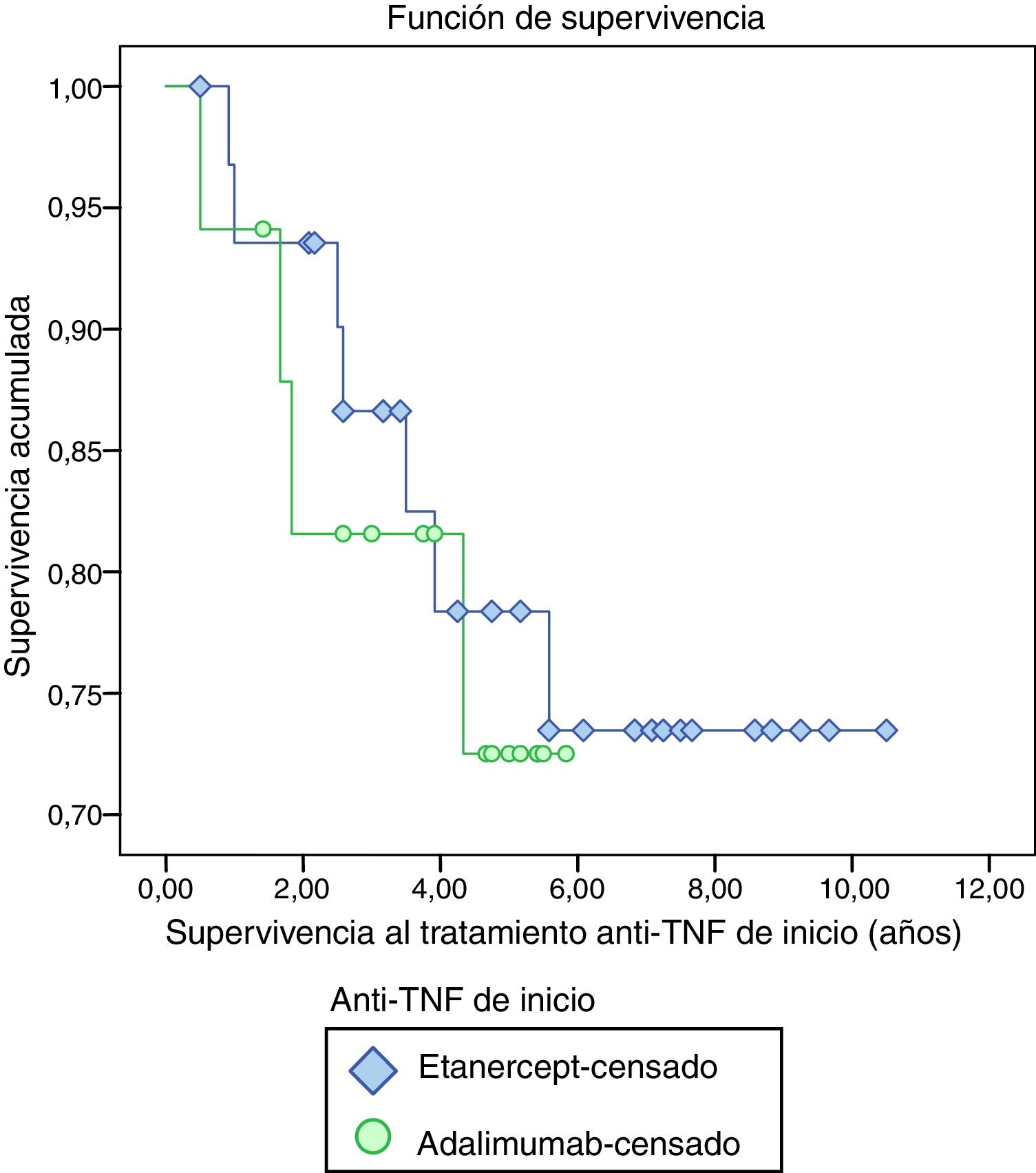
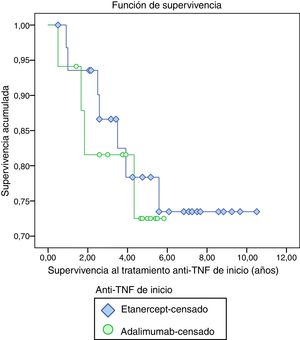
La supervivencia media del tratamiento anti-TNF de inicio fue de 8,40 años (IC 7,32-9,48), mostrando una mayor supervivencia etanercept (8,53 años, IC 7,26-9,80) en comparación con adalimumab (4,87 IC 4,01-5,73), aunque sin presentar una diferencia estadísticamente significativa (p=0,706) (fig. 1).
El tratamiento anti-TNF ha sido interrumpido de forma definitiva en 11 pacientes (22,4%). La principal razón de discontinuación fue por fallo secundario (90,9%). Tan solo el 9,1% fue por fallo primario. La proporción de discontinuación de tratamiento anti-TNF fue similar tanto en el grupo que recibió etanercept como en el grupo de adalimumab.
DiscusiónEn nuestro estudio, en la práctica clínica diaria, la prevalencia de discontinuación del tratamiento biológico a los 5 años fue del 22,4%. Este resultado muestra una mayor supervivencia que en estudios previos, donde se describe una prevalencia de discontinuación de 49,7% a los 2 años6.
En cuanto a la supervivencia media del tratamiento anti-TNF, una medida indirecta de la efectividad del fármaco, en nuestra población muestra una mayor supervivencia etanercept que adalimumab. Nuestros resultados son similares a los publicados por Neovius et al.11 y encontrados en un estudio italiano12 de práctica clínica, donde comparan la respuesta al tratamiento y la ratio de remisión de pacientes tratados con adalimumab, etanercept o infliximab, concluyendo una retención mayor para etanercept comparado con adalimumab o infliximab. Por otra parte, un metaanálisis reciente13 que incluye 98 estudios, muestra similares resultados, pero con una ratio de retención significativamente mayor para etanercept que para infliximab y adalimumab.
La principal causa de interrupción definitiva en nuestro estudio fue la pérdida de eficacia. Estos hallazgos son consistentes con el estudio de García-Lagunar et al.14, donde la ratio de discontinuación de tratamiento debido a ineficacia fue mayor que la debida a efectos secundarios. En cuanto a la pérdida de eficacia la identificación de anticuerpos frente al fármaco, puede ser de especial relevancia15. Por razones técnicas, en nuestro estudio, no disponemos de este dato.
La principal limitación de nuestro estudio es el pequeño tamaño muestral, por lo cual las diferencias encontradas entre el grupo de etanercept y adalimumab en cuanto a la ratio de discontinuación no consiguieron significación estadística. En el periodo durante el cual hemos realizado nuestro estudio únicamente se disponía de la comercialización de 2 anti-TNF subcutáneos.
En conclusión, en nuestro centro y en la práctica clínica habitual, la supervivencia a largo plazo de los tratamientos anti-TNF subcutáneos fue elevada e independiente de que tuvieran o no tratamiento inmunosupresor concomitante. La principal causa de interrupción del tratamiento fue por fallo secundario.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.