Describir la metodología del Registro de pacientes con miopatía inflamatoria idiopática (MII) de España (Myo-Spain), así como sus fortalezas y limitaciones. El objetivo principal del proyecto es analizar la evolución y el manejo clínico de una cohorte de pacientes con MII.
Material y métodoEstudio observacional, longitudinal, ambispectivo y multicéntrico de una cohorte de pacientes con MII atendidos en servicios de reumatología de España. Se incluirán todos los pacientes con diagnóstico de MII en seguimiento habitual por los centros participantes, sin tener en cuenta la edad de inicio del proceso. Los casos incidentes serán todos los pacientes que al inicio del estudio en cada centro estén diagnosticados desde hace menos de 12 meses y casos prevalentes desde hace más de 12 meses. Se construirá un registro en el que se incluirán los datos de la visita basal, del año y dos años. Se recogerán variables sociodemográficas, clínicas, analíticas, complicaciones, comorbilidad, asociación con otras enfermedades reumáticas, ingresos hospitalarios, mortalidad y tratamientos. Además, se determinarán índices, escalas y cuestionarios de actividad, afectación muscular, daño, discapacidad y calidad de vida. El periodo de reclutamiento será de 23 meses. El propósito es conseguir una cohorte de 400 pacientes con MII.
ConclusionesEl estudio Myo-Spain constituye la oportunidad para desarrollar una cohorte de pacientes incidentes y prevalentes con MII en España. Myo-Spain permitirá evaluar en detalle, las características clínicas de la enfermedad en diferentes momentos. Se espera que la información exhaustiva recogida en las visitas suponga una amplia fuente de datos para futuros análisis.
To describe the methods of the Spanish Registry of patients with idiopathic inflammatory myopathy (IIM) (Myo-Spain), as well as its strengths and limitations. The main objective of the project is to analyse the evolution and clinical management of a cohort of patients with IIM.
MethodsObservational, longitudinal, ambispective and multicentre study of a cohort of patients with IIM seen in rheumatology units in Spain. All patients with a diagnosis of IMM will be included in the regular follow-up of the participating centres, regardless of age on initiation of the process. Incident cases will be all patients who at the beginning of the study have been diagnosed for less than 12 months and prevalent cases for more than 12 months. The registry will include data from the visit at baseline, one year and two years. Socio-demographic, clinical, analytical variables, complications, comorbidities, association with other rheumatic diseases, hospital admissions, mortality and treatments will be collected. In addition, indices, scales and questionnaires of activity, muscle involvement, damage, disability, and quality of life will be determined. The recruitment period will be 23 months. The purpose is to obtain a cohort of 400 patients with IMM.
ConclusionsMyo-Spain registry provides the opportunity to develop a cohort of incident and prevalent patients with IMM in Spain. Myo-Spain will be able to assess in detail the clinical characteristics of the disease at different times. The comprehensive information collected during the visits is expected to provide a broad source of data for future analysis.
Las miopatías inflamatorias idiopáticas (MII) comprenden un grupo heterogéneo de enfermedades de origen autoinmune caracterizadas por una inflamación no supurativa de la musculatura esquelética, debilidad muscular progresiva y expresividad variable en diferentes órganos y sistemas1. Las MII son enfermedades raras, cuya incidencia media oscila entre los 1 y 19 casos/millón de habitantes/año2,3, variando en función de la zona geográfica, la metodología y los criterios de clasificación aplicados. En un estudio sobre la estimación de la incidencia en España entre los años 1997-2004, se observó una tasa de incidencia de 8,9 casos nuevos/millón habitantes/año (intervalo de confianza [IC] 95% 8,6-9,2), con una mayor incidencia de casos de dermatomiositis (DM) respecto a las polimiositis (PM)4. La etiología y los factores predisponentes para el desarrollo de las MII todavía no están del todo claros. Actualmente se considera que son procesos inmunomediados y posiblemente desencadenados por factores ambientales en individuos genéticamente predispuestos5. Las MII presentan una gran variedad de manifestaciones clínicas, siendo característica la debilidad muscular secundaria a la inflamación crónica del músculo estriado. Otros órganos afectados son la piel, las articulaciones, el pulmón, el tracto gastrointestinal o el corazón. Las complicaciones incluyen infecciones y neoplasias6–8. A pesar de que el pronóstico de la enfermedad ha mejorado sustancialmente en las últimas décadas, la mortalidad está incrementada respecto a la población general9. Además, al menos un tercio de los pacientes presentan una discapacidad moderada o grave, fundamentalmente debida a la afección pulmonar, al desarrollo de calcinosis y a la debilidad muscular10.
En las últimas décadas, la identificación de anticuerpos específicos y asociados, el acceso a técnicas de imagen como la resonancia magnética nuclear y la ecografía, las mejoras en la interpretación de la biopsia muscular y el desarrollo de nuevos criterios de clasificación han permitido un mejor conocimiento de este grupo de enfermedades11.
Sin embargo, la heterogeneidad de las manifestaciones clínicas, de su evolución y su pronóstico, unido a su baja prevalencia e incidencia, dificulta el estudio de la enfermedad. En España, los estudios prospectivos son limitados, en especial aquellos que incluyen todos los subtipos de MII. No disponemos de información sobre actividad de la enfermedad, gravedad, discapacidad, calidad de vida, manejo de tratamientos o factores pronósticos. Tampoco se ha estudiado si el comportamiento de la enfermedad es diferente al comparar pacientes que al diagnóstico cumplen los nuevos criterios de clasificación del American College of Rheumatology y de la European League Against Rheumatism (ACR/EULAR) con aquellos que los cumplen durante el seguimiento o nunca llegan a cumplirlos.
Por este motivo, se puso en marcha el proyecto Registro de pacientes con miopatía inflamatoria idiopática de España (Myo-Spain), cuyo objetivo principal es analizar la evolución y el manejo de una cohorte de pacientes con MII, atendidos en servicios de reumatología en España. En el presente trabajo se describe la metodología del proyecto, así como sus posibles fortalezas y limitaciones.
MetodologíaDiseño generalEstudio observacional, longitudinal, ambispectivo y multicéntrico. Se ha propuesto un seguimiento inicial a dos años que se prevé sea superior para alcanzar el objetivo principal del proyecto (analizar la evolución y manejo de las MII). El protocolo completo del estudio está disponible en https://myospain.ser.es.
Población de referenciaPacientes con diagnóstico de MII de cualquier tipo en seguimiento habitual por los servicios de reumatología, sin tener en cuenta la edad de inicio del proceso.
Se han considerado dos grupos de pacientes, según el momento de diagnóstico. Los casos incidentes serán todos los pacientes que al inicio del estudio en cada centro estén diagnosticados desde hace menos de 12 meses y casos prevalentes, todos los que estén diagnosticados desde hace más de 12 meses.
Población de estudio. Criterios de inclusión y exclusión- 1.
Criterios de inclusión
- -
Pacientes con diagnóstico de MII, según criterio del facultativo responsable, y en seguimiento activo. Los tipos de MII pueden ser: DM, PM, DM amiopática, DM hipomiopática, miositis por cuerpo de inclusión (MCI), miopatía necrotizante inmunomediada (MNIM), miopatías juveniles, síndrome antisintetasa, otros síndromes de solapamiento con miositis y no clasificable.
- -
Ningún grupo de edad queda excluido del estudio. En caso de menor no maduro, los cuestionarios serán contestados por sus padres o tutores.
- -
- 2.
Criterios de exclusión
- -
Pacientes que, a juicio del investigador, tengan dificultades para acudir a las visitas o cumplimentar los formularios.
- -
Individuos con diagnóstico de miopatías de causa tóxica o infecciosa o secundaria a enfermedad neuromuscular.
- -
Cuando los datos completos requeridos para los criterios de clasificación o un diagnóstico médico final no estén disponibles.
- -
Se invitó a participar a todos los hospitales con atención especializada en reumatología que pertenecen al Grupo de Trabajo de Enfermedades Autoinmunes Sistémicas de la Sociedad Española de Reumatología (GT EASSER) y a miembros de la Sociedad Española de Reumatología (SER) interesados. Se llevó a cabo una encuesta online (junio de 2017), en la que se obtuvo información sobre experiencia y casuística de MII. Posteriormente, se realizó una preselección a través de una solicitud de participación que los centros interesados enviaron (7 de marzo al 10 de abril de 2018), en la que se detallaba la capacidad de reclutamiento y experiencia en el manejo de MII. Durante el mes de junio de 2018 se realizó la selección de centros. Finalmente, en el proyecto participan 32 centros (tabla 1).
Listado de centros participantes
| Hospital participante | Comunidad Autónoma |
|---|---|
| Hospital Universitario de Badajoz | Extremadura |
| Hospital Universitario de la Santa Creu i Sant Pau | Cataluña |
| Complejo Asistencial Universitario de Salamanca | Castilla y León |
| Hospital Universitario 12 de Octubre | Comunidad de Madrid |
| Hospital del Mar | Cataluña |
| Hospital General Universitario Gregorio Marañón | Comunidad de Madrid |
| Hospital Universitario Puerta de Hierro | Comunidad de Madrid |
| Hospital General Universitario de Alicante | Comunidad Valenciana |
| Hospital Universitario de Bellvitge | Cataluña |
| Hospital General Universitario de Elda | Comunidad Valenciana |
| Hospital Universitario Virgen del Rocío | Andalucía |
| Complejo Hospitalario Universitario A Coruña | Galicia |
| Hospital Universitario Ramón y Cajal | Comunidad de Madrid |
| Hospital Universitario de la Princesa | Comunidad de Madrid |
| Hospital Universitario de Basurto | País Vasco |
| Hospital Germans Trias i Pujol | Cataluña |
| Hospital General de Granollers | Cataluña |
| Hospital Universitario de Gran Canaria Doctor Negrín | Canarias |
| Hospital Universitario Infanta Sofía | Comunidad de Madrid |
| Hospital Universitario la Paz | Comunidad de Madrid |
| Hospital Universitario Fundación Jiménez Díaz | Comunidad de Madrid |
| Hospital Universitario HM Sanchinarro | Comunidad de Madrid |
| Complejo Hospitalario Universitario de Vigo | Galicia |
| Hospital Universitario Son Llàtzer | Baleares |
| Hospital Universitario Virgen de la Arrixaca | Comunidad de Murcia |
| Hospital Universitario de Canarias | Canarias |
| Hospital Universitario Donostia | País Vasco |
| Hospital Universitario Reina Sofía | Andalucía |
| Hospital Clínico Universitario de Valencia | Comunidad Valenciana |
| Complejo Hospitalario Universitario de Santiago | Galicia |
| Hospital Universitario Vall d’Hebron | Cataluña |
| Hospital Universitario Príncipe de Asturias | Comunidad de Madrid |
El periodo de reclutamiento es de 23 meses. Se pretende reclutar a todos los pacientes con diagnóstico de MII que cumplan los criterios de inclusión y ninguno de exclusión. Todos los pacientes deben proporcionar su consentimiento informado previo a su entrada en el estudio.
Los pacientes son invitados a participar consecutivamente en una de sus visitas habituales al reumatólogo. Las vías de acceso de los pacientes a los servicios de reumatología para el diagnóstico y seguimiento son las habituales (urgencias, atención primaria e interconsultas de otras especialidades como dermatología, neumología o neurología). El estudio está abierto a investigadores colaboradores de otras especialidades como neurología y medicina interna, aunque la coordinación en cada centro se lleva a cabo desde reumatología. El periodo de reclutamiento se inició en junio de 2019.
El Cuaderno de Recogida de Datos (CRD) electrónico asigna un código de identificación en el estudio a cada uno de los participantes, para así mantener la confidencialidad de los datos, de acuerdo con la normativa vigente (Reglamento UE 2016/679 del Parlamento Europeo y del Consejo de 27 de abril de 2016 de Protección de Datos [RGPD]), así como toda aquella normativa española y europea aplicable en materia de privacidad y protección de datos personales. El estudio ha sido aprobado por el Comité de Ética de Investigación Clínica (CEIC) de referencia (Hospital La Paz, Madrid) y por cada uno de los CEIC de los centros participantes.
Recogida de datosSe ha creado un CRD electrónico específico de Myo-Spain, al que accede cada centro participante. La recogida de la información clínica es tanto retrospectiva (casos prevalentes), a partir de la historia clínica, como prospectiva (casos prevalentes e incidentes), obtenida de las visitas basal y de seguimiento, al cabo de uno y dos años.
Variables y medicionesPara alcanzar los objetivos del proyecto, es necesario realizar múltiples análisis con diferentes variables de desenlace, por lo que no se ha definido una variable de desenlace principal concreta.
Las variables y mediciones se recogerán en el CRD online, tanto en la visita basal como en la visita de seguimiento, al cabo de uno y dos años.
- 1.
Datos generales, de inclusión y sociodemográficos
Estas variables incluyen la fecha de nacimiento, sexo, raza, nivel de estudios, criterios de clasificación de MII que cumple el paciente, tipo de MII, fecha de inicio de síntomas de la MII, fecha de diagnóstico de la MII y fecha de la visita. Además, en las visitas de seguimiento del año 1 y año 2 se recogerán la fecha y causa de pérdida de seguimiento en los pacientes que abandonen el estudio.
- 2.
Criterios de clasificación
Se registran variables relacionadas con los criterios de clasificación, como la forma de inicio de la MII (agudo [0-14 días desde inicio], subagudo [> 14 días a ≤ 2 meses] o insidioso [> 2 meses a años]), presencia de debilidad en las extremidades y en la musculatura flexora-extensora del cuello, dolor muscular a la presión o dolor muscular espontáneo, elevación de los niveles de enzimas musculares, presencia de erupción típica de DM, manifestaciones articulares, digestivas y sistémicas, resultados de la biopsia muscular, electromiografía y resonancia magnética nuclear.
- 3.
Actividad de la enfermedad
Incluye el Myositis Disease Activity Assessment (MYOACT) que evalúa, por el médico, la actividad de la enfermedad en las cuatro últimas semanas mediante escala visual analógica (EVA) de 10 cm en siete órganos/sistemas (constitucional, cutáneo, esquelético, gastrointestinal, pulmonar, cardiaco y muscular). Además, incluye evaluación extramuscular global y evaluación global (muscular y extramuscular) del MYOACT en las cuatro últimas semanas en EVA de 0-10 cm12,13. Por otro lado, se recogen la presencia de variables específicas a nivel cutáneo (ulceración, paniculitis, erupción eritematosa, alteración en capilares periungueales, alopecia, manos de mecánico, vasculitis cutánea, esclerodactilia [engrosamiento y endurecimiento localizado de la piel de los dedos de manos y pies], fenómeno de Raynaud y otras), esquelético (artritis y artralgia), gastrointestinal (disfagia o dismotilidad), pulmonar (capacidad de difusión de monóxido de carbono [DLCO], capacidad vital forzada [CVF], patrones de neumopatía intersticial en tomografía axial computarizada de alta resolución [TACAR], necesidad de oxígeno crónico domiciliario) y cardiaco (pericarditis, miocarditis y arritmias). Finalmente, se incluye la valoración global de la enfermedad por el médico y el paciente/padres o tutor en el momento de la visita (EVA 0-10 cm), y el Manual Muscle Testing sobre ocho grupos musculares (MMT-8) que evalúa la fuerza muscular12,13.
- 4.
Capacidad funcional
Se recoge el valor del cuestionario de función física Health Assessment Questionnaire (HAQ) en adultos, y en niños, el HAQ infantil (CHAQ), en relación con la semana previa a la visita12,13.
- 5.
Daño
El daño son los cambios persistentes en la anatomía, fisiología, patología o función, como resultado de cualquier causa desde el inicio de la miositis y está presente durante al menos seis meses. Se incluye el Myositis Damage Index (MDI) que evalúa, por el médico, la gravedad del daño mediante EVA de 10 cm en 11 órganos/sistemas (muscular, esquelético, cutáneo, gastrointestinal, pulmonar, cardiovascular, vascular periférico, endocrino, ocular, infección y neoplasia maligna). Además, se recoge la evaluación global de la gravedad del daño (EVA de 0-10 cm) del MDI12,13. Por otro lado, se registra la presencia y fecha de diagnóstico de variables específicas de daño a nivel cutáneo (calcinosis, lipodistrofia), pulmonar (hipertensión arterial pulmonar), cardiovascular (hipertensión arterial, cardiopatía isquémica), vascular periférico (trombosis venosa o arterial), endocrino (diabetes mellitus), infecciones graves (incluida localización), neoplasias malignas (incluido tipo), mortalidad (incluida causa). Finalmente se incluye la valoración global del daño por el médico y paciente/padres o tutor en el momento de la visita (EVA 0-10 cm)12,13.
- 6.
Laboratorio
Se recogen los valores de enzimas musculares (CPK, GOT, GPT y LDH), velocidad de sedimentación globular (VSG), proteína C reactiva (PCR) y ferritina.
- 7.
Anticuerpos
Se recoge información sobre la presencia de anticuerpos específicos y asociados con miositis (antisintetasa, anti-MDA5, anti-Mi2, anti-SRP, anti-TIF1-γ, anti-NXP2, anti-HMG-CoA reductasa, anti-SAE, anti-Ku, anti-Ro, anti-RNP, anti-PMSCL).
- 8.
Otras comorbilidades
Añade información sobre comorbilidades que no se incluyen en las variables de daño (dislipemia, tabaquismo y asociación con otras enfermedades autoinmunes).
- 9.
Hospitalización
Incluye la información sobre hospitalizaciones e ingresos en unidades de cuidados intensivos (fecha y causa).
- 10.
Tratamiento
Se recogen los principales tratamientos utilizados en esta enfermedad y su indicación: glucocorticoides, antipalúdicos, inmunosupresores sintéticos, inmunosupresores biológicos y sintéticos dirigidos, inmunoglobulinas intravenosas y plasmaféresis (fecha de inicio, fecha de finalización y causa de suspensión). Además, se recogen otros tratamientos menos habituales como trasplante pulmonar o hemoperfusión directa con polimixina B.
- 11.
Calidad de vida
Recoge la información del cuestionario de calidad de vida 12-Item Short-Form Health Survey (SF-12)12,13.
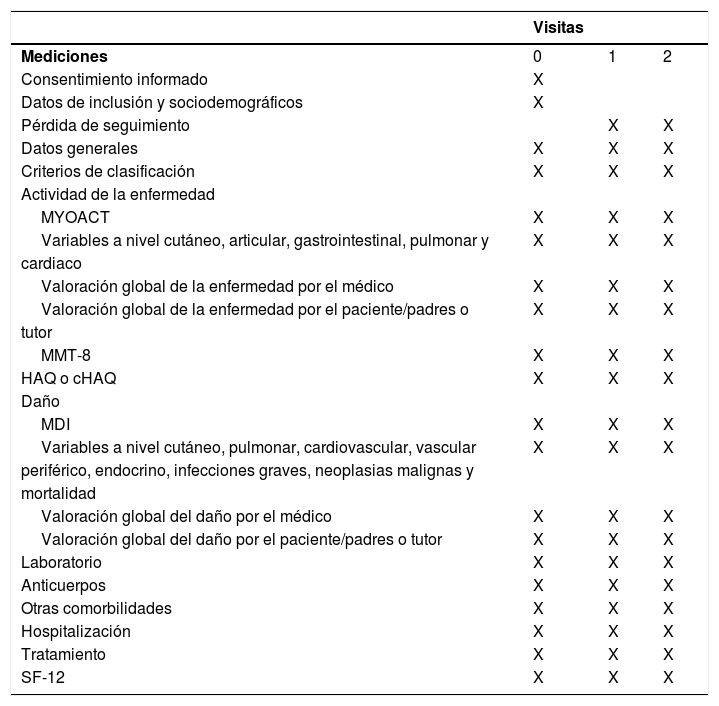
En la tabla 2 aparecen las mediciones realizadas en cada visita del estudio.
Mediciones realizadas en cada visita del estudio
| Visitas | |||
|---|---|---|---|
| Mediciones | 0 | 1 | 2 |
| Consentimiento informado | X | ||
| Datos de inclusión y sociodemográficos | X | ||
| Pérdida de seguimiento | X | X | |
| Datos generales | X | X | X |
| Criterios de clasificación | X | X | X |
| Actividad de la enfermedad | |||
| MYOACT | X | X | X |
| Variables a nivel cutáneo, articular, gastrointestinal, pulmonar y | X | X | X |
| cardiaco | |||
| Valoración global de la enfermedad por el médico | X | X | X |
| Valoración global de la enfermedad por el paciente/padres o | X | X | X |
| tutor | |||
| MMT-8 | X | X | X |
| HAQ o cHAQ | X | X | X |
| Daño | |||
| MDI | X | X | X |
| Variables a nivel cutáneo, pulmonar, cardiovascular, vascular | X | X | X |
| periférico, endocrino, infecciones graves, neoplasias malignas y | |||
| mortalidad | |||
| Valoración global del daño por el médico | X | X | X |
| Valoración global del daño por el paciente/padres o tutor | X | X | X |
| Laboratorio | X | X | X |
| Anticuerpos | X | X | X |
| Otras comorbilidades | X | X | X |
| Hospitalización | X | X | X |
| Tratamiento | X | X | X |
| SF-12 | X | X | X |
MYOACT: Myositis Disease Activity Assessment; MMT-8: Manual Muscle Testing sobre ocho grupos musculares; MDI: Myositis Damage Index; HAQ: Health Assessment Questionnaire; cHAQ: HAQ infantil; SF-12: 12-Item Short-Form Health Survey.
No se ha realizado estimación del tamaño muestral, teniendo en cuenta los objetivos del registro. Está previsto que se incluyan en el estudio todos los pacientes de cada centro participante que cumplan los criterios de inclusión. Se estima, con base en una encuesta previa realizada a los centros con interés, que el número total de pacientes estará en torno a 400. En el primer año de reclutamiento se han incluido 186 pacientes.
Control de calidad de la base de datosSe llevará a cabo una monitorización online anual. Cada año se revisará la consistencia de todos los nuevos datos registrados en la plataforma de recogida de datos, con especial atención a aquellas variables que recogen información relacionada con los objetivos del estudio. Sólo se considerarán pacientes evaluables para los análisis aquellos en los que se cumplimente > 80% de las variables de la visita.
Además del proceso de monitorización, se ha llevado a cabo una estandarización de los procedimientos. Esta estandarización ha quedado recogida en un manual del investigador de Myo-Spain disponible para todos los investigadores participantes en el estudio.
Recordatorio de las visitasDurante el periodo de inclusión (V0), se envía de forma periódica (cada dos a tres meses) correos electrónicos recordatorios y del estado del proyecto a todos los centros participantes. Además, de forma sistemática y desde el CRD online se envía un correo electrónico recordatorio a los investigadores de cada centro, avisando en una fecha cercana (en el mes previo a la fecha teórica) cuándo son las visitas de seguimiento (V1 y V2), con el objeto de que se cumplan las visitas y se recoja la información de los pacientes.
DiscusiónEn el presente trabajo se describe la metodología del registro Myo-Spain. Este proyecto constituye la creación de una cohorte multicéntrica española de pacientes incidentes y prevalentes con cualquier tipo de MII, y con un seguimiento prospectivo a dos años.
A nivel internacional, hay que destacar varios registros instaurados para investigar diferentes aspectos de las MII. En el año 1999 se creó el registro multicéntrico EuroMyositis, en el que en la actualidad participan más de 20 países fundamentalmente de Europa14. El registro pretende obtener datos longitudinales uniformes sobre miositis juvenil y del adulto, con el fin de lograr un mayor conocimiento sobre el curso de la enfermedad y el pronóstico. Hay un área de recogida de datos obligatoria que contiene información básica que alguna vez estuvo presente durante la duración de la miositis, y otra área, que no es obligatoria cumplimentar, y corresponde a las visitas individuales destinadas a seguir el curso de la enfermedad (actividad y daño, debilidad muscular, tratamiento, anticuerpos y resultados de biopsias). El registro cuenta con más de 3.000 participantes y en las publicaciones realizadas se han estudiado asociaciones entre subtipos clínicos, implicación extramuscular, exposiciones ambientales, anticuerpos y medicamentos14,15. Además, en esta cohorte junto con la cohorte de Reino Unido e Irlanda, el Juvenile Dermatomyositis Research Group (JDRG), se validaron los nuevos criterios de clasificación EULAR/ACR11,16.
En el año 2010, la asociación estadounidense de pacientes con miositis tuvo la iniciativa de crear el registro nacional MYOVISION. De diciembre de 2010 a julio de 2012, se incluyeron en este registro 1.806 pacientes con MII (PM, DM, MCI), que aceptaron realizar una encuesta en papel o en formato online con 83 preguntas sobre datos demográficos, de trabajo o escuela, actividades de ocio, exposiciones ambientales, de la enfermedad y de calidad de vida relacionada con la salud. Se han publicado varios estudios trasversales centrados en las exposiciones ambientales y la calidad de vida17,18. A partir del registro multicéntrico estadounidense Childhood Arthritis and Rheumatology Research Alliance (CARRA), en el que se incluyó entre 2010 y 2014 pacientes con enfermedades reumáticas infantiles, se han publicado estudios trasversales de la cohorte de DM juvenil con 688 pacientes sobre las características clínicas y la asociación entre la exposición a radiación ultravioleta y la gravedad de la enfermedad19,20. Debido a las limitaciones en el número de variables, en la información sobre tratamientos, en el proceso de recogida de datos que no era sistemático en cada visita, se creó en 2015 el nuevo registro CARRA, limitado únicamente a artritis idiopática juvenil21.
La cohorte del grupo colaborativo American and European NEtwork of Antisynthetase Syndrome (AENEAS) forma parte de un estudio internacional, multicéntrico restrospectivo, iniciado en el año 2014 y que incluye pacientes con síndrome antisintetasa con al menos seis meses de seguimiento. Las publicaciones de esta cohorte se han centrado en la forma de presentación de la enfermedad, evolución, desenlaces, y el comportamiento concreto de la enfermedad, según la presencia de los diferentes anticuerpos antisintetasa o manifestaciones específicas como la artritis22–24.
A nivel nacional hay que subrayar tres iniciativas. La primera fue el registro de pacientes con síndrome antisintetasa del grupo de estudio de enfermedades autoinmunes sistémicas (GEAS) de medicina interna, que aportó información sobre manifestaciones y desenlaces a largo plazo en pacientes con anticuerpos anti-jo125. La segunda, el registro de pacientes con miopatía inflamatoria de la Sociedad Madrileña de Reumatología (REMICAM), con participación de 12 servicios de reumatología de la Comunidad de Madrid y recogida de información clínica y de mortalidad de forma retrospectiva de pacientes en seguimiento en algún momento entre 1980 y diciembre de 2014. Este registro ha proporcionado información sobre mortalidad, desenlaces pulmonares a largo plazo, síndromes de solapamiento con miositis y formas juveniles26–29. Finalmente, el Registro nacional de pacientes con síndrome MDA5 (MEDRA5), registro multicéntrico y multidisciplinar, que pretende conocer la historia natural del síndrome MDA5, y en el que se ha realizado una recogida retrospectiva de datos clínicos de estos pacientes hasta diciembre de 2019.
Entre las fortalezas, y a diferencia de la mayoría de los registros enumerados, en Myo-Spain se va a realizar un seguimiento prospectivo protocolizado con visitas anuales de todos los pacientes, que inicialmente se ha planteado a dos años, pero que se prevé sea superior, dado que las MII son enfermedades infrecuentes, heterogéneas y se precisa un mayor seguimiento para conocer su evolución y manejo (objetivo principal del proyecto). Todas las variables del registro están estandarizadas y se va a llevar a cabo una estricta monitorización de los datos, prescindiendo para el análisis de aquellos pacientes que no alcancen el 80% de las variables requeridas. Aunque en el registro EuroMyositis también se pueden recoger de forma prospectiva datos de las visitas de seguimiento, no es algo obligado, por lo que se podría infraestimar la incidencia de nuevas manifestaciones a lo largo del tiempo. Además, en los primeros años del registro todavía no se habían reconocido todos los subtipos de MII actuales, como la MNIM, y no se habían descubierto algunos anticuerpos específicos de miositis, por lo que un porcentaje de los pacientes podrían estar clasificados incorrectamente. Otra fortaleza de Myo-Spain es que se ha diseñado desde el inicio para constituir dos cohortes, una con pacientes incidentes (< 12 meses del diagnóstico) y otra con pacientes prevalentes (> 12 meses del diagnóstico), en la que todos los pacientes al ser incluidos deben estar vivos y en seguimiento activo. Al ser una enfermedad poco frecuente, se decidió un periodo de reclutamiento extenso, incrementando la probabilidad de incluir casos incidentes. A su vez, hemos pretendido conocer la actividad de la enfermedad, el daño, la discapacidad, la fuerza muscular y la calidad de vida utilizando índices y cuestionarios validados que nos permitirán evaluar el estado de la enfermedad y buscar asociaciones de una forma más objetiva. Asimismo, al incluir todos los subtipos de MII podremos realizar comparaciones y conocer diferencias en nuestra población. Por otro lado, también se podrá estudiar la utilidad diagnóstica de los nuevos criterios de clasificación en esta cohorte, de los futuros criterios de clasificación del síndrome antisintetasa o determinar las diferencias entre los pacientes con formas completas e incompletas al inicio de la enfermedad.
Sin embargo, nuestro registro también presenta una serie de limitaciones. En primer lugar, no se ha diseñado para que fuera representativo de la distribución geográfica de las MII a nivel nacional. Esta cohorte no incluye pacientes de todas las comunidades autónomas; en concreto, no hay datos de centros de Aragón, Asturias, Cantabria, Castilla La Mancha, La Rioja y Navarra. Otra posible limitación es la existencia de un sesgo de selección de pacientes, incluyéndose aquellos que puedan presentar un seguimiento más fácil o que cuenten con menos comorbilidades. Para evitar este sesgo, se ha recogido la necesidad de reclutar a todos los pacientes que cumplan criterios de inclusión por centro, lo que a su vez se convierte también en una necesidad debido a los datos de prevalencia e incidencia que presentan las MII. El reclutamiento de todos los pacientes que cumplan criterios de inclusión se ha reforzado mediante comunicaciones periódicas con los investigadores participantes y en las reuniones de inicio y seguimiento del estudio. Aunque es un proyecto de la Sociedad Española de Reumatología y los investigadores principales de cada centro son reumatólogos, para minimizar un posible sesgo de reclutamiento se ha abierto a la participación de investigadores colaboradores de otras especialidades como medicina interna y neurología.
ConclusionesEl estudio Myo-Spain constituye una cohorte de pacientes con cualquier tipo de MII reclutados en servicios de reumatología de toda España. Este es el primer estudio prospectivo de estas características que promueve la SER en una enfermedad rara. La cohorte contará con un grupo de pacientes incidentes y otro de prevalentes, lo que permitirá evaluar en detalle las características clínicas de la enfermedad en diferentes momentos. Se espera que la información exhaustiva recogida en las visitas suponga una amplia fuente de datos, para futuros análisis e investigaciones.
FinanciaciónMyo-Spain está financiado por Kern Pharma (España), Nordic Pharma (España), Sandoz (España) y Bristol-Myers Squibb (España). Ninguna de estas compañías ha intervenido en el diseño del estudio, en la recogida o análisis de datos, ni en la redacción de este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Fernando Sánchez-Alonso y Nuria Montero, personal de la Unidad de Investigación de la Sociedad Española de Reumatología que colabora en el desarrollo del proyecto.