Los anticuerpos antinucleares son inmunoglobulinas que reconocen componentes celulares autólogos (nucleares y citoplasmáticos). Además de los ANA autoinmunes, pueden estar en circulación ANA infecciosos y naturales.
La detección de ANA debe realizarse mediante inmunofluorescencia indirecta (IFI) en líneas celulares como prueba de tamizado inicial debido a su alta sensibilidad. Una muestra positiva para ANA, detectados mediante IFI, debe confirmarse mediante técnicas más sensibles y específicas como ELISA, electroinmunotransferencia (Western blot) u otras.
Los ANA detectados por IFI deben ser evaluados en base al patrón y al título. La detección específica de diversos autoanticuerpos (anti-ENA, ADNcd, etc.) resulta útil en el diagnóstico y seguimiento de pacientes con enfermedades autoinmunes. Por tal motivo, su detección debe realizarse de manera ordenada y razonable, empleando las guías o estrategias enfocadas al buen uso e interpretación de la presencia de autoanticuerpos. El objetivo de la revisión es presentar una recopilación de la literatura y nuestra experiencia en la detección y estudio de los ANA.
Anti-nuclear antibodies (ANA) are immunoglobulin directed against autologous cell nuclear and cytoplasmic components. Besides the autoimmune ANA there are other ANA that can be detected in circulation, like natural and infectious ANA. Because of its high sensibility, detection of the ANA must be done by indirect immunofluorescence (IIF) as screening test and all of those positive samples are convenient to confirm its specificity by ELISA, western blot or other techniques.
Positive ANA detected by IIF must be evaluated taking in to account the pattern and titer. The following recommended step is the specificity characterization (reactivity against extractable nuclear antigens [ENA], dsDNA, etc.) which is useful for the diagnosis and follow up of patients with autoimmune diseases, and by such reasoning, its detection must be performed in an orderly and reasonable way using guides or strategies focused to the good use and interpretation of the autoantibodies. The objective of this review is to present a compilation of the literature and our experience in the detection and study of the ANA.
El estudio de los anticuerpos antinucleares (ANA) se inició con la identificación en pacientes con lupus eritematoso generalizado (LEG) de las células LE, descrito por Hargraves en 19481. La detección de las células LE fue durante mucho tiempo una prueba utilizada para confirmar el diagnóstico de LEG. Sin embargo, años después se demostró su baja especificidad, ya que pueden estar presentes en pacientes con artritis reumatoide (25%), síndrome de Sjögren (15–20%), cirrosis pancreática (33%), hepatitis crónica activa (50–70%) y en otras enfermedades (1–2% miastenia gravis y púrpura trombocitopenia idiopática). En 1959, Holman mostró que el fenómeno de las células LE se debía a la presencia de anticuerpos que reconocen antígenos nucleares2. Lo anterior llevó al desarrollo de técnicas como la inmunodifusión (doble difusión radial u Ouchterlony y contrainmunoelectroforesis), hemoaglutinación, fijación de complemento, etc. y de técnicas de microscopía, empleando anticuerpos conjugados con moléculas fluorescentes (inmunofluorescencia indirecta [IFI]) que aumentaron la especificidad y sensibilidad para la detección. Actualmente, la técnica más utilizada para la detección de los ANA es la IFI, la cual fue desarrollada en 1950 por Conns et al3 y, posteriormente, modificada por Tan4 en 1966, que empleaba como sustratos cortes de hígado o riñón de ratón. Diez años más tarde, publicaron los resultados de la estandarización para la detección de los ANA en pacientes con padecimientos reumáticos5.
Actualmente, la detección de los ANA se hace empleando como sustratos las líneas celulares HEp-2 y HeLa, siendo la primera por su facilidad de crecimiento la más utilizada. La detección de ANA mediante IFI en líneas celulares se considera la prueba inicial de laboratorio que apoya al diagnóstico de las enfermedades autoinmunes debido a su alta sensibilidad. Sin embargo, dada su relativa baja especificidad, es necesario emplear técnicas más sensibles y específicas como: radioinmunoanálisis (RIA), ELISA, electroinmunotransferencia (EIT) o Western blot, etc. para aumentar la sensibilidad y especificidad de los ANA para el diagnóstico de las enfermedades autoinmunes.
Definición de ANA y ENALos ANA son inmunoglobulinas que reaccionan contra diferentes componentes autólogos nucleares (v. g. ADNcd, SSA/Ro, proteínas del centrómero, etc.) y citoplásmicos (v. g. aminoacil tRNA sintetasa o Jo-1, mitocondrias, etc.). Estos últimos, no obstante, son antígenos citoplásmicos y los anticuerpos que los reconocen son referidos también como ANA6. Si bien existe controversia en relación a si es correcto o no llamar a los patrones citoplásmicos como ANA para simplificar la forma de referirse a los autoanticuerpos que reconocen antígenos ubicuos del núcleo o citoplasma sin importar su ubicación, nos referiremos a ellos como ANA. Existe una propuesta interesante que sugiere que se llamen anticuerpos «anticelulares» (Dr. Ignacio García de la Torre, comunicación personal, Jornadas Médicas de Actualización en Enfermedades Autoinmunes, junio de 2009, México DF), pero requiere ser aceptado en consenso internacional. Desde la perspectiva de laboratorio, los anticuerpos que reconocen antígenos en ambos compartimentos son detectados en un solo sustrato antigénico (células HEp-2) y ambos se reportan como ANA (patrón nuclear y citoplásmico).
Por otra parte, la identificación de los antígenos reconocidos por los ANA fue originalmente estudiada purificando proteínas nucleares mediante técnicas de extracción con soluciones salinas; de ahí surgió el nombre de antígenos extraíbles del núcleo o mejor conocidos como ENA (del inglés, extractable nuclear antigens), de los cuales existen más de 100 antígenos conocidos. Sin embargo, los más estudiados y mejor caracterizados son: SSA/SSB, RNP-U1/Sm, Sm, Scl70 y Jo-16.
Clasificación de los ANAEn circulación pueden estar presentes tres tipos de ANA. Uno de ellos está presente en todos los individuos a títulos relativamente bajos y forman parte del repertorio de los ANA naturales7. Por ello, es importante establecer valores de referencia ajustados a las poblaciones étnicas que los van a usar como referencia7–9. En un trabajo realizado en el 2005 mostramos la importancia de establecer los valores normales de ANA tomando en cuenta el grupo étnico, el patrón observado y los títulos de los anticuerpos9. Un segundo tipo de ANA son los que se producen como resultado de procesos infecciosos. En este sentido, los ANA cuyo origen son los procesos infecciosos no se asocian a manifestaciones clínicas de enfermedad autoinmune y sus títulos bajan en cuanto se resuelve el proceso infeccioso que les dio origen7. El tercer tipo es el de los ANA autoinmunes, los cuales reflejan la pérdida de la tolerancia inmunológica y su origen es multifactorial. Su producción depende de carga genética, medio ambiente, cambios hormonales, etc.10(tabla 1).
Clasificación de los ANA
| ANA | Origen | Características |
| Naturales | No se conoce el estímulo antigénico que origina su síntesisEn niños y adultos mayores pueden estar presentes a títulos relativamente altos |
|
| Infecciosos | Producidos en respuesta a estímulos antigénicos externos (infecciones) |
|
| Autoinmunes | El estímulo que origina su síntesis es endógeno o exógeno Son de origen multifactorial (pérdida de tolerancia inmunológica, carga genética, interacción con el medio ambiente, otros) |
|
El sustrato utilizado para la detección de los ANA es muy importante, ya que existen antígenos cuya concentración en las células de los tejidos es muy baja en contraste con lo que sucede en las células HEp-2, que por ser una línea celular epitelial su concentración está aumentada. Otra característica de estas células es que tienen más de 46 cromosomas, más de dos nucleolos y, por ser células muy activas metabólicamente, tienen una gran cantidad de mitocondrias. Su núcleo es más grande que el de cualquier célula epitelial normal, por ello la observación de patrones nucleares y citoplásmicos se convierte en una tarea relativamente fácil. Sin embargo, es importante confirmar la especificidad de los autoanticuerpos detectados mediante ELISA, EIT o técnicas con sensibilidad y especificidad similares o mayores11.
Otra técnica utilizada para la detección de ANA es el ELISA, en el cual las placas de poliestireno son recubiertas con macerados (principalmente núcleos) de las líneas celulares HEp-2 o HeLa. En este caso, la especificidad es mínima ya que si se obtiene un resultado positivo no se sabe el o los autoantígenos que están dando la positividad o reactividad. Por el contrario, los patrones obtenidos en células HEp-2 permiten sospechar la especificidad de los ANA. Por ejemplo, el patrón homogéneo sugiere reactividad contra antígenos de la cromatina (nuclesomas, ADNcd, ADNcs y/o histonas); el patrón centromérico sugiere reactividad contra las proteínas del centrómero CENP-A, CENP-B, CENP-C, etc.
Es importante resaltar que en os ELISA de tercera y cuarta generación, las placas están sensibilizadas con antígenos purificados o recombinantes. Estos últimos presentan un reducido número de epítopos12. Lo anterior implica que se debe ser muy cauto al interpretar los resultados del tamizado inicial y en la confirmación mediante otras técnicas más sensibles y específicas. Un ejemplo de lo anterior es cuando el suero de un paciente da un patrón centromérico mediante IFI en células HEp-2 y el ELISA que detecta actividad anti-CENP-B resulta negativo. Lo anterior se explica porque en las células HEp-2 están presentes todos los antígenos que componen los centrómeros (CENP-A, B, C, D, E y F) y en el ELISA el único antígeno que está presente es la proteína CENP-B.
La EIT, también conocida como Western blot, es una técnica que tiene múltiples usos; entre ellos está la detección de actividad contra componentes celulares. Es altamente sensible y específica, y su uso (debido a su costo, tiempo de preparación del ensayo, tiempo de desarrollo del ensayo y número de muestras que se pueden correr al mismo tiempo) está enfocado principalmente a investigación. Sin embargo, recientemente algunas compañías están comercializando equipos para uso en laboratorios de diagnóstico. La detección de ANA mediante EIT permite identificar una gran cantidad de autoantígenos. Sin embargo, su interpretación no es sencilla. Resultados obtenidos en nuestro laboratorio muestran que existen autoanticuerpos que reconocen solo la forma nativa de las proteínas del centrómero en células HEp-2 y no las formas desnaturalizadas o modificadas obtenidas con frecuencia en la EIT. Lo anterior confirma que existen anticuerpos que reconocen epítopos conformacionales de los antígenos13,14.
Actualmente se están empleando otras técnicas para la detección de ANA11 como microinmunoensayos enzimáticos y técnicas luminométricas de detección múltiple (tecnología xMAP), entre otras. En las dos citadas, se tiene la ventaja de detectar múltiples antígenos en un solo ensayo. Sin embargo, se deben considerar también los puntos mencionados anteriormente: antígenos específicos purificados y/o recombinantes, sensibilidad, especificidad y modificación de la conformación nativa de las proteínas.
Patrones de ANA detectados mediante IFIA continuación se describen las características de los patrones que con mayor frecuencia se detectan por IFI en células HEp-2 en sueros de pacientes con enfermedades autoinmunes14–19.
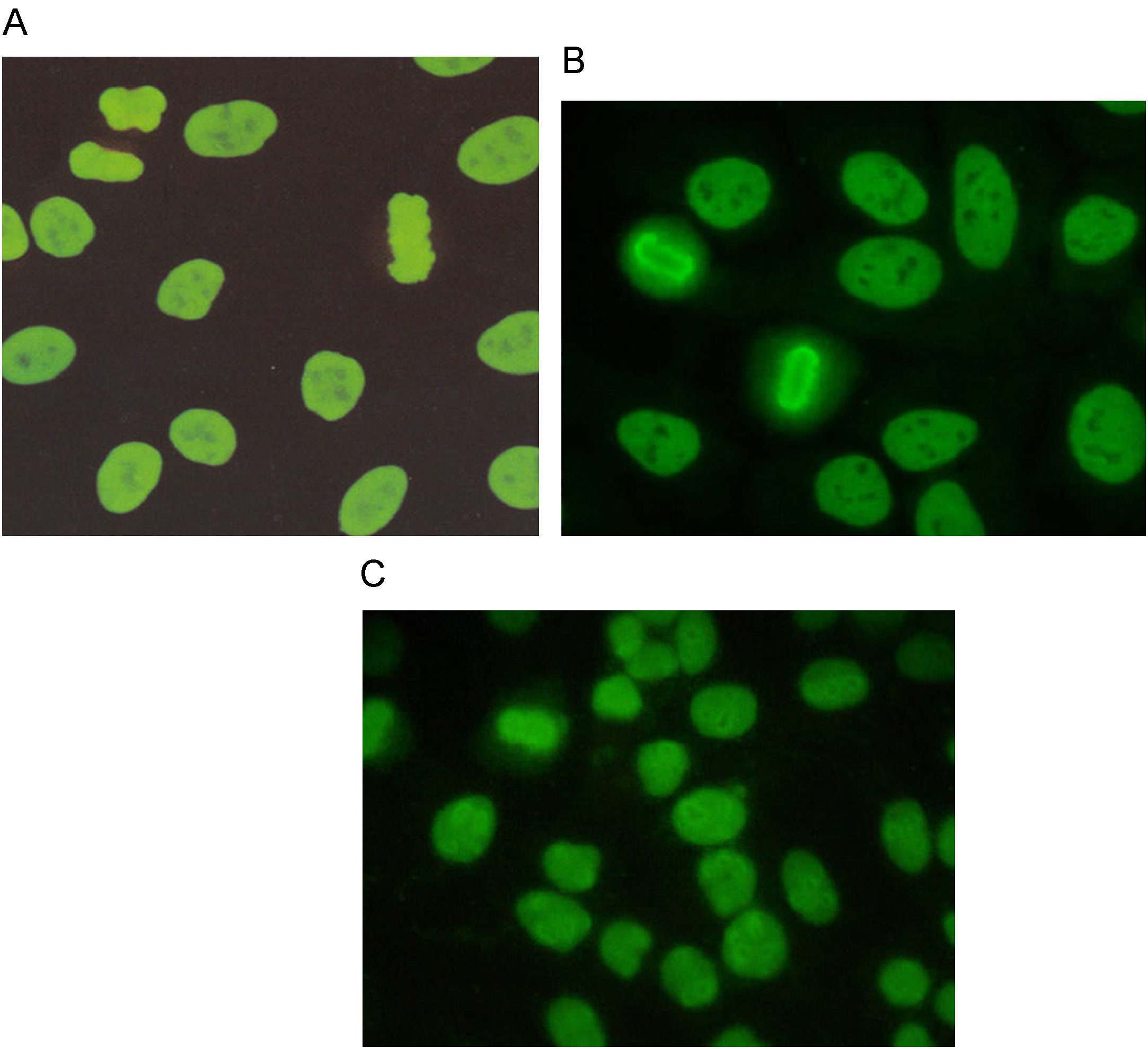
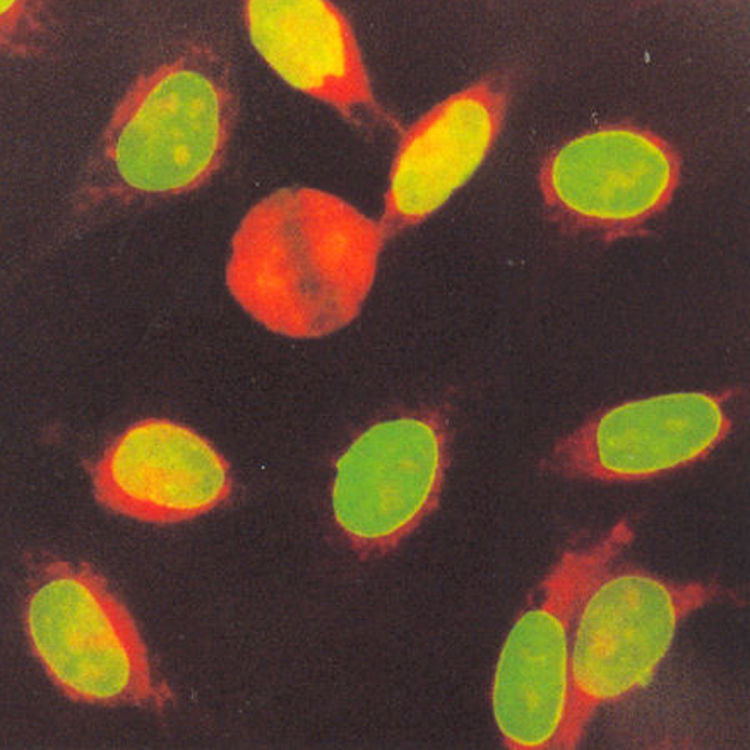
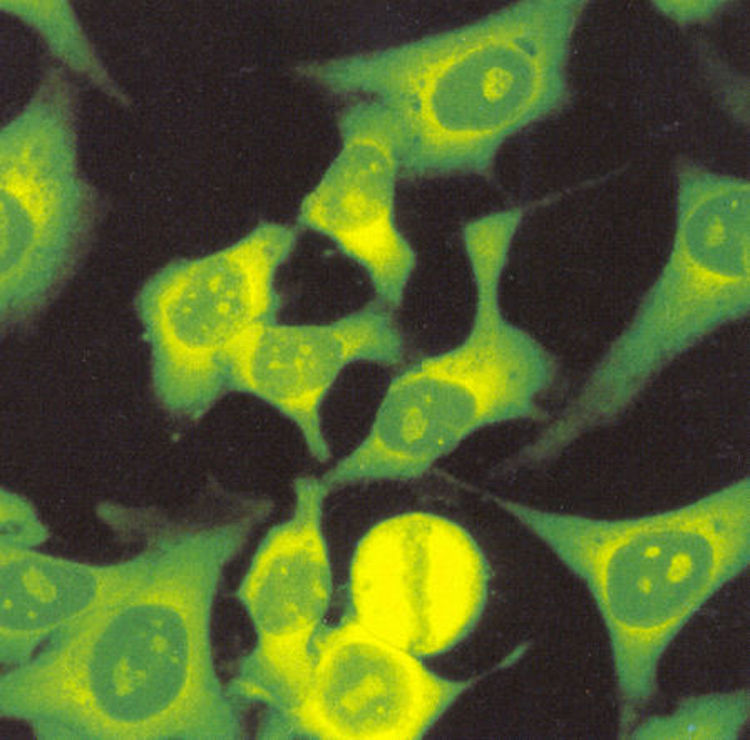
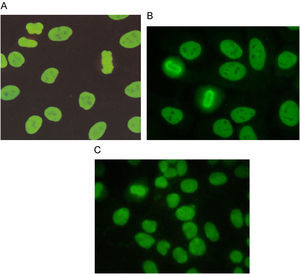
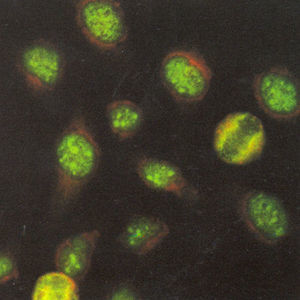
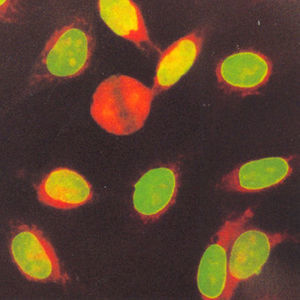
El patrón homogéneo se caracteriza por una tinción homogénea en el núcleo, cuya intensidad puede variar dependiendo de la concentración de los anticuerpos presentes en el suero. La placa de la cromatina en células en división puede estar teñida de manera compacta (fig. 1A), delineada (fig. 1B) o difusa (fig. 1C) y los nucleolos pueden o no estar teñidos20.
El patrón periférico se caracteriza por tinción regular alrededor del núcleo; el centro de este patrón muestra menos tinción (fig. 2). La placa de la cromatina se tiñe de forma delineada o compacta.
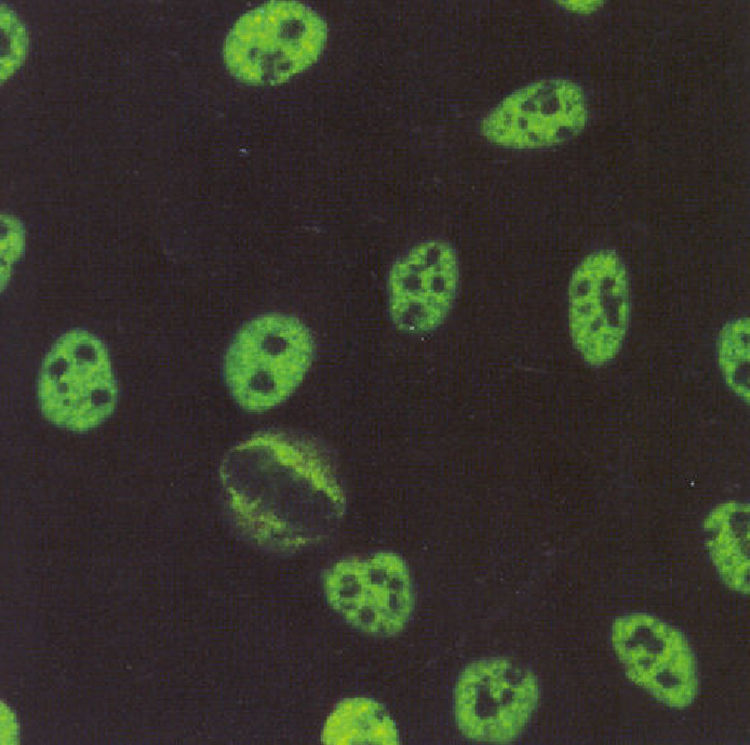
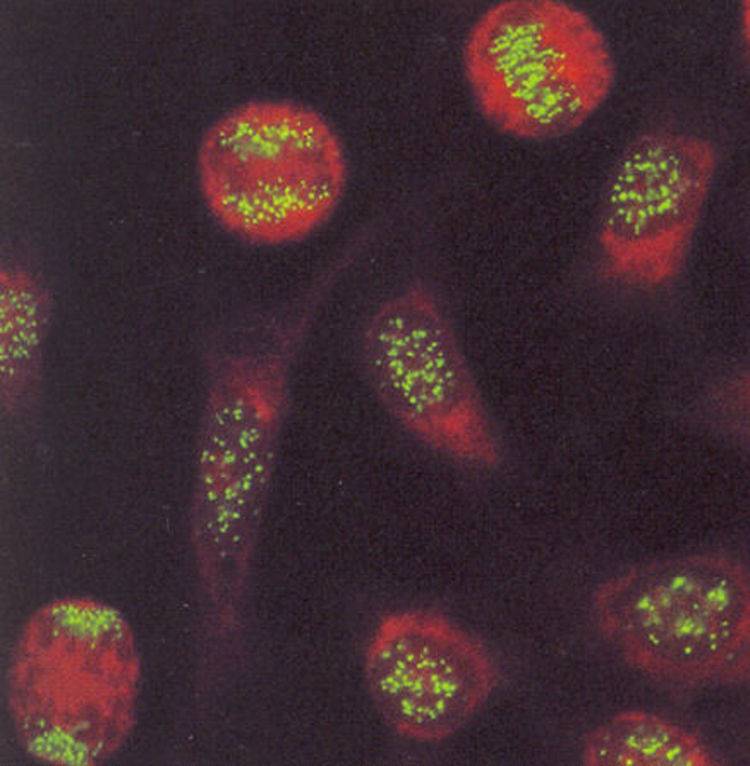
Los patrones de ANA que se observan con mayor frecuencia son los moteados, tanto fino como grueso. La descripción de estos patrones ha generado confusión, en el sentido de que varios autores definen el patrón moteado grueso como aquel en el que el núcleo se observa teñido con gránulos gruesos y el patrón moteado fino lo definen como núcleo teñido con gránulos finos. No hay problema cuando los gránulos son muy gruesos o muy finos, en puntos intermedios la interpretación es subjetiva. Nuestra propuesta es que el patrón moteado grueso se debe definir como tinción en el núcleo con gránulos finos o gruesos, los nucleolos están teñidos y la placa de la cromatina en células en división no se tiñe, es decir, no hay reconocimiento de los componentes de la cromatina (fig. 3).
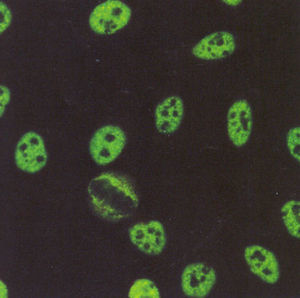
En cuanto al patrón moteado fino, este se caracteriza por tinción del núcleo con gránulos finos o gruesos, los nucleolos no se tiñen así como tampoco se tiñe la placa de la cromatina en células en división (fig. 4). Esta definición de los patrones moteado grueso y fino es más fácil de entender e interpretar. Además, tiene sustento en la diferencia de reactividades que muestran los sueros que dan los patrones14.
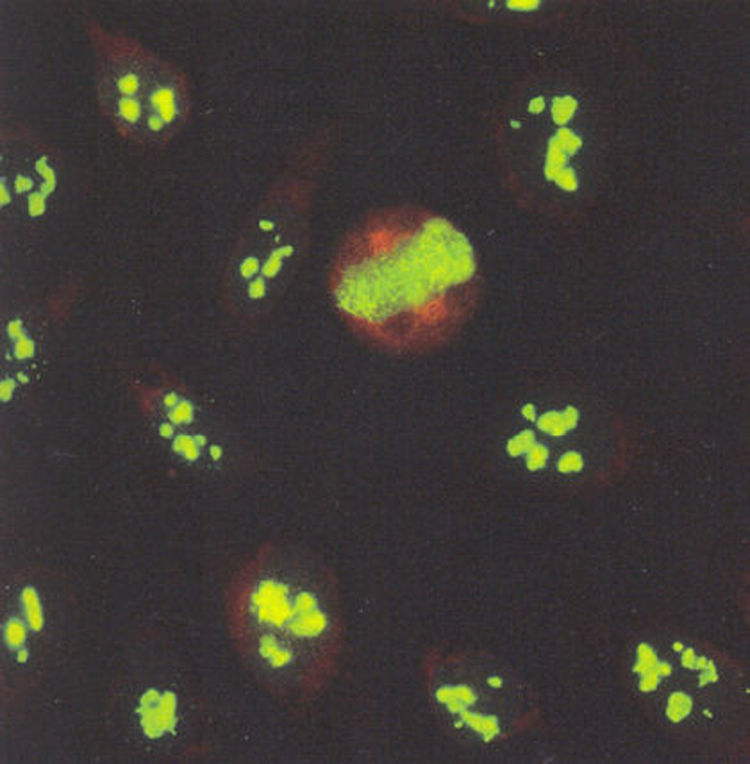
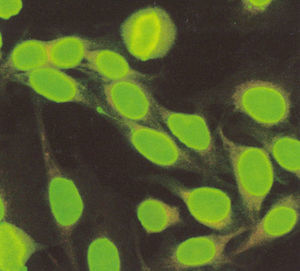
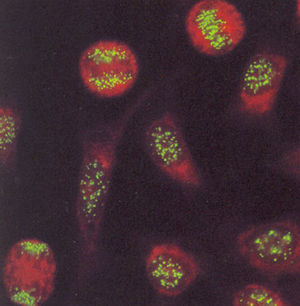
El patrón centromérico tiene como características que los núcleos se tiñen con puntos finos distribuidos de manera homogénea en el nucleoplasma de las células en interfase (fig. 5). La tinción en las células en división muestra un punteado fino localizado en la placa de la cromatina.
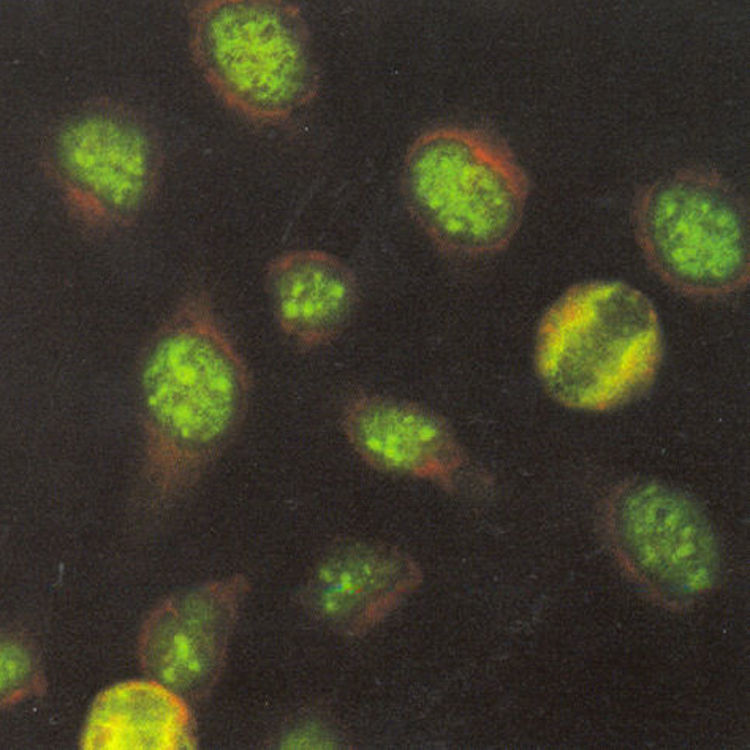
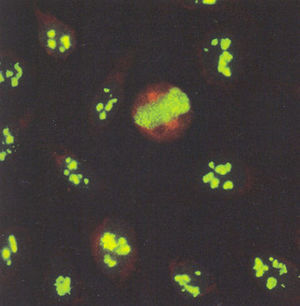
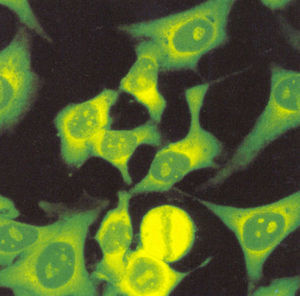
El patrón nucleolar tiene como característica una tinción intensa de los nucleolos (fig. 6). La placa de la cromatina en las células en división se tiñe de manera difusa debido a reactividad cruzada de los anticuerpos dirigidos contra los RNA nucleolares con el ADN de la cromatina.
El patrón de la lámina nuclear o laminar es aquel en el que se observa tinción concentrada alrededor del núcleo y no se extiende hacia el citoplasma (fig. 7). A diferencia del patrón periférico, la placa de la cromatina en las células en división es negativa.
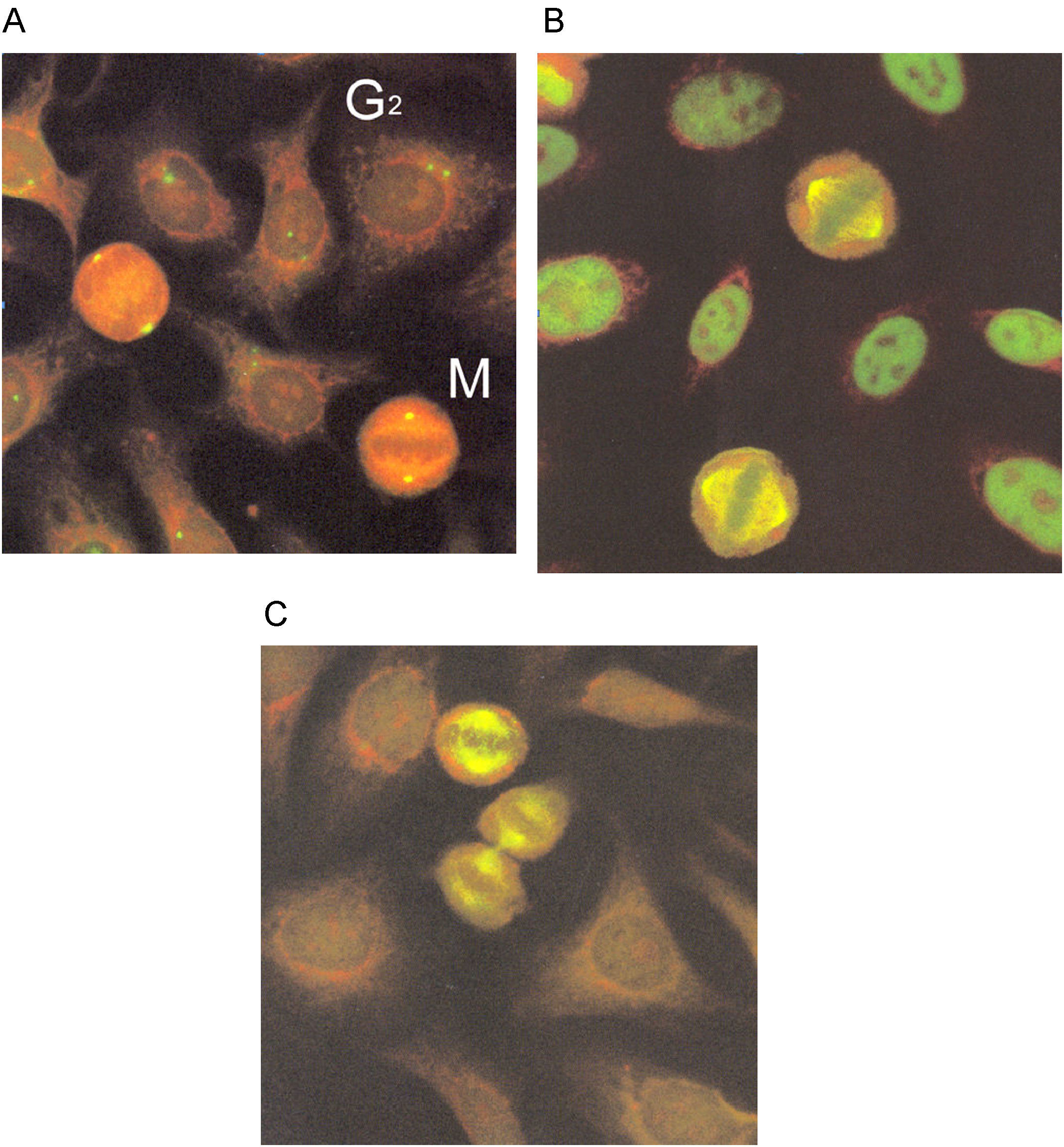
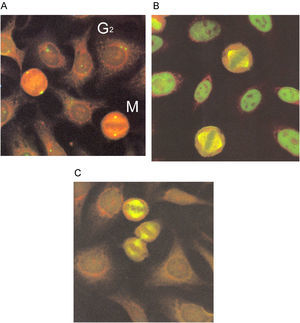
El patrón centriolar se identifica por la tinción intensa de los centriolos en células en división. Las estructuras teñidas se pueden identificar desde la fase G2, donde se ven dos puntos muy juntos, y en metafase, donde se localizan en los polos de la célula (fig. 8A). Cuando se tiñen los centriolos, los filamentos del huso acromático y las células en interfase tienen un patrón moteado fino. El patrón se define como NuMA-1(del inglés, nuclear mitotic apparatus) (fig. 8B). La tinción de los centriolos y del huso mitótico sin tinción del nucleoplasma en células en interfase se define como NuMA-2 (fig. 8C).
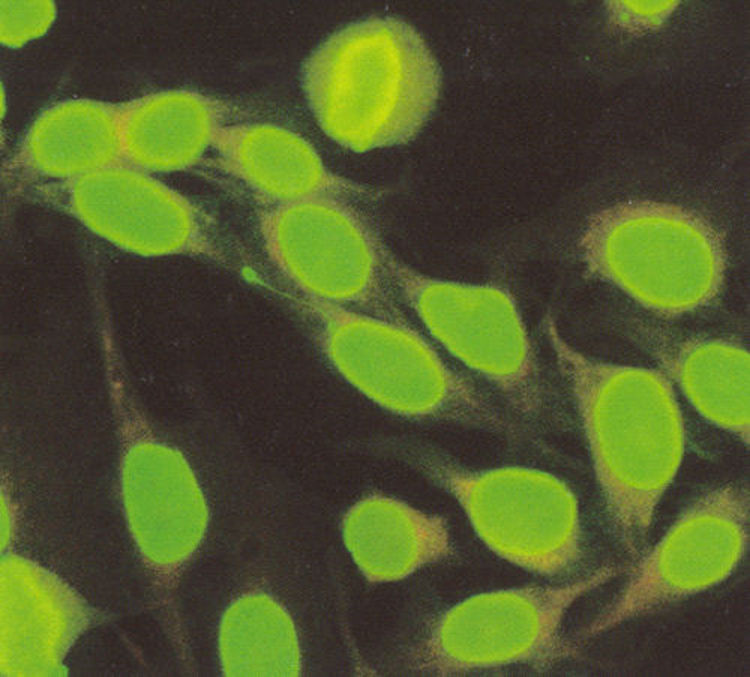
En relación a los patrones citoplásmicos identificados en células HEp-2, se describen a continuación los más frecuentes. El patrón citoplásmico se define como tinción homogénea que cubre todo el citoplasma (fig. 9). El patrón mitocondrial se caracteriza por una tinción granular en hileras punteadas que rodean al núcleo y se extienden hacia el citoplasma sin cubrirlo por completo.
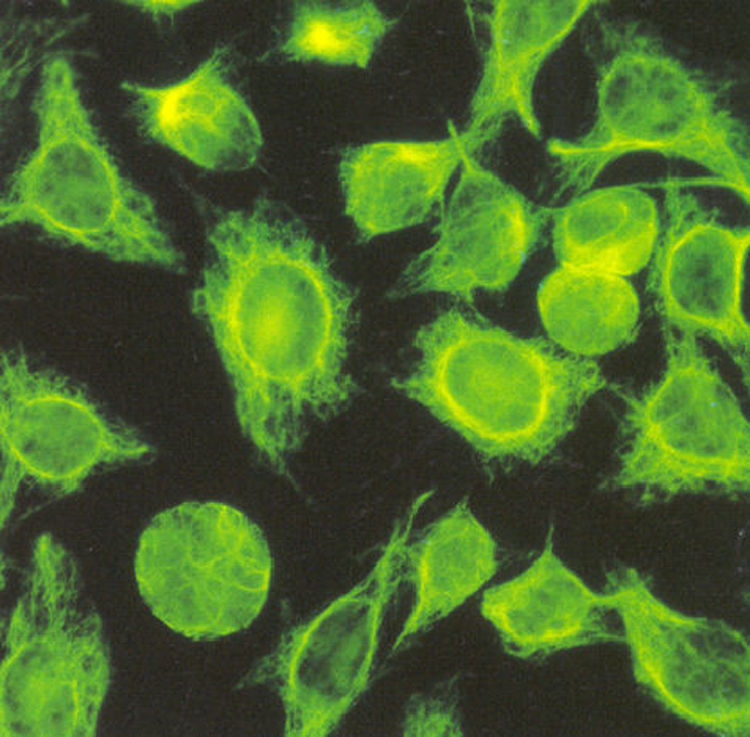
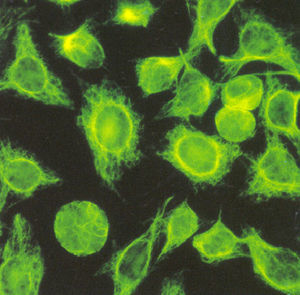
El reconocimiento de los componentes del citoesqueleto (microtúbulos, microfilamentos y filamentos intermedios) da un patrón citoplásmico que se conoce como patrón de filamentos intermedios o de músculo liso y se caracteriza por tinción en forma de hilos en el citoplasma21 (fig. 10). Un patrón de filamentos intermedios con título mayor a 1:160, de acuerdo a los valores de referencia previamente reportados en mestizos mexicanos9, se debe interpretar como un resultado positivo para anticuerpos antimúsculo liso.
Se han reportado otros patrones de ANA (v. g. lisosomal, Na, PCNA, peroxisomas, etc.) que pueden ser identificados en células HEp-2, pero son poco frecuentes y su valor diagnóstico está en estudio.
Los patrones nucleares y citoplásmicos descritos anteriormente son patrones puros. Sin embargo, es importante resaltar que más del 90% de los ANA detectados en células HEp-2 se presentan combinados con al menos 2 patrones diferentes nucleares y/o citoplásmicos.
Anticuerpos antinucleares y su relevancia clínicaLa relevancia clínica de los ANA en las enfermedades autoinmunes ha sido ampliamente estudiada. En la presente revisión se abordará de manera general. Los ANA detectados mediante IFI se encuentran con una alta frecuencia en enfermedades autoinmunes como: LEG, síndrome de Sjögren, enfermedad mixta del tejido conectivo, esclerosis sistémica y otras. Sin embargo, su relevancia clínica aún no ha sido bien establecida7.
Los ANA tienen una alta prevalencia, a títulos relativamente bajos, en población mexicana sana9,22. En niños y adultos mayores se detectan también, pero a títulos altos.
Los patrones cuya relevancia clínica muestran un mayor significado diagnóstico son el patrón homogéneo y el centromérico. Sin embargo, es importante confirmar el o los epítopes reconocidos por los autoanticuerpos presentes en el suero de los pacientes, como se mencionará posteriormente.
Uso y aplicación de guías para la detección de ANAEl patrón homogéneo en células HEp-2 sugiere la presencia de autoanticuerpos contra componentes de la cromatina. La cromatina está formada por ADN de cadena doble (ADNcd), histonas (H1, H2a, H2b, H3, H4), nucleosomas y ADN de cadena simple (ADNcs). En un trabajo reciente evaluamos la especificidad de dichos componentes en muestras de pacientes con LEG que dieron patrón homogéneo mediante IFI23. Los resultados mostraron reactividad contra ADNcd (60–80%), nucleosomas (95%), histonas (20–40%) y ADNcs (60–80%). Según nuestra experiencia (trabajos en preparación), es frecuente tener muestras de pacientes con LEG con títulos altos de anticuerpos contra un solo componente de la cromatina, por lo que sugerimos confirmar el patrón homogéneo mediante la detección de la reactividad contra: 1). ADNcd, 2). nucleosomas, 3). histonas y 4). ADNcs, teniendo en cuenta la enfermedad, evolución del paciente y la actividad. Si la reactividad contra los componentes de la cromatina es negativa, la muestra puede presentar actividad contra otros antígenos, el mejor estudiado es Scl-70.
Por otro lado, en estudios realizados en nuestro laboratorio, la caracterización inmunoquímica mediante EIT de los sueros que dan patrón moteado fino en la IFI, muestran reactividad contra SSA/Ro nativa y SSA/Ro de 52kDa en el 55% de las muestras y SSB/La en el 5%, seguida del reconocimiento contra la molécula RNP/Sm en el 10%. En cuanto al moteado grueso, la reactividad es principalmente contra RNP/Sm en el 65% de las muestras, el 36% reaccionó contra SSA/Ro recombinante de 52kDa, el 5% contra SSB/La y el 32% contra CENP-B14. En base a nuestros resultados y apoyados en reportes de otros grupos de investigación, sugerimos que la búsqueda de las especificidades de los autoanticuerpos se debe realizar de forma ordenada y racional, tomando como base el patrón y el título de ANA observado en células HEp-2.
Interpretación y búsqueda de especificidadCuando un paciente presenta manifestaciones clínicas de enfermedad autoinmune, la primera prueba que se debe solicitar es la detección de ANA por la técnica de IFI utilizando como sustrato células HEp-2, debido a su alta sensibilidad. Posteriormente, los diferentes patrones de ANA y su intensidad (expresada en dilución) deberán ser cuidadosamente evaluados para pasar al segundo nivel de caracterización mediante pruebas más sensibles y específicas como ELISA, radioinmunoanálisis, EIT, etc. para confirmar el antígeno reconocido por los ANA presentes en la muestra del paciente.
Si bien no se ha observado una clara asociación entre patrones y títulos de ANA con manifestaciones clínicas de las diferentes patologías autoinmunes, es clara la asociación entre patrones de ANA y el reconocimiento de antígenos específicos. Un ejemplo de esto es la asociación del patrón homogéneo o periférico a títulos altos (>1:5120) y el reconocimiento de ADNcd y/o nucleosomas. Los ANA no caracterizan a una enfermedad autoinmune en particular, pero grupos de autoanticuerpos se encuentran presentes con mayor frecuencia en enfermedades autoinmunes específicas. Apoyados en lo anterior, sugerimos que el uso y/o detección de autoanticuerpos se haga de manera ordenada, siguiendo las guías propuestas por el colegio americano de patólogos11,19,24–27. Con relación a cómo proceder para la solicitud de los ANA, existen más preguntas que respuestas. Si bien algunos grupos han mostrado la importancia de la aplicación de guías diseñadas para el buen uso de los ANA detectados mediante IFI utilizando células HEp-2 como sustrato, la mayoría muestra una clara tendencia hacia la disminución en la cantidad de estudios específicos solicitados a los pacientes empleando dichos esquemas o estrategias. En este sentido, Tampoia et al en 2007 publicaron un estudio realizado en 685 pacientes27, el cual reveló que la aplicación de guías para el diagnóstico utilizando la detección de ANA previamente validadas26 reduce de manera importante el número de inmunoensayos o pruebas de «segundo nivel» realizadas.
Es importante resaltar que cuando se tiene una determinación de ANA detectados mediante IFI negativa y el paciente tiene manifestaciones clínicas de enfermedad autoinmune, se puede pasar al segundo nivel de detección de autoanticuerpos por ELISA o EIT, debido a que se está aumentando la sensibilidad y especificidad para la detección de autoanticuerpos.
El trabajo de Tampoia muestra, además, una disminución importante en la cantidad de estudios de segundo nivel solicitados; estudios cuyo costo tiene un impacto importante en la economía de los pacientes. Por ello, enfatizamos la importancia de la aplicación adecuada de las guías y/o algoritmos desarrollados tomando en cuenta: 1. el patrón de ANA, 2. los puntos de corte establecidos en el grupo étnico de interés y 3. los puntos de corte ajustados o establecidos por patrón, lo cual proporcionará resultados que ayudan más al clínico para el diagnóstico y el seguimiento de los pacientes.
ConclusionesLos ANA son inmunoglobulinas que reconocen componentes autólogos tanto del núcleo como del citoplasma. No obstante, en su descripción original se llamaba así solo a los que estaban dirigidos contra componentes del núcleo.
La determinación de ANA mediante IFI es la principal prueba de tamizado inicial cuando se sospecha de enfermedades autoinmunes. Sin embargo, la presencia de ANA puede no ser necesariamente de origen autoinmune, es decir, pueden ser naturales o infecciosos.
La definición de los diferentes patrones de ANA determinados mediante IFI en células HEp-2 debe incluir el análisis de células en interfase y células en división, debido a que existen antígenos que solo son expresados en ciertas fases del ciclo celular.
Los ANA se deben interpretar en base a valores de referencia o puntos de corte establecidos por patrón de tinción y en el grupo étnico con el que se van a comparar.
La aplicación de guías o algoritmos que ayudan a la identificación del epítope o de los epítopes que reconocen los ANA tienen impacto no solo a nivel clínico, sino también económico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.