La artritis séptica por Staphylococcus aureus resistente a la meticilina (SARM) es una infección grave que ha aumentado su incidencia en los últimos 10años.
MétodosEstudio retrospectivo (1984-2011) en el que se realiza una descripción de las características clínicas y epidemiológicas de las artritis por SARM en adultos y se comparan después las infecciones en articulación nativa causadas por SARM vs Staphylococcus aureus sensible a la meticilina (SASM).
ResultadosSe incluyeron 14 infecciones por SARM (7 sobre articulación nativa, 5 protésicas y 2 bursas). Ningún caso fue poliarticular. Tenían importante comorbilidad, aunque ninguno con artritis reumatoide. Siete pacientes presentaron bacteriemia. Cuatro requirieron tratamiento quirúrgico. Seis fallecieron. Se compararon los 7 pacientes con infección de articulación nativa por SARM con los 17 casos causados por SASM. No se encontraron diferencias significativas en los factores de riesgo, excepto más neoplasias en el grupo SARM. La infección fue poliarticular en 7 casos (41%) del grupo SASM. La bacteriemia fue más frecuente en el grupo SARM (71,4 vs 58,8%). El antibiótico empírico resultó apropiado en el 28,6% de los casos SARM, frente al 100% de los casos SASM. Existió mayor tendencia a la mortalidad en las artritis por SARM (57,1% vs 17,6%, p=0,07).
ConclusiónLa artritis séptica por SARM es una entidad grave que acontece en pacientes ancianos y con gran comorbilidad. Es generalmente monoarticular, con hemocultivos positivos y mayor mortalidad que la artritis por SASM. En los pacientes de riesgo el tratamiento antibiótico empírico indicado es la vancomicina.
Septic arthritis due to methylcyllin resistant Staphylococcus aureus (MRSA) is a serious infection that has increased in incidence in the past 10years.
MethodsWe conducted a retrospective study (1984-2011) in which a description of the clinical and epidemiological characteristics of MRSA arthritis in adults was performed and then compared to native joint infections caused by MRSA vs. methylcyllin sensitive Staphylococcus aureus (MSSA).
ResultsFourteen MRSA infections were included (7 native joint, 5 prosthetic and 2 bursae). No case was polyarticular. There was significant comorbidity, although none was associated to rheumatoid arthritis. Seven patients had bacteremia. Four required surgical treatment. Six died. When comparing the 7 patients with native joint MRSA infection with the 17 cases caused by MSSA, no significant differences in risk factors were seen, except more malignancies in the MRSA group. The infection was polyarticular in 7 cases (41%) of the MSSA group. Bacteremia was more frequent in the MRSA group (71.4 vs 58.8%). Empirical antibiotic was useful in 28.6% of MRSA cases versus 100% of MSSA cases. There was a greater tendency to associated mortality in MRSA arthritis (57.1% vs 17.6%, P=.07).
ConclusionsMRSA septic arthritis is a serious condition that occurs in the elderly and patients with high comorbidity. It is usually monoarticular, with positive blood cultures and higher mortality than MSSA arthritis. In patients at risk, vancomycin empiric antibiotic therapy is indicated.
La artritis séptica es una artritis infecciosa producida por la colonización de un microorganismo piógeno en la cavidad articular. La rápida destrucción articular que produce condiciona el deterioro de la función articular y una notable morbimortalidad, que obligan a considerarla una verdadera urgencia médica.
Se calcula que la incidencia en Europa es de 4-10 casos por 100.000 pacientes y año1-3. Tiene lugar en pacientes con factores de riesgo clásicos para infección4: longevidad (edad >80años; OR=3,5), diabetes mellitus (OR=3,3), hemodiálisis, uso de drogas por vía parenteral, y tratamiento con glucocorticoides y fármacos inmunosupresores. Pero además se han descrito factores de riesgo específicos: la presencia de úlceras cutáneas (OR=27,2), la colocación de prótesis articulares (OR=15), así como la práctica previa de otras técnicas invasivas para la articulación. Se calcula que se infectan 4 de cada 10.000 infiltraciones locales con glucocorticoides y unas 14 de cada 10.000 artroscopias. Predispone a la infección la existencia de patología articular previa, particularmente la artritis reumatoide (AR), pero también otras artropatías inflamatorias y, en menor grado, la artrosis2,5,6. Algunos datos recientes6 sugieren un riesgo mayor de artritis séptica en pacientes tratados con antagonistas del factor de necrosis tumoral α en comparación a los tratados con fármacos modificadores de enfermedad (FARME).
La artritis séptica tiene una mortalidad del 11% cuando la afectación es monoarticular y de hasta el 50% en los pacientes con AR e infección poliarticular2,7.
En las últimas décadas Staphylococcus aureus es el germen responsable del 40-50% de los casos de artritis séptica, y en los últimos años entre un 6-22% de ellas corresponden a Staphylococcus aureus resistente a la meticilina (SARM)2,3,8,9. El primer aislamiento de SARM tuvo lugar en Reino Unido en 196110. Hasta la década de los setenta las infecciones por SARM en Europa se limitaban a brotes puntuales intrahospitalarios, inicialmente en unidades de cuidados intensivos y posteriormente en salas de ingreso convencional. Desde finales de los ochenta su frecuencia ha aumentado gradualmente, hasta que recientemente se han comunicado casos de infección por SARM adquiridos en la comunidad, por lo que actualmente es un verdadero problema epidemiológico11.
A pesar de todas estas implicaciones, la información sobre la epidemiología de la artritis séptica por SARM es limitada. La mayor parte procede de estudios retrospectivos de cohortes, que incluyen poblaciones heterogéneas (niños, portadores de prótesis y articulación nativa, diferentes gérmenes causales) y en los que la definición de caso no siempre comprende el aislamiento del microorganismo en el líquido sinovial y/o hemocultivos.
El objetivo de este estudio es describir las características clínicas y el desenlace de las artritis sépticas por SARM en adultos y compararlas con las causadas por Staphylococcus aureus sensible a la meticilina (SASM).
Material y métodosEstudio retrospectivo llevado a cabo en el Hospital Universitario Germans Trias i Pujol, con una población de referencia de 800.000 habitantes. Hospital de tercer nivel situado en el área metropolitana de Barcelona. Se revisaron las artritis sépticas en articulaciones periféricas recogidas entre 1984 y 2011. Los criterios de inclusión fueron: edad mayor de 18años y tener un cultivo de líquido sinovial positivo para SARM durante ese período.
Para la parte descriptiva se incluyeron las infecciones por SARM sobre articulación periférica tanto nativa como protésica. Posteriormente se realizó un subanálisis de los pacientes con infección por SARM de articulación nativa para compararlos con las producidas por SASM que tuvieron lugar durante el mismo período. Para el análisis estadístico se realizaron test no paramétricos, test de Fisher y χ2. Se escogió un nivel de significación de p<0,05.
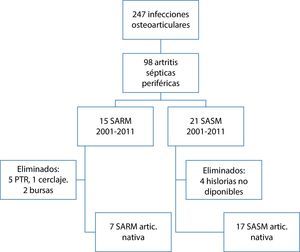
ResultadosEn el período 1984-2011 se registraron en Reumatología 247 infecciones osteoarticulares, 98 de las cuales correspondían a artritis periférica en adultos (fig. 1).
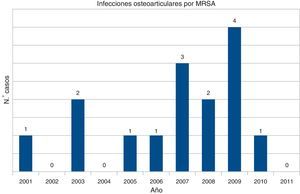
A partir de los registros microbiológicos de nuestro centro se identificaron 14 casos con SARM aislado en líquido sinovial. El primer aislamiento se hizo en el año 2001 (fig. 2). Siete eran artritis séptica sobre articulación nativa, 5 sobre articulación protésica y 2 eran bursitis. Se trataba de 8 hombres y 6 mujeres, con una edad media de 70años (intervalo 35-88años).
Las características demográficas y clínicas de los pacientes pueden verse en la tabla 1. Trece de los 14 pacientes (92,8%) tenían comorbilidad significativa: 11 (78,5%) hipertensión arterial (HTA), 4 (28,6%) cardiopatía isquémica, 3 (21,4%) diabetes mellitus, 3 (21,4%) cirrosis hepática, 2 (14,3%) una neoplasia sólida, 2 (14,3%) una hemopatía (síndrome mielodisplásico y mieloma), uno (7,1%) enfermedad pulmonar obstructiva crónica (EPOC) y un paciente (7,1%) en hemodiálisis. No se observaron como factores predisponentes la presencia de AR, artrocentesis, infiltraciones locales recientes o traumatismos. Solo se pudo confirmar ingreso hospitalario previo (12meses) en 4 casos.
Características de los pacientes con artritis séptica por SARM
| Paciente | Edad | Sexo | Localización | Puerta de entrada | Comorbilidad | Evolución |
|---|---|---|---|---|---|---|
| 1 | 63 | H | Rodilla | PTR | HTA, neovesical | Shock séptico, IRA |
| 2 | 85 | M | Rodilla | Cerclaje rótula | HTA, asma, taquiarritmia | Buena |
| 3 | 73 | M | Rodilla | PTR | Cirrosis hepática | Shock séptico, DAE, muerte |
| 4 | 76 | H | Codo | Hematógena | HTA, DM2, cirrosis hepática, neoplasia de páncreas | Shock séptico, DAE, muerte |
| 5 | 82 | H | Rodilla | Desconocida | HTA, cardiopatía isquémica, síndrome mielodisplásico, neoplasia vesical, cirrosis hepática | Muerte |
| 6 | 88 | M | Rodilla | PTR | HTA, DM2, dislipidemia, insuficiencia venosa | Buena |
| 7 | 47 | H | Tobillo | Mal perforante plantar | HTA, DM2, dislipidemia, obesidad, miocardiopatía dilatada, | Shock séptico, gota, anemia, vasculitis leucocitoclástica, síndrome nefrótico |
| 8 | 80 | M | Rodilla | Desconocida | HTA, dislipidemia, fractura Colles | IAM, gota |
| 9 | 77 | H | 1.ª MTCF | Hematógena | HTA, cardiopatís isquémica e hipertensiva, valvulopatía mitro-aórtica, EPOC, vasculopatía SNC, epilepsia, demencia, amaurosis derecha | Muerte |
| 10 | 74 | H | Rodilla | PTR | HTA | Buena |
| 11 | 35 | H | Bursa prerrotulina | Celulitis | Buena | |
| 12 | 54 | H | Bursa olecraneana | Celulitis | HTA, DM2, HTP, insuficiencia venosa+úlceras flebostáticas | Muerte |
| 13 | 85 | M | Rodilla | PTR | Insuficiencia venosa + úlceras flebostáticas | Buena |
| 14 | 74 | M | Rodilla | Hematógena (endocarditis) | HTA, cardiopatía isquémica, mieloma múltiple, IRC en hemodiálisis | Muerte |
DAE: descompensación ascítico edematosa; DM2: diabetes mellitus tipo 2; EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión arterial; HTP: hipertensión pulmonar; IAM: infarto agudo de miocardio; IRA: insuficiencia renal aguda; IRC: insuficiencia renal crónica; MTCF: metacarpofalángica; PTR: prótesis total de rodilla; SARM: Staphylococcus aureus resistente a la meticilina; SNC: sistema nervioso central; UDVP: usuario de drogas por vía parenteral; VHC: virus de la hepatitis C.
La artritis séptica se localizó en la rodilla en 9 casos (64,3%). Cinco (35,7%) de ellas acontecieron sobre articulación protésica, mientras que una paciente era portadora de un cerclaje en la rótula por una fractura traumática antigua. Hubo una artritis infecciosa de codo, una de tobillo y otra sobre una articulación metacarpofalángica. Dos enfermos tuvieron una bursitis (olecraneana y prerrotuliana). No hubo ningún caso de artritis séptica politópica por SARM.
Respecto a la puerta de entrada, en los 5 casos de infección sobre rodilla protésica se consideró esta la puerta de entrada, en 3 casos fue la vía hematógena, en 3 una infección cutánea y en otros 3 fue desconocida.
Siete de los 14 pacientes (50%) presentaron bacteriemia por SARM: 4 de las 7 (57,1%) infecciones en articulación nativa y 3 de las 5 (60%) infecciones protésicas. Solo 8 (57,4%) tuvieron fiebre en el momento de presentación. La velocidad de sedimentación media fue de 85mm la primera hora (rango 28-107) y la proteínaC reactiva de 193mg/l (rango 28-480). La cifra media de leucocitos en sangre fue de 12,9×109/mm3 (5,50-27,20). La celularidad del líquido articular fue de 40.132 leucocitos/mm3 (250-133.330), con una glucosa media de 40,2mg/dl (5,4-203).
Todos los pacientes recibieron tratamiento con vancomicina (1g cada 12h por vía intravenosa) a partir de la confirmación microbiológica. La duración media del tratamiento antibiótico fue de 30días (intervalo 3-56). Cuatro (28,7%) pacientes requirieron intervención quirúrgica: desbridamiento articular en 2 casos, recambio de prótesis de rodilla en otro y retirada del cerclaje rotuliano en el cuarto. La duración media del ingreso en el hospital fue de 26días (intervalo 3-55). No existieron diferencias significativas entre los pacientes que fallecieron durante el ingreso y los que no.
Seis (42,8%) pacientes fallecieron durante el ingreso. Cuatro pacientes presentaron shock séptico y 2 shock hemodinámico por su patología concomitante. Un paciente presentó un infarto agudo de miocardio y otro, insuficiencia renal aguda.
En un segundo subanálisis se compararon los 7 pacientes con artritis séptica por SARM sobre articulación nativa periférica con los 17 con cultivo de líquido sinovial positivo para SASM que tuvieron lugar en el mismo período de tiempo (2001-2011) (fig. 1 y tabla 2).
Comparación entre las características clínicas y epidemiológicas de las artritis por SARM y SASM
| SARM | SASM | p | |
|---|---|---|---|
| n | 7 | 17 | |
| H/M | 4H/3M | 13H/4M | 0,374 |
| Edad media (años) | 77 (47-85) | 66 (30-82) | 0,023 |
| Localización | |||
| Rodilla | 4 (57,14%) | 10 (58,82%) | 0,767 |
| Hombro | 0 | 4 (23,53%) | 0,494 |
| Tobillo | 1 (14,28%) | 4(23,53%) | 1 |
| Carpo | 0 | 2 (11,76%) | 0,53 |
| Codo | 1 (14,28%) | 3 (17,65%) | 0,659 |
| ACV | 0 | 2 (11,76%) | 1 |
| ECV | 0 | 1 | 1 |
| Discitis | 0 | 1 | 1 |
| Otras | 1 | 1 | 1 |
| Bursas | 0 | 2 | |
| Poliarticular | 0 | 7 (41,18%) | 0,13 |
| DM | 2 (28,57%) | 5 (29,41%) | 1 |
| IRC | 1 (14,28%) | 4 (23,53%) | 1 |
| Hemodiálisis | 1 (14,28%) | 2 (11,76%) | 1 |
| Enolismo | 0 | 5 (29,41%) | 0,272 |
| Cirrosis | 2 (28,57%) | 3 (17,65%) | 0,608 |
| Neoplasia | 3 (42,86%) | 2 (11,76%) | 0,013 |
| Neutropenia | 0 | 0 | |
| ADVP | 0 | 0 | |
| SIDA | 0 | 0 | |
| Corticoides sistémicos | 0 | 2 (11,76%) | 0,515 |
| Inmunosupresión | 0 | 0 | |
| Artritis reumatoide | 0 | 0 | |
| Otras artritis | 2 | 8 | 0,825 |
| Artrocentesis + infiltración | 0 | 2 (11,76%) | 1 |
| Artrocentesis sin infiltración | 0 | 2 (11,76%) | 1 |
| Artroscopia | 0 | 1 (5,88%) | 1 |
| Puerta de entrada | 0,247 | ||
| Desconocida | 3 (42,86%) | 4 (23,53%) | |
| Hematógena | 3 (42,86%) | 3 (17,65%) | |
| Cutánea | 1 (14,28%) | 8 (47,06%) | |
| Procedimiento invasivo sobre articulación | 0 | 2 (11,76%) | |
| Fiebre | 4 (57,14%) | 9 (52,54%) | 1 |
| VSG (mm 1.ahora) | 97 (29-102) | 95 (20-109) | 1 |
| PCR (mg/l) | 174 (28-480) | 259 (8-537) | 0,608 |
| Leucocitos en plasma (×109/mm3) | 11,6 (7-27,5) | 14,09 (4,1-34) | 1 |
| Líquido articular | |||
| Leucocitos (×109/mm3) | 22,5 (4,7-62,5) | 48,54 (14,5-120,00) | 0,266 |
| Glucosa (mg/dl) | 12 (5-203) | 59 (44-99) | |
| Cristales | 3 (42,86%) | 3 (17,65%) | 0,51 |
| Hemocultivos | 5 (71,43%) | 10 (58,82%) | 0,001 |
| N.° días desde inicio clínica-diagnóstico | 12 (1-21) | 7 (1-52) | 0,341 |
| N.° días de ingreso | 33 (8-49) | 20 (7-82) | 0,361 |
| Antibiótico empírico adecuado | 2 (28,57%) | 17 (100%) | 0,003 |
| Tratamiento quirúrgico | 3 (42,86%) | 7 (41,18%) | 0,788 |
| Muerte | 4 (57,14%) | 3 (17,65%) | 0,071 |
ACV: articulación acromioclavicular; ADVP: adicto a drogas por vía parenteral; DM: diabetes mellitus; ECV: articulación esternoclavicular; H: hombre; IRC: insuficiencia renal crónica; M: mujer; PCR: proteínaC reactiva; SARM: Staphylococcus aureus resistente a la meticilina; SASM: Staphylococcus aureus sensible a la meticilina; SIDA: síndrome de inmunodeficiencia humana adquirida; VSG: velocidad de sedimentación globular.
No se encontraron diferencias en la distribución por género y edad de ambos grupos. Tampoco en la distribución articular, siendo la rodilla la articulación más frecuentemente afectada en ambos. Hubo 7 (41,1%) pacientes con afectación poliarticular en el grupo SASM, y ninguno en el grupo de artritis séptica por SARM (p=0,13).
No se encontraron diferencias entre los factores de riesgo clásicos descritos en la artritis séptica. No obstante, sí había un número significativamente mayor (p=0,013) de neoplasias entre los pacientes del grupo SARM (42,8%) respecto al grupo SASM (11,8%). No hubo casos de AR en ninguna de las 2 cohortes en el periodo de estudio. Ningún paciente del grupo SARM había sido sometido a procedimientos invasivos articulares recientemente, en tanto que a 2 pacientes del grupo SASM se les había practicado una infiltración local con corticoides, a 2 más una artrocentesis evacuadora y a otro una artroscopia. Al comparar las puertas de entrada de ambos grupos no hubo diferencias significativas (p=0,247).
No se encontraron diferencias entre ambos grupos en cuanto a la presencia de fiebre, aumento de reactantes de fase aguda, recuento leucocitario en sangre periférica, ni en el recuento celular y de glucosa en el líquido sinovial.
Los pacientes con artritis séptica por SARM mostraron más tendencia a presentar bacteriemia que los del grupo SASM (hemocultivos positivos en 71,4% vs 58,8%, p=0,001).
El tratamiento antibiótico empírico inicial fue apropiado en el 28,5% del grupo SARM frente al 100% del grupo SASM (p=0,003). La duración media del tratamiento antibiótico fue de 30días para el grupo SARM y 45 para el grupo SASM (p=0,608). La duración media de ingreso hospitalario fue de 33 y 20días respectivamente (p=0,361). El porcentaje de pacientes que necesitaron intervención quirúrgica fue similar (42,9% vs 41,2%).
Los pacientes con artritis séptica por SARM tuvieron más tendencia a sufrir complicaciones y mayor mortalidad (57,6% vs 17,6%) durante el ingreso que el grupo SASM, aunque sin alcanzar diferencias estadísticamente significativas (p=0,07).
DiscusiónEste estudio describe las características clínicas y epidemiológicas de las artritis sépticas por SARM acontecidas en los últimos 20años en un hospital universitario de Barcelona y las compara con las caudas por SASM.
Cabe señalar que el primer caso de artritis séptica por SARM aislado en nuestro centro se produjo en 2001, 40años después de la comunicación de las primeras infecciones por SARM en Europa10 y unos 20años después de los primeros casos en España11.
Aunque existen numerosos casos comunicados12-18, solo 2 trabajos publicados hasta el momento comparan directamente una cohorte de pacientes con artritis séptica de articulación periférica nativa causada por SARM con otra originada por SASM19,20. Es destacable que en ambos trabajos la incidencia global de artritis séptica, así como el porcentaje de la misma causada por SARM, es notablemente mayor que en nuestro centro. Entre los años 2000-2005 el grupo estadounidense registró 59 casos de artritis séptica (25% por SARM)19, y 58 casos el grupo británico (25,8% por SARM)20. Mientras que casi en el doble de tiempo (2001-2011) en nuestro hospital se registraron 37 artritis sépticas, 24 por Staphylococcus aureus, siendo 7 de ellas por SARM, lo que supone un 18,9% del total.
Las artritis infecciosas suelen acontecer en pacientes añosos y con importante comorbilidad. A diferencia de otros trabajos19,20, no se encontró asociación con los de factores de riesgo habituales para artritis séptica. Únicamente se observó mayor número de neoplasias del grupo SARM.
Otros autores resaltan que la presencia de una enfermedad reumática es un factor predisponente de vital importancia. Llama la atención que en nuestra serie no hubo ningún caso de infección por SARM ni por SASM en pacientes con AR. Una posible explicación es que en la última década se ha generalizado el tratamiento intensivo y precoz de la AR. Está demostrado que esta estrategia reduce a largo plazo la necesidad de glucocorticoides sistémicos y el daño estructural, así como la necesidad de prótesis. Además, en nuestro centro todas las punciones se practican con medidas de asepsia, y se aconseja retirar los tratamientos biológicos de 2-4semanas antes de una cirugía mayor programada. Por contra, sí hubo 8 casos de artritis cristalina coexistente con la infección. En el grupo SARM, 2 pacientes tenían presencia de cristales de urato monosódico y uno de pirofosfato cálcico en el mismo líquido donde se aisló Staphylococcus aureus. En el grupo SASM se visualizaron cristales de urato en 4 casos y de pirofosfato en otro. Además, un paciente con artritis por SASM tenía artropatía psoriásica previa.
Independientemente del germen causal, la rodilla fue la articulación más afectada. No observamos ningún caso con afectación poliarticular por SARM, en contraste con una revisión reciente que señaló un 23% de sujetos con afectación politópica15. Hubo más hemocultivos positivos en los casos de infección por SARM. Es conocida la mayor mortalidad de la bacteriemia por SARM que por SASM (OR=1,88; IC95%: 1,33-2,69; p<0,001)7. Su virulencia está ligada a la presencia del Sthaphylococcal chromosomal cassette mec (SCCmec), que contiene el gen mecA. Este gen está presente en la gran mayoría de las cepas SARM y codifica la proteína 2a-PBP (penicillin binding protein), una transpeptidasa que permite la síntesis continua de pared celular bacteriana en presencia de agentes betalactámicos21.
No se encontraron diferencias en la duración del tratamiento antibiótico, en el número de casos que requirieron tratamiento quirúrgico ni en el número de días de ingreso hospitalario entre ambos grupos de infección estafilocócica, resultados que son compartidos por otros autores20. Probablemente debido al bajo índice de sospecha inicial, el número de días de demora diagnóstica fue mayor en el grupo SARM (12 vs 7, p=0,34). También el antibiótico empírico resultó ser apropiado solo en el 28,6% de las artritis por SARM, mientras que el en las infecciones por SASM lo fue en el 100% de los casos. Este hecho plantea la necesidad de incluir la vancomicina en la pauta antibiótica inicial de la artritis séptica en pacientes con sospecha clínica. Hay que destacar que más de la mitad de los pacientes con artritis séptica por SARM tenían ingresos hospitalarios durante el año previo, si bien la colonización por SARM no estaba documentada en ninguno de ellos. Tampoco lo estaba en las series presentadas por otros autores.
La virulencia de este germen, junto con la fragilidad de los pacientes a los que afecta, hace que su mortalidad sea elevada, aunque probablemente debido a la n pequeña de nuestra serie, no resultó estadísticamente significativo; la mortalidad durante el ingreso de la infección por SARM fue mayor que la causada por SASM (57 y 17%, respectivamente) (p=0,071). Ambos datos son peores que los comunicados en las series anteriores. La mortalidad durante el ingreso en el grupo americano fue del 20% para los casos SARM y del 7% para los SASM19, mientras que el grupo inglés comunicó una mortalidad a los 6meses del 13% vs 5% (SARM vs SASM) relacionada con la sepsis20.
El presente trabajo tiene las limitaciones propias de haber sido hecho en un único hospital, además del diseño retrospectivo y el relativamente pequeño número de pacientes.
La artritis séptica por SARM es una infección potencialmente grave que ha aumentado su incidencia en la última década. Se debe sospechar en pacientes con exposición reciente o frecuente al medio hospitalario o sociosanitario, además de en aquellos con infección o colonización previa documentada por este microorganismo.
La inclusión de la vancomicina en la pauta antibiótica empírica inicial en estos casos podría conseguir una disminución de la mortalidad de la infección por este germen.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.