El síndrome de Sjögren primario (SSp) es una enfermedad autoinmune sistémica crónica, que cursa con destrucción del tejido glandular lagrimal y salival. Sus síntomas más frecuentes y tempranos son la sequedad oral y ocular. La sequedad oral dificulta que el paciente hable, deguste y mastique correctamente, lo que disminuye la calidad de vida del enfermo. Los signos y síntomas orales más frecuentes son la hiposialia con o sin xerostomía, la caries dental, las infecciones fúngicas, las lesiones orales traumáticas, la disfagia, la disgeusia y la inflamación de las glándulas salivales. Existen distintas estrategias terapéuticas en función de la gravedad de cada caso que aumentan la cantidad de saliva y disminuyen el número de caries e infecciones orales. Por ello, es de especial importancia establecer una relación cercana entre el dentista y el reumatólogo que permita hacer un diagnóstico temprano y correcto, fomentar las medidas dietéticas e higiénicas adecuadas, tratar y prevenir las posibles complicaciones orales.
Primary Sjögren's syndrome is a chronic systemic autoimmune disease that causes destruction of lacrimal and salivary glands. The most common and earliest symptoms are oral and ocular dryness. Dry mouth makes talking difficult, tasting and chewing properly, impairing quality of life of these patients. The most common oral signs and symptoms are hyposialia with or without xerostomia, tooth decay, fungal infections, traumatic oral lesions, dysphagia, dysgeusia, and inflammation of salivary glands. There are different therapeutic strategies, depending on the severity of each case, and the increase in the amount of saliva, to reduce the number of cavities and oral infections. It is particularly important to establish a close relationship between the dentist and the rheumatologist in order to make an early and correct diagnosis, promoting appropriate dietary and hygiene measures, as well as to treat and prevent potential oral complications.
El síndrome de Sjögren primario (SSp) es una enfermedad reumatológica autoinmune sistémica crónica caracterizada por la presencia de un infiltrado inflamatorio linfocitario a nivel de las glándulas salivales y lagrimales, lo que ocasiona una destrucción del tejido glandular. Los síntomas más frecuentes y tempranos de esta enfermedad son la sequedad ocular y oral, aunque pueden desarrollarse también manifestaciones extraglandulares musculoesqueléticas, pulmonares, gástricas, hematológicas, dermatológicas, renales y neurológicas1,2.
El SSp fue descrito por primera vez en 1933 por el doctor sueco Henrik Sjögren, que publicó 19 casos de mujeres que presentaban sequedad ocular y en su gran mayoría artritis reumatoide3. Existen 2 tipos de síndrome de Sjögren, el SSp, que aparece de forma aislada, y el secundario (SSs), que se encuentra en asociación con otras enfermedades autoinmunes como la artritis reumatoide y el lupus eritematoso sistémico2,4. La patogénesis del SSp se ha relacionado con factores inmunológicos, inflamatorios, genéticos, epigenéticos, ambientales, hormonales e infecciosos5.
La prevalencia del SSp varía del 0,5-4% de la población general adulta. Es más frecuente en mujeres que en hombres, con una proporción de 9:1, y suele presentarse entre la cuarta y la sexta décadas de la vida, aunque puede aparecer a cualquier edad2,4,6,7. Es una enfermedad ampliamente reportada en el mundo, aunque es más prevalente en la raza caucásica. Su pobreza sintomática, sobre todo en estadios iniciales, condiciona un importante retraso en el tiempo de diagnóstico y subregistro, con un tiempo medio transcurrido desde el inicio de los síntomas hasta el establecimiento del diagnóstico de 3 años y medio7.
Los criterios de clasificación del SSp incluyen manifestaciones clínicas y pruebas objetivas, relacionadas con el ojo y boca secos, alteraciones serológicas características (presencia de Anti-Ro/SSA y/o Anti-La/SSB), e histopatología compatible (sialoadenitis linfocítica focal, con un focus score≥1; un foco queda definido como un agregado de al menos 50 linfocitos en una superficie de 4mm2) de glándula salival menor8. En la actualidad los criterios de clasificación que con más frecuencia se emplean son los de consenso europeo-americanos de 2002 (tabla 1)9. Recientemente el colegio americano de reumatología y el grupo Sjögren's International Collaborative Clinical Alliance han elaborado unos criterios de clasificación nuevos (tabla 2)1,10.
Criterios diagnósticos del American-European Consensus Group para el diagnóstico del síndrome de Sjögren primario
| Síntomas oculares: respuesta positiva al menos a una de las siguientes preguntas:¿Tiene usted ojos secos diariamente de forma persistente y molesta desde hace al menos 3 meses?¿Tiene usted sensación de grava o arenilla en los ojos de forma recurrente?¿Utiliza usted lágrima artificial más de 3 veces al día? |
| Síntomas orales: respuesta positiva al menos a una de las siguientes preguntas:¿Tiene usted sensación de boca seca diariamente desde hace al menos 3 meses?¿Sufre hinchazón de las glándulas salivales de forma recurrente o persistente?¿Bebe frecuentemente líquidos para poder tragar la comida seca? |
| Signos oculares, que es una evidencia objetiva de afectación ocular por un resultado positivo de al menos uno de los siguientes test:Test de Schirmer I, realizado sin anestesia (<5mm en 5min)Marcador de rosa de Bengala u otro colorante ocular (>4 de acuerdo al sistema de puntuación de van Bijsterveld) |
| Histopatología de glándulas salivales menores (obtenida a través de mucosa de aspecto sano): sialoadenitis linfocítica focal, con un focus score≥1; un foco queda definido como un agregado de al menos 50 linfocitos en una superficie de 4 mm2 de glándula salival menor |
| Afectación de las glándulas salivales, evidencia objetiva de afectación de las glándulas salivales definido por un resultado positivo al menos a una de las siguientes pruebas diagnósticas:Flujo salival total no estimulado (<1,5ml en 15mins)Sialografía parotídea que muestre la presencia de sialectasias difusas (de patrón puntiforme, cavitario o destructivo), sin evidencia de obstrucción de los conductos mayores de acuerdo al sistema de evaluación de Rubin y HoltEscintigrafía salival que muestre una concentración reducida o una excreción retardada del contraste de acuerdo al método propuesto por Schall et al. |
| Autoanticuerpos: presencia en suero de los siguientes autoanticuerpos:Anticuerpos para antígenos Ro(SSA) o La(SSB), o ambos |
| Normas revisadas para la clasificación del SSp: en pacientes sin ninguna enfermedad potencial asociada SSp debe definirse como:La presencia de 4 de los 6 apartados anteriores para SSp, siempre que el apartado 4 (histopatología) y el 6 (serología) sean positivosLa presencia de 3 de los 4 criterios objetivos (por ejemplo, apartado 3, 4, 5 y 6)El procedimiento de clasificación en árbol representa un método alternativo válido para la clasificación, aunque debe ser correctamente usado en estudios clínico-epidemiológicos |
Criterios diagnósticos de la American College of Rheumatology y la Sjögren's International Collaborative Clinical Alliance para el SSp
| Según este grupo los pacientes con SS deben cumplir 2 de los siguientes 3 ítems:Tener presencia de anti-Ro/SSA y/o anti-La/SSB o presencia de factor reumatoide y ANA≥1:320.Queratoconjuntivitis seca con una puntuación de mancha ocular (staining score) 3 o más (siempre que el sujeto no use gotas para el glaucoma y no haya recibido cirugía corneal o cirugía estética para párpados en los 5 años anteriores)Biopsia a glándulas salivales menores que muestre sialoadenitis linfocitaria focal con un foco con calificación mayor de 1 por 4 mm2 de tejido glandular |
La mayoría de los pacientes con SSp suelen presentar en primer lugar sequedad oral y/o sequedad ocular. La sequedad oral dificulta al paciente poder hablar correctamente y degustar y masticar adecuadamente los alimentos. La boca seca es con frecuencia el primer síntoma que refieren estos enfermos, que necesitan masticar chicle o chupar caramelos constantemente para estimular su producción de saliva y se despiertan varias veces por la noche para beber gran cantidad de agua2,11. La sequedad oral, por lo tanto, influye de manera importante en la calidad de vida de los pacientes con SSp12–14.
El individuo con sequedad oral suele consultar en primer lugar a su médico de atención primaria que, en muchos casos, no dispone de medios para comprobar si la sequedad oral referida por el paciente es real (hiposialia) o es subjetiva (xerostomía). Establecer esta diferencia es fundamental, porque existe un gran número de individuos de edad avanzada, en su mayoría mujeres, que sufren síndrome de boca ardiente (SBA), cuadro complejo que cursa, entre otros síntomas, con sensación subjetiva de boca seca no objetivable en las pruebas complementarias. El SBA es un cuadro caracterizado por la presencia de sensación de quemazón en la mucosa oral, en ausencia de alteraciones analíticas o disminución de flujo salival. Aparece más frecuentemente en mujeres a partir de los 40 años. Su prevalencia varía del 0,7-7%, siendo mayor en mujeres posmenopáusicas, donde la prevalencia asciende al 12-18%. El SBA afecta frecuentemente a la punta y bordes laterales de la lengua, labios y paladar duro y blando. Los pacientes con SBA presentan además dolor, alteraciones del sabor y xerostomía15–17.
Es imprescindible descartar también otras posibles causas de boca seca como alteraciones de estímulos aferentes, alteraciones a nivel central, alteración de vías aferentes vegetativas, inflamación crónica de las glándulas salivales (de causa inmunológica y no inmunológica), uso de fármacos asociados a xerostomía18 (tabla 3), alteraciones psicológicas, consumo de tabaco y otras drogas, enfermedades sistémicas, tratamiento con radioterapia de cabeza y cuello y deshidratación4. Si el médico de atención primaria no encuentra ninguna causa modificable asociada a la xerostomía, el paciente debería derivarse al odontólogo para una valoración completa; si existe en la anamnesis o exploración algún dato que sugiera síndrome de Sjögren el enfermo debería derivarse además al reumatólogo.
Fármacos asociados a la presencia de xerostomía
| AnoréxicosAnsiolíticosAnticonvulsionantesAntidepresivos tricíclicosAntieméticosAntihistamínicosAntiparkinsonianosAntipsicóticosBroncodilatadoresDescongestionantesDiuréticosRelajantes muscularesAnalgésicos narcóticosSedantesAntihipertensivosAntiartríticos |
El odontólogo es, en otras ocasiones, el primer especialista al que acude el paciente con boca seca. Este deberá comprobar si el paciente sufre hiposialia realizando una historia clínica exhaustiva que debe incluir, entre otras herramientas, un cuestionario sobre boca seca que refleje cómo la xerostomía influye en la calidad de vida del enfermo12–14; en este se recogerán los síntomas referidos por el paciente y los fármacos que toma. Además deberá realizar una medición del flujo salival (sialometría)15 y una cuantificación del grado de severidad de la sequedad oral que percibe el paciente mediante una escala visual analógica7.
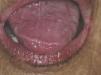
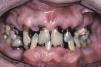
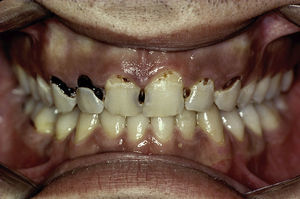
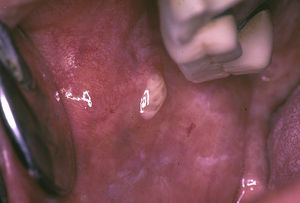
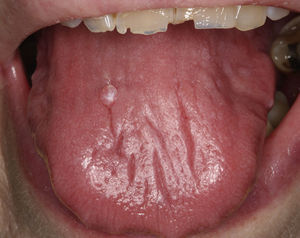
Algunos datos de la entrevista clínica nos orientan hacia la hiposialia: la dificultad para hablar, masticar y tragar, las alteraciones del gusto y la necesidad de beber continuamente agua (incluso por la noche). Del mismo modo, existen una serie de signos clínicos asociados a la hiposialia: la presencia de labios secos y fisurados y la lengua saburral, eritematosa y fisurada. Es común también encontrar una saliva de aspecto filante (fig. 1), queilitis angular, caries rampantes de localizaciones atípicas (figs. 2 y 3), desgaste oclusal, inflamación de las glándulas, mucositis y ulceraciones orales7. Si el odontólogo objetiva la existencia de hiposialia y no encuentra ninguna causa local debe, además, intentar aliviar los síntomas del paciente, derivarle con un informe detallado al médico de atención primaria para que este a su vez pueda derivarle al reumatólogo para estudio de la enfermedad sistémica.
La mayoría de las manifestaciones orales que presenta el paciente con SSp son el resultado de la hipofunción de las glándulas salivales16,17. A continuación describiremos de forma individual y detallada cada uno de los síntomas/signos orales que puede presentar el paciente con SSp (tabla 4).
Los 3 pares de glándulas salivales mayores (parótida, submandibular y sublingual) son las responsables de la producción del 90% de saliva total16. La producción de saliva en los adultos es normalmente de 0,4ml/min o de 1-1,5l/día4,17. La saliva es un proceso regulado. La mayor producción de saliva se desarrolla por la estimulación de procesos químicos y/o mecánicos, fundamentalmente la masticación y la comida, y entre comidas, la producción disminuye, llegando casi a cero durante el sueño4.
La saliva está compuesta fundamentalmente por agua, pero también contiene electrolitos, proteínas, glucoproteínas, enzimas como defensinas, proteasas, histatinas y lisozimas y otras moléculas que tienen propiedades biológicas y bioquímicas esenciales para mantener la fisiología del entorno bucal. La composición microbiológica de la saliva desempeña un papel fundamental; los pacientes con un flujo de saliva disminuido tienen alterada la composición de la placa bacteriana oral. El recuento total de bacterias en la saliva es similar entre pacientes con SSp y pacientes control, pero una disminución del flujo salival está relacionado con un incremento en la concentración de algunos microorganismos como Lactobacillus acidophilus, Streptococcus mutans y Candida albicans, que pueden ser el origen de un mayor índice de caries y candidiasis en estos pacientes. Al contrario, los microorganismos relacionados con la enfermedad periodontal no están aumentados en los pacientes con SSp, por lo que no se ha encontrado un aumento de periodontitis en estos enfermos4,17.
La saliva ayuda a hablar correctamente, lubrica la mucosa, tiene efecto buffer o tampón, remineraliza el esmalte, ayuda a saborear los alimentos y a formar el bolo alimenticio, inicia la digestión y tiene defensas que protegen de las infecciones17. Del mismo modo, forma una película sobre los tejidos duros y blandos de la cavidad bucal, que protege y mantiene la humedad, no solo de la boca sino también de la orofaringe y el esófago. Además, los componentes de la saliva amortiguan los cambios de pH en la cavidad oral y las proteínas salivales pueden ser absorbidas por las superficies dentarias formando una película orgánica donde la desmineralización y remineralización de los tejidos dentarios tienen lugar4. Por lo tanto, la disminución de saliva en el paciente con SSp tiene como consecuencia el desarrollo de caries, infecciones (candidiasis), sensación de quemazón oral, glosodinia (sensación de quemazón en la lengua), disfagia, disgeusia (alteración del gusto), dificultad para el habla correcta, lesiones orales, inflamación de las glándulas salivales y reflujo gastroesofágico6,17.
CariesLa caries se debe a una disolución de los tejidos duros dentarios por los ácidos producidos por la placa dental. Existen muchos factores asociados a un mayor índice de caries como la dieta (composición y frecuencia), higiene, educación y conocimiento del problema, expectativa de salud y las características de la saliva (cantidad, composición, función tampón, capacidad para aclarar los azúcares, concentración de flúor, etc.)4,17. Los pacientes con hiposialia, además, presentan una disminución de la secreción de IgA, un anticuerpo responsable de la inmunidad de la mucosa oral que previene de la caries dental17.
La fuerza del flujo salival y la acción de la lengua, las mejillas y los labios contra los dientes movilizan las bacterias de los dientes y de la cavidad oral. Los pacientes con SSp sufren empaquetamientos de comida en las caras vestibulares de los dientes debido a la pobre lubricación y a la falta de acción mecánica de la saliva19.
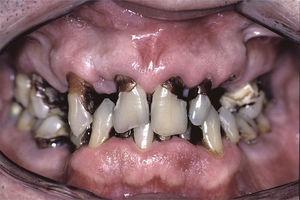
Estos enfermos tienen un mayor índice de caries y además estas aparecen en la superficie, cerca de la raíz del diente y en otras localizaciones atípicas como caras linguales, incisales y las cúspides de los dientes (figs. 2 y 3) 4,6,17. Además, estos pacientes regulan peor el pH salival, por ejemplo, tras la ingesta de dulces el pH disminuye, sin embargo en el individuo con SSp su saliva no lo tampona correctamente, de modo que aumenta su riesgo de caries4. El mayor número de caries hace que estos enfermos acudan con mayor frecuencia al dentista, pierdan mayor número de dientes y tengan mayor número de dientes restaurados en comparación con sujetos control20.
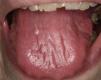
Infecciones fúngicasLos pacientes con SSp tienen una mayor prevalencia de infecciones fúngicas orales, fundamentalmente candidiasis6,21. Esta infección es debida a la disminución de saliva y de la capacidad tampón de la misma. La candidiasis oral puede presentarse clínicamente de diversas formas: lesiones eritematosas, candidiasis subprótesis (bajo las dentaduras) y candidiasis pseudomembranosa (fig. 4). A nivel extraoral puede dar lugar a la queilitis angular, que se caracteriza por lesiones secas, fisuradas y eritematosas en las comisuras labiales6,17. La candidiasis crónica eritematosa puede llegar a afectar a un 70-80% de los pacientes con SSp y principalmente afecta a la lengua, paladar y comisuras labiales7,17,22.
Otras lesiones de la mucosa oralLa saliva desempeña un papel fundamental en la lubrificación de la mucosa oral, previniendo el daño traumático o friccional. En pacientes con SSp pueden aparecer lesiones traumáticas después de tomar alimentos que son ásperos o rugosos, como tostadas o patatas fritas debido a la sequedad de la mucosa6,17.
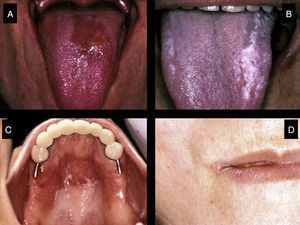
Los individuos con SSp pueden tener labios secos y fisurados y depapilación lingual. La lengua de los enfermos con hiposalivación tiene un aspecto de carne picada, seca, fisurada y pegajosa al tacto17,20,22. Asimismo, estos pacientes suelen tolerar mal sus prótesis parciales o completas, ya que la saliva forma una película que ayuda a la retención de estas y, al estar disminuida, su estabilidad es peor. A su vez, las prótesis suelen producir más lesiones traumáticas6,17,23.
Dolor orofacialEl síntoma que acompaña normalmente a la xerostomía del SSp es la quemazón oral o ardor oral, también llamado glosodinia. En estos pacientes esta sensación se debe fundamentalmente a la hiposialia, y puede agravarse si se presenta candidiasis o si el paciente toma fármacos que favorecen la disminución de saliva. Es importante realizar en estos casos un diagnóstico diferencial con otras situaciones que causan ardor oral como la anemia, alergias, lesiones orales y el SBA17,23.
En un 5-20% de los pacientes con SSp pueden aparecer alteraciones del sistema nervioso periférico que complican la sintomatología. La más frecuente a nivel craneal es la neuropatía trigeminal, que normalmente ocurre de forma bilateral y de forma progresiva y se caracteriza por adormecimiento o parestesia con o sin dolor. Las neuropatías sensoriales son más frecuentes que la disfunción motora, que si aparece puede afectar al nervio facial17,24.
Disfagia/disgeusiaDebido a la sequedad bucal el paciente con SSp tiene dificultad para masticar, hablar y tragar los alimentos. Para poder tragar los alimentos el paciente tendrá que tomar mayor cantidad de agua. Estos enfermos suelen también tolerar mal los alimentos muy sabrosos debido a la alteración del sentido del gusto6,17.
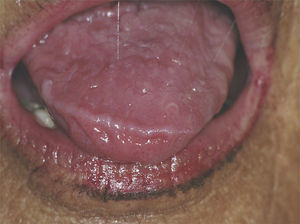
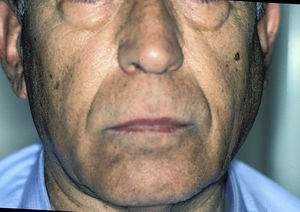
Inflamación de las glándulas salivalesEl aumento de tamaño de las glándulas salivales es característico del SSp (fig. 5). La glándula parótida suele afectarse en un 30-40% de estos enfermos. La inflamación de una única glándula puede deberse, entre otras, a una infección, sin embargo, si perdura en el tiempo obliga a descartar un linfoma17.
El aumento de tamaño bilateral de las glándulas parótidas puede aparecer en el 25-60% de los pacientes con SSp y puede ser agudo o crónico. El agudo puede ser bilateral o unilateral, suele cursar con dolor y suele deberse a la obstrucción de las glándulas salivales por tapón mucoso, que se forma cuando las células secretoras mucosas comienzan a formar la mayor parte de la cantidad de saliva. En ocasiones será necesario eliminar el moco con endoscopia y, en aquellos casos donde se desarrolle además una infección bacteriana, donde suele aparecer pus en el ostium del conducto de Stenon (fig. 6), añadiremos tratamiento antibiótico adecuado para la flora oral (cocos gram positivos)25.
La inflamación glandular puede afectar a las glándulas parótidas y/o glándulas submandibulares. El infiltrado inflamatorio es mixto, con células T y B y abundante secreción de citoquinas que promueven la quimiotaxis local, exacerbándose la inflamación glandular. En estos casos las glándulas son dolorosas a la palpación, pero no se expulsa pus por el conducto excretor25.
Reflujo gastroesofágicoEl reflujo gastroesofágico es frecuente en el paciente con SSp. Los síntomas más comunes son acidez o ardor de estómago y regurgitación. El reflujo puede además producir lesiones bucales, especialmente la erosión dental17.
Lesiones orales de etiología autoinmuneExisten en la literatura médica estudios que muestran cierta asociación entre el SSp y la presencia de lesiones orales de etiología autoinmune como el liquen plano, la estomatitis aftosa recurrente, el penfigoide de las mucosas y el pénfigo vulgar26.
ComplicacionesLas principales complicaciones a nivel bucofacial en el SSp son la pérdida de dientes, que dificulta la alimentación del paciente, y el desarrollo de linfoma.
Los pacientes con SSp debido a las caries pierden con frecuencia dientes. Estos pueden ser reemplazados mediante prótesis removibles o implantes dentales. Las dentaduras en estos enfermos, debido a la sequedad bucal, se retienen peor, causan irritación de la mucosa y molestias y son poco aceptadas. Existen dentaduras con reservorios para saliva artificial, pero la literatura científica al respecto muestra resultados contradictorios. Los estudios sobre el tratamiento con implantes dentales son escasos, la mayoría con pocos pacientes y casos clínicos, pero los resultados parecen ser prometedores. El tratamiento con implantes en pacientes con SSp puede recomendarse para rehabilitar a estos individuos, ya que la enfermedad no afecta a la salud ósea ni a la osteointegración. Sí deben tenerse en cuenta ciertos fármacos, como los corticoides o los bisfosfonatos, que pueden alterar el procedimiento, por lo que, antes de colocar el implante el dentista debe realizar una interconsulta al reumatólogo del paciente4,27,28.
Los pacientes con síndrome de Sjögren primario tienen un riesgo mayor de desarrollar linfoma que la población general, variable según la serie (SIR 2,52-48,1). Un 5-10% de los casos lo desarrollarán a lo largo de 10 años. La mayoría de los linfomas son de linfocitos B y, sin duda, el tipo más frecuente es el linfoma del tejido linfoide asociado a mucosas o MALT, aunque también se han descrito paraproteinemia, gammapatía de cadena ligera, linfoma T y linfoma de Hodking. El linfoma MALT suele ser de bajo grado, en el 70% de un estadio i o ii, de curso indolente, con baja masa tumoral, de localización nodal en el 15%, extranodal en el 46%, nodal y extranodal en el 39%; la LDH y b2-microglobulina suelen ser normales, en el 20% presenta más de una localización extranodal, puede afectar a los ganglios linfáticos regionales, y en el 7% aparecerá infiltración de médula ósea. Los síntomas más frecuentes son: tumefacción parotídea y ausencia de cortejo B (fiebre, pérdida de peso, diaforesis nocturna). La localización más frecuente son las glándulas salivales, especialmente la parótida; otras localizaciones descritas son estómago, nasofaringe, piel, hígado, riñón y pulmón. La transición a una linfoproliferación maligna se caracteriza por la aparición de ciertos parámetros de forma precoz: parotidomegalia, esplenomegalia, linfoadenopatía, vasculitis cutánea, hipocomplementemia, crioglobulinemia, anemia, linfopenia, linfopenia CD4+, neutropenia y antiRo/La. La detección de estos marcadores predictivos es crucial para el seguimiento clínico e intervención terapéutica29.
Estrategias terapéuticas en boca secaEstrategias para aumentar el flujo salivalEs fundamental para el individuo con boca seca intentar conseguir niveles adecuados de saliva para eliminar la sintomatología, evitar la aparición de caries e infecciones y facilitar que el paciente pueda hablar, comer y deglutir correctamente. Para ello, existen diferentes tratamientos que utilizaremos en función del grado de sequedad oral. Es imprescindible no crear al paciente falsas expectativas, ya que no es siempre posible satisfacer las necesidades del mismo. Sugerimos a continuación el uso de diferentes tratamientos en función de la gravedad de la hiposialia, bien mediante estimuladores salivales (locales o sistémicos), bien con sustitutos salivales (tabla 5):
- •
Estimuladores salivales locales: la producción salival puede estimularse mediante chicles sin azúcar, que aumentan el pH y la capacidad tampón, y los caramelos sin azúcar, sobre todo los de limón, que favorecen la producción de saliva al estimular las papilas gustativas4,6,11.
- •
También se han propuesto otras alternativas, mucho más complejas y costosas, como la estimulación vibro táctil salival, que estimula la capacidad secretora residual mediante la modulación del arco reflejo autónomo que regula la salivación; esta se lleva a cabo mediante dispositivos intraorales electroestimuladores. Actualmente la evidencia científica es insuficiente para determinar la efectividad de la electroestimulación en el tratamiento de la xerostomía o la hiposialia en pacientes con SSp7,30.
- •
Estimuladores salivales sistémicos: los fármacos salivales colinérgicos se utilizan para el tratamiento de la xerostomía y xeroftalmia. Entre ellos, el más estudiado y utilizado es la pilocarpina (en dosis de 5mg/6h antes de las comidas y antes de acostarse, con un máximo de 30mg/día), que no proporciona buenos resultados en todos los pacientes y presenta contraindicaciones y efectos secundarios que limitan su uso (tabla 6). Estos fármacos se han de utilizar en pacientes con glándula salival residual funcional. Los estudios muestran una mejoría de la sequedad oral con estos medicamentos hasta en el 60-70% de los enfermos7,11,31–37.
Tabla 6.Efectos secundarios y contraindicaciones de la pilocarpina
Efectos secundarios Sudoración profusa Nauseas-vómitos Sialorrea Lagrimeo Miosis Nistagmo Bradicardia/taquicardia/bloqueo AV/otras arritmias Vasodilatación/rubefacción Hipertensión Polaquiuria Agitación/convulsiones/temblores Broncoespasmo Dolor abdominal Estreñimiento Síndrome seudogripal Contraindicaciones Asma bronquial no controlada EPOC Enfermedad ocular en la que la provocación de miosis esté contraindicada (iritis, glaucoma de ángulo estrecho) Embarazo/lactancia Alergia al fármaco - •
Sustitutos salivales: existen gran variedad de productos para disminuir la sensación de boca seca en los pacientes con SSp. Todos ellos contienen sustancias con un componente acuoso suplementados con calcio, fosfato e iones fluorhídricos. Estos productos previenen la desmineralización y están disponibles en colutorio, gel, spray y en dispositivos intraorales. No existen estudios concluyentes acerca de su eficacia en la prevención de la caries dental4,37,38.
Estrategias terapeúticas para aumentar el flujo salival en función de la gravedad en el paciente con SSp
| Grado | Características | Recomendaciones terapéuticas |
|---|---|---|
| 1 | Molestias leves y esporádicas al comer alimentos secos o ásperosNo se observan signos de sequedad oralNivel de saliva no estimulada≥0,25ml/minNivel de saliva estimulada≥1ml/min | Educación y modificación alimentaciónEliminar, si es posible, medicación relacionada con xerostomíaEvitar uso de alcohol y tabacoHidratación |
| 2 | Molestias leves e intermitentes con o sin exposición a alimentosNo se observan signos de sequedad oralNivel de saliva no estimulada<0,25 y> 0,1 ml/minNivel de saliva estimulada<1 y>0,7ml/min | Añadir al grado 1:Uso de chicles sin azúcar y caramelos de limón sin azúcarUso de sustitutos salivales: gel y spray |
| 3 | Molestias frecuentes y constantes con o sin exposición a alimentosLimitación al comer, tragar y hablarSe observan signos de sequedad oralNivel de saliva no estimulada≤0,1ml/minNivel de saliva estimulada≤0,7ml/min | Añadir al grado 1 y 2:Uso saliva artificialSi no mejora con saliva artificial, uso de fármacos estimuladores sistémicos (previa biopsia de glándulas salivales para comprobar que existe cierta función salival) |
| 4 | Molestias permanentesGran limitación para comer, tragar y hablarSignos avanzados de sequedad oralNivel de saliva no estimulada≤0,05 ml/minNivel de saliva estimulada≤0,3 ml/min | Añadir al grado 1, 2 y 3:Valorar uso de dispositivos intraorales con saliva artificial |
En pacientes con SSp se debe evitar el uso de agentes irritantes como el alcohol y el tabaco, siendo esencial la higiene bucal. El uso de agua con bicarbonato sódico, té y soluciones salinas debe realizarse con precaución, ya que en cantidades excesivas eliminan las pequeñas cantidades de saliva mucosa de los tejidos orales, lo que puede incrementar la sensación de boca seca7.
Estrategias para evitar la aparición de cariesEs fundamental en el tratamiento de la caries evaluar el estado oral del paciente y los factores de riesgo que favorecen la aparición de nuevas caries. Es obligatorio que el enfermo con SSp se implique en el cuidado bucal, llevando a cabo una correcta higiene oral, controlando la dieta hipocariogénica y acudiendo a las visitas que su dentista considere oportunas. El reumatólogo y el dentista deben evaluar la historia médica y dental del paciente. Los factores a tener en cuenta son la dieta (ingesta y frecuencia de consumo de productos azucarados), el flujo de saliva, la actividad de caries (número de caries nuevas, por ejemplo, cada año), las medidas de higiene y el uso de productos específicos para evitar la caries (flúor), para poder modificar los hábitos inadecuados del paciente4,6.
La higiene oral depende de la habilidad de cada individuo. El odontólogo debe enseñar al paciente cómo realizar una correcta higiene bucal, ya que existen estudios que muestran cómo una cuidadosa higiene oral con pasta fluorada es efectiva para controlar la aparición y progresión de la caries. Sin embargo, el uso de flúor sin un buen control de placa no reporta beneficios en el control de la caries dental.
Respecto a la dieta, es necesario conocer la ingesta total de alimentos, aconsejando al paciente que apunte todos los alimentos y bebidas ingeridas durante una semana para poder luego indicarle las modificaciones a realizar. Una alta ingesta de productos azucarados produce un mayor número de caries; además, si los productos azucarados son ingeridos entre las comidas principales aumenta más el riesgo de sufrir caries dental. En estos pacientes se recomienda evitar además beber bebidas ricas en azúcar (sacarosa, maltosa y lactosa) y gasificadas4.
Los edulcorantes no calóricos (aspartamo, acesulfamo potásico, ciclamato y sacarina) no producen caries, ya que no son metabolizados a ácidos. Los alcoholes de azúcar como el sorbitol y el xilitol tienen bajo poder cariogénico. El sorbitol es fermentado por las bacterias orales, pero la producción de ácidos es baja. El xilitol no es fermentado por los estreptococos orales, por lo que no disminuye el pH salival y, además, parece tener un efecto bacteriostático4,6.
El control químico de la placa dental se utiliza para disminuir la adhesión y crecimiento de los microorganismos presentes en dicha placa. Estos productos están disponibles en spray, gel, barnices, chicles, pastas y colutorios. Los más utilizados son4:
- •
Clorhexidina: agente bacteriostático que inhibe algunas enzimas que interfieren con la acumulación microbiana. Si este producto se combina con flúor disminuye la progresión de la caries dental.
- •
Xilitol: no promueve la caries dental, disminuye el número de bacterias y parece inhibir la glucólisis. Este producto está presente en muchos productos para la higiene dental.
- •
Flúor: previene la caries dental. Su aplicación en la consulta dental y en casa es muy importante, junto con un control de la dieta y las medidas de higiene dental. Se encuentra en pastas, geles, barnices (normalmente aplicados en la consulta dental) y colutorios.
Además de estas 3 sustancias están en estudio nuevos productos. Los probióticos interfieren en la formación de la película dental, alteran el ecosistema de la placa dental y producen sustancias que inhiben el crecimiento bacteriano; en algunos casos también modulan o estimulan la respuesta inmunológica del paciente. A nivel odontológico estas sustancias se emplean en la prevención de la caries, enfermedad periodontal y la candidiasis oral, a pesar de que no existen resultados concluyentes al respecto. Las fosfoproteínas/fosfopéptidos sirven para estabilizar el calcio y el fosfato de los dientes. Estos están presentes en sustancias naturales como la saliva y la leche y existen estudios que muestran cómo inhiben la desmineralización y promueven la remineralización. Colutorios con estos componentes han sido utilizados en pacientes con SSp, mostrando baja eficacia para el control de la caries4.
Relación reumatólogo-odontólogoPara el correcto diagnóstico y control del paciente con SSp es fundamental que exista una estrecha relación entre el reumatólogo y el dentista. Cuando un paciente con xerostomía acude a la consulta dental el odontólogo deberá prestar especial atención a los signos de boca seca previamente descritos, descartar otras entidades (uso de medicamentos y enfermedades) y realizar una cuantificación de saliva estimulada y no estimulada. Si el paciente presenta ciertamente hiposialia (fig. 7) y no tiene otras enfermedades relacionadas con dicha entidad se deberá valorar la realización de una biopsia de glándulas salivales menores y derivar al paciente al reumatólogo para que este complete el estudio. El reumatólogo deberá derivar al odontólogo todo posible paciente con SSp, para que este realice una evaluación bucal completa y las pruebas complementarias necesarias.
El odontólogo establecerá las recomendaciones de higiene, dietéticas y terapéuticas orales en función de la gravedad del cuadro, así como el calendario de visitas a la clínica dental, que durante el primer año no deberían espaciarse más de 3 meses; de este modo se valora el riesgo de nuevas caries y la respuesta al tratamiento. Si el paciente tuviera una afectación grado 1 (tabla 5) y no presenta caries durante el primer año, las citas podrían espaciarse cada 6 meses. La cuantificación de la saliva estimulada y no estimulada debería realizarse al menos una vez al año y después de cambiar tratamientos, sobre todo si son de tipo sistémico. Así se obtiene una valoración objetiva del paciente.
Es fundamental una correcta y fluida comunicación entre el dentista y el reumatólogo. Conocer todos aquellos cambios observados en el enfermo y modificaciones terapéuticas permitirá a ambos profesionales reforzar aquellas conductas que mejoran el estado oral del paciente.
Como conclusión, creemos que es importante diagnosticar correctamente los signos orales del paciente con SSp, fomentar las correctas medidas dietéticas e higiénicas y tratar correctamente la hiposialia del paciente, para así aumentar la producción de saliva y disminuir la producción de caries e infecciones orales. Para ello es imprescindible y necesaria una buena relación reumatólogo-odontólogo, que repercutirá en el correcto tratamiento de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.