La artritis reumatoidea (AR) es una enfermedad autoinmune y crónica caracterizada por la presencia de autoanticuerpos como factor reumatoide (FR) y anticuerpos antiproteínas citrulinadas. Una población de células T helper foliculares (Tfh), que expresan CD4+CXCR5+, colabora con las células B para la producción de anticuerpos. La expresión diferencial de CXCR3 y CCR6 dentro de las células CD4+CXCR5+ define 3 subpoblaciones mayores: CXCR3+CCR6− (Tfh1), CXCR3-CCR6− (Tfh2) y CXCR3-CCR6+ (Tfh17). El objetivo del estudio fue evaluar si existe asociación entre el porcentaje de estas células y la AR, y la correlación de las mismas con actividad de la enfermedad.
Material y métodosParticiparon 24 pacientes con AR, 22 controles saludables (CS) y 16 pacientes con artritis indiferenciada (AI). Los porcentajes de las células CD4+CXCR5+ y sus subpoblaciones fueron analizados por citometría de flujo.
ResultadosNo hubo diferencias en los porcentajes de células CD4+CXCR5+ entre los pacientes con AR y CS o entre AR y AI. Tampoco en las subpoblaciones Tfh1, Tfh2 y Tfh17. No hubo correlación entre las células T CD4+CXCR5+, Tfh1, Tfh2 y Tfh17 y el «Disease Activity Score in twenty-eigth joints» (DAS28), así como tampoco con la velocidad de sedimentación globular. Sorpresivamente, hubo una correlación positiva entre las células Tfh17 y la proteína C reactiva. Finalmente, no hubo correlación entre las células TCD4+CXCR5+ o cualquiera de las subpoblaciones y antivimentina mutada citrulinada así como tampoco entre dichas células y el FR.
ConclusiónNo se hallaron diferencias entre los porcentajes de las células T CD4+CXCR5+ y sus subpoblaciones en sangre periférica de los pacientes con AR y las células de los grupos controles. Esto no descarta un papel patogénico de estas células en el desarrollo y actividad de la AR.
Rheumatoid arthritis (RA) is a chronic autoimmune disease that is characterized by the presence of different autoantibodies such as rheumatoid factor (RF) and anti-citrullinated protein antibodies. CD4T cells expressing CXCR5, referred as follicular helper T cells (Tfh), collaborate with B cells to produce antibodies. Differential expression of CXCR3 and CCR6 within CD4+CXCR5+ T cells defines three mayor subsets: CXCR3+CCR6− (Tfh1), CXCR3-CCR6− (Tfh2) and CXCR3-CCR6+ (Tfh17). The aim of the study was to assess whether there is an association between the percentage of these cells and RA and whether there is a correlation with disease activity.
Material and methodsTwenty-four RA patients, 22 healthy controls (HC) and 16 undifferentiated arthritis (UA) patients were included. Percentage of CD4+CXCR5+ T cells and their subsets were analyzed by flow cytometry.
ResultsNo differences were found in the percentages of CD4+CXCR5+ T cells in the comparison of RA vs HC or RA vs UA patients. Tfh1, Tfh2 and Tfh17 subsets showed no differences either. There was no correlation between CD4+CXCR5+T cells, Tfh1, Tfh2 and Tfh17, and Disease Activity Score in twenty-eight joints (DAS28) or erythrocyte sedimentation rate. Surprisingly, there was a positive correlation between Tfh17 cells and C-reactive protein. Finally, there was no correlation between CD4+CXCR5+ T cells, or their subsets, and anti-mutated citrullinated vimentin, or between the cells and RF.
ConclusionThere were no differences between the percentages of CD4+CXCR5+ T cells and their subsets in peripheral blood of RA patients and the percentages of cells in the control groups. This finding does not rule out a pathogenic role of these cells in the development and activity of RA.
La artritis reumatoide (AR) es una enfermedad autoinmune, inflamatoria, crónica, que no solo afecta a las articulaciones y los huesos, sino que además se asocia con complicaciones generales y muerte temprana1,2. Se caracteriza por la presencia de autoanticuerpos circulantes, como factor reumatoide (FR) y anticuerpos antiproteínas citrulinadas 2,3. Recientemente, se ha descrito una subpoblación de células T CD4 presente en los folículos de las células B, llamadas células T helper foliculares (Tfh), especializada en colaborar con la célula B para la producción de anticuerpos4–8. Las células Tfh expresan el receptor de quimiocina CXCR5, el que les permite su migración a los folículos de células B en respuesta a su ligando CXCL134–9. Entre los rasgos distintivos de las células Tfh se incluyen la expresión de «B-cell lymphoma 6 protein» (Bcl6), «programmed cell death protein 1» (PD-1), «inducible T-cell costimulator» (ICOS) y «cluster of differentiation 40 ligand» (CD40L), así como la liberación de interleucina 21 (IL-21)4–6. Sin embargo, estas células fueron definidas no solo por sus marcadores fenotípicos, sino también por su localización anatómica en los órganos linfáticos secundarios, lo que dificulta su análisis de rutina en humanos4,8. Actualmente, ha sido definida una población circulante de células T helper que expresa CXCR5 y tiene similar funcionalidad y marcadores fenotípicos que las células Tfh residentes en los tejidos10–16. Son heterogéneas y comprenden distintas subpoblaciones que secretan citocinas características de células Th1, Th2 y Th17, y se pueden discriminar por sus marcadores de superficie CXCR3 y CCR6 en: CXCR3+CCR6− (like-Th1), CXCR3-CCR6− (like-Th2) y CXCR3-CCR6+ (like-Th17)10,16. El aumento de células Tfh ha sido implicado en el desarrollo de autoinmunidad sistémica en ratones17. En humanos se ha estudiado el papel patogénico de estas células en diferentes patologías autoinmunes, como lupus eritematoso sistémico11,12, síndrome de Sjögren11,18, dermatomiosistis juvenil10 e incluso en AR12,19–23, observándose discordancias entre los resultados obtenidos. El objetivo de este trabajo fue determinar si las células T CD4+CXCR5+ y sus distintas subpoblaciones (CXCR3+CCR6–, CXCR3–CCR6–, CXCR3−CCR6+) se asocian con AR y si correlacionan con la actividad de la enfermedad, así como también con otros parámetros pronósticos, como autoanticuerpos y reactantes de fase aguda.
Materiales y métodosPacientes y controlesSe realizó un estudio transversal de casos y controles. Los pacientes fueron admitidos por el Servicio de Reumatología del Hospital Nacional de Clínicas, Universidad Nacional de Córdoba, Argentina, entre marzo del 2014 y febrero del 2015. Se incluyeron a 24 pacientes con AR entre los 18 y los 70 años, diagnosticados según los criterios ACR/EULAR 201024, de estos, 15 con artritis virgen de tratamiento y 9 con más de 12 meses de evolución de su enfermedad, que abandonaron su medicación por distintos motivos y no tenían tratamiento inmunosupresor o inmunomodulador durante al menos 2 meses previos a su consulta con el Servicio de Reumatología. Se excluyeron a aquellos pacientes tratados con rituximab dentro del último año o con dosis de glucocorticoides mayor de 10mg de prednisona/día o su equivalente en otros glucocorticoides de diferente potencia; vacunados con vacuna antiviral o antibacteriana en los últimos 2 meses; aquellos que presentaban otras enfermedades asociadas de tipo autoinmunes, procesos agudos o neoplasias, y mujeres embarazadas. En el momento de la admisión se evaluó la actividad de la enfermedad empleando el índice «Disease Activity Score in twenty-eigth joints» (DAS28) de 4 puntos: articulaciones dolorosas e inflamadas, escala visual análoga y velocidad de sedimentación globular (VSG)25. Como grupos controles se estudiaron: un grupo de 16 pacientes con artritis indiferenciada (AI) que presentaban artritis clínica pero que no reunían criterios para diagnóstico de AR ni otras artropatías inflamatorias al momento de ser incluidos en el trabajo; para este grupo se tuvieron en cuenta los mismos criterios de selección que para pacientes con AR; y un grupo control sano (CS) constituido por 22 adultos voluntarios dentro del mismo rango etario y distribución de sexo que los pacientes, que no presentaron enfermedades autoinmunes, procesos agudos virales o bacterianos, endocrinopatías, ni neoplasias, que tampoco recibieron antibióticos o vacunación antiviral o antibacteriana en los últimos 2 meses. Todos los participantes del estudio dieron su consentimiento por escrito. El trabajo fue aprobado por el Comité de Ética (CIEIS) del Hospital Nacional de Clínicas, Universidad Nacional de Córdoba.
Exámenes de laboratorioLas muestras de sangre entera anticoagulada con EDTA-K2 fueron utilizadas para análisis citológicos y las muestras de suero para las demás determinaciones de laboratorio. Los análisis citológicos completos se realizaron empleando el contador hematológico Counter 19/19CP (Wiener Laboratorios SAIC, Rosario, Argentina) y los recuentos diferenciales utilizando la tinción de May-Grunwald Giemsa. FR se realizó por técnica de látex, Artritest (Wiener Laboratorios SAIC, Rosario, Argentina), empleando un corte=1/20. La valoración de la proteína C reactiva (PCR) se realizó por inmunoanálisis turbidimétrico acelerado con partículas (SIEMENS, Nueva York, EE. UU.) empleando el autoanalizador SIEMENS Dimensión RxL Max (Nueva York, EE. UU.), valor de referencia (VR): ≤ 9mg/L. Los anticuerpos antivimentina mutada citrulinada (anti-VMC) fueron determinados mediante ensayo de inmunoabsorción ligado a enzima (Orgentec Diagnostika GmbH, Mainz, Alemania). El procedimiento se realizó siguiendo las instrucciones del fabricante. Se consideraron positivos aquellos valores ≥ 20 U/mL. Finalmente, las inmunoglobulinas (inmunoglobulina [Ig] G VR: 650-1.370 mg%, IgM VR: 25-198 mg% e IgA VR: 35-350mg%) y las fracciones C3 (VR: 80-180 mg%) y C4 (VR: 17-40 mg%) del complemento fueron medidas empleando inmunodifusión radial simple.
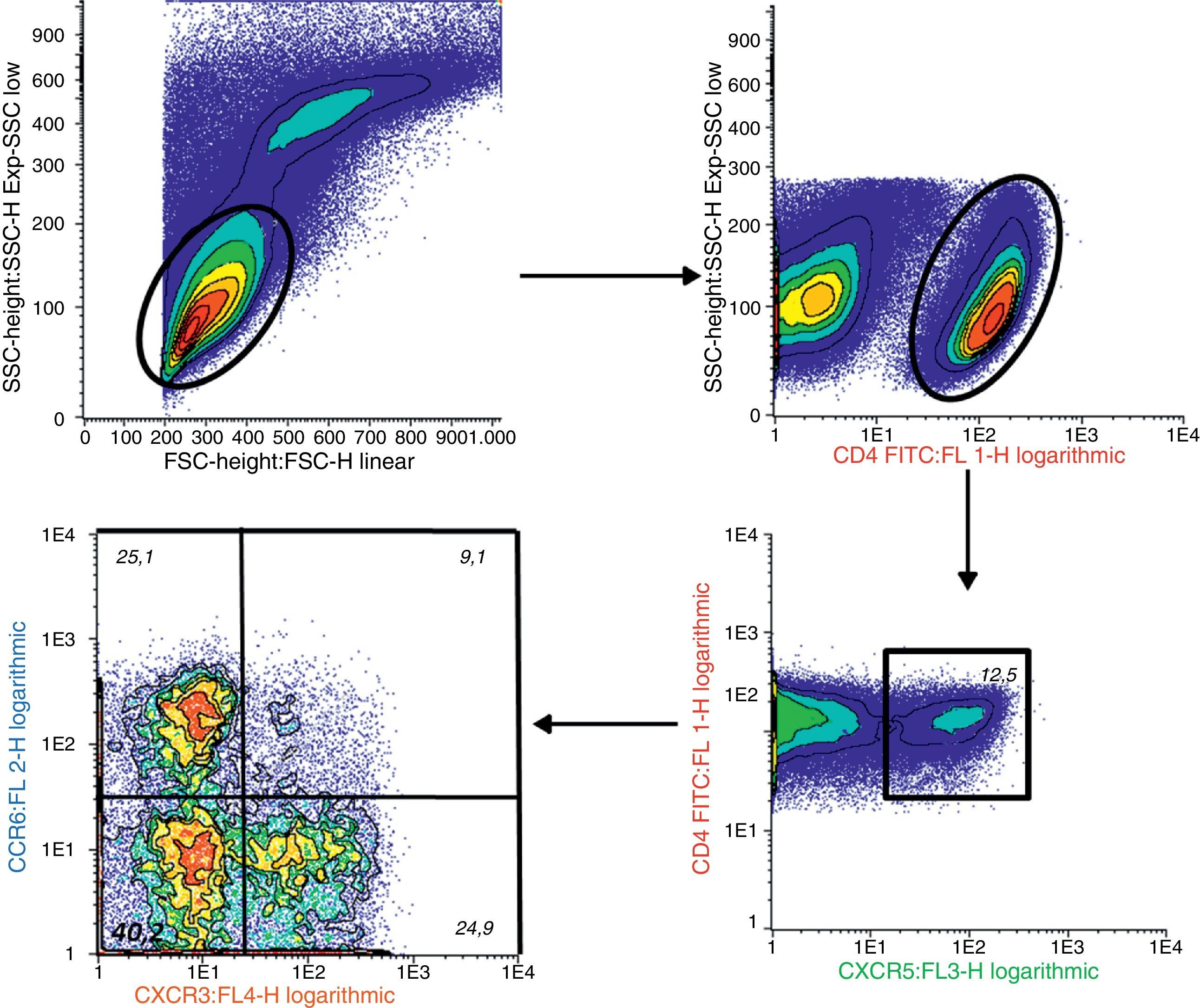
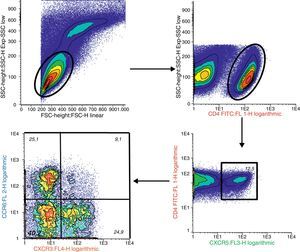
Determinación de linfocitos T CD4+CXCR5+ y sus distintas subpoblaciones por citometría de flujoSe separaron células mononucleares de sangre periférica (CMSP) por gradiente de densidad usando Ficoll-PaqueTM Plus (GE Healthcare Bio-Sciences AB, Uppsala, Suecia). Para la inmunomarcación se utilizaron 1,106 CMSP y los siguientes anticuerpos: anti-CD4 humano-FITC (clon RPA-T4), anti-CD196 humano (CCR6)-PE (clon 11a9), anti-CD183 humano (CXCR3)-APC (clon IC6/CXCR3) y anti-CXCR5 humano-PerCP-Cy™5.5 (clon RF8B2) (BD Pharmingen™, San José, EE. UU.). Se adquirieron los datos inmediatamente después de la tinción en citómetro de flujo FACS Calibur de 4 colores (Becton-Dickinson, EE. UU.). En cada muestra se analizaron al menos 50.000 células CD4 utilizando el programa Infinicyt™1.7. (Citognos SL, Salamanca, España).
Análisis estadísticoLos datos se analizaron con el programa MedCalc 10.2.0.0 (MedCalc Software, Bélgica). La normalidad se evaluó con la prueba de Kolmogorov-Smirnov. Para las variables con distribución normal o cuya transformación logarítmica tuviera distribución normal se utilizaron pruebas paramétricas como análisis de varianza (ANOVA) de una vía y Bonferroni, así como el coeficiente de correlación de Pearson. Para las demás variables se utilizaron pruebas no paramétricas, como Kruskal-Wallis y Dunn, y el coeficiente de correlación de Spearman. Los datos categóricos se compararon con Chi-cuadrado. Una p<0,05 fue considerada estadísticamente significativa.
ResultadosCaracterísticas de los grupos en estudio: la tabla 1 muestra las características demográficas y clínicas de los grupos en estudio. La edad y la distribución de sexo fueron homogéneas entre los grupos. Como se esperaba, los valores de VSG y PCR fueron superiores en los pacientes con AR cuando se compararon con el grupo CS. Un 79% de los pacientes con AR tuvieron FR positivo, mientras que ninguno de los controles lo tuvo positivo. Asimismo, los niveles de autoanticuerpos anti-VMC fueron significativamente mayores en los pacientes con AR cuando se compararon con ambos grupos. Los niveles de IgM fueron mayores en los pacientes con AR cuando se compararon con el grupo CS y los de IgA cuando se compararon con los pacientes con AI. La concentración de la fracción C4 del complemento fue menor en los pacientes con AR cuando se comparó con los de AI, pero en ambos grupos se mantuvieron dentro del rango normal. La mayoría de los pacientes con AR presentó un nivel de actividad alto de la enfermedad (tabla 2). Dos pacientes se encontraron con actividad baja, de los cuales uno estaba en remisión (DAS28 < 2,6)26.
Resumen de controles y pacientes en el estudio
| AR (n=24) | CS (n=22) | AI (n=16) | AR vs. CS, valor de p | AR vs. AI, valor de p | |
|---|---|---|---|---|---|
| Sexo, F/M | 21/3 | 19/3 | 13/3 | 0,77c | 0,93c |
| Edad, años | 51±10 | 49±10 | 52±11 | > 0,05d | > 0,05d |
| GBa, n. 109/L | 6,98±1,85 | 7,23±1,96 | 6,84±1,74 | > 0,05d | > 0,05d |
| Hba, g/L | 12,6±1,91 | 12,6±0,98 | 12,96 ±1,07 | > 0,05e | > 0,05e |
| Plaqa, n. 109/L | 255±80 | 254±41 | 249±59 | > 0,05e | > 0,05e |
| VSGa, mm/h | 25±21 | 9±6 | 14±12 | < 0,01e | > 0,05e |
| PCRa, mg/L | 18 ±14 | 9 ±2 | 14±8 | < 0,01e | > 0,05e |
| FR+, n (%) | 19 (79) | 0 (0) | 0 (0) | < 0,0001c | < 0,0001c |
| VMCb, U/mL | 75,0(7,7-530,0) | 2,8(2,3-5,3) | 2,9(2,5-3,8) | < 0,001e | < 0,001e |
| IgGa, mg% | 1310±338 | 1325±257 | 1212±336 | > 0,05c | > 0,05c |
| IgMa, mg% | 220±88 | 169±55 | 179±60 | < 0,05c | > 0,05c |
| IgAa, mg% | 363±126 | 313±80 | 261±114 | > 0,05c | < 0,05c |
| C3a, mg% | 112±33 | 119±26 | 130±30 | > 0,05c | > 0,05c |
| C4a, mg% | 24±9 | 26±7 | 31±8 | > 0,05c | < 0,05c |
| DAS-28a | 5,16±1,35 | – | – | – | – |
AI: artritis indiferenciada; AR: artritis reumatoidea; CS: control sano; DAS28: Disease Activity Score in twenty-eigth joints; FR: factor reumatoide; GB: glóbulos blancos; Hb: hemoglobina; Ig: inmunoglobulina; PCR: proteína C-reactiva; Plaq: plaquetas; VMC: antivimentina mutada citrulinada; VSG: velocidad de sedimentación globular.
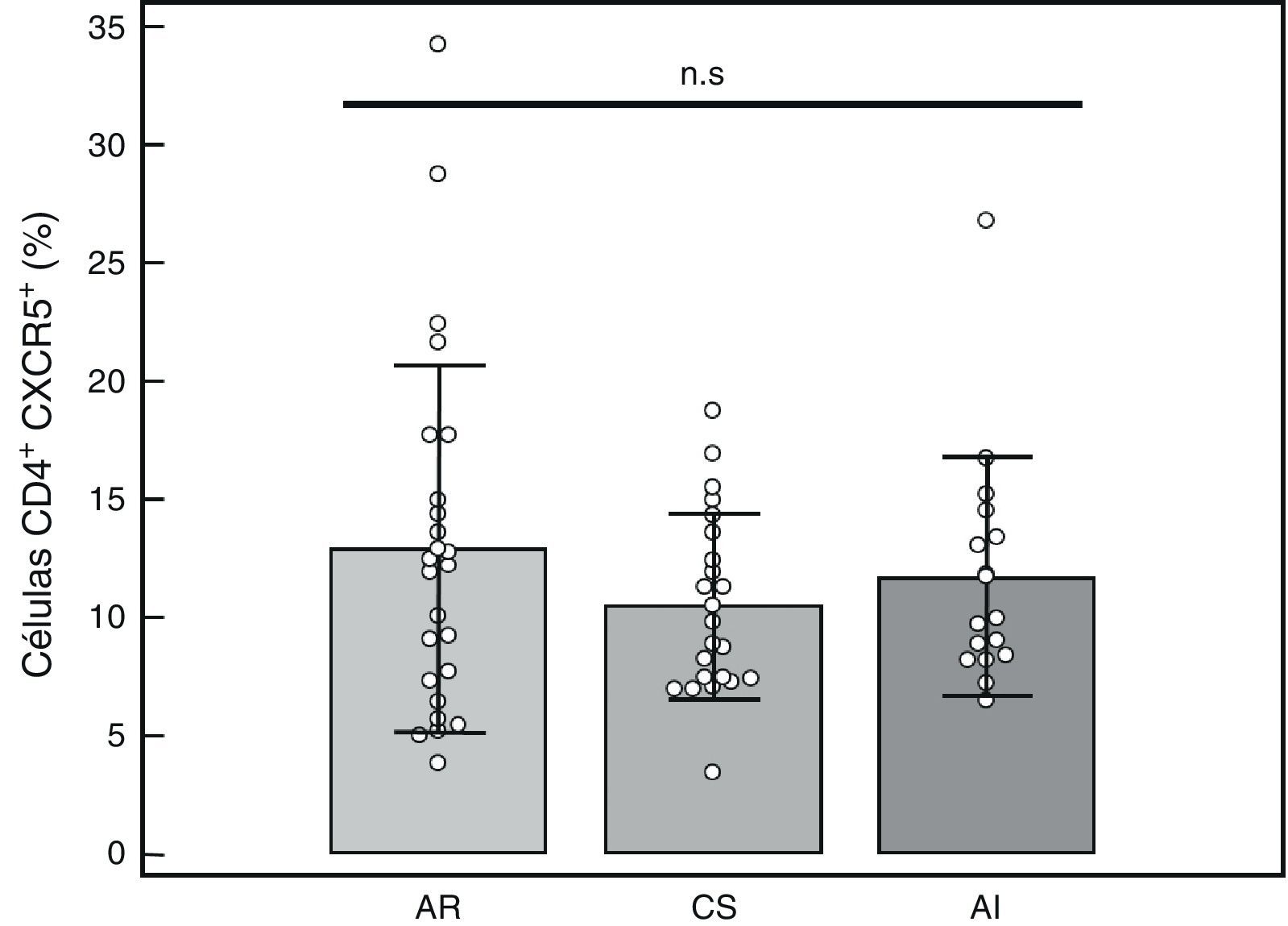
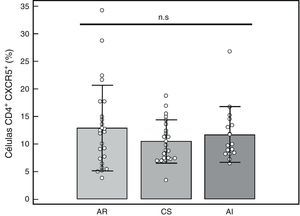
Porcentaje de células T CD4+CXCR5+: para identificar las distintas subpoblaciones de estas células por citometría de flujo se siguió la estrategia detallada en la figura 1. Se comparó el porcentaje de células T CD4+CXCR5+ entre los 3 grupos, no hallándose diferencias significativas (AR: 12,89%±7,73%, CS: 10,48%±3,90%, AI: 11,71%±5,04%, p = 0,66), tal como se muestra en la figura 2. Tampoco se hallaron diferencias entre los grupos cuando se consideró solo a los pacientes actividad alta (DAS28>5,1, n=14, 12,84%±8%, p=0,73).
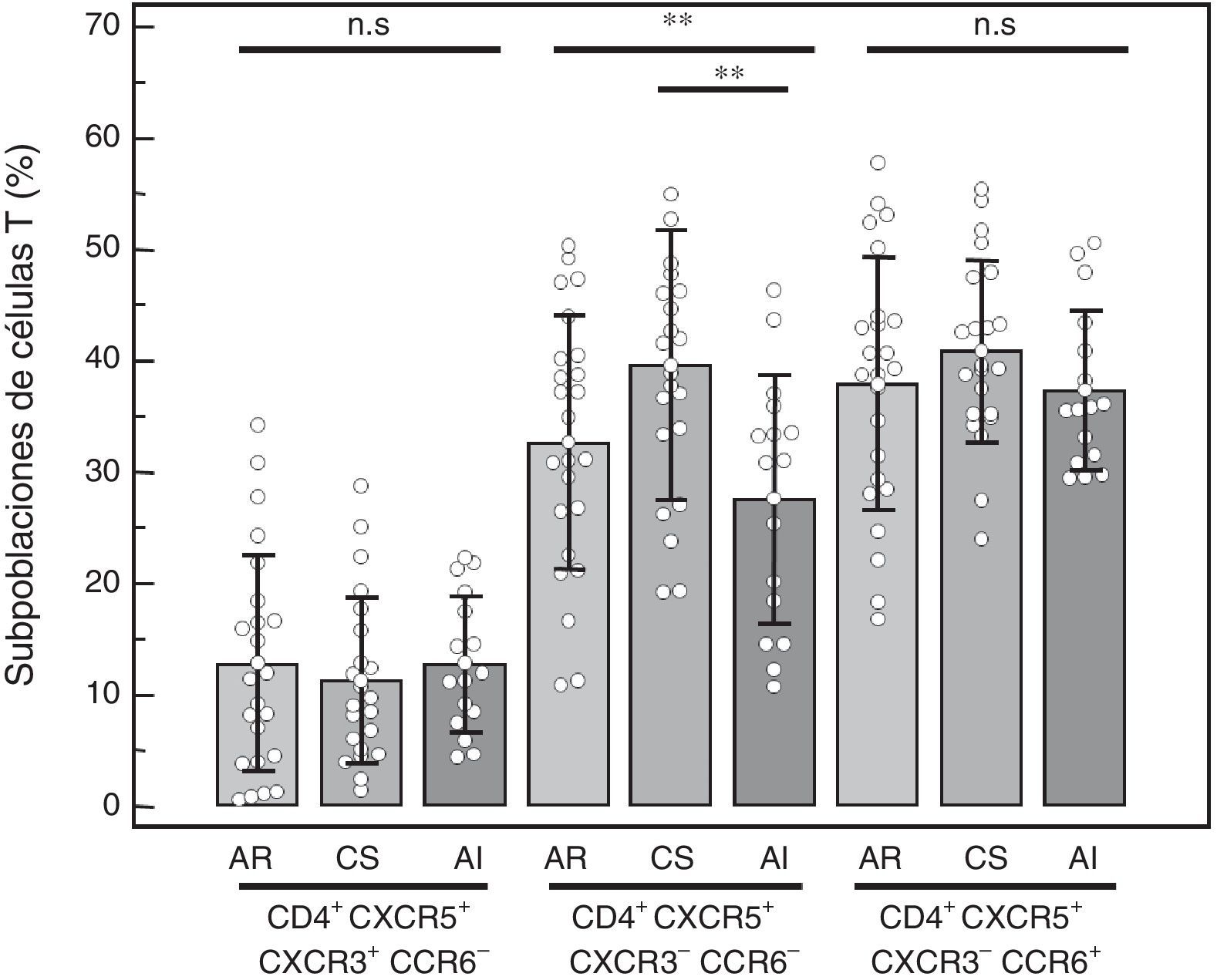
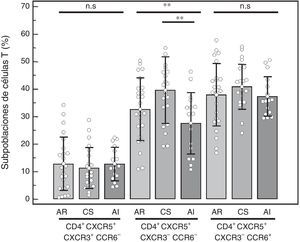
Subpoblaciones de células T CD4+CXCR5+: se compararon los porcentajes de las distintas subpoblaciones de células CXCR3+CCR6− (Tfh1), CXCR3-CCR6− (Tfh2) y CXCR3-CCR6+ (Tfh17) dentro de la población CD4+CXCR5+ (fig. 3). No se hallaron diferencias en la subpoblación Tfh1 (AR = 12,75%±9,72%, CS = 11,21%±7,48%, AI = 12,81%±6,13%, p=0,77), así como tampoco en la subpoblación Tfh17 (AR = 37,94%±11,34%, CS=40,79%±8,17%, AI = 37,34%±7,16%, p=0,45). La diferencia encontrada en la subpoblación Tfh2 (AR = 32,66%±11,46%, CS=39,53%±12,12%, AI=27,56%±11,25%, p=0,0092) se debió a un menor porcentaje hallado en el grupo de AI cuando se comparó con CS (p<0,01). Tampoco se halló diferencia cuando se comparó solo a aquellos pacientes con AR y actividad alta de la enfermedad (n=14) y los grupos control (Tfh1 AR 12,74%±9,19%, p=0,77; Tfh2 AR 35,03%±11,64%, p=0,01; Tfh17 AR 36,21%±10,80%, p=0,26), nuevamente y como se esperaba, la diferencia en Tfh2 se debió a AI vs. CS (p<0,01).
Porcentaje de las distintas subpoblaciones de células T CD4+ CXCR5+ en células mononucleares de sangre periférica de pacientes con AR, controles saludables (CS) y pacientes con artritis indiferenciada (AI). Prueba de ANOVA de una vía y posprueba de Bonferroni.
n.s.: no significativo.
**p<0,01.
Correlación de las poblaciones en estudio con actividad de la enfermedad: se analizó la correlación entre la población CD4+CXCR5+ y sus distintas subpoblaciones con el DAS28. No se observó correlación entre la población de células CD4+CXCR5+ y DAS28 (r=–0,19 p=0,37), así como tampoco entre ninguna de las subpoblaciones Tfh1, Tfh2 y Tfh17, y el índice de actividad estudiado (Tfh1 y DAS28 r=0,09, p=0,68; Tfh2 y DAS28 r = 0,36, p=0,09; Tfh17 y DAS28 r = –0,20, p=0,35). Cuando se tuvieron en cuenta solo a los pacientes con actividad alta (n=14), tampoco hubo correlación entre ninguna de las subpoblaciones en estudio con el DAS28 (CD4+CXCR5+ y DAS28 r = –0,32, p= 0,26; Tfh1 y DAS28 r=–0,17, p = 0,56; Tfh2 y DAS28 r = 0,33, p=0,25; Tfh17 y DAS28 r = 0,024, p=0,94).
Correlación entre las células Tfh y los diferentes autoanticuerpos en pacientes con AR: puesto que las células Tfh colaboran con las células B para la producción de anticuerpos, nos propusimos investigar si las células T CD4+CXCR5+ y sus distintas subpoblaciones podrían estar relacionadas con la producción de autoanticuerpos en pacientes con AR. No se halló correlación entre los porcentajes de células T CD4+CXCR5+ (r=0,38, p = 0,066), así como tampoco entre las distintas subpoblaciones (Tfh1 r=–0,04, p=0,84; Tfh2: r = –0,14, p=0,51; Tfh17: r=–0,19, p=0,37) y los anti-VMC. El mismo resultado se obtuvo cuando se correlacionaron los porcentajes de estas poblaciones celulares y FR (CD4+CXCR5+: r=0,30, p=0,15; Tfh1: r=–0,18, p=0,38; Tfh2: r=–0,15, p=0,46; Tfh17: r=0,0051, p=0,98).
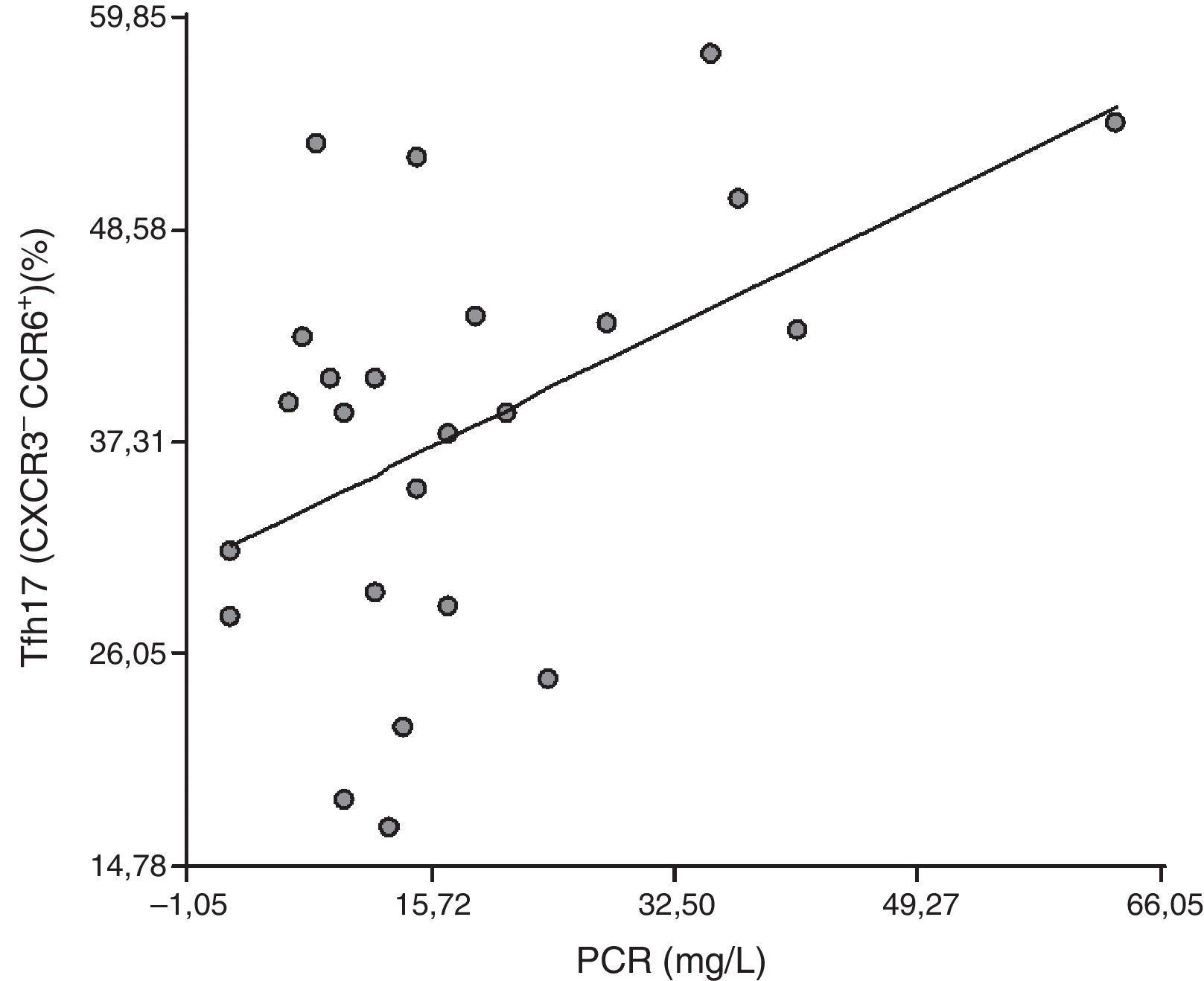
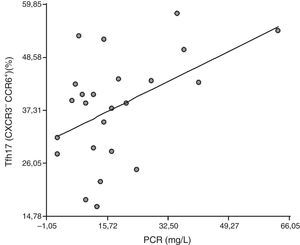
Correlación entre las células Tfh y sus distintas subpoblaciones celulares con marcadores de inflamación: para dilucidar si las células Tfh y las diferentes subpoblaciones tienen un papel en el proceso inflamatorio que ocurre en pacientes con AR, se correlacionaron con la VSG y la PCR. No se halló correlación entre la población CD4+CXCR5+ y la VSG ni la PCR (r=0,18, p=0,39 y r=0,27, p=0,20, respectivamente). Tampoco se halló correlación entre Tfh1, Tfh2 y Tfh17 con VSG (r=0,080, p=0,71; r=–0,0094, p=0,97 y r=–0,25 p=0,23, respectivamente), así como tampoco entre Tfh1 y PCR (r=–0,27, p=0,20), ni Tfh2 y PCR (r=0,14, p=0,51). Sorpresivamente, se halló una correlación positiva entre Tfh17 y PCR (r=0,47, p=0,021) (fig. 4).
DiscusiónSi bien se han propuesto muchos mecanismos inmunopatogénicos, la causa de la AR es aún desconocida. En consecuencia, el descubrimiento tanto de los elementos del sistema inmunitario que participan como de los mecanismos involucrados es de gran valor para el desarrollo de terapias más efectivas. En esta investigación se estudió una subpoblación de células T CD4, las células Tfh, que cumplen un papel muy importante en la colaboración para la producción de anticuerpos por parte de las células B. Sin embargo, no se encontraron diferencias significativas en el porcentaje de células T CD4+CXCR5+ en sangre de pacientes con AR al compararlos con CS o con pacientes con AI. Tampoco cuando se consideró solo a aquellos pacientes con AR y actividad clínica alta. La bibliografía muestra resultados muy variables que pueden estar relacionados con la manera de caracterizar esta población en sangre periférica. Nuestros resultados concuerdan con el trabajo realizado por Chakera et al., que no encuentran diferencias cuando seleccionan a las células Tfh como CD4+CXCR5+, CD4+CD45RO+CXCR5+, CD4+CXCR5+ICOShigh o CD4+CXCR5+PD-1high20. En otro estudio, tampoco se encontró diferencia en el porcentaje de células CD4+CXCR5+CD45RA− o CD4+CXCR5+CD45RA-CCR7loPD-1hi12. Asimismo, en el trabajo de Irene Arroyo-Villa et al. no se halló diferencia cuando se emplearon CD4 y CXCR5 para caracterizarlas21. Sin embrago, cuando se añadió ICOS a la marcación original, se observó un número mayor de células CD4+CXCR5+ICOS+ en pacientes con AR21. De forma similar, y en contraposición con nuestros hallazgos, en otro grupo de estudios reportados en la bibliografía se observa un aumento en el número de células Tfh en pacientes con AR cuando añaden ICOS como tercer marcador celular e incluso PD-1 sumado a los marcadores antes mencionados19,22,23. Estudios previos de células T CD4+CXCR5+ de centros germinales en ratones determinaron una población que expresa el regulador máster Bcl6 y Foxp3, con capacidad para prevenir autoinmunidad mediada por anticuerpos, las que se denominan células T foliculares regulatorias (TFR)27. Recientemente, esta población ha sido también descrita en sangre y amígdalas humanas28,29. Debido a que las células Tfh y TFR cumplen funciones opuestas y comparten la expresión de muchos marcadores, como CXCR5, ICOS y PD-1, sería crítico adicionar la marcación de Foxp3 para poder discriminarlas. Esto podría ayudar a reconciliar hallazgos aparentemente contradictorios en relación con las consecuencias de cambios numéricos en estas poblaciones durante los procesos autoinmunes.
Para la determinación de las subpoblaciones celulares Tfh, se empleó la combinación de los marcadores CCR6 y CXCR3, siguiendo los criterios empleados por Morita et al. en el año 201110. Este grupo y otro encontraron que las subpoblaciones Tfh2 y Tfh17 son buenas colaboradoras con las células B para la inducción de la síntesis de distintos isotipos de inmunoglobulinas10,21. Al ser la AR una enfermedad con producción de autoanticuerpos, esperábamos hallar un aumento en las subpoblaciones Tfh2 y Tfh17; sin embargo, no encontramos diferencia en ninguna de estas subpoblaciones, así como tampoco en la subpoblación Tfh1. Nuevamente, la bibliografía reporta resultados contradictorios cuando se estudia a pacientes con AR. El grupo de Arroyo-Villa et al. encontró diferencia en la población Tfh17 pero no en la población Tfh221, mientras que otro grupo no encontró diferencias significativas entre ninguna de las subpoblaciones en pacientes con AR20.
En el estudio de las comparaciones de las distintas poblaciones con DAS28, PCR, VSG, FR y anti-VMC no se encontró correlación en ninguno de los casos, excepto entre las Tfh17 y la PCR. Similar a lo ocurrido en este estudio, trabajos previos reportados en la bibliografía tampoco hallaron correlación entre las células Tfh y los parámetros de actividad de la enfermedad como DAS2821, PCR y VSG23. Contrariamente, otros grupos encontraron correlación positiva entre Tfh y DAS2822–23 o entre Tfh y anti-péptidos citrulinados cíclicos19,22 o Tfh y FR19. En cuanto a la correlación hallada entre Tfh17 y PCR, un trabajo anterior determinó que la subpoblación Tfh17 produce IL-21, IL.17A e IL-2210. Estas citocinas podrían inducir indirectamente la producción de PCR al estimular los hepatocitos, queratinocitos y células epiteliales a producir IL-1β e IL-630, que actúan en el hígado para inducir la síntesis de PCR2, lo que podría ser el mecanismo empleado en la AR.
En conclusión, no hallamos diferencias numéricas entre las células Tfh y las distintas subpoblaciones en sangre periférica, así como tampoco correlación con parámetros de actividad de la enfermedad y marcadores inflamatorios. A pesar de ello, no podemos descartar la posibilidad de que desempeñen un papel patogénico en la AR. Esta población podría ser reclutada al sitio inflamatorio, en este caso la articulación, y colaborar con las células B para la producción de autoanticuerpos en los centros germinales ectópicos, localizados en la membrana sinovial de los pacientes con AR.
Una definición fenotípica clara de los subgrupos de células Tfh de memoria en la sangre es importante, no solo para poder comprender sus funciones biológicas, sino también para propósitos traslacionales, debido a que estas células circulantes podrían servir como potenciales biomarcadores para monitorear las respuestas desreguladas de anticuerpos en enfermedades autoinmunes como la AR.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónLos fondos para la realización del trabajo fueron aportados por la Sociedad Argentina de Reumatología.
Conflicto de interesesNinguno de los autores tiene conflictos de interés.
Agradecemos a las bioquímicas Cecilia María Rodriguez y Melina Cloquell, por colaborar con el análisis de las muestras en el citómetro de flujo.